穿心莲制剂HMPL-004药物临床研究的国际化历程*
华烨
(和记黄埔医药有限公司上海201203)
穿心莲制剂HMPL-004药物临床研究的国际化历程*
华烨*
(和记黄埔医药有限公司上海201203)
2006年,和黄医药的首个中药穿心莲制剂-HMPL-004成功获得FDA临床研究批件,在美国、加拿大等国启动临床研究。至2014年,HMPL-004先后在欧美国家开展了8项临床研究,初步确立了该药的人体安全性及其在溃疡性结肠炎和克罗恩病中的疗效。在该药的国际临床开发过程中,和黄医药采取了与其他跨国企业雀巢公司合作的方式,很大程度上解决了海外临床开发经验和技术的不足。由于剂型选择和研究设计的缺陷,该药III期临床研究在中期分析时被终止,HMPL-004的国际化道路未能顺利完成。但是,这一经历为和黄医药的研发人员积累了宝贵经验,并在此基础上开发了HMPL-004的II代产品-HMPL004-6599。
植物药穿心莲HMPL-004溃疡性结肠炎
目前,中成药在美国进行新药注册需要通过临床试验,对药品的疗效及安全性做定性和定量分析,提供严谨、科学的数据论证,并由统计检验来验证结果是否显著。中医“辨证论治”用现代语言描述就是“个体化医疗”,中医临床医生基于同样的方剂,根据患者具体病情增减药味或某些药味在剂量上适当增减。如果要把个体化用药的中药复方改制成群体用药,就得用西方科学论证的方式对中成药的药效进行评估,这使得中成药在美国进行药物注册面临巨大挑战。和记黄埔医药(上海)有限公司于2002年成立,建立了创新药研发团队。当时和黄医药的理念是发掘中国传统药物宝库,加以提炼后,运用西方科学研究方法进行现代化研发后上市。经过几年的不懈努力和经验积累,用中草药穿心莲富集提取的药物HMPL-004终于进入临床试验阶段,而其它类似的中药提取物的研发并不成功。从2004年开始,和黄医药转型为以化药研发为主的模式,先后开发了多个酪氨酸激酶抑制剂,进行抗肿瘤的靶向药物研究。整个研发团队主要成员具有海外留学背景并在跨国药企多年从事新药研究的科研人员。虽然,公司在抗肿瘤的靶向药物研究中取得了许多建树,本着不忘初心和坚持不懈地信念,中药穿心莲的提取物HMPL-004的临床研发加紧了国际化的脚步。
1 穿心莲制剂HMPL-004的开发和制剂工艺
穿心莲作为一种古老的抗炎草药,有着上千年的临床应用历史。用现代检测方法检测到穿心莲含有多种化学成分,但并未确定对肠道炎症是有效的成分。而且,当草药被提炼成制剂后,每一批次的药物活性成分的评估也需制定一个标准范围,以保持药物疗效的一致性。
和黄医药的研究团队对穿心莲的化学成分做了大量分析后,确定了4个标志物[1],并规定了在制剂生产中应该占有的比例范围,使同一年份不同产地或同一产地不同年份的穿心莲在经过加工提炼后,保证每一批次药物的化学标志物的成分基本一致,从而达到该制剂的不同批次在疗效上的一致性[2]。
2 HMPL-004治疗肠道炎症的依据
目前,临床治疗炎症性肠病(Inflammatory Bowel Disease,IBD)的药物主要有两大类:化药5-ASA类和生物制剂如TNF-α单抗。但是,5-ASA治疗IBD的疗效不稳定、不持久;单抗药物治疗IBD的疗效虽然较好,但其毒副作用大,一般作为2线药物或用于重度IBD的治疗,且长期使用会增加淋巴瘤的风险[2]。穿心莲在一定程度上能抑制肠道NF-κB的表达,从而抑制其下游多种炎性因子TNF-α、IL-1β等的激活,而达到抑制肠道炎症的功效[3]。以上是穿心莲制剂HMPL-004能有效治疗IBD的理论基础。
动物活体研究表明,DNBS所致的结肠炎模型发现HMPL-004可改善结肠炎模型肠道的病理结构,也可减少盲肠、结肠、直肠炎性细胞数量和降低组织中TNF-α、IFN-γ、IL-6和IL-10的表达[4]。在完成了充分的动物研究之后,公司在向美国国家食品和药品管理局(FDA)申请了新药临床试验(IND)并于2006年在美国正式开展HMPL-004的临床试验。
3 穿心莲制剂HMPL-004的二期临床研究
HMPL-004在动物研究中取得较好疗效后,本团队又展开了2个二期临床试验,试验的目的一方面来进一步确定HMPL-004的用药剂量,另一方面评估HMPL-004的疗效和安全性。
在克罗恩病(Crohn's Disease)Ⅱ期研究中,我们采用了随机双盲对照试验,HMPL-004用量为1 200 mg TID、对照组采用安慰剂,治疗8周,用CDAI-100进行疗效评估,两组间有效率和临床缓解期的差异进行统计检验。该试验的样本量为101例,治疗第8周时,HMPL004组有37.3%(19/51)的受试者达到了CDAI-100的疗效终点,安慰剂组为22.0%(11/50)。两组之间的差异为15.3%(95%置信区间[-2.3%,32.8%])。尽管上述疗效差异未达到统计学意义,但还是显示了一定的疗效趋势**Double-blinded,Randomized,Multicenter,Placebo-Controlled Phase II Study of Efficacy and Safety of HMPL 004 in Subjects with Active Moderate Crohn's Disease.2011.**A Phase IIb,Randomized,Multicenter,Placebo-Controlled Trial of HMPL-004 in Patients with Mild to Moderate Active Ulcerative Colitis With or Without Mesalamine.***A Phase III,Randomized,Multicenter,Placebo-Controlled Trial of HMPL-004 in Subjects with Mild to Moderate Active Ulcerative Colitis(NATRUL-3).。其原因可能是样本量太小,也可能是试验设计存在缺陷,如患者人群的总体代表性偏重于东欧,而且只设计了一个剂量组。限于当时公司规模和研发资金有限,试验设计得不够完善,所以未能在克罗恩病适应症上获得一个明确的结论。
另一个临床试验是针对溃疡性结肠炎(Ulcerative Colitis,UC)的二期研究,HMPL-004给药为1 200 mg和1 800 mg TID两个剂量,样本量为223例,治疗8周后评估疗效和安全性,疗效评价采用了当时注册研究的金标准Mayo评分。这次试验达到了预期效果,即与安慰组相比,HMPL-004治疗组取得显著疗效,高剂量组(72.6%)比安慰剂组(43.5%)显示出更突出的疗效,剂量效应呈正相关性[5]。在诱导临床缓解和促进黏膜愈合方面,HMPL-004也显示了明显的优势。另外我们还做了亚组分析,研究发现HMPL-004联合5-ASA治疗UC的疗效(72.7%)比单用HMPL-004(37.5%)更为显著***Double-blinded,Randomized,Multicenter,Placebo-Controlled Phase II Study of Efficacy and Safety of HMPL 004 in Subjects with Active Moderate Crohn's Disease.2011.**A Phase IIb,Randomized,Multicenter,Placebo-Controlled Trial of HMPL-004 in Patients with Mild to Moderate Active Ulcerative Colitis With or Without Mesalamine.***A Phase III,Randomized,Multicenter,Placebo-Controlled Trial of HMPL-004 in Subjects with Mild to Moderate Active Ulcerative Colitis(NATRUL-3).。
4 穿心莲制剂HMPL-004的三期临床研究
鉴于二期研究的成果,HMPL-004的验证性三期临床试验随之展开。该试验为随机、双盲、多中心研究,三期临床试验(图1)。本阶段试验设计了HMPL-004 1 800 mg和2 400 mg TID高低两个剂量对照安慰剂,联合5-ASA治疗持续8周,疗效评价指标仍然为当时的金标准Mayo评分。本次试验样本量为420例,涉及全球150个中心。由于本次研究HMPL-004的剂量较高,而单个胶囊的剂量仅为200 mg,所以对剂型做了改进,开发了600 mg片剂。
三期临床试验方案设计了中期分析。2015年初达到方案要求的中期分析病例数,由独立数据监控委员会(IDMC)揭盲分析。结果显示,HMPL-004两个治疗组与安慰剂组相比在首要疗效终点上没有统计学差异(图2)****Double-blinded,Randomized,Multicenter,Placebo-Controlled Phase II Study of Efficacy and Safety of HMPL 004 in Subjects with Active Moderate Crohn's Disease.2011.**A Phase IIb,Randomized,Multicenter,Placebo-Controlled Trial of HMPL-004 in Patients with Mild to Moderate Active Ulcerative Colitis With or Without Mesalamine.***A Phase III,Randomized,Multicenter,Placebo-Controlled Trial of HMPL-004 in Subjects with Mild to Moderate Active Ulcerative Colitis(NATRUL-3).。我们接着又做了大量统计分析,包括多个亚组分析,发现在对5-ASA疗效不敏感的患者中,患者对安慰剂应答率较高,影响了HMPL-004疗效的体现;在5-ASA敏感和不敏感的两个亚组中,患者的并发症和其他疾病特征在3个治疗组中也分布不均衡。当去掉这些混杂因素后,HMPL-004的疗效优势就明朗了,而且也与二期临床结果一致。

图1 HMPL-004三期临床试验设计
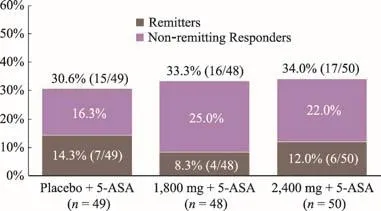
图2 HMPL-004三期临床试验中期分析结果
虽然,本次三期临床在中期失败了,但我们通过总结发现影响结果的以下因素:①剂型的变化,即二期临床研究采用的胶囊,三期研究采用的片剂,剂型改变之前并没有进行生物等效性试验;②方案对患者的选择不够准确,本研究应该选用长期服用稳定剂量5-ASA而且疗效不显著的患者,但在执行中并未考虑进去。
在接下来的TNO(gastro-)Intestinal Models(TIM)研究中,我们分析了片剂和胶囊的药物代谢特征,结果提示胶囊和片剂的PK特征基本一致。此外,药物批次检验也未显示明显差异。综合考虑认为,导致该研究失败的主要因素可能是人群选择不当,而非药物缺乏疗效。鉴于这一推论,穿心莲制剂仍然开展了进一步开发工作,新的制剂已经准备就绪,新剂型HMPL-004-6599的IND申请也指日可待。
5 穿心莲制剂HMPL-004-6599的研发
HMPL-004-6599是在HMPL-004的基础上对某些有效活性成分进行提纯,使这些生物活性成分的含量有所提高,批次之间的稳定性和制造工艺也有所提高,为接下来的临床试验提供了稳定可靠的药物制剂。在体外实验中,HMPL-004-6599对炎症因子的抑制效应显著高于5-ASA(图3)**Inhibition of inflammatory cytokine expression of HMPL004-6599 vs HMPL-004 and 5-ASA.。在将来的临床试验中,我们将基于HMPL-004的人体研究数据和HMPL-004、HMPL004-6599的临床前、人体PK研究数据,选择合适的剂量,观察HMPL004-6599在轻、中度活动性溃疡性结肠炎患者中的疗效趋势及安全性。最终将会通过两个三期大样本随机、双盲、安慰剂对照试验,验证HMPL004-6599联合5-ASA用于轻、中度活动性溃疡性结肠炎诱导和维持治疗的疗效和安全性。
6 小结与展望
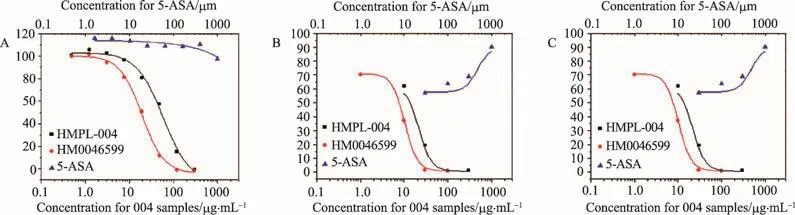
图3 HMPL-004-6599对炎症因子的抑制效应
中草药的现代化研发将有助于发掘祖国传统医学的巨大宝库,以贡献全人类的健康事业。2004年6月美国食品和药品监督管理局(FDA)发布了《植物药研制指导原则》,为中药的国际化开辟了新的道路。2006年10月,FDA批准了第一个植物药Veregen TM。FDA对中药、植物药的认可,与和记黄埔医药(上海)有限公司的中药国际化战略不谋而合,也更坚定了和黄医药从中药宝库中发掘潜力产品的信心。多年来,穿心莲制剂的研发道路一波三折,我们在总结了经验教训之后看到了新的希望。在新一代穿心莲制剂HMPL-004-6599的药学制剂研究中掌握了新的经验,我们有信心再次尝试,在中国开展新一轮的中药复方制剂临床研究和探索。
1 Wang J,Yang W,Wang G,et al.Determination of six components of Andrographis paniculata extract and one major metabolite of andrographolide in rat plasma by liquid chromatography-tandem mass spectometry.J Chromatogr B Analyt Technol Biomed Life Sci,2014,951-952:78-88.
2Rubbert-Roth A.Assessing the safety of biologic agents in patients with rheumatoid arthritis.Rheumatology(Oxford),2012,51(Suppl 5):38-47.
3 Moldoveanu A C,Diculescu M,Braticevici C F.Cytokines in inflammatory bowel disease.Rom J Intern Med.,2015,53(2):118-127.
4 Michelsen K S,Wong M H,Ko B,et al.HMPL-004(Andrographis paniculata extract)prevents development of murine colitis by inhibiting T-cell proliferation and TH1/TH17 responses.Inflamm Bowel Dis,2013,19 (1):151-164.
5 Sandborn W J,Targan S R,Byers V S,et al.Andrographis paniculata extract(HMPL-004)for active ulcerative colitis.Am J Gastroenterol, 2013,108(1):90-98.
Andrographis Paniculata HMPL-004,An Old Medicine with New Story
Hua Ye
(Hutchison MediPharma Ltd.,Shanghai 201203,China)
In June 2004,the US Food and Drug Administration(FDA)issued Guidance for Industry:Botanical Drug Development,which opened a new path for the internationalization of traditional Chinese medicine(TCM).In October 2006,the first botanical drug product Veregen TM was approved by the FDA.The regulatory policy for botanical and herbal medicine coincides with the internationalization strategy of Hutchison MediPharma Ltd.(hereinafter referred to as“Hutchison”).In 2006,Hutchison's first herbal mixture medicine andrographis paniculata HMPL-004 successfully obtained Investigational New Drug(IND)from the US.From 2006 to 2014,there are eight clinical studies of HMPL-004 being conducted in Europe and the US,from Phase 1 safety study to proof-of-concept trials in ulcerative colitis(UC)and Crohn’s disease.To strengthen HMPL-004 development on a global scale,Hutchison made business alliance with Nestle Health Science in clinical development as well as basic research.Due to futile outcome of an interim analysis,the Phase III registration study in UC was terminated.However,valuable lessons were learned with the birth of the generation botanical drug product HMPL004-6599.
Botanical drug product,andrographis paniculata,HMPL-004,ulcerative colitis
10.11842/wst.2017.03.012
R289
A
(责任编辑:马雅静,责任译审:王晶)
2017-03-20
修回日期:2017-03-20
*通讯作者:华烨,博士,主要研究方向:中药新药研发。

