分子模拟—活性自由基聚合法制备山奈酚分子印迹整体柱及其性能评价
买买提·吐尔逊+热萨莱提·伊敏+买合木提江·杰力+古丽巴哈尔·达吾提+楚刚辉+尹学博

摘 要 通过分子模拟研究模板分子与功能单体的相互作用,可以缩短优化时间,为选取合适的功能单体以及模板分子/功能单体比例提供依据。本研究以山奈酚为模板分子,通过分子模拟优化实验条件,确定以甲基丙烯酸(MAA)为最优的功能单体,山奈酚/MAA最佳比例为1∶4 (w/w)。此外,以二苄基三硫代碳酸酯(DBTTC)为可逆加成链断裂转移剂,乙二醇二甲基丙烯酸酯(EDMA)为交联剂,实现了仅需优化引发剂和可逆加成断裂链转移聚合(RAFT)试剂即可制得性能优异的山奈酚分子印迹整体柱。此整体柱对山奈酚和相似物槲皮素的分离度为1.52,相对标准偏差为1.8%。实验结果表明,分子模拟计算简化了实验步骤,以DBTTC为RAFT试剂得到了具有更好形态和结构的分子印迹整体柱。
关键词 山奈酚; 分子印迹; 整体柱; 高效液相色谱; 分子模拟
1 引 言
采用分子印迹技术可以制备针对目标分子具有专一性识别和高亲和力的聚合物。非共价分子印迹技术是目前广泛使用的分子印迹聚合物(MIP)制备方法[1,2]。相对而言,非共价分子印迹聚合物虽然对目标分子的识别专一性略低,但具有吸附解吸附快等优点,特别适合制备样品前处理柱和色谱柱[3,4]。其中,分子印迹整体柱结合了MIP的高选择性和整体柱的优点,近年来受到了研究者的广泛关注[5~10]。
制备柱效高的色谱固定相材料是整体柱制备的关键。影响色谱柱柱效的因素有聚合物的形态和孔结构,以及单体与模板分子比例。一些文献报道了聚合条件和方法对整体柱形态和孔结构的影响[11]。常用的自由基聚合方法在合成整体柱聚合物过程中,存在偶合终止反应、歧化终止反应和链转移反应等,使制备过程难以控制[12,13],得到的MIP聚合物分子量分布宽,聚合物结构均匀性差。而开发新的可逆加成断裂链转移聚合(RAFT)试剂有助于消除自由基聚合中的副反应[14,15]。对于聚合反应中单体与模板分子比例的选择,目前多采用实验摸索,即比较不同比例的单体与模板分子所制备得到的聚合物的性质,以确定最佳的比例,但这种通过实验的方法复杂费时,且由于需考虑较多的影响因素,因此较难得到优化的比例。
针对上述问题,本研究采用分子模拟计算考察了模板分子山奈酚(Kaempferol)和功能单体的结合能以及结合比,计算结果表明,与2乙烯基吡啶(2VP)相比,甲基丙烯酸(MAA)为更好的功能单体,且模板分子山奈酚/MAA的最佳比例为1∶4 (w/w)。制备了二苄基三硫代碳酸酯(Dibenzyltrithiocarbonate, DBTTC)为RAFT试剂[16],有效抑制了双基终止反应,从而实现对自由基聚合的有效控制,并克服了MIP整体柱结构的不均匀性问题,仅需优化引发剂和RAFT试剂即可制备出性能优异的整体柱。
2 实验部分
2.1 仪器与试剂
LC20AT高效液相色谱仪,配有SPDM20A二极管阵列检测器、DGU20A5在线脱气机、LCsolution 工作站(日本岛津公司);S3500N扫描电子显微镜(日本日立公司);Tristar 3000氮吸附仪(美国Micromeritics公司);Autopore Ⅳ 9500压汞仪(Micromeritics, USA)。
山奈酚(纯度98%,中国药品生物制品检定所);甲基丙烯酸(MAA,分析纯,天津大茂化学试剂厂);2乙烯基吡啶(2VP,分析纯,上海阿拉丁试剂有限公司);乙二醇二甲基丙烯酸酯(EDMA,分析纯,山东烟台云开化工有限责任公司);偶氮二异丁腈(AIBN,化学纯,上海试四赫维化工有限公司);其余试剂均为分析纯;实验用水为二次蒸馏水。
2.2 实验方法
2.2.1 复合物的分子模拟计算 利用喀什大学高性能计算平台上的Gaussian 09 软件, 使用DFT RBVP86模拟计算模板分子与功能单体形成复合物之间的相互作用能,计算了山奈酚为模板分子与MAA或2VP为功能单体形成的复合物的结构、成键情况、结合能以及复合物的聚合比等。计算平台包括24個6核通用处理器,内存容量128 GB,计算机群在Linux 操作系统下执行Gaussian 09 软件, 主要采用密度泛函理论(DFT)方法。
2.2.2 分子印迹整体柱的制备 采用文献[16]报道的相转移催化法合成RAFT 试剂二苄基三硫代碳酸酯 (DBTTC)。模板分子山奈酚加入甲醇1.0 mL、MAA 0.24 g (2.8 mmol,功能单体)、EDMA 2.8 g (14.0 mmol,交联剂)、十二醇7.6 mL,超声10 min使之混合均匀;加入引发剂AIBN和RAFT试剂DBTTC,再次超声10 min,通氮气10 min。将混合溶液注入两端接有PVC管的不锈钢色谱柱管(150 mm×4.6 mm)中,封口,60 ℃水浴反应24 h后,将延长管取下,色谱柱接入液相色谱系统,用HAcCH3OH(20∶80, V/V)为流动相,洗去模板分子及未反应物。改变AIBN和DBTTC的比例,按照上述过程制备不同比例的整体柱。非印迹柱的制备除不加模板分子外,其余条件与印迹整体柱相同。
2.2.3 山奈酚分子印迹整体柱材料的形态及孔径分析 将延长管中的聚合物取出,以冰乙酸甲醇(20∶80, V/V)、甲醇索氏提取,置于真空干燥箱中50℃干燥2 h。扫描电镜观察整体柱聚合物的形貌,氮吸附(BET法)测定孔容和比表面积。整体柱的孔隙率(ε)、通透性KF用以下公式[17]进行计算。
2.2.4 液相色谱法评价整体柱的分离效率 以分子印迹整体柱作为固定相,0.1% H3PO4甲醇(20∶80, V/V)为流动相,测定印迹整体柱和非印迹整体柱对山奈酚和槲皮素(Quercetin)的分离效率。检测波长为365 nm,保留因子k、分离因子α、分离度(Rs)用以下公式进行计算。
3 结果与讨论
3.1 复合物的计算模拟
山奈酚和槲皮素是植物界分布最广的类黄酮化合物,具有较强的抗氧化性能[18,19],开发山奈酚选择性提取或分离的MIP技术尤为重要。在本研究组前期条件实验(结果未给出)的基础上,从5个不同功能单体中选择MAA和2VP两种功能单体,采用Gaussian 09 软件, 使用DFT RBVP86模拟计算模板分子山奈酚与MAA和2VP两种功能单体之间的相互作用能及复合物的氢键键长。图1为模拟计算得到的山奈酚与功能单体MAA和2VP的结构示意图,其中阴影部分为模板分子山奈酚,周围是与山奈酚通过氢键结合的功能单体分子。
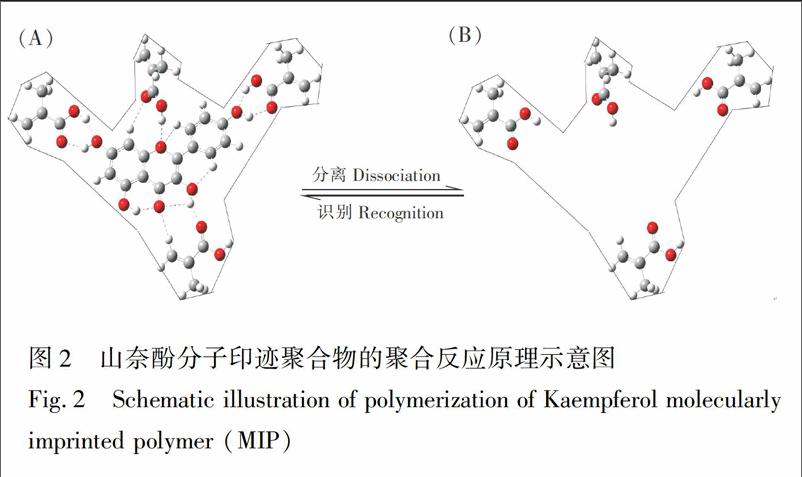
计算结果表明,山奈酚与MAA的摩尔比为1∶4时,可以通过氢键形成完整的包结结构(图1A)。山奈酚分子与MAA分子之间24O与28H、48O与23H、31O与79H等形成较稳定的氢键网络,增加了复合物结构稳定性。而且,山奈酚分子22号、29号位置的O(22O、29O)和MAA分子55号、43号位置的H(55H、43H)所形成的氢键键长较短,键能较大。山奈酚与功能单体MAA所形成的氢键数为12,而与功能单体2VP所形成的复合物中氢键总数为10个。结合单体分子MAA与模板分子形成的氢键键长更短(表1)可知,由山奈酚与MAA所形成的印迹聚合物分子结构更稳定。因此,MAA适合作为山奈酚MIP的功能单体,且山奈酚/MAA的最优分子比例为1∶4。分子模拟还可以预测分子印迹空穴的形状,图2显示了MAA为功能单体时的分子印迹空穴及山奈酚吸附解吸附的过程。
3.2 聚合条件对于分子印迹整体柱结构形态的影响
进行RAFT聚合时,双官能团二苄基三硫代碳酸酯DBTTC作为链转移试剂, 和由AIBN引发得到的聚合链进行可逆链转移,抑制双基终止反应,从而实现对自由基聚合的有效控制,得到分子量分布窄的MIP [20]。分子模拟计算表明MAA比2VP更适合作为功能单体,且MAA和山奈酚优化的摩尔比为4∶1。因此,选择MAA为功能单体,EDMA为交联剂,模板分子/功能单体/交联剂的摩尔比为1∶4∶20。为验证分子模拟计算结果,同时使用2VP为功能单体合成山奈酚MIP整体柱,但所得聚合物颗粒小,柱压过大后容易塌陷,这也从另一侧面验证了分子模拟计算结果的正确性。因此,通过分子模拟计算可以省去功能单体的选择及功能单体和模板分子比例的优化等步骤。
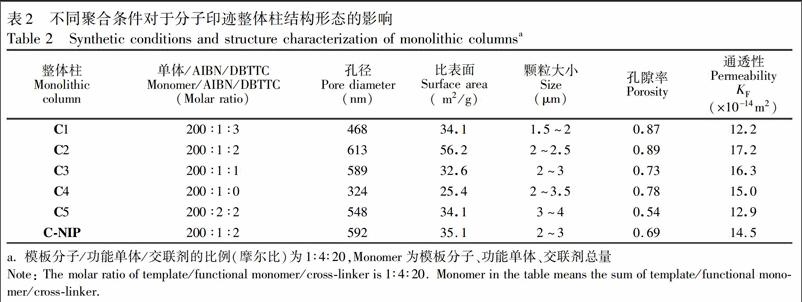
选择甲醇十二醇(20∶80,V/V)为致孔剂,AIBN为引发剂,DBTTC为链转移剂,优化单体总量和致孔剂的比例,探讨了RAFT法制备分子印迹整体柱的合成条件及其对于结构、色谱分离特性的影响。表2为改变引发剂浓度及AIBN和DBTTC的比例合成的整体柱情况。研究了RAFT聚合条件对于整体柱结构及分离效果的影响,并以氮吸附和压汞实验测定了聚合物的孔径和比表面积(表2,图3)。
氮气吸附和压汞实验表明,加入RAFT试剂合成的C1和C2柱平均孔径小于不加RAFT的C4。与AIBN引发传统自由基反应的整体柱相比,RAFT方法制备的整体柱孔径分布较窄,聚合物颗粒均匀,证明了RAFT方法的可控性。同时,加入RAFT 试剂的C1和C2具有更大的比表面及孔隙率,具有更好的孔结构。
从表2、图3和图4的结果可知,单体浓度增大导致整体柱材料的孔径变小,比表面积增大和颗粒粒径也变小。可能是因为随着溶剂(致孔剂)量的减小,引发剂浓度增大导致活性中心增多,反应速度加快,从而导致链增长和相分离速度加快。小颗粒相互连接成簇,且簇与簇之间的连接紧密,导致孔径减小。与传统自由基聚合相比,加入DBTTC的整体柱固定相孔径较小,且比表面和孔隙率明显较高。最终,选取C2柱的合成条件制备山奈酚MIP整体柱。
3.3 合成时Monomer/AIBN/RAFT比例对分离效率的影响
为考察印迹整体柱和非印迹整体柱对山奈酚和槲皮素的分离效率,测定了不同整体柱对于山奈酚和槲皮素的保留因子、选择性、分离度(表3,图5)。随着RAFT试剂加入量的增加,由于孔径分布较窄,比表面增大,结构更加均匀,山奈酚印跡柱的分离因子和柱效都明显提高,分离度增大。
图5为C2柱的分离色谱图,色谱数据显示,结构类似物槲皮素几乎没有被山奈酚整体柱保留,而作为模板分子的山奈酚被有效保留,并显示出典型的分子印迹整体柱的洗脱曲线特性—拖尾。均匀的结构是决定聚合物整体柱性能的重要因素,而RAFT试剂起到了控制聚合过程、调节聚合物形态和性能的作用。
3.4 整体柱的稳定性
以0.1% H3PO4甲醇(20∶80,V/V)为流动相,呈良好的线性关系。流速达到3.0 mL/min时,柱压仅为3.5 MPa。 另外,取山奈酚和槲皮素混合溶液, 6次进样,每次进样量20 μL,山奈酚和槲皮素的平均分离度为1.52,分离度的相对标准偏差为1.8%。上述结果表明,整体柱存在大的通孔,且孔结构稳定。
4 结 论
研究结果表明, 分子模拟可以提供优化的功能单体以及单体/模板分子比例信息,有效缩短整体柱制备的条件优化过程。同时,采用二苄基三硫代碳酸酯为RAFT试剂可以实现可控自由基聚合,从而获得更为均匀的分子印迹整体柱和较好分离效果。与传统自由基聚合法相比,RAFT自由基聚合法得到的整体柱比表面积大、孔径较小、骨架结构均匀。本研究中的分子模拟优化的功能单体和选择单体/模板分子比例的方法也可用于其它模板分子的MIP的制备。
Referneces
1 Levkin P A, Eeltink S, Stratton T R. J. Chromatogr. A, 2008, 1200: 55-61
2 Zhong X W, Deng F, Wang Y H, Luo X B. Microchim. Acta, 2013, 180: 1453-1460
3 YANG JianWen, LIU YaHong, WANG ZongNan, BIAN Kui, SONG XuQin, ZHOU Tong, ZHANG FangYu, HE LiMin, SAI GengDian. Chinese J. Anal. Chem., 2014, 42(6): 878-884
杨建文, 刘雅红, 王宗楠, 卞 愧, 宋旭琴, 周 同, 张方愉, 贺利民, 赛庚啶. 分析化学, 2014, 42(6): 878-884
4 WANG YanHong, HUO JiaPing, ZHANG Hong, WANG ShiCheng, SI ShiHui, LIN GuiFeng, LI GuoChen, LIU Wei. Chinese J. Anal. Chem., 2010, 38(5): 678682
王颜红, 霍佳平, 张 红, 王世成, 司士辉, 林桂凤, 李国琛, 刘 伟. 分析化学, 2010, 38(5): 678-682
5 Haginaka J. J. Sep. Sci., 2009, 32(10): 1548-1565
6 Whitcombe M J, Chianella I, Larcombe L, Piletsky S A, Noble J, Porter R, Horgan A. Chem. Soc. Rev., 2011, 40(3): 1547-1571
7 GONG YanRu, WANG Yue, DONG JiaBin, YANG Jing,REN XiaoWei, GONG BoLin. Chinese J. Anal. Chem., 2014, 42(1): 28-35
龔艳茹, 王 玥, 董佳斌, 杨 静, 任晓伟, 龚波林. 分析化学, 2014, 42(1): 28-35
8 Zhang Z H, Zhang M L, Liu Y A, Yang X, Luo L, Yao S Z. Sep. Purif. Technol., 2012, 87: 142-148
9 LI Hua, JI Xiang, WEI Liu. Chinese J. Anal. Chem., 2015, 43(8): 1130-1135
李 桦, 冀 翔, 卫 柳. 分析化学, 2015, 43(8): 1130-1135
10 Liu Z S, Xu L, Yan C, Gao R Y. Anal. Chim. Acta, 2004, 523: 243-250
11 LIU Yong, JIN YuZi. Polymer Bulletin, 2009, (6): 59-67
刘 勇, 金玉子. 高分子通报, 2009, (6): 59-67
12 Quinn J F, Chaplin R P, Davis T P, J. Polym. Sci. A, 2002, 40: 2956-2966
13 ZHANG Yi, DONG XiangChao. Journal of Instrumental Analysis, 2008, 27(10): 1025-1030
张 毅, 董襄朝. 分析测试学报, 2008, 27(10): 1025-1030
14 Zhang Y, Ding J H, Gong S W. J. Appl. Polym. Sci., 2013, 128(5): 2927-2932
15 ZHANG H Q. Eur. Polym. J, 2013, 49(3): 579-600
16 Lee A W M, Chan W H, Wong H C. Synth. Commun., 1998, 18: 1531-1536
17 Turson M, Zhou M, Jiang P, Dong X C. J. Sep. Sci., 2011, 34(2): 127-134
18 Boots A W, Haenen GR, Bast A. Eur. J. Pharmacol., 2008, 585(23): 325-337
19 ZHU YaYun, PAN LiangJun, ZHAO LiangRong, YAN MingXun. YANG ChangYing. Natural Product Research and Development, 2013, 25(6): 792-795
祝亚云, 潘良军, 赵良容, 晏名勋, 杨昌英. 天然产物研究与开发, 2013, 25(6): 792-795
20 Bai R K,You Y Z, Pan C Y. Macromol. Rapid Commun., 2001, 22: 315-319

