结直肠癌组织KRAS、BRAF基因突变情况及其临床意义
陈伊,韦常宏,宁淑芳,韦文娥,刘海洲,利基林,张力图
(广西医科大学附属肿瘤医院,南宁 530021)
结直肠癌组织KRAS、BRAF基因突变情况及其临床意义
陈伊,韦常宏,宁淑芳,韦文娥,刘海洲,利基林,张力图
(广西医科大学附属肿瘤医院,南宁 530021)
目的 探讨结直肠癌组织KRAS、BRAF基因突变情况及其临床意义。方法 选择行手术治疗的结直肠癌患者262例,采用ARMS-PCR法检测其结直肠癌组织KRAS基因外显子2第12、13位密码子及BRAF V600E基因突变情况,分析其与患者临床病理参数、肝转移及预后的关系。结果 262例结肠癌患者中女性患者98例。262例份结肠癌组织中,KRAS基因突变49例(18.7%),其中第12位密码子突变37例(包括1例KRAS复合突变),第13位密码子突变12例;184例份结肠癌组织中,BRAF V600E基因突变6例。结直肠癌组织KRAS基因突变与患者性别(女性)、原发肿瘤直径、远处转移情况均有关,BRAF基因突变与民族、家族史、原发肿瘤分化程度均有关(P均<0.05)。同时性肝转移患者KRAS基因突变率高于异时性肝转移患者,KRAS基因G13D突变率低于异时性肝转移患者(P均<0.05)。KRAS基因突变的结直肠癌患者生存时间短于未突变者(P<0.05)。KRAS基因突变是结直肠癌患者预后的独立危险因素(P<0.01)。BRAF基因突变与未突变者生存时间比较差异无统计学意义(P>0.05)。结论 结直肠癌组织KRAS基因突变率高,BRAF基因突变率低;KRAS基因突变多发生于女性,与结直肠癌的发生、发展有关。
结直肠癌;KRAS基因;BRAF基因;基因突变;预后
KRAS基因是EGFR信号通路上的一个重要作用靶点,抗EGFR单克隆抗体(西妥昔单抗、帕尼单抗)治疗结直肠癌的疗效与KRAS基因突变状态密切相关,只有KRAS野生型患者才可从抗 EGFR单克隆抗体单药治疗或联合化疗中获益[1]。BRAF V600E基因是KRAS基因下游的作用位点,其突变状态可能会影响抗EGFR单克隆抗体的治疗效果。2009年1月~2012年12月,本研究观察了结直肠癌组织KRAS与BRAF基因的突变情况,现分析结果并探讨其临床意义。
1 资料与方法
1.1 临床资料 选择同期于广西医科大学附属肿瘤医院行手术治疗的结直肠癌患者262例,男164例、女98例,年龄24~87岁、中位年龄55岁;民族:汉族182例、壮族70例、其他10例;家族史:结直肠腺癌家族史4例、大肠腺瘤家族史2例、溃疡性结肠炎家族史2例、家族性腺瘤性息肉病1例;组织学类型:腺癌229例、黏液腺癌+印戒细胞癌33例;肿瘤部位:左半结肠81例、右半结肠70例、直肠111例;原发肿瘤分化程度:低分化93例、中分化161例、高分化8例;原发肿瘤直径:≤5 cm 146例、>5 cm 116例;T分期:T1、T2期20例、T3、T4期242例;N分期:N0期95例、N1期98例、N2期69例;远处转移情况:无转移70例、肝转移135例、其他部位转移57例;肝转移情况:同时性肝转移105例、异时性肝转移30例;临床分期:Ⅰ、Ⅱ期35例、Ⅲ、Ⅳ期227例。均经病理组织学检查确诊为结直肠癌,术前均未接受抗EGFR靶向治疗。本研究经医院伦理委员会审核,患者及其家属均签署知情同意书。
1.2 癌组织KRAS、BRAF基因突变检测 采用ARMS-PCR法。收集262例患者术中切除的新鲜肿瘤组织,立即放入液氮中冷冻, -80 ℃冰箱保存。将组织进行甲醛固定、石蜡包埋,4 μm厚切片,脱蜡、水化,共10张切片。取1张切片进行HE染色,显微镜下选择肿瘤细胞富集区域,确保其肿瘤细胞比例≥80%。取其余9张切片,参照DNeasy Blood &Tissue Kit和QIAamp DNA FFPE Tissue Kit试剂盒(德国Qiagen公司)说明书提取样本DNA,采用ARMS-PCR法检测KRAS基因外显子2第12、13位密码子突变情况。其中184例份结直肠癌组织仅行BRAF V600E突变检测。参照人类KRAS基因7种突变检测试剂盒和人类BRAF基因V600E突变检测试剂盒说明书,KRAS基因外显子2上游引物:5′-AGGCCTGCTGAAAATGACTG-3′,下游引物:5′-GGTGCAGGACCATTCTTTGA-3′,目的片段:173 bp;BRAF基因第15号外显子上游引物:5′-GCTFGCTCTGATAGGAAAATGAG-3′,下游引物:5′-GTAACTCAGCAGCATCTCAGG-3′,目的片段:237 bp。反应循环参数:95 ℃、5 min;95 ℃、25 s,64 ℃、20 s,72 ℃、20 s,循环15次;93 ℃、25 s,60 ℃、35 s,72 ℃、20 s,循环31次。每次试验均按要求设定阴性、阳性对照孔及空白对照孔。使用Roche480Ⅱ实时荧光定量PCR仪进行检测,PCR产物经3%琼脂糖凝胶电泳确定后,根据突变检测试剂盒说明书提供的判读原则,将样品ΔCt值(突变Ct值-外控Ct值)与信号阈值比较,样品检测结果分为阳性和阴性。
1.3 相关性分析 分析KRAS、BRAF基因突变与患者临床病理参数的关系;随访至2015年12月,以死亡为终点事件,绘制生存曲线,分析KRAS、BRAF基因突变与患者生存时间及预后的关系。
1.4 统计学方法 采用SPSS19.0统计软件。KRAS、BRAF基因突变率与临床病理参数的关系采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法绘制生存曲线,Log-Rank检验法分析KRAS、BRAF基因突变对患者生存时间的影响,COX比例风险回归模型进行预后影响因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 KRAS、BRAF基因突变情况 262例份结肠癌组织中,KRAS基因突变49例(18.7%);第12位密码子突变37例(14.1%),包括1例KRAS复合突变(G12V和G12R同时突变),第13位密码子突变12例(4.6%),未检出第12、13位密码子同时突变;其余均未发生突变。184例份结肠癌组织中,BRAF V600E基因突变6例(3.3%)。见表1。同时性与异时性肝转移患者KRAS基因突变率分别为27.6%(29/105)、6.7%(2/30),二者比较P<0.05; KRAS基因G13D突变率分别为4.8%(5/105)、30%(9/30),二者比较P<0.05;同时性与异时性肝转移患者KRAS基因其他类型突变率比较P均>0.05。
2.2 结直肠癌组织KRAS、BRAF基因突变与患者临床病理参数的关系 见表2。
2.3 结直肠癌组织KRAS、BRAF基因突变与患者预后的关系 患者术后随访2.37~77.31个月,失访8例,随访率为96.9%。 共30例患者死亡, 中位
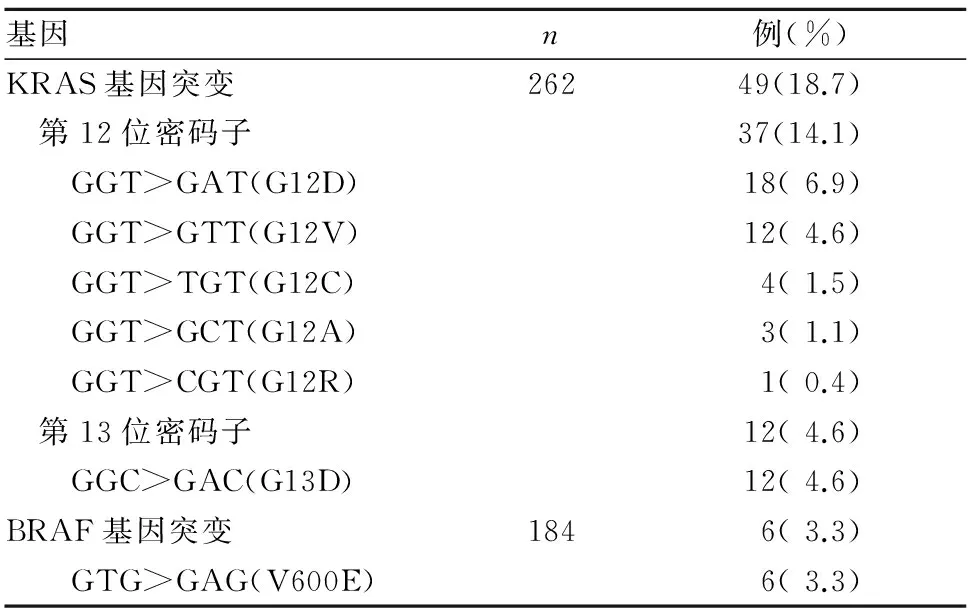
表1 结直肠癌组织中KRAS、BRAF基因突变情况
注:检出1例KRAS复合突变,为G12V和G12R同时突变。

表2 结直肠癌组织KRAS、BRAF基因突变与患者临床病理参数的关系
生存时间为22.43个月。生存曲线分析结果显示,KRAS基因突变的结直肠癌患者生存时间为(27.43±3.2)个月,未突变者为(46.22±4.25)个月,二者比较P<0.05;BRAF基因突变的结直肠癌患者生存时间为(31.23±3.61)个月,未突变者为(35.93±2.19)个月,二者比较P>0.05。COX比例风险回归模型多因素分析结果显示,KRAS基因突变是结直肠癌患者预后不良的独立危险因素(β=2.044,RR=7.725,95%CI:2.722~21.927,P<0.01)。
3 讨论
结直肠癌的发生、转移是一个受多基因、多因素影响的过程,EGFR与肝转移密切相关[2]。KRAS、BRAF基因是该信号通路下游的重要位点,其中BRAF基因又是KRAS基因下游的重要位点,与恶性肿瘤的发生、发展密切相关。KRAS基因野生型患者能从抗EGFR靶向治疗中获益,但仍有部分患者对抗EGFR药物治疗无反应;BRAF基因与抗EGFR治疗效果的关系目前无统一定论,尚不能单独作为预测因子。本研究结直肠癌组织KRAS基因突变率为18.7%,BRAF基因突变率为3.3%,与目前国内外研究报道接近[3~5]。一项来自多地区、纳入6 346例患者的研究表明, G12R突变为我国罕见突变类型[6]。本研究检出1例G12R突变,该患者同时伴有G12V突变;并未检出KRAS基因第12、13位密码子同时突变,表明各密码子突变是相互独立的。V600E为BRAF基因的常见突变位点,本研究显示该位点突变率较低,仅为3.3%。
高静等[4]研究认为,KRAS突变更易发生在女性且分化程度较好的右半结肠癌患者中,并与年龄有关。也有研究认为,KRAS基因突变与结直肠癌患者的年龄、性别、分化程度、肿瘤位置等临床病理参数均无关[7,8]。本研究结果显示,结直肠癌组织KRAS基因突变与患者的性别、原发肿瘤直径、远处转移情况均有关。Chen等[9]大样本Meta分析结果显示,女性、老年患者以及右半结肠癌患者BRAF基因突变率较高;但也有研究显示BRAF突变与临床病理参数之间无显著性关系[10]。本研究中结直肠癌组织BRAF基因突变与患者的民族、家族史、原发肿瘤分化程度均有关。
KRAS、BRAF基因突变对结直肠癌患者肝转移及预后的影响报道不一[10,11]。Bazan等[12]认为,KRAS基因第13位密码子突变与高度侵袭性结直肠癌相关,预示其可能是肿瘤扩散和导致患者死亡的独立危险因素。Yaeger等[13]研究表明,BRAF基因突变与转移性结肠癌预后差有关,伴有该基因突变的患者更容易发生肝、腹膜转移,且转移瘤术后生存期更短。Modest等[14]研究结果表明,KRAS基因第13位密码子突变与结直肠癌发生同时性肝转移及局部转移相关。梁立等[15]指出,结直肠癌同时性肝转移与RAS-RAF-ERK、P13K-PTEN-AKT通路同时激活有关,异时性肝转移与P13K-PTEN-AKT单独激活、RAS-RAF-ERK不激活有关。本研究结果显示,同时性肝转移患者KRAS基因突变率高于异时性肝转移患者,KRAS基因G13D突变率低于异时性肝转移患者。G13D突变有一定的疗效评估作用,G13D突变的结直肠癌患者能从一线西妥昔单抗治疗中获益,而且其获益程度与KRAS野生型相仿,提示KRAS基因G13D突变的特殊性。由于已经得出BRAF基因突变与患者远处转移情况无关的结果,故本研究未对同时性与异时性肝转移患者的BRAF基因突变率进行对比分析。文献报道,KRAS第13位密码子突变的患者较未突变者生存期更短[5, 16]。但本研究结果显示,KRAS基因突变的结直肠癌患者生存时间明显短于未突变者,KRAS基因突变是结直肠癌患者预后的独立危险因素,提示KRAS基因突变患者预后较差;但本研究并未发现KRAS基因G13D突变、BRAF基因突变与预后的关系,可能与样本量小、随访时间短有关。
综上所述,结直肠癌组织KRAS基因突变率高,BRAF突变率低;KRAS基因突变多发生于女性,与结直肠癌的发生、发展有关。未来将进一步明确KRAS基因在结直肠癌肝转移中的作用,及其突变相关生物标志物的表达变化,以期为结直肠癌的快速诊断、病情判断及预后评估提供理论依据。
[1] Xu J, Qin X, Wang J, et al. Chinese guidelines for the diagnosis and comprehensive treatment of hepatic metastasis of colorectal cancer[J]. J Cancer Res Clin Oncol, 2011,137(9):1379-1396.
[2] Folprecht G, Lutz MP, Schöffski P, et al. Cetuximab and irinotecan/5-fluorouracil/folinic acid is a safe combination for the first-line treatment of patients with epidermal growth factor receptor expressing metastatic colorectal carcinoma[J]. Ann Oncol, 2006,17(3):450-456.
[3] Maughan TS, Adams RA, Smith CG, et al. Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial[J]. Lancet, 2011,377(9783):2103-2114.
[4] 高静,孙志伟,李艳艳,等.中国结直肠癌患者966例中KRAS和BRAF基因突变分析[J].中华病理学杂志,2012,41(9):579-583.
[5] Chen J, Guo F, Shi X, et al. BRAF V600E mutation and KRAS codon 13 mutations predict poor survival in Chinese colorectal cancer patients[J]. BMC Cancer, 2014,(14):802.
[6] 王东,梁旺,段笑微,等.中国6 364例结直肠癌患者KRAS基因突变检测分析[J].中华病理学杂志, 2014,43(9):583-587.
[7] Rui Y, Wang C, Zhou Z, et al. K-Ras mutation and prognosis of colorectal cancer: a meta-analysis[J]. Hepatogastroenterology, 2015,62(137):19-24.
[8] Li Z, Chen Y, Wang D, et al. Detection of KRAS mutations and their associations with clinicopathological features and survival in Chinese colorectal cancer patients[J]. J Int Med Res, 2012,40(4):1589-1598.
[9] Chen D, Huang JF, Liu K, et al. BRAFV600E mutation and its association with clinicopathological features of colorectal cancer: a systematic review and meta-analysis[J]. PLoS One, 2014,9(3):e90607.
[10] Martinetti D, Costanzo R, Kadare S, et al. KRAS and BRAF mutational status in colon cancer from Albanian patients[J]. Diagn Pathol, 2014,(9):187.
[11] Prahallad A, Sun C, Huang S, et al. Unresponsiveness of colon cancer to BRAF(V600E) inhibition through feedback activation of EGFR[J]. Nature, 2012,483(7387):100-103.
[12] Bazan V, Migliavacca M, Zanna I, et al. Specific codon 13 K-ras mutations are predictive of clinical outcome in colorectal cancer patients, whereas codon 12 K-ras mutations are associated with mucinous histotype[J]. Ann Oncol, 2002,13(9):1438-1446.
[13] Yaeger R, Cercek A, Chou JF, et al. BRAF mutation predicts for poor outcomes after metastasectomy in patients with metastatic colorectal cancer[J]. Cancer, 2014,120(15):2316-2324.
[14] Modest DP, Stintzing S, Laubender RP, et al. Clinical characterization of patients with metastatic colorectal cancer depending on the KRAS status[J]. Anticancer Drugs, 2011,22(9):913-918.
[15] 梁立,韦烨,钟芸诗,等.K-ras基因突变与结直肠癌肝转移及其预后关系的研究[J].中华胃肠外科杂志,2012,15(11):1156-1161.
[16] Douillard JY, Siena S, Cassidy J, et al. Randomized, phase Ⅲ trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study[J]. J Clin Oncol, 2010,28(31):4697-4705.
广西科学研究与技术开发计划基金资助项目(桂科攻1298003-2-8);南宁市青秀区科学研究与技术开发计划基金资助项目(2015S03)。
张力图(E-mail: zhanglitu@gmail.com)
10.3969/j.issn.1002-266X.2017.16.026
R735.3
B
1002-266X(2017)16-0077-04
2016-10-13)

