电针对5月龄APP/PS1转基因小鼠海马组织及组织间液可溶性 Ab1-42水平的影响
步青云,薛卫国
电针对5月龄APP/PS1转基因小鼠海马组织及组织间液可溶性 Ab1-42水平的影响
步青云,薛卫国
(北京中医药大学针灸推拿学院,北京 100029)
目的 观察电针干预对早期阿尔茨海默病(AD)小鼠脑组织间液(interstitial fluid,ISF)及海马组织中可溶性Ab1-42水平的影响。方法 将雄性5月龄APP/PS1转基因阳性小鼠16只随机分为模型组和针刺组,将8只同窝、同性别转基因阴性小鼠设为正常对照组,采用电针百会、涌泉或同等条件束缚作为干预手段,以脑微透析技术获取小鼠海马组织间液,以Elisa检测3组小鼠海马组织以及海马ISFb淀粉样蛋白1-42水平分别在干预后的第6、7、8、9个小时变化情况。结果 与正常对照组相比,模型组海马组织以及ISF中可溶性Ab1-42明显升高(<0.01);与模型组相比,针刺组小鼠ISF可溶性Ab1-42降低(<0.05),海马组织Ab1-42对比无统计学差异(>0.05)。针刺组在电针治疗后的第6~9个小时之间的样品检测结果没有随时间变化的趋势(>0.05)。结论 电针可降低AD模型小鼠海马ISF可溶性Ab1-42水平。
阿尔茨海默病;电针;早期干预;脑组织间液;微透析;小鼠
阿尔茨海默病(Alzheimer's disease,AD)是一种中枢神经系统退行性疾病,临床表现主要为患者认知功能及记忆力的减退、智力衰退和生活自理能力的下降等,严重危害老年人的健康和生活质量。其主要病理改变是细胞间因淀粉样蛋白沉积而形成的老年斑(senile plaque,SP)、神经细胞内存在的神经原纤维缠结(neurofibrillary tangles,NFTs)及神经元丢失(neurons loss)等。AD发病机制有多种假说,包括氧化应激学说、Tau蛋白学说、神经血管学说、胆碱能学说等,目前占据主导地位、认可度最高的是b淀粉样蛋白(Beta-Amyloid Protein,Ab)级联学说[1-2]。
Ab级联学说进一步的研究显示,疾病早期Ab代谢紊乱可能是AD发病的初始事件。Ab在脑内的代谢异常可以分为生成增多和清除减少。研究表明,占AD发病群体95%以上的晚发性AD缺少基因突变促使Ab过度生成的证据[3],而Ab的清除障碍成为了晚发性AD最具可能性的病因。正常情况下,Ab从神经元产生后,可通过酶降解、细胞吞噬隔离和向外周血液转运等途径进行清除,组织间液(interstitial fluid,ISF)是其进入不同代谢途径的中间场所。Ab清除过程不易观察,选择其清除通路的中间环节——ISF检测可溶性Ab水平,是对电针能否切实改变Ab清除水平从而改善AD症状的较优选择。
本次实验设计采用电针疗法干预发病早期(5月龄)的APP/PS1小鼠,穴位组方选用涌泉、百会,上下交通,安神清气,益气通络。试图探讨电针干预对AD小鼠海马组织及海马ISF中可溶性Ab1-42水平的影响,为说明电针干预AD的疗效及机制提供实验依据。
1 材料与方法
1.1 动物及分组
实验采用清洁级雄性APP/PS1转基因阳性与同窝转基因阴性小鼠(南京大学模式动物研究所)作为实验对象。转基因阳性小鼠16只随机分为模型组(M)、针刺组(A),每组8只,转基因阴性小鼠(野生型)8只为正常对照组(C)。购入时为16周龄,体重(28±5)g。小鼠置于中国中医科学院医学实验中心动物房Individual ventilated caging system(IVC系统)饲养3星期以适应环境,室温20~25℃,相对湿度50%~65%,自由进食及饮水。本实验严格遵守中华人民共和国国家科学技术委员会制定的《实验动物管理条例》,并经北京中医药大学实验动物伦理委员会批准实施。
1.2 穴位选择和针刺方法
针刺组:将小鼠以自制鼠袋固定于操作台上,按照大鼠针灸穴位图谱及比较解剖学方法,在顶骨正中取百会,在两足底前、中1/3交界处取涌泉。选用华佗牌针灸针(苏州医疗用品厂有限公司),规格0.25 mm×13 mm,穴位与针具常规消毒,刺入2~3 mm,百会用手针,双涌泉行小幅度捻转后接HANs电针仪,采用疏密波,频率为1/50 Hz,强度0.5 mA,以针柄震颤、动物保持安静不挣扎嘶叫为度。每次针刺持续15 min,每日1次,连续3 d。
模型组、正常对照组:以相同方法用鼠袋束缚15 min,每日1次,连续3 d。
1.3 主要试剂和仪器
1.3.1 药品与试剂
5%水合氯醛(批号为20130201,国药集团化学试剂有限公司),医用生理盐水(氯化钠注射液,批号为B14041607,山东康宁药业有限公司);人工脑脊液Ⅰ(批号为2014080301,湖州英创生物科技有限公司);超敏试剂盒同批次Ab1-42标准品,浓度稀释至100 pg/mL,用于体外回收率测定。
人Ab42 Elisa试剂盒(美国,invitrogen, KHB3441);人Ab42超敏Elisa试剂盒(96T,美国,life technologies,KHB3544);Trizol(美国,Invitrogen, 15596026)。以上药品及试剂均在4℃冰箱保存,备用。
1.3.2 仪器与材料
68002双臂脑立体定位仪,68030小鼠及幼大鼠适配器(深圳市瑞沃德生命科技有限公司); STRONG90+102颅骨钻(SAESHIN PRECISION IND.CO.,韩国);玻璃子体水门汀(批号为201312,上海医疗器械股份有限公司齿科材料厂);微透析系统包括CMA130体外固定支架,CMA402双通道微量注射泵,CMA470低温微量收集器,CMA120清醒活动装置,1.0 mL玻璃微量注射器(瑞典CMA/Microdialysis公司);五通转环清醒活动装置(Instech Laboratories,Inc,美国);MAB13.8.1微透析探针(有效透析膜长为1 mm,分子截留量为100 kD)及MAB10.8.IC探针导管(Microbiotech/se AB公司,瑞典);YP2001N电子天平(上海精密科学仪器有限公司);韩氏穴位神经刺激仪(北京华卫产业开发公司,HANs LH202H型);一次性使用无菌针灸针(0.25 mm
×13 mm,北京中研太和医药有限公司)等。
1.4 实验方法
1.4.1 微透析采样
第3天干预后开始计时,将小鼠称重,腹腔注射5%水合氯醛麻醉(450 mg/kg),小鼠头部剃毛,固定于脑立体定位仪,使颅骨处于水平位(门齿位置低于两耳杆水平度约1 mm)。头部皮肤碘酒消毒,75%乙醇脱碘,然后切开长约1 cm小口,撑开,暴露颅骨表面。参考Paxinos G和Franklin KBJ[4]编写的小鼠立体定位图谱,以前囟(Bregma)为坐标原点,左侧海马的定位坐标为前囟后0.28 cm,中缝线左0.30 cm,垂直深度为 0.20 cm(微透析探针深度为0.21 cm)。在定位坐标处,打孔,插入探针导管至设定深度。在对侧位置打孔,拧上固定用螺丝,玻璃子体水门汀固定整个导管。待小鼠逐渐清醒后,备用。手术将微透析探针埋入小鼠左侧海马C3区内下方。于干预结束后第5个小时将其送入CMA/120清醒动物活动装置。将探针与CMA微量取样系统相连接,进行内外压平衡1 h。于干预结束后第6个小时开始正式的微透析采样工作。
以0.5mL/min的灌流速度进行微透析,灌流液选择人工脑脊液,一次取样透析时间为1 h,每小时采样结束即将样品放入﹣80℃冻存等待检测。每只小鼠取4次透析液样品,即干预治疗或束缚后第6、7、8、9个小时的样品,用于分析研究。
1.4.2 脑组织取材及样品制备
微透析采样结束后,将每组8只小鼠,予0.3%戊巴比妥钠(30 mg/kg)麻醉,开颅取微透析操作的对侧海马,及时做Elisa样品制备,完成后迅速置于﹣80℃冰箱保存。
Elisa样品的制备。每组8只小鼠采用微透析操作的方法操作对侧海马,称取海马的湿重,以8倍体积的5 mol盐酸胍、50 mmol Tris盐酸(pH8.0)、1 mmol PMSF混合液在冰上匀浆。4℃下16000 r/min,离心20 min,离心结束后立即取上清液。模型组按1:100的体积比加入标准稀释液(Invitrogen,KHB3441),电针组按1:20的体积比加入标准稀释液,正常对照组样品不稀释上清液,待测。
1.4.3 小鼠海马组织以及ISF Ab1-42的测定
采用Elisa双抗体夹心法,用人Ab1-42Elisa超敏试剂盒检测ISF中的含量,每孔按照1:1体积比各加入标准品或待测样品与样品稀释液,室温静置30 min。充分洗板,每孔加入检测抗体50mL(空白对照组除外),4℃过夜。次日上午充分洗板,每孔加二抗100mL,室温静置30 min。充分洗板,加入稳定色原,每孔100mL,放入暗箱避光,室温静置30 min。每孔加入100mL终止液。15 min内用酶标仪在450 nm处测吸光度值。以Excel绘制标准蛋白线,按样品OD值换算样品Ab1-42浓度,并根据样品读数及稀释浓度计算出海马区脑细胞间液可溶性Ab1-42浓度。
使用人Ab42Elisa试剂盒对海马组织样品Ab1-42含量进行检测。每孔各加入标准品或待测样品50mL。依照试剂盒说明常规操作检测。以Excel绘制标准蛋白线,按样品读数换算样品Ab1-42浓度,并根据样品稀释浓度计算出小鼠海马组织Ab1-42浓度。
1.4.4 待测样品Ab水平计算方法
依据小鼠在体实验Elisa检测结果,酶标仪读出样品OD值、标准品OD值,结合标准品对应的密度值用Excel做标准曲线2=0.9992>0.95,绘制曲线接近于直线。Ab1-42标准曲线公式为:蛋白浓度=37.042×OD值-6.2194。利用标准曲线公式计算每孔浓度(pg/mL),根据样品稀释比例,计算待测样品蛋白含量(pg/mL)。
由于3组小鼠样品均按照1:1稀释,故3组组织匀浆待测样品浓度的计算公式均为:Ab1-42含量=(37.042×OD值-6.2194)×2×8/1000。而每只小鼠脑内ISF所含Ab1-42水平为Ab1-42水平=(37.042×OD值-6.2194)×2/P。P为每只小鼠所用探针对应的回收率(见表1)。
1.5 统计学方法
应用SPSS17.0统计软件进行统计学处理。计量数据以均数±标准差表示。重复测量数据与时间相关性检测选用球形检验,组间比较如方差齐则采用单因素方差分析(-),两两比较用-检验,非正态分布的采用多样本的非参数检验。以<0.05为有统计学差异,<0.01为具有显著统计学差异。
2 结果
2.1 探针体外回收率检测
在正式实验之前,首先对所用探针进行体外回收率检测,共4个探针,每个探针每小时冻存一次样品,共3 h。流速0.5mL/min,透析原液为浓度100 pg/mL的Ab42标准品。Elisa得到标准曲线为=41.726-5.5367(2=0.9988),透析样品OD值套入标准曲线得到回收率结果如表1。
表1 探针体外回收率检测结果 (±s)

表1 探针体外回收率检测结果 (±s)
项目2号探针4号探针6号探针7号探针 探针OD值0.78±0.010.77±0.020.78±0.020.78±0.01 P(透析液)/(pg·mL﹣1)16.54±0.1616.43±0.4416.76±0.3916.62±0.22 h(探针回收率)/%16.54±0.1616.43±0.4416.76±0.3916.62±0.22
2.2 电针干预对5月龄APP/PS1小鼠海马组织及ISF可溶性Ab1-42水平的短时影响
以进行单因素方差分析,Elisa结果见表2、图1。检验进行各组间两两比较,海马组织检测结果,模型组Ab1-42表达水平高于正常对照组(<0.01);针刺组Ab1-42表达水平与模型组比较差异无统计学意义(>0.05)。ISF检测结果,模型组可溶性Ab1-42表达水平高于正常对照组(<0.01);针刺组可溶性Ab1-42表达水平低于模型组(<0.05)。
表2 电针对5月龄APP/PS1鼠海马组织及ISF Ab1-42表达水平的短时影响 [±s,r/(pg·mL﹣1)]
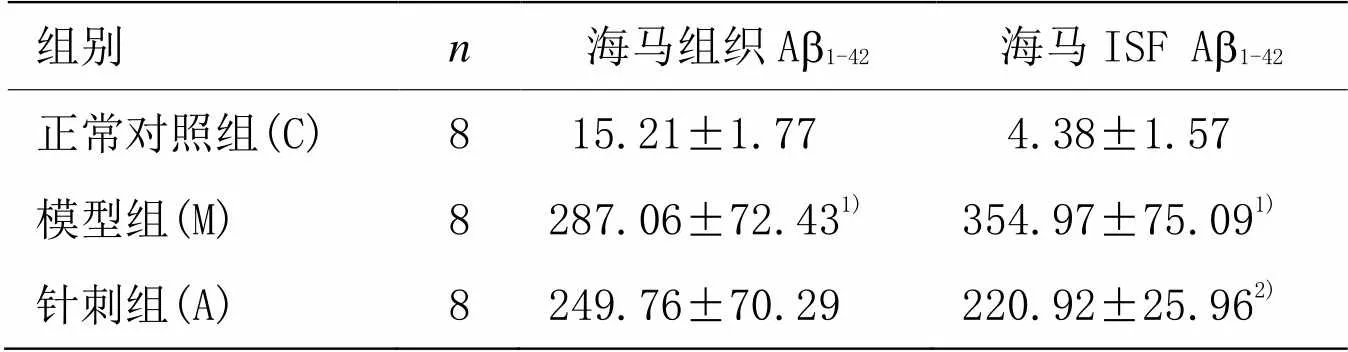
表2 电针对5月龄APP/PS1鼠海马组织及ISF Ab1-42表达水平的短时影响 [±s,r/(pg·mL﹣1)]
组别n海马组织Ab1-42海马ISF Ab1-42 正常对照组(C)815.21±1.774.38±1.57 模型组(M)8287.06±72.431)354.97±75.091) 针刺组(A)8249.76±70.29220.92±25.962)
注:与正常对照组比较1)<0.01;与模型组比较2)<0.05
2.3 小鼠经不同干预后脑组织间液(ISF)Ab1-42随时间变化
2.3.1 各组数据比较分析
重复测量数据分析3组ISF样品检测结果, Mauchly球形检验计量=0.900,=0.838,不拒绝球形假设,不用矫正。分组与时间的交互作用无统计学意义,时间因素的作用不随着分组的不同而不同。而组间效应方差分析结果,=93.427,=3.52E-11<0.01,表示针刺组、模型组与正常对照组的结果间存在显著差异。各组小鼠ISF中Ab1-42水平随时间变化结果用单因素分析如表3,与正常对照组相比,模型组海马ISF可溶性Ab1-42明显升高(<0.01);与模型组相比,针刺组小鼠ISF可溶性Ab1-42降低(<0.05,<0.01)。
2.3.2 针刺后短期内小鼠ISF的Ab1-42水平随时间变化结果
如前所述,Hour采用球形度结果,=0.788,=0.505>0.05,不同时间的检验结果差异没有统计学意义。故而采用单因素方差分析,Elisa结果OD值以及计算浓度见图2、表4。
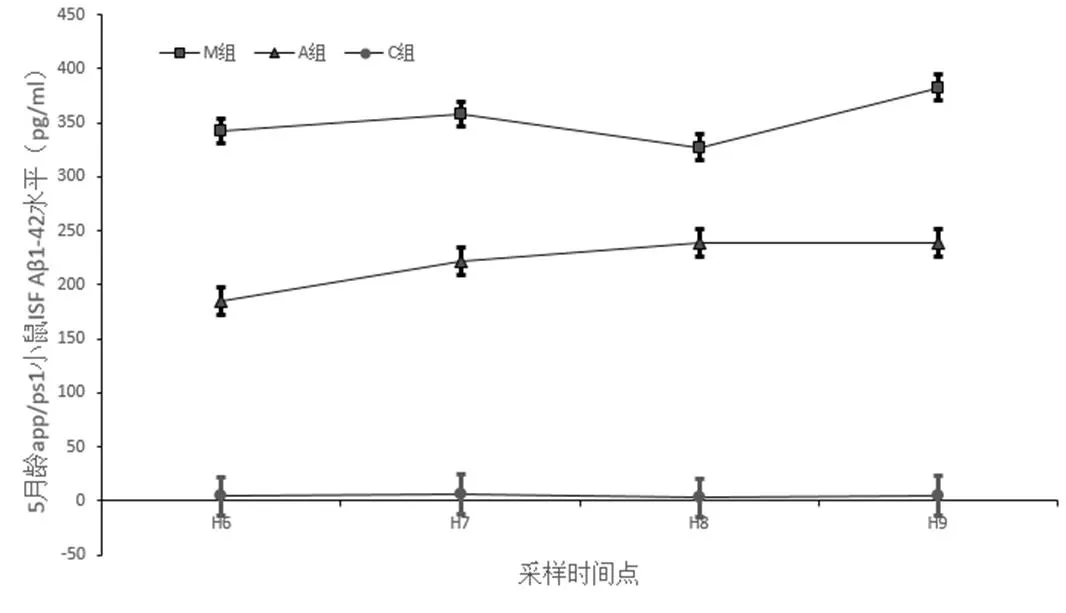
图2 小鼠脑组织间液可溶性Ab1-42均值对比[±s, r/(pg·mL﹣1)]
小鼠电针后第6、7、8、9小时样品ISF中Ab1-42含量相比较,>0.05,无统计学差异。模型组水平也较为恒定,表明针刺组在连续3 d治疗后,其可溶性Ab1-42水平降低效果,在最后一次针刺干预后6~9小时相对稳定。这有可能表示针刺干预后6~9小时处于一种恒定的低水平,也可能是连续3 d治疗的累积效应。
表3 小鼠脑组织间液可溶性Ab1-42水平 [±s,r/(pg·mL﹣1)]
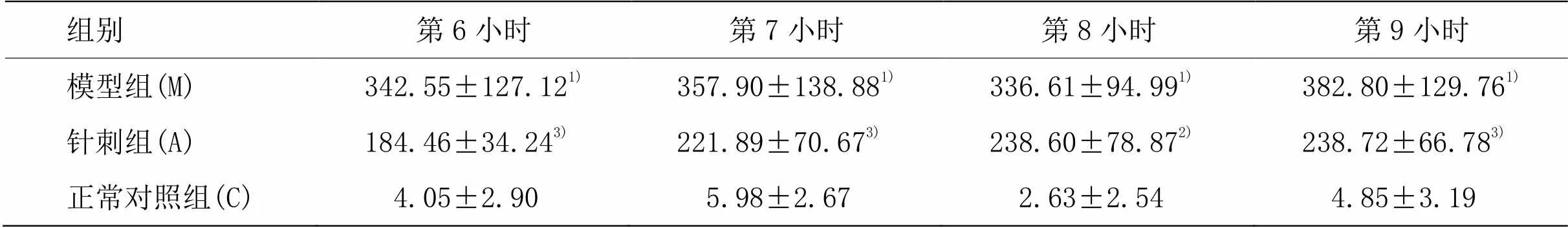
表3 小鼠脑组织间液可溶性Ab1-42水平 [±s,r/(pg·mL﹣1)]
组别第6小时第7小时第8小时第9小时 模型组(M)342.55±127.121)357.90±138.881)336.61±94.991)382.80±129.761) 针刺组(A)184.46±34.243)221.89±70.673)238.60±78.872)238.72±66.783) 正常对照组(C)4.05±2.905.98±2.672.63±2.544.85±3.19
注:与正常对照组比较1)<0.01;与模型组比较2)<0.05,3)<0.01
表4 针刺组小鼠海马ISF中Ab1-42表达水平随时间变化的结果 [±s,r/(pg·mL﹣1)]
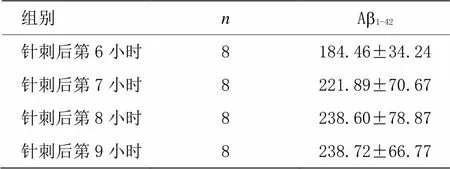
表4 针刺组小鼠海马ISF中Ab1-42表达水平随时间变化的结果 [±s,r/(pg·mL﹣1)]
组别nAb1-42 针刺后第6小时8184.46±34.24 针刺后第7小时8221.89±70.67 针刺后第8小时8238.60±78.87 针刺后第9小时8238.72±66.77
3 讨论
在人类的成年期,几乎没有新的神经元形成,任何大脑细胞因外伤和/或疾病而失去功能,都是不能以生成取代其作用的新细胞来挽救的。因此神经元损失通常会导致大脑功能受损,在大多数情况下,这种损伤是永久性的。神经退行性疾病的神经元丢失是一个重要的特性,可呈隐匿性发展,随后出现的临床症状则取决于大脑受影响的区域和神经退行性变化的程度与速度。阿尔茨海默病的临床表现就是这一病理过程的典型体现,疾病早期的病理因素诊查显得尤为重要。
早期的Ab级联学说发现,脑内以Ab为主要成分的老年斑作为AD三大病理特征之一,同时也是疾病症状产生的主要病理因素。近期的Ab级联学说倾向于认为AD患者早期出现的记忆缺失是由于神经元突触功能障碍而非神经元死亡,造成这种障碍很有可能是单体或寡聚体而非老年斑。这解释了模型小鼠学习记忆行为学改变早于老年斑形成的现象,印证了AD发病隐匿、病程缓慢的特点。通过近些年的研究,人们也越来越加深了对这种假设的认可。可溶性Ab从“疾病病理指标”逐渐走向了“AD重要的早期诊断指标”这一角色[5]。
Ab在脑内存在形式多样,可溶性Ab包括单体、可溶性寡聚体、及Ab原纤维等,不可溶性Ab主要是变性的纤维化Ab(Fibrils)。其中可溶性Ab1-42单体及其寡聚体在纳摩尔水平即可产生较为明显的神经毒性[6]。
Ab总体水平的升高可归因于产生增多或是清除减少,对于遗传家族性AD而言前者为病因[7-8],而占据AD发病多数的散发性AD则缺乏Ab过度产生的证据,因此有理由认为其清除障碍是淀粉样病变发生的主要原因。
Ab的代谢途径主要有脑内降解酶降解和外周的肝肾降解酶降解,脑内的神经元、胶质细胞和血管内皮细胞都可以表达产生这类降解酶[9]。生理状态下,脑内Ab的产生和清除处于一个动态平衡。但是Ab主要的降解场所究竟是在脑内还是外周仍是研究焦点之一。
Banks WA和Kastin AJ[10]在1989年使用过碘标记法观察Ab后,研究者们开始采用各种办法观察脑内Ab的外流和滞留情况[11]。实验结果表明,通过血-脑屏障(blood- brain barrier,BBB)将Ab转运至对其有强大清除能力的外周血液,是脑内Ab的主要清除路径[12]。
既有研究显示,血脑屏障的损坏是中枢神经系统疾病的一大关键因素[13],在神经退行性疾病方面尤其明显。血脑屏障是由内皮细胞与细胞粘附分子形成的存在于大脑血液与组织间液ISF之间的渗透屏障。除主要结构是内皮细胞形成的紧密连接之外,血脑屏障的组成还包括周细胞、星形胶质细胞终足和基底膜,这些结构形成一个集合,或称为神经-血管单元。形成血脑屏障的血管内皮细胞含有选择性运输作用的转运蛋白和有分解代谢作用的酶,用于实现血脑屏障的关键功能。要穿过BBB的分子必须具备适当的物理化学属性,能够在脑ISF中达到足够的时量曲线(time-concentration)。也因为如此,血脑屏障的这种隔离功能不只使得研发能够在不破坏中枢神经系统功能的前提下进入脑组织发挥作用的中枢神经系统药物变得困难重重,同时也给对脑微环境的观察及动态研究设置了障碍。
组织微量透析法是测量脑ISF中的神经活化复合物最直接的方法[14],虽然脑室的室管膜内衬允许CSF和ISF中溶质的扩散和对流交换[15],但由于其他代谢途径的参与[16],溶质在CSF的浓度与在ISF中并不完全一样[17]。有研究将实验动物脑组织ISF与侧脑室和小脑延髓池的CSF平行取样,选择乙酰氨基酚浓度的检 测结果作为大脑BBB被动转运研究并建立多时间点浓度观测的参照指标,同时也对其血液样本中同一目标溶质浓度进行了观测。平均而言,大脑ISF的目标溶质浓度约为CSF中目标溶质浓度的4倍。并且大脑ISF、侧脑室CSF和小脑延髓池CSF中目标溶质浓度与平均脑-血浆曲线下面积(area under the curve,AUC)比率分别为121%、28%、35%[18]。因此可以说,对脑内代谢环境进行观察时ISF是优于CSF的选择。
电针可能通过改善大脑Ab清除效率,降低脑内Ab水平,减少其产生的神经毒性作用,延缓AD病程发展,缓解临床症状。在课题组前期的实验工作中,我们观察到电针百会、涌泉可降低4月龄、7月龄、10月龄APP/PS1转基因小鼠海马Ab总量,并对血脑屏障Ab转运相关的低密度脂蛋白相关受体蛋白-1表达水平有一定影响[19-20]。
低密度脂蛋白相关受体蛋白-1(low-density lipoprotein receptor-related protein-1,LRP1)是Ab在脑间质液-血脑屏障清除转运途径的最相关蛋白[21]。电针是否可能通过提高Ab血脑屏障清除相关受体LRP1表达从而降低脑间质液Ab1-42水平,还需要从脑微环境Ab水平与LRP1表达水平两个方面进行验证。但LRP1在机体内的表达丰富多样,作用复杂[22-23],动物模型亦不成熟,故欲阐明电针降低脑内整体Ab水平机制是否是通过脑间质液-血脑屏障(interstitial fluid-blood brain barrier,ISF-BBB)清除通道发挥作用,首先应验证电针能否降低脑组织间液Ab水平。
本实验在前期实验结果的基础上,选择从电针能否降低小鼠脑ISF Ab水平的实验角度,完善对电针降低脑内整体Ab水平机制是否是通过ISF-BBB清除通道发挥作用的推测验证。
小鼠脑ISF Ab水平与老年斑的形成与否相联系,一般而言老年斑形成之后由于其不断地“吸附”游离淀粉样蛋白沉积在一起,细胞间液以及脑脊液中Ab水平可见明显降低[24],故而对脑间质液可溶性Ab1-42水平的干预研究应该选用老年斑还未形成的早期模型小鼠。本研究选用5月龄APP/PS1双转基因AD模型小鼠为研究对象,该鼠6~8月龄产生老年斑[25-26]。课题组对5月龄小鼠的实验结果显示,海马Ab总体水平已有增高而还未产生老年斑,因而是理想的早期干预实验对象。
本次实验结果显示,针刺可降低脑组织间液Ab1-42水平,提示存在电针通过影响脑ISF-BBB转运途径功能降低脑内整体Ab水平机制的可能性。实验选取电针后第6、7、8、9小时4个时间点进行采样,结果显示没有明显的随时间变化趋势,提示电针后第6~9小时间,小鼠脑组织间液Ab1-42水平较为平稳,结合组间比较结果,表明小鼠ISF中Ab水平的变化在最后一次电针干预后6小时之前已经发生,这也可能是3 d电针干预积累的结果。
海马组织Ab1-42总体水平检测结果显示模型小鼠淀粉样蛋白代谢障碍已存在,然针刺干预对其总体水平调节作用不明显(>0.05),推测可能是由于Ab在脑内存在形式的多样性,导致相较于可溶性Ab单体或寡聚体而言,Ab总体水平的变化不显著。
本实验下一步的研究应完善采样时间的选择,考虑如何更好地运用时间医学分析方法。此外,由于探针膜截流分子量的选择有限,为保证Ab分子顺利地通过而选择了10 kd的探针型号,导致采集的ISF样品中可能包含Ab单体以及一部分寡聚体,为细化电针调节的病理因素对象,在之后的研究中,应该设计区分Ab单体及寡聚体的测量方法,完善理论的探究。以及需要相关指标检测排除其他可能影响Ab水平的因素,比如产生通路等。期望以更完善的实验设计阐明电针早期干预对AD治疗的重要性及可行性。
[1] Gregory JL, Prada CM, Fine SJ,. Reducing available solubleb-amyloid prevents progression of cerebral amyloid angiopathy in transgenic mice[J]., 2012,71(11):1009-1017.
[2] Karran E, Mercken M, De Strooper B. The amyloid cascade hypothesis for Alzheimer’s disease: an appraisal for the development of therapeutics[J]., 2011,10(9):698-712.
[3] Tanzi RE, Bertram L. Twenty years of the Alzheimer’s disease amyloid hypothesis: a genetic perspective[J]., 2005,120(4):545-555.
[4] Paxinos G, Franklin KBJ.[M]. 2nd Ed, London: Academic Press, 2011:6.
[5] Dubois B, Feldman HH, Jacova C,. Advancing research diagnostic criteria for Alzheimer’s disease: the IWG-2 criteria[J]., 2014,13(6):614 -629.
[6] 刘郁东,梁直厚,孙圣刚,等.不同浓度b_淀粉样蛋白寡聚体的毒性差异[J].卒中与神经疾病,2010,17(6): 323-329.
[7] Sambamurti K, Greig NH, Lahiri DK. Advances in the cellular and molecular biology of the beta- amyloid protein in Alzheimer’s disease[J]., 2002,1(1):1-31.
[8] Rosenberg RN. The molecular and genetic basis of AD: the end of the beginning: the 2000 Wartenberg lecture[J]., 2000,54(11):2045-2054.
[9] Turner AJ, Fisk L, Nalivaeva NN. Targeting amyloid- degrading enzymes as therapeutic strategies in neurodegeneration[J]., 2004,1035(1): 1-20.
[10] Banks WA, Kastin AJ. Quantifying carrier-mediated transport of peptides from the brain to the blood[J]., 1989,168:652-660.
[11] Mawuenyega KG, Sigurdson W, Ovod V,. Decreased clearance of CNS beta-amyloid in Alzheimer’s disease[J]., 2010,330(6012):1774.
[12] Sutcliffe JG, Hedlund PB, Thomas EA,. Peripheral reduction ofb-amyloid is sufficient to reduce brainb-amyloid: implications for Alzheimer’s disease[J]., 2011,89(6):808-814.
[13] Carvey PM, Hendey B, Monahan AJ. The blood-brain barrier in neurodegenerative disease: arhetorical perspec- tive[J]., 2009,111(2):291-314.
[14] Darvesh AS, Carroll RT, Geldenhuys WJ,. In vivo brain microdialysis: advances in neuropsychopharma- cology and drug discovery[J]., 2011,6(2):109-127.
[15] Liu X, Smith BJ, Chen C,. Evaluation of cerebrospinal fluid concentration and plasma free concentration as a surrogate measurement for brain free concentration[J]., 2006,34(9): 1443-1447.
[16] Abbott NJ. Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology[J]., 2004,45(4):545-552.
[17] Shen DD, Artru AA, Adkison KK. Principles and applicability of CSF sampling for the assessment of CNS drug delivery and pharmacodynamics[J]., 2004,56(12):1825-1857.
[18] Westerhout J, Ploeger B, Smeets J,. Physiologically based pharmacokinetic modeling to investigate regional brain distribution kinetics in rats[J]., 2012,14 (3):543-553.
[19] 王鑫,加吾拉·阿不力孜,李芙,等.电针对APP/PS1双转基因小鼠行为学及皮层Ab1-42、LRP1表达的影响[J].中华中医药杂志,2015,30(5):1513-1518.
[20] 李芙,李丽娜,王鑫,等.电针“百会”“涌泉”对APP/PS 1双转基因小鼠海马b淀粉样蛋白及低密度脂蛋白受体相关蛋白-1水平的影响[J].针刺研究,2015, 40(1):30-34.
[21] Zlokovic BV, Deane R, Sagare AP,. Low-density lipoprotein receptor-related protein-1: a serial clearance homeostatic mechanism controlling Alzheimer’s amyloidb-peptide elimination from the brain[J]., 2010,115(5):1077-1089.
[22] Sagare AP, Deane R, Zlokovic BV. Low-density lipoprotein receptor-related protein 1: a physiological Abhomeostatic mechanism with multiple therapeutic opportunities[J]., 2012,136(1):94- 105.
[23] 步青云,高堂珂,李芙,等.阿尔茨海默病脑内b_淀粉样蛋白经血-脑屏障清除相关研究概况[J].中国脑血管病杂志,2014,11(12):663-668.
[24] Hong S, Quintero-Monzon O, Ostaszewski BL,. Dynamic analysis of amyloidb-protein in behaving mice reveals opposing changes in ISF versus parenchymal Abduring age-related plaque formation[J]., 2011,31(44):15861-15869.
[25] Kim JH, Choi KH, Jang YJ,. Electroacupuncture acutely improves cerebral blood flow and attenuates moderate ischemic injury via an endothelial mechanism in mice[J]., 2013,8(2): e56736.
[26] 唐银杉,李志刚,陈万顺,等.音乐电针和脉冲电针对快速老龄化SAMP8小鼠行为学和血清Ab蛋白的影响[J].中医药学报,2014,42(1):87-90.
Effect of Electroacupuncture on Hippocampal Tissue and Interstitial Fluid Soluble Ab1-42 Levels in 5-month-old APP/PS1 Transgenic Mice
100029,
Objective To investigate the intervening effect of electroacupuncture on brain interstitial fluid (ISF) and hippocampal soluble Ab1-42levels in mice with early Alzheimer's disease. Method Sixteen 5-month-old male APP/PS1 positive transgenic mice were randomized to model and acupuncture groups, 8 mice each in one cage. Isosexual negative transgenic mice constituted a normal control group. Electroacupuncture at Baihui(GV20) and Yongquan(KI1) or binding under the same condition was used as an intervention measure. Mouse hippocampal interstitial fluid was obtained by brain microdialysis. Hippocampal tissue and ISFbamyloid protein 1-42 levels were measured by ELISA in the three groups of mice at 6, 7, 8 and 9 hrs after intervention to observe the changes. Result Hippocampal tissue and ISF soluble Ab1-42levels were significantly higher in the model group than in the normal group (<0.01). ISF soluble Ab1-42levels were significantly lower in the acupuncture group of mice than in the model group (<0.05) and there were no statistically significant differences in hippocampal Ab1-42levels between the two groups (>0.05). The results of sample detection did not show a tendency to change over time (>0.05). Conclusion Electroacupuncture can decrease hippocampal soluble Ab1-42levels in a mouse model of AD.
Alzheimer's disease; Electroacupuncture; Early intervention; Brain interstitial fluid; Microdialysis; Mice
1005-0957(2017)06-0744-07
R2-03
A
10.13460/j.issn.1005-0957.2017.06.0744
2016-12-20
国家自然科学基金项目(81273826);北京中医药大学自主选题项目(2015-JYB-XS120)
步青云(1990—),女,2016级硕士生,Email:BuQYun@163.com
薛卫国(1968—),男,副教授,博士,硕士生导师,研究方向为针刺治疗阿尔茨海默病机理研究,Email:snowman xue@126.com

