利用SSR标记分析西瓜自交系的遗传关系
许彦宾,王艳玲,温新惠,胡建斌,李 琼,孙守如,马长生
(1.河南农业大学园艺学院 郑州 450002; 2.平罗县种子管理站 宁夏平罗 753400)
利用SSR标记分析西瓜自交系的遗传关系
许彦宾1,王艳玲1,温新惠2,胡建斌1,李 琼1,孙守如1,马长生1
(1.河南农业大学园艺学院 郑州 450002; 2.平罗县种子管理站 宁夏平罗 753400)
为了明确西瓜自交系间的遗传关系,采用SSR和EST-SSR标记分析34份高代自交系的基因型,计算各材料间的相似系数,并进行聚类分析。结果表明,9个基因组SSR和8个EST-SSR标记共检测到83个等位基因,平均4.88个,PIC值变幅为0.112~0.686,平均0.425,基因组SSR的多态性明显高于EST-SSR。所有材料聚为A、B、C 3类,B、C 2类包含多态性较高的4份自交系(X36、X48、X84和X89),均为来自西北地区的小果型材料,可以用来丰富栽培西瓜的多样性;A类包含剩余的30份自交系,主要是国内外的单果质量大于或等于1.5 kg的材料(除X38、X80外),其遗传多样性较低,遗传背景需要进一步拓展。A类可分为3个亚类,每个亚类材料的植物学性状和来源地大不相同。研究结果将为西瓜杂交亲本选配和种质资源创新提供理论依据。
西瓜;自交系;SSR;遗传关系
杂交育种是目前大多数园艺作物培育新品种的主要方法,其首要条件是具备一定遗传差异的亲本材料[1]。西瓜是我国主要园艺作物,种植面积和产量位居世界前列[2]。但我国不是西瓜的发源地,种质资源相对匮乏。20世纪60年代,我国从美国、日本、前苏联等国家引入了许多优良西瓜品种,促进了西瓜主要农艺性状的遗传改良,也极大地推动了我国西瓜品种的更新换代[3]。有研究表明,栽培西瓜的遗传基础较为狭窄,特别是品种之间DNA水平的差异较小[4-5],限制了杂交亲本的选择。近年来,我国西瓜栽培面积稳中有增,消费市场多元化发展趋势愈加明显,品种更新速度也愈来愈快。但由于大多数西瓜育种者只重视杂交组合的配制而忽视育种材料遗传关系评价,频繁地利用少数亲缘关系较近的骨干亲本配制杂交组合,以致新育成品种的一些重要农艺性状未得到明显改良,因而难以育成突破性的西瓜新品种。随着西瓜全基因组测序的完成,利用分子标记技术分析西瓜育种材料的遗传关系,有助于育种者在DNA水平上选择具有差异的育种材料,从而实现对西瓜重要农艺性状的有效改良[6]。
目前,RAPD、AFLP、SSR等多种分子标记已用于西瓜的遗传多样性分析,其中SSR分子标记因其稳定性好、多态性高、共显性、多等位性等优点而应用更为广泛[7-9]。笔者采用SSR标记对34份西瓜自交系的遗传关系进行分析,以期选择在DNA水平上具有差异的育种材料,为西瓜杂交亲本的选配提供参考依据。
1 材料与方法
1.1 材料
供试材料为34份西瓜自交系,由河南豫艺种业科技发展有限公司提供(表1)。所有材料均是从国内外多个西瓜商业品种中自交分离而得,自交7代以上,主要农艺性状已经稳定,但自交系的含糖量与杂交种相比普遍偏低。2010—2015年在郑州荥阳田间连续种植,性状调查见表1(5 a平均值),各材料在果实性状方面存在较大的差异,可溶性固形物含量取果实中心至边缘1/2处的果肉测定。
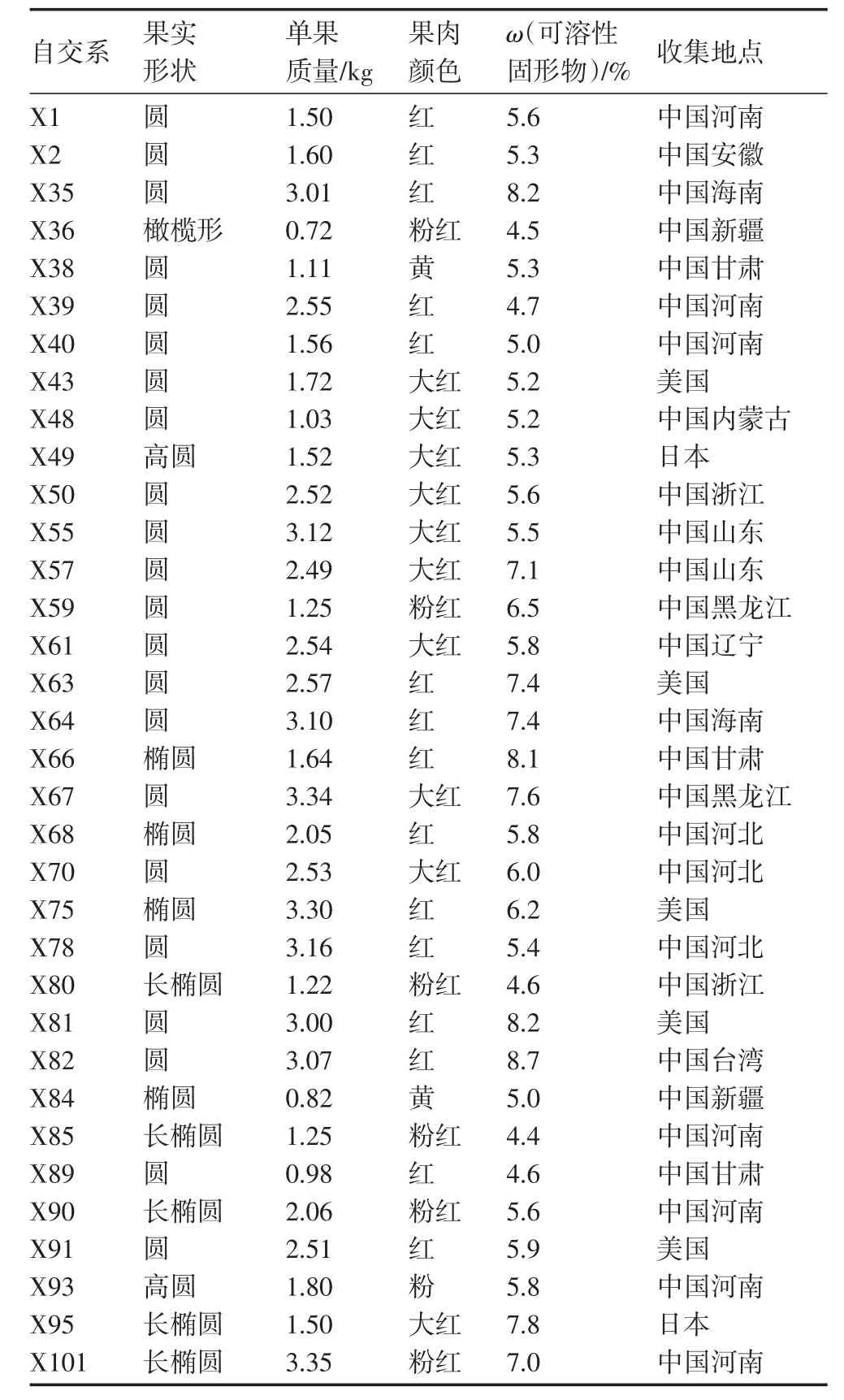
表1 2010—2015年34份西瓜材料及果实性状调查
1.2 SSR-PCR扩增
采用CTAB小量法[10]从西瓜幼嫩叶片中提取基因组DNA,利用紫外分光光度计检测DNA浓度与纯度,将其稀释到终浓度20 ng·μL-1。试验采用基因组SSR和EST-SSR进行基因型鉴定,基因组SSR引物选自Joobeur等[11]的报道,EST-SSR引物选自Guerra-Sanz[12]和Verma等[13]的报道,筛选多态性好的SSR引物。PCR反应体系15 μL,其中包括:1×Buffer,1.5 mmol·L-1MgCl2,200 μmol·L-1dNTPs,0.4 μmol·L-1引物,1 UTaq酶,50 ng DNA模板。PCR反应在PTC-200型PCR扩增仪(MJ Reserch,Inc.)上进行。反应程序为:94℃预变性5 min;94℃变性1 min,55℃复性45 s,72℃延伸1 min,35个循环;72℃延伸6 min。扩增产物用6%非变性聚丙烯酰胺凝胶电泳分离,进行银染、显带。
1.3 数据分析
以PCR条带在凝胶中相对迁移位置的有无赋值为“1”或“0”,生成分子数据矩阵。采用Jaccard[14]的方法计算各材料间的遗传距离和相似系数,利用NTSYS-pc 2.10软件中的不加权成对算术平均法(UPGMA)对34份自交系进行聚类,绘制树状聚类图。根据Botstein等[15]报道的方法计算SSR标记的多态性信息含量(PIC,polymorphism information con⁃tent)值,即PIC=1-∑Xi2,其中Xi表示第i种基因型出现的频率。
2 结果与分析
2.1 SSR标记的多态性
根据文献报道共合成了35对SSR引物,从中筛选出带谱清晰、多态性好的17对。其中,基因组SSR引物9对,EST-SSR引物8对。17对引物对34份西瓜自交系的扩增结果见表2。所有引物共检测到83个等位基因,平均每对引物检测到4.88个,MCPI05检测到的等位基因数最多(10个),EST00667检测到的等位基因数最少(2个);PIC值变幅 0.112(EST00667)~0.686(MCPI11),平均0.425,图1为MCPI11电泳图。基因组SSR的平均等位基因数和 PIC值分别为 5.89和 0.514,EST-SSR的平均等位基因数和PIC值分别为3.75和0.326,基因组SSR的多态性明显高于EST-SSR。
图1 MCPI11非变性聚丙烯酰胺凝胶电泳图
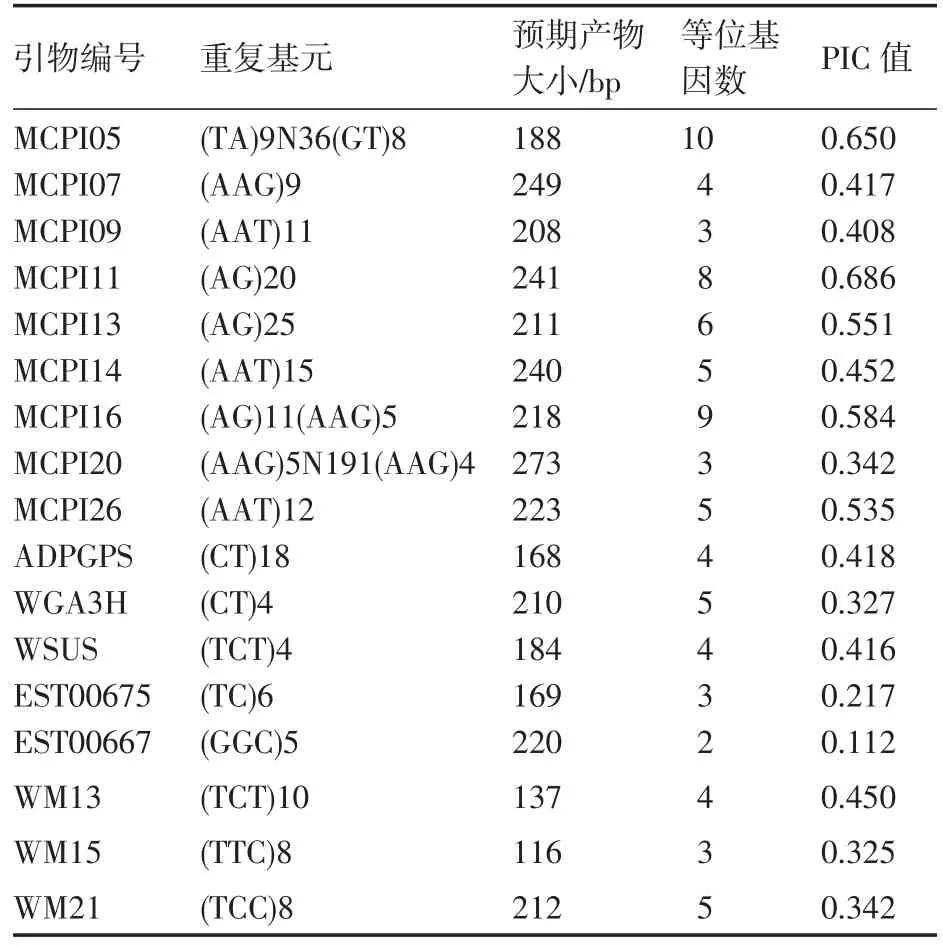
表2 17对SSR引物的特征及其多态性
2.2 西瓜自交系的遗传多样性
为了明确西瓜各自交系之间的遗传关系,采用SSR基因型数据计算各材料之间的相似系数,获得34份自交系的相似系数矩阵。结果表明,所有材料的相似系数变幅为 0.24~0.93,平均相似系数为0.56,X66与X61的相似系数最大,X82或X85与X36之间的相似系数最小。如果排除自交系X36,所有材料的平均相似系数为0.65。上述结果说明,西瓜自交系之间的遗传分化较小,遗传背景较为狭窄。
2.3 西瓜自交系的聚类分析
根据各材料间的相似系数对所有自交系进行聚类作图,以明确其遗传关系。图2表明,34份材料在相似系数为0.48的水平上可聚为A、B、C共3类。其中,X36单独成一类(C类),说明其遗传背景较为独特。B类也仅包括3份自交系,即X48、X84和X89。这2类所包含的4份材料均为小果型自交系(单果质量小于1.2 kg),是从中国西北地区的西瓜品种中分离所得,具有较高的遗传多样性。
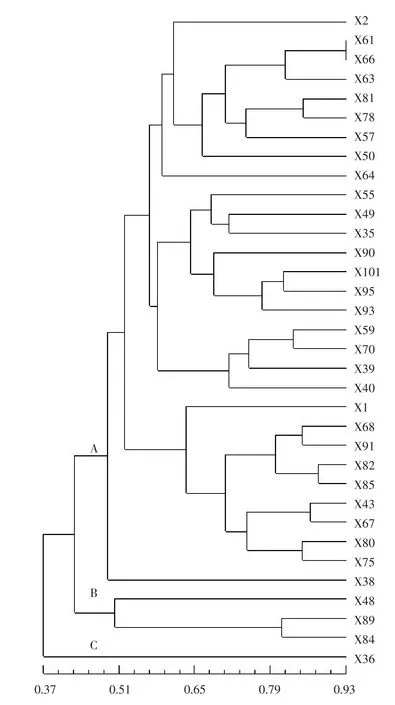
图2 34份西瓜自交系的聚类结果
除B、C类之外的30份自交系全部聚集在A类,其平均相似系数高达0.78,说明该类材料遗传多样性不足,遗传背景十分狭窄。A类中,X38可单独作为一个亚类,其他29份材料分别可划分为3个亚类,第1个亚类有9份材料(X2、X61、X66、X63、X81、X78、X57、X50、X64),第2个亚类有11份材料(X55、X49、X35、X90、X101、X95、X93、X59、X70、X39、X40),第3个亚类有9份材料(X1、X68、X91、X82、X85、X43、X67、X80、X75),每个亚类材料的来源地并不一致,其果实性状也有一定的差异。A类中,除X38、X80外,其他单果质量都大于或等于1.50 kg
3 讨 论
本研究中自交系的可溶性固形物含量普遍比杂交种偏低,原因可能有几点:1)自交系果实含糖量一般会低于杂交种;2)自交系果实中心至边缘可溶性固形物含量梯度差异较大,其中间部位含量偏低;3)2010—2015年自交系材料均是露地种植,管理相对粗放,采收期为6月下旬至7月上旬,此时正是多雨季节,土壤水分过高则降低了果实的可溶性固形物含量。
SSR标记可分为基因组SSR和EST-SSR,前者来源于基因组的重复序列,一般通过构建文库、筛选、测序等步骤开发,后者是基于cDNA文库克隆(EST序列)的重复序列开发所得[16]。由于EST-SSR来源于转录组序列,其多态性很有可能与该物种的性状有关,因而被认为是“绝对”的遗传标记,但其多态性一般低于基因组SSR。本研究结果表明,EST-SSR所检测到的等位基因数和PIC值均低于SSR,与Fernandez-Silva等[17]的报道一致。Mondini等[18]认为利用2种或2种以上的分子标记进行基因型分析,可提高基因组覆盖率,检测更多的基因组变异。
基于2种分子标记的研究结果表明,34份西瓜自交系的平均相似系数为0.56,大体可分为3类(A、B和C)。其中,B、C 2类包含4份自交系(X36、X48、X84和X89),其果实较小,均从中国新疆、甘肃等地的品种中自交分离所得,具有较高的遗传多样性。在主要植物学性状上,这些小果型材料与当地的地方品种极为相似,可以作为育种材料增加栽培西瓜的遗传多样性,但其农艺性状(适应性、抗病性等)有待进一步考察。
A类包含30份自交系,除X38外均为大果型材料,平均相似系数高达0.78,其遗传背景十分狭窄。尽管A类存在3个明显的亚类,但并不能依据材料的性状和来源归类,说明不同地区的材料之间可能存在基因交换。仔细分析发现,来自美国的5份自交系(X43、X63、X75、X81和X91)和日本的2份自交系(X49和X95)均归在A类,与国内西瓜品种的自交系聚在一起,说明国内外西瓜材料间可能有一定的血缘关系。中国曾在20世纪60年代大规模引进美国和日本的商业西瓜品种,如美国的‘Charleston Gray’‘Jubilee’‘Crimson Sweet’‘Sugar⁃lee’‘Sugar Baby’等,日本的主要是新大和、旭大和系列[3],这些品种及其衍生系被反复用作杂交亲本,在中国西瓜的育种历史上发挥了重要作用,可以说中国的西瓜品种具有很深的美国、日本品种的烙印。虽然34份自交系的系谱无法全部考证,但这些引种事实可以部分解释国内外材料紧密聚类在一起的原因。Levi等[19]曾报道非洲野生西瓜的遗传多样性极为丰富,且具有较强的抗病性、适应性,可以用来拓宽栽培西瓜的遗传背景。但这些野生材料的抗病或抗逆基因一般与品质不利基因(如苦味、涩味等)连锁,因此在应用过程中应注意利用辐射、化学诱变、多代回交等方法打破遗传连锁,加快种质资源的创新与性状改良进程。
[1]曹家树,申书兴.园艺植物育种学[M].北京:中国农业大学出版社,2001.
[2]马跃.透过国际分析,看中国西瓜甜瓜的现状与未来[J].中国瓜菜,2011,24(2):64-67.
[3]刘文革.我国西瓜品种选育研究进展[J].中国瓜菜,2016,29(1):1-7.
[4]LEVI A,THOMAS C E,WEHNER T C,et al.Low genetic diversity indicates the need to broaden the genetic base of cultivated watermelon[J].HortScience,2001,36(6):1096-1101.
[5]LEVI A,THOMAS C E,KEINATH A P,et al.Genetic diversity among watermelon(Citrullus lanatusandCitrullus colocynthis)accessions[J].Genetic Resources Crop Evoution,2001,48(6):559-566.
[6]GUO S,ZHANG J,SUN H,et al.The draft genome of watermelon(Citrullus lanatus)and resequencing of 20 diverse accessions[J].Nature Genetics,2013,45(1):51-60.
[7]刘传奇,高鹏,栾非时.西瓜遗传陶谱构建及果实相关性状QTL分析[J].中国农业科学,2014,47(14):2814-2829.
[8]高磊,赵胜杰,路绪强,等.西瓜回交世代酸味株系基因型分析[J].中国瓜菜,2016,29(4):5-9.
[9]REDDY U K,NIMMAKAYALA P,LEVI A,et al.High-resolu⁃tion genetic map for understanding the effect of genome-wide recombination rate on nucleotide dilversity in watermelon[J].G3:Genes|Genomes|Genetics,2014,4(11):2219-2230.
[10]MURRAY M G,THOMPSON W F.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Research,1980,8(19):4321-4325.
[11]JOOBEUR T,GUSMINI G,ZHANG X,et al.Construction of a watermelon BAC library and identification of SSRs anchored to melon orArabidopsisgenomes[J].Theoretical and Applied Genetics,2006,112(8):1553-1562.
[12]GUERRA-SANZ J M.Citrullussimple sequence repeats markers from sequence databases[J].Molecular Ecology Notes,2002,2(3):223-225.
[13]VERMA M,ARYA L.Development of EST-SSRs in watermelon(Citrullus lanatusvar.lanatus)and their transferability toCucumisspp.[J].Journal of Horticultural Science&Biotechnology,2008,83(6):732-736.
[14]JACCARD P.Nouvelles recherches sur la distribution florale[J].Bulletin De La Societe Vaudoise Des Sciences Naturelles,1908,44(163):223-270.
[15]BOTSTEIN D,WHITE R L,SKOLNICK M,et al.Construction of genetic linkage map in man using restriction fragment length polymorphisms[J].American Journal of Human Genetics,1980,32(3):314-331.
[16]KALIA R K,RAI M K,KALIA S,et al.Microsatellite markers:an overview of the recent progress in plants[J].Euphytica,2011,177(3):309-334.
[17]FERNANDEZ-SILVA I,EDUARDO I,BLANCA J,et al.Bin mapping of genomic and EST-derived SSRs in melon(Cucumis meloL.)[J].Theoretical and Applied Genetics,2008,118(1):139-150.
[18]MONDINI L,NOORANI A,PAGNOTTA M A.Assessing plant genetic diversity by molecular tools[J].Diversity,2009,1(1):19-35.
[19]LEVI A,THOMAS C E,KEINATH A P,et al.Estimation of genetic diversity amongCitrullusaccessions using RAPD markers [J].Hortscience,2000,35(3):385-390.
The use of SSR markers for analyzing the genetic relationship among watermelon inbred lines
XU Yanbin1,WANG Yanling1,WEN Xinhui2,HU Jianbin1,LI Qiong1,SUN Shouru1,MA Changsheng1
(1.College of Horticulture,Henan Agricultural University,Zhengzhou 450002,Henan,China;2.Seed Control Station of Pingluo Country,Pingluo 753400,Ningxia,China)
The present study aims to identify the relationship among the watermelon inbred lines by using SSR markers.Two markers,SSR and EST-SSR,were used to analyze the genotypes of the 34 inbred lines,which was adopted to calculate the similarity coefficient among the accessions and then cluster the accessions.The results showed that 9 genomic SSRs and 8 EST-SSRs detected 83 alleles totally,with a mean of 4.88.The PIC value ranged from 0.112 to 0.686,averaging 0.425.The polymorphism level of genomic SSR was higher than EST-SSR.All the materials were clustered into 3 groups(A,B and C). of the groups,B and C contained 4 accessions(X36,X48,X84,and X89)with high polymorphism,which were small fruit type accessions collected from northwest region.The 4 accessions could be used to increase the polymorphism of the cultivated watermelon.Group A contained the rest 30 domestic and foreign inbred lines which fruit weight no less than 1.5 kg with an exception of X38 and X80.These accessions had a low polymorphism and the genetic background need to be ex⁃panded further.Group A could be subdivided into 3 subgroups,each of which contained accessions with different origins and botanical characters.The results obtained here will offer theoretical basis for parent selection of watermelon cross breeding and new germplasm creation.
Watermelon;Inbred lines;SSR;Genetic relationship
2017-02-10;
:2017-03-14
国家农业科技成果转化基金项目(2014D00000103)
许彦宾,男,在读硕士研究生,研究方向为西甜瓜遗传育种。E-mail:xuyanb0514@163.com
胡建斌,男,教授,研究方向为西甜瓜遗传育种。E-mail:jianbinhu@henau.edu.cn

