甲磺酸阿帕替尼引发手足综合征五例临床分析
卢淑娇,毛世旺,施 勇
·临床诊疗提示·
甲磺酸阿帕替尼引发手足综合征五例临床分析
卢淑娇1,毛世旺1,施 勇2*
目的 分析5例甲磺酸阿帕替尼引发手足综合征(HFS)的临床特征,为临床医生提供相关的诊治帮助。方法 收集2015—2016年丽水市人民医院皮肤科诊治的5例甲磺酸阿帕替尼引发的HFS患者的临床资料。回顾性分析5例患者的一般资料、临床表现、治疗建议及随访结果。结果 5例患者中男2例,女3例;原发肿瘤:胃癌4例,乳腺癌1例;甲磺酸阿帕替尼使用剂量750~850 mg/d;潜伏期16~35 d;常见不良反应事件评价标准(CTCAE)分级为1~3级。3例甲磺酸阿帕替尼引发的HFS CTCAE分级为1级的患者临床表现为手掌和足底散在红斑,无自觉症状;1例CTCAE分级为2级的患者临床表现为上述部位水肿性红斑伴有麻木和轻微疼痛感;1例CTCAE分级为3级的患者临床表现为上述部位水肿红斑基础上伴有脱屑、水疱,以及难以忍受的刺痛感。5例HFS患者均给予疾病相关健康教育,减少手足部受刺激,建议补充B族维生素,根据患者的自觉症状酌情使用塞来昔布止痛,同时配合外用润肤剂保湿护肤。CTCAE分级为1~2级的4例患者经治疗后HFS均得到很好的控制,未影响继续使用甲磺酸阿帕替尼的肿瘤治疗;对于1例CTCAE分级为3级的患者,在上述治疗无效且HFS持续加重时,把甲磺酸阿帕替尼服用剂量减少为500 mg/d后HFS症状明显缓解。结论 新近应用于临床的抗肿瘤药物甲磺酸阿帕替尼引发的HFS并不少见,通过对症治疗或者减少使用剂量一般可以控制HFS的病情,不影响其继续应用于肿瘤的治疗。
手足综合征;抗肿瘤药;甲磺酸阿帕替尼
卢淑娇,毛世旺,施勇.甲磺酸阿帕替尼引发手足综合征五例临床分析[J].中国全科医学,2017,20(18):2267-2270.[www.chinagp.net]
LU S J,MAO S W,SHI Y.Clinical manifestations in five cases of hand-foot syndrome induced by Apatinib mesylate[J].Chinese General Practice,2017,20(18):2267-2270.
药物引发的变态反应性疾病是皮肤科最为主要的病种之一。国外一项针对美国爱荷华大学附属医院内皮肤科会诊情况的回顾性研究发现,药疹患者占总会诊量的10%,仅次于皮炎、湿疹患者[1]。此外,近年来各种层出不穷的新药不断应用到临床,使得药疹的种类越来越多样化,识别和诊断难度越来越大,对皮肤科医生是一个巨大的挑战。2015—2016年,丽水市人民医院皮肤科诊治了5例由甲磺酸阿帕替尼片(商品名:艾坦,生产厂家:江苏恒瑞医药股份有限公司,国药准字H20140103)引发的手足综合征(HFS)患者,现对其临床特点归纳整理如下。
1 资料与方法
1.1 临床资料 收集2015—2016年丽水市人民医院皮肤科诊治的5例由甲磺酸阿帕替尼引发的HFS患者的临床资料。纳入标准:(1)使用甲磺酸阿帕替尼治疗的恶性肿瘤患者;(2)在治疗期间出现手掌和足底皮疹,经由两名临床经验丰富的皮肤科专科医生根据患者病史及皮肤表现诊断为HFS者。排除标准:(1)使用甲磺酸阿帕替尼治疗者本身有手足部皮肤疾患,如手足癣及手足部湿疹等;(2)不能规律随访者。
1.2 方法 回顾性分析5例患者的一般资料、临床表现、治疗建议及随访结果。
2 结果
2.1 一般资料 5例甲磺酸阿帕替尼引发的HFS患者中男2例,女3例;原发肿瘤:胃癌4例,乳腺癌1例;甲磺酸阿帕替尼使用剂量750~850 mg/d;潜伏期16~35 d;常见不良反应事件评价标准(CTCAE)分级为1~3级(见表1)。
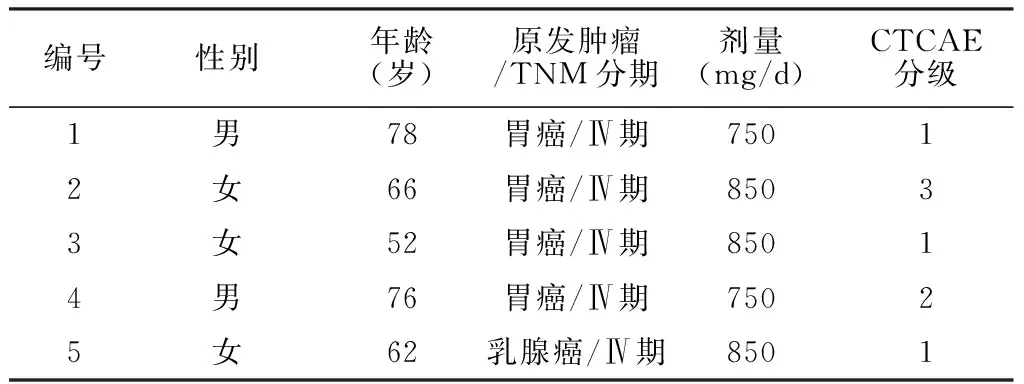
表1 5例患者一般资料
注:CTCAE=常见不良反应事件评价标准
2.2 临床表现 3例甲磺酸阿帕替尼引发的HFS CTCAE分级为1级的患者临床表现为手掌和足底散在红斑,无自觉症状;1例CTCAE分级为2级的患者临床表现为上述部位水肿性红斑伴有麻木和轻微疼痛感;1例CTCAE分级为3级的患者临床表现为上述部位水肿红斑基础上伴有脱屑、水疱,以及难以忍受的刺痛感。5例患者服用甲磺酸阿帕替尼至出现皮疹或不适的时间最短为13 d,最长为35 d,平均23.6 d;其中1例胃癌患者入院前已经服用甲磺酸阿帕替尼一段时间,服药约1个月时出现手足部皮疹,未予特殊重视,皮疹逐渐加重,并出现较剧烈的刺痛。
2.3 治疗建议 5例HFS患者均给予疾病相关健康教育,减少手足部受刺激,如避免接触过冷或过热的水,穿宽松柔软的鞋袜以避免手足部摩擦过度,避免接触化学洗涤用品。补充B族维生素,口服复合维生素B片(生产厂家:广东恒健制药有限公司,国药准字H44021164),根据患者的自觉症状酌情使用塞来昔布胶囊(生产厂家:辉瑞制药有限公司,国药准字J20120063)止痛;同时配合外用润肤剂保湿护肤,如尿素乳膏(生产厂家:上海运佳黄浦制药有限公司,国药准字H20063666)。对于1例CTCAE分级为3级的患者,建议在上述治疗无效且持续加重时考虑减少甲磺酸阿帕替尼的剂量或停药。
2.4 随访结果 CTCAE分级为1~2级的4例患者经治疗后HFS均得到很好的控制,未影响继续使用甲磺酸阿帕替尼进行肿瘤的治疗;CTCAE分级为3级的患者甲磺酸阿帕替尼服用剂量减少为500 mg/d后HFS症状明显缓解。
3 讨论
甲磺酸阿帕替尼是新一代小分子血管内皮生长因子受体2(VEGFR-2)酪氨酸激酶抑制剂,通过阻断血管内皮生长因子(VEGF)与其受体结合后的信号转导通路,强效抑制肿瘤血管生成,从而发挥抗肿瘤作用。该药于2014-10-17由国家食品药品管理监督总局(CFDA)批准作为国家1.1类新药上市,主要用于晚期胃癌或胃食管结合部腺癌三线及三线以上治疗[2]。
HFS也被称作掌跖红斑、肢端红斑及化疗引发的肢端红斑等,是一种与抗肿瘤药物相关的皮肤毒性反应,其典型表现为手掌和足底的红斑、肿胀及刺痛,于1974年首次被报道,其是由使用米托坦引起[3]。HFS的潜伏期通常为2~21 d不等,亦因为缓释药物在体内持续代谢长达10个月[4]。美国国家癌症研究所(NCI)制定的CTCAE 4.0版将HFS分为3级:1级为无痛性轻微皮肤改变或皮肤炎症;2级为皮肤改变(如脱屑、水疱、出血、肿胀或角化过度)伴疼痛,工具性日常活动受限;3级为重度皮肤改变伴疼痛,自理性日常活动受限[5]。最常引发HFS的抗肿瘤药物有脂质体阿霉素、卡陪他滨、5-氟尿嘧啶、阿糖胞苷及多西他赛,此外新型靶向抑制剂如索拉非尼、舒尼替尼、阿西替尼、帕唑帕尼、瑞格非尼及维罗非尼亦有可能引发HFS[6]。甲磺酸阿帕替尼为上市不久的新型抗肿瘤靶向药物,目前关于其引起HFS尚鲜有报道,与其类似的药物拉帕替尼则有较多的临床资料。国外一项针对使用拉帕替尼治疗76例晚期乳腺癌患者的研究中,55例患者发生了HFS,HFS是最常见的不良反应事件[7]。
HFS的发生风险具有剂量依赖性。服用甲磺酸阿帕替尼缓释剂或持续给药的方式能使肿瘤患者血药浓度维持较高水平,但其发生HFS的概率更高[8]。有研究显示,性别、药物剂量、恶性肿瘤种类以及遗传基因多态性也是HFS发生的影响因素,其中女性HFS发病率较高;应用索拉非尼的患者中,肾脏恶性肿瘤患者发生HFS风险较其他恶性肿瘤者高[9]。目前国内外许多研究显示HFS的发生与个体遗传基因多态性有关。其中国内有研究提示COX-S/EP2/PGE炎性通路的单核苷酸多态性与服用卡培他滨进行治疗的肿瘤患者发生HFS有关,该研究采集了225例服用卡培他滨胃肠癌患者血样,进行19个COX-S/EP2/PGE炎性通路单核苷酸多态性位点的检测,结果发现rs3810255及rs17131450基因型与HFS的发生存在相关性,这有可能成为预测HFS发生的新指标[10]。
HFS在组织学上主要表现为皮肤屏障的破坏,可出现基底细胞空泡变性、棘层细胞水肿、角质细胞坏死脱落、真皮乳头层水肿,真皮血管周围可有淋巴细胞和嗜酸粒细胞浸润。靶向抗肿瘤药物引发HFS确切的机制尚不明确,目前主要有以下猜测。多激酶抑制剂类的靶向抗肿瘤药物可以通过抑制VEGF受体诱导毛细血管损伤,手足承受较多机械压力和摩擦力,可进一步加剧毛细血管损伤,使有害物质进入皮肤组织产生毒性反应[11]。此外,有研究发现该类药物可以在皮肤的外泌汗腺处富集,通过作用于汗腺导管上皮的VEGF及血小板源性生长因子受体介导汗腺的损伤,从而引发皮肤炎性反应[12]。
HFS病情通常较轻,但其可以造成患者情绪压抑,从而影响患者的日常活动和生活质量。无论是HFS还是其他药物相关不良反应,对肿瘤晚期患者来说无疑是雪上加霜。虽然该病并不致命,却有可能影响肿瘤患者的治疗强度或疗程,从而引发严重的不良反应事件[13]。也有研究发现HFS的发生与抗肿瘤药物的疗效可能存在一定关系,如国内一项针对卡培他滨治疗晚期直肠癌的研究发现,发生HFS与未发生HFS的患者化疗客观有效率(45.8%与13.3%,P=0.024)、疾病控制率(75%与40%,P=0.065)有差异[14]。
目前,对HFS的治疗以对症治疗和支持性治疗为主,避免对手足过度刺激,外用温和的保湿润肤剂[15]。一篇系统回顾研究指出,400 mg/d的维生素B6对HFS可能有预防作用,但仍需要大样本的试验进一步验证,特别是评估大剂量维生素B6的疗效和安全性[16]。此外也有研究指出塞来昔布对于CTCAE分级为1~2级的HFS有预防和治疗作用,其治疗机制可能为塞来昔布抑制的环氧合酶参与介导了HFS皮疹部位的血管炎性反应[17]。对于严重无法控制的HFS,抗肿瘤药物减量或停用,HFS常能明显缓解[18]。1例进行贲门癌根治术的54岁男性患者,服用甲磺酸阿帕替尼850 mg/d两周后出现手足掌红肿脱屑,伴有肢端麻木和疼痛,影响日常生活,给予维生素B6100 mg/次、3次/d口服和尿素软膏外用后HFS好转,且不影响抗肿瘤药物的治疗[19]。
甲磺酸阿帕替尼应用于临床的时间较短,丽水市人民医院皮肤科于2015—2016年发现5例甲磺酸阿帕替尼引发的HFS,可见HFS的发病率不低,遗憾的是未能统计同期使用该药的患者总数。HFS常可通过对症治疗得到有效控制,一般不影响抗肿瘤药物的继续应用。如今医疗技术飞速发展,新药不断上市并应用于临床,皮肤科医生对于相关的药物不良反应的认识必须与时俱进,通过不断的学习,掌握不同药物的特点和处理方法,更好地为患者服务,为其他科室的同仁提供切实有效的帮助,切莫对所有怀疑药物相关皮肤不良反应的患者提出“停用可疑致敏药物”的建议。
作者贡献:卢淑娇进行文章的构思与设计、研究的实施与可行性分析;毛世旺进行数据整理;卢淑娇、毛世旺进行数据收集、撰写论文、论文修订;施勇进行结果分析与解释,负责文章的质量控制及审校;卢淑娇、施勇对文章整体负责,监督管理。
本文无利益冲突。
[1]DAVILA M,CHRISTENSON L J,SONTHEIMER R D.Epidemiology and outcomes of dermatology in-patient consultations in a Midwestern U.S.university hospital[J].Dermatol Online J,2010,16(2):12.
[2]秦叔逵,李进.阿帕替尼治疗胃癌的临床应用专家共识[J].临床肿瘤学杂志,2015,20(9):841-847. QIN S K,LI J.Apatinib for clinical application,expert consensus for the treatment of gastric cancer[J].Chinese Clinical Oncology,2015,20(9):841-847.
[3]GRESSETT S M,STANFORD B L,HARDWICKE F.Management of hand-foot syndrome induced by capecitabine[J].J Oncol Pharm Pract,2006,12(3):131-141.
[4]FARR K P,SAFWAT A.Palmar-plantar erythrodysesthesia associated with chemotherapy and its treatment[J].Case Rep Oncol,2011,4(1):229-235.DOI:10.1159/000327767.
[5]CHEN A P,SETSER A,ANADKAT M J,et al.Grading dermatologic adverse events of cancer treatments:the Common Terminology Criteria for Adverse Events Version 4.0[J].J Am Acad Dermatol,2012,67(5):1025-1039.DOI:10.1016/j.jaad.2012.02.010.
[6]ALLEY E,GREEN R,SCHUCHTER L.Cutaneous toxicities of cancer therapy[J].Curr Opin Oncol,2002,14(2):212-216.
[7]ARAKI K,FUKADA I,HORII R,et al.Lapatinib-associated mucocutaneous toxicities are clinical predictors of improved progression-free survival in patients with human epidermal growth factor receptor(HER2)-positive advanced breast cancer[J].Breast Cancer Res Treat,2014,148(1):197-209.DOI:10.1007/s10549-014-3148-7.
[8]NAGORE E,INSA A,SANMARTN O.Antineoplastic therapy-induced palmar plantar erythrodysesthesia(′hand-foot′) syndrome[J].Am J Clin Dermatol,2000,1(4):225-234.
[9]LIPWORTH A D,ROBERT C,ZHU A X.Hand-foot syndrome(hand-foot skin reaction,palmar-plantar erythrodysesthesia):focus on sorafenib and sunitinib[J].Oncology,2009,77(5):257-271.DOI:10.1159/000258880.
[10]廖鑫.COX-2/PGES/EP 通路和卡培他滨代谢通路相关基因的单核苷酸多态性与手足综合征相关性研究[D].武汉:华中科技大学,2014. LIAO X.The association between single nucleotide polymorphismin the COX-2/PGES/EP signaling pathway and thecapecitabine metabolism pathway and risk of hand footsyndrome in patients taking capecitabine[D].Wuhan:Huazhong University of Science and Technology,2014.
[11]LACOUTURE M E,REILLY L M,GERAMI P,et al.Hand foot skin reaction in cancer patients treated with the multikinase inhibitors sorafenib and sunitinib[J].Ann Oncol,2008,19(11):1955-1961.DOI:10.1093/annonc/mdn389.
[12]MEDRANO J V,MARQUES-MARI A I,AGUILAR C E,et al.Comparative analysis of the germ cell markers c-KIT,SSEA-1 and VASA in testicular biopsies from secretory and obstructive azoospermias[J].Mol Hum Reprod,2010,16(11):811-817.DOI:10.1093/molehr/gaq044.
[13]DEGEN A,ALTER M,SCHENCK F,et al.The hand-foot-syndrome associated with medical tumor therapy-classification and management[J].J Dtsch Dermatol Ges,2010,8(9):652-661.DOI:10.1111/j.1610-0387.2010.07449.x.
[14]秦鑫添,王希成,李玉齐,等.卡培他滨治疗晚期结直肠癌发生手足综合征与疗效的观察[J].临床医学工程,2011,18(2):221-223.DOI:10.3969/j.issn.1674-4659.2011.02.0221. QIN X T,WANG X C,LI Y Q,et al.Study on correlation between curative effect and hand-foot syndrome induced by capecitabine as a therapy to advanced colorectal cancer[J].Clinical Medical Engineering,2011,18(2):221-223.DOI:10.3969/j.issn.1674-4659.2011.02.0221.
[15]ENG C.Toxic effects and their management:daily clinical challenges in the treatment of colorectal cancer[J].Nat Rev Clin Oncol,2009,6(4):207-218.DOI:10.1038/nrclinonc.2009.16.
[16]CHEN M,ZHANG L,WANG Q,et al.Pyridoxine for prevention of hand-foot syndrome caused by chemotherapy:a systematic review[J].PLoS One,2013,8(8):e72245.DOI:10.1371/journal.pone.0072245.
[17]ZHANG R X,WU X J,WAN D S,et al.Celecoxib can prevent capecitabine-related hand-foot syndrome in stage Ⅱ and Ⅲ colorectal cancer patients:result of a single-center,prospective randomized phase Ⅲ trial[J].Ann Oncol,2012,23(5):1348-1353.DOI:10.1093/annonc/mdr400.
[18]MARSÉ H,VAN CUTSEM E,GROTHEY A,et al.Management of adverse events and other practical considerations in patients receiving capecitabine(Xeloda)[J].Eur Med J Oncol Nurs,2004,8 Suppl 1:S16-30.
[19]赵成龙,张闽闽,陈杨,等.2例阿帕替尼致不良反应的药学监护[J].中国新药杂志,2016,25(2):238-240. ZHAO C L,ZHANG M M,CHEN Y,et al.Pharmaceutical care for two cases of apatinib-induced adverse reactions[J].Chinese Journal of New Drugs,2016,25(2):238-240.
(本文编辑:毛亚敏)
Clinical Manifestations in Five Cases of Hand-foot Syndrome Induced by Apatinib Mesylate
LUShu-jiao1,MAOShi-wang1,SHIYong2*
1.DepartmentofDermatologyandVenereology,LishuiPeople′sHospital,Lishui323000,China2.CenterforBreastDiseaseDiagnosisandTreatment/DepartmentofThyroidandBreastSurgery,LishuiPeople′sHospital,Lishui323000,China
Objective To analyze the clinical manifestations of five cases of hand-foot syndrome(HFS) induced by Apatinib mesylate,so as to provide a reference for clinical diagnosis and treatment of the disease.Methods We collected the clinical data of five patients with HFS induced by Apatinib mesylate diagnosed and treated in Department of Dermatology of Lishui People′s Hospital between 2015 and 2016,and reviewed their demographic data,clinical manifestations,treatment recommendations and follow-up results.Results Of the five cases(two males and three females;four cases of gastric cancer,and one case of breast cancer),the dose of Apatinib mesylate administered was 750-850 mg/d;the incubation period of HFS induced by Apatinib mesylate was 16-35 d.The status of HFS was assessed by Common Terminology Criteria for Adverse Events (CTCAE).Three of the five cases had staging 1 HFS with the clinical manifestations of erythema scattering on palms and soles without subjective symptoms;one case had staging 2 HFS with edematous erythema appearing on palms and soles accompanied by numbness and mild pain;one case had staging 3 HFS with erythema appearing on palms and soles accompanied by desquamation,blisters and intolerable tingling.All of them were treated with health education,reducing the irritation on hands and feet,vitamin B supplements,Celecoxib for easing the pain based on the subjective symptoms,and external moisturizer for moisturizing and caring the skin.HFS was well controlled by the above treatment without affecting the antineoplastic therapy with Apatinib mesylate in three patients with staging 1 HFS and one patient with staging 2 HFS.However,the above treatments were ineffective for the one patient with staging 3 HFS whose HFS even aggravated.In such conditions,the dose of Apatinib mesylate for the patient was reduced to 500 mg/d,and the HFS symptoms were relived significantly.Conclusion HFS is a common side effect of antineoplastic therapy with Apatinib mesylate in recent years.In general,it can be controlled by symptomatic treatment or reducing the dose of Apatinib mesylate without affecting the further antineoplastic therapy.
Hand-foot syndrome;Antineoplastic agents;Apatinib mesylate
浙江省医药卫生科技计划项目(2012KYA193)
R 246.7
B
10.3969/j.issn.1007-9572.2017.18.021
2016-12-06;
2017-04-06)
1.323000浙江省丽水市人民医院皮肤病与性病科
2.323000浙江省丽水市人民医院乳腺疾病诊治中心/甲状腺乳腺外科
*通信作者:施勇,副主任医师;E-mail:shiyong111@163.com
*Correspondingauthor:SHIYong,Associatechiefphysician;E-mail:shiyong111@163.com

