Palosuran改善四氯化碳肝硬化模型大鼠肝纤维化的机制研究
刘殿刚,张育先,张若蹊,张 超,李 非,王 宇
·论著·
Palosuran改善四氯化碳肝硬化模型大鼠肝纤维化的机制研究
刘殿刚1*,张育先2,张若蹊1,张 超1,李 非1,王 宇3
目的 探究尾加压素Ⅱ(UⅡ)受体拮抗剂Palosuran对四氯化碳(CCl4)肝硬化模型大鼠肝纤维化的改善作用。方法 2015年1—12月,将32只SPF/VAF级雄性Wistar大鼠随机分为对照组、4周模型组、8周模型组、治疗组,各8只。4周模型组、8周模型组分别腹腔注射0.2 ml/100 g CCl4溶液(分别连续4周、8周)建造肝硬化模型,造模后分别处死;对照组腹腔注射等量0.9%氯化钠溶液(连续8周),结束注射后处死;治疗组腹腔注射等量CCl4溶液(连续4周)建造肝硬化模型,之后改为Palosuran灌胃(4周),第8周末处死。取各组肝组织进行天狼猩红染色,观察各组肝组织病理组织学变化、统计肝纤维化半定量计分;检测各组肝组织羟脯氨酸(Hyp)水平;采用RT-qPCR检测各组肝组织Ⅰ型胶原(ColⅠ)mRNA表达水平;采用ELISA检测各组血清ColⅠ水平;采用免疫组化法检测各组肝组织α平滑肌肌动蛋白(α-SMA)阳性细胞计数。结果 对照组仅在肝内汇管区及静脉壁周围可见胶原沉积;4周模型组可见肝脏结构紊乱、纤维组织增生、假小叶形成;8周模型组可见肝小叶结构破坏,纤维组织增生明显,将肝小叶分隔成大小不等的肝细胞团,肝细胞索排列弥漫,中央静脉周围带大片肝细胞气球样肿胀,胞质疏松淡染,肝窦受压变窄;治疗组纤维间隔细小,增生的纤维组织明显减少。治疗组肝纤维化半定量计分〔(8.6±2.5)分〕低于8周模型组〔(16.1±2.2)分〕(P<0.05)。治疗组肝组织Hyp水平〔(135.6±20.9)ng/g〕低于8周模型组〔(332.4±2.6)ng/g〕(P<0.05);治疗组肝组织ColⅠ mRNA表达水平(103.63±7.96)及血清ColⅠ水平(8.75±1.67)均低于8周模型组(160.00±17.85,16.13±2.03)(P<0.05)。治疗组肝组织α-SMA阳性细胞计数〔(110.35±11.09)个〕少于8周模型组〔(210.57±38.09)个〕(P<0.05)。结论 Paolsuran可以改善CCl4肝硬化模型大鼠的肝纤维化程度,其机制可能是减少肝脏α-SMA阳性细胞。
肝硬化,实验性;尾加压素Ⅱ受体拮抗剂;四氯化碳
刘殿刚,张育先,张若蹊,等.Palosuran改善四氯化碳肝硬化模型大鼠肝纤维化的机制研究[J].中国全科医学,2017,20(18):2232-2236.[www.chinagp.net]
LIU D G,ZHANG Y X,ZHANG R X,et al.Mechanism of palosuran in the improvement of CCl4-induced liver fibrosis in rats[J].Chinese General Practice,2017,20(18):2232-2236.
尾加压素Ⅱ(UⅡ)是目前已知的最强的缩血管活性物质。UⅡ与其受体GPR14结合后引起的一系列生物学效应,与全身大部分脏器疾病密切相关[1]。近期研究发现,UⅡ在肝硬化门脉高压症患者中明显升高,且与疾病的严重程度相关[2]。本课题组前期研究发现血浆UⅡ水平与四氯化碳(CCl4)肝硬化模型大鼠肝纤维化程度呈正相关[3]。UⅡ可以促进肝纤维化进展,加剧肝脏血流动力学改变。有研究发现UⅡ受体拮抗剂Palosuran可以改善肺纤维化,对肺动脉高压有一定的治疗作用[4-6]。故推测Palosuran可以改善肝纤维化、降低门静脉高压,还可作为肝硬化潜在的治疗靶点,因此本实验拟从动物实验探讨Palosuran对CCl4肝硬化大鼠模型肝纤维化程度的影响,并初步探讨其机制。
1 材料与方法
1.1 实验材料 SPF/VAF级雄性Wistar大鼠32只,平均体质量(220.0±12.5)g(北京维通利华实验动物技术有限公司)。Palosuran由瑞士Actelion公司惠赠,分子量516.6;CCl4含量>99.5%(北京化工厂);UⅡ ELISA试剂盒(美国Phoneix公司);反转录酶、RNA抑制酶、Oligo(dT)(美国Promega公司);qPCR试剂盒(日本TakaRa公司);小鼠抗大鼠α平滑肌肌动蛋白(α-SMA)单抗(美国Sigma公司);大鼠Ⅰ型胶原(ColⅠ)ELISA试剂盒(武汉中美科技有限公司);A030-2羟脯氨酸(Hyp)测试盒(南京建成生物工程研究所);小鼠抗大鼠α-SMA单抗(美国Sigma公司);即用型第二代免疫组化Elivision plus(福州脉新生物技术开发有限公司)。
1.2 动物分组、模型制备及标本留取 2015年1—12月,将32只Wistar大鼠随机分为对照组、4周模型组、8周模型组、治疗组,各8只。肝硬化模型的具体操作方法参照文献[2]。对照组给予0.2 ml/100 g 0.9%氯化钠溶液腹腔注射,1次/d,连续8周;4周模型组给予0.2 ml/100 g CCl4溶液(40% CCl4∶橄榄油=4∶6)腹腔注射,连续4周;8周模型组给予等量CCl4溶液腹腔注射,连续8周;治疗组给予等量CCl4溶液腹腔注射连续4周后,给予300 mg·kg-1·d-1Palosuran〔4 g Palosuran加入200 ml 0.9%氯化钠溶液中,并与0.2%甲基纤维素(粘度300~550 mPa·s)混合〕[7-9]连续灌胃4周。
对照组、8周模型组、治疗组于实验第8周末处死,4周模型组于实验第4周末处死,分别心脏取血,切取同一部位肝组织,分两份,一份做病理检查,另一份迅速投入液氮,并转入-80 ℃冰箱保存。
1.3 病理组织学观察、肝纤维化半定量计分及肝组织Hyp水平检测 切取的肝组织经10%甲醛溶液固定后进行病理组织学检查。染色方法:天狼猩红(Sirus Red);光学显微镜观察肝组织病理组织学变化;并采用王泰龄教授介绍的肝纤维化半定量计分判断肝纤维化程度[10]。按照Hyp测试盒(碱水解法)说明书检测肝组织Hyp水平。
1.4 肝组织ColⅠ mRNA表达水平及血清ColⅠ水平测定 提取肝组织总蛋白,按反转录试剂盒操作说明书将mRNA反转录为cDNA,以三磷酸甘油醛脱氢酶(GADPH)为内参,ColⅠ上游引物:5′-CCTTTCTCCACCCCCTCTT-3′,下游引物:5′-TGTGTCTTTGGGGGAGACTT-3′,产物69 bp。PCR反应体系20 μl,96孔板加样后,3 000 r/min离心10 min(离心半径10 cm),上机运行程序反应条件:50 ℃预变性2 min,95 ℃变性10 min,95 ℃退火15 s,60 ℃延伸1 min,共40个循环。在每个循环延伸后收集荧光,以荧光强度为纵坐标,循环数为横坐标,绘制曲线计算每个样品的阈值(Ct值),重复3次,采用2-ΔΔCt法计算ColⅠ mRNA表达水平。
采用双抗体夹心ELISA检测血清ColⅠ水平,按照ELISA试剂盒说明书进行测定。
1.5 免疫组化法检测肝组织α-SMA阳性细胞计数 肝组织石蜡切片置于67 ℃烘箱中,烘片2 h,脱蜡至水,用pH=7.4的磷酸盐缓冲液(PBS)冲洗3次,3 min/次;每张切片加1滴3%过氧化氢(H2O2),室温下孵育10 min,以阻断内源性过氧化物酶的活性,PBS冲洗;小鼠抗大鼠α-SMA单抗(浓度1∶200),室温下孵育2 h;PBS冲洗;加入二抗HRP标记山羊抗小鼠IgG(浓度1∶1 500);按即用型第二代免疫组化Elivision plus试剂盒说明书操作,苏木素复染,0.1%HCl分化,自来水冲洗,蓝化,切片经梯度乙醇脱水干燥,二甲苯透明,中性树胶封固,晾干后显微镜下观察。参照本研究前期操作方法检测α-SMA阳性细胞计数[11]。
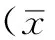
2 结果
2.1 肝组织病理组织学改变 对照组仅在肝内汇管区及静脉壁周围可见胶原沉积(见图1A)。4周模型组可见肝脏结构紊乱,天狼猩红染色可见纤维组织增生、假小叶形成(见图1B)。8周模型组可见肝小叶结构破坏,纤维组织增生明显,将肝小叶分隔成大小不等的肝细胞团,肝细胞索排列弥漫,中央静脉周围带大片肝细胞气球样肿胀,胞质疏松淡染,肝窦受压变窄(见图1C)。治疗组纤维间隔细小,增生的纤维组织明显减少(见图1D)。
2.2 4组肝纤维化半定量计分比较 对照组、4周模型组、8周模型组、治疗组肝纤维化半定量计分分别为0、(9.4±1.9)、(16.1±2.2)、(8.6±2.5)分;4组肝纤维化半定量计分比较,差异有统计学意义(F=93.61,P<0.001);治疗组与4周模型组肝纤维化半定量计分比较,差异无统计学意义(q=0.51,P=0.441);治疗组肝纤维化半定量计分低于8周模型组,差异有统计学意义(q=-4.46,P=0.002)。
2.3 4组肝组织Hyp水平比较 对照组、4周模型组、8周模型组、治疗组肝组织Hyp水平分别为(41.8±15.5)、(113.0±23.6)、(332.4±2.6)、(135.6±20.9)ng/g;4组肝组织Hyp水平比较,差异有统计学意义(F=72.16,P<0.001);治疗组肝组织Hyp水平低于8周模型组,差异有统计学意义(q=-3.12,P=0.004);治疗组肝组织Hyp水平高于对照组,差异有统计学意义(q=4.15,P=0.014)。
2.4 4组肝组织ColⅠmRNA表达水平及血清ColⅠ水平比较 4组肝组织ColⅠmRNA表达水平及血清ColⅠ水平比较,差异有统计学意义(P<0.001);其中治疗组肝组织ColⅠmRNA表达水平及血清ColⅠ水平均低于8周模型组,差异有统计学意义(P<0.05,见表1)。
2.5 4组肝组织α-SMA阳性细胞计数比较 对照组、4周模型组、8周模型组、治疗组肝组织α-SMA阳性细胞计数分别为(9.56±1.23)、(100.32±23.57)、(210.57±38.09)、(110.35±11.09)个;4组肝组织α-SMA阳性细胞计数比较,差异有统计学意义(F=103.24,P<0.001);治疗组肝组织α-SMA阳性细胞计数少于8周模型组,差异有统计学意义(q=-3.46,P=0.003,见图2)。

注:A为对照组,B为4周模型组,C为8周模型组,D为治疗组
图1 各组肝组织病理图(天狼猩红染色,×100)
Figure 1 Pathological manifestations in liver tissue specimens with sirius red staining in each groups

注:A为对照组,B为4周模型组,C为8周模型组,D为治疗组
图2 4组肝组织α平滑肌肌动蛋白阳性细胞(免疫组化染色,×200)
Figure 2 α-SMA-positive cells in liver tissue specimens stained by immunohistochemistry in the 4 groups

Table1ComparisonoflevelsofColⅠmRNAinlivertissuespecimensandserumColⅠin4groups

组别只数ColⅠmRNAColⅠ(ng/ml)对照组80.98±0.076.88±1.254周模型组8140.50±10.0612.00±2.348周模型组8160.00±17.8516.13±2.03治疗组8103.63±7.96a8.75±1.67aF值332.3351.69P值<0.001<0.001
注:ColⅠ=Ⅰ型胶原;与8周模型组比较,aP<0.05
3 讨论
UⅡ最早是在鱼尾下垂体中发现的调节肽,是目前所知最强的缩血管活性物质,其生物学活性多样[1]。UⅡ需与其特异性受体孤儿G-蛋白耦联受体U受体(UT)结合发挥作用,现多将两者统一称为UⅡ/UT系统[1]。有研究发现,UⅡ在肝炎肝硬化门脉高压症中起重要作用[8]。血清UⅡ水平随着肝病的发展而逐渐升高,可作为综合评价肝纤维化的潜在指标之一[12]。KEMP等[2]发现,肝硬化患者血浆UⅡ水平明显升高,且血浆UⅡ水平与门静脉压力及疾病严重程度成正比[2]。本课题组前期研究也发现肝硬化门脉高压症患者肝脏UⅡ/UT mRNA表达水平明显升高,肝脏UT表达水平也明显升高,UT主要定位于肝脏枯否细胞、肝窦内皮细胞,肝星状细胞也表达UT[13]。而这些细胞在肝纤维化的发生发展中至关重要,因此笔者推测UⅡ可能通过其血管活性作用、丝裂原活性、纤维化作用等多种生物学活性,作用于上述细胞,从而在肝纤维化发生发展中发挥重要作用。
UⅡ受体拮抗剂理论上可以改善肝纤维化,降低门静脉高压,可作为肝硬化潜在治疗靶点,而相关研究尚缺乏实验证据。Palosuran是UT特异拮抗剂,理化特性稳定,用药途径简单,且已在Ⅱ期临床试验用于治疗糖尿病肾病,安全性高[14]。TREBICKA等[15]研究Palosuran对胆管结扎肝硬化大鼠血流动力学的影响,结果发现Palosuran可以降低门静脉压力。在肝纤维化的发展机制中,肝星状细胞活化并分泌细胞外基质是肝纤维化形成的中心环节,肝ColⅠ mRNA表达水平升高是肝纤维化的突出特点,肝星状细胞被认为是纤维化肝脏中产生ColⅠ的主要来源[16]。因此本文选用肝组织ColⅠ及血清ColⅠ水平来验证Palosuran的抗纤维化作用。
本研究结果显示,治疗组肝纤维化半定量计分、肝组织Hyp水平、肝组织ColⅠ mRNA表达水平及血清ColⅠ水平均低于8周模型组,表明Palosuran可以明显降低CCl4肝硬化模型大鼠肝纤维化半定量计分,降低肝脏Hyp水平,降低肝ColⅠ mRNA表达水平及外周血ColⅠ水平,从而改善肝脏纤维化程度。本研究结果显示,治疗组肝组织α-SMA阳性细胞计数少于8周模型组,表明Palosuran可以减少肝脏α-SMA阳性细胞。已知活化的肝星状细胞表达α-SMA,且肝星状细胞活化是肝纤维化的中心环节[17]。推测Palosuran通过作用于肝星状细胞抑制ColⅠ胶原合成及分泌,进而改善肝纤维化程度。本课题组前期研究发现UⅡ受体拮抗剂SB-710411可预防肝纤维化发生[11],本实验从治疗角度证实UⅡ拮抗剂可逆转肝纤维化,但本实验局限于仅从CCl4大鼠模型证实Palosuran治疗效果,下一步拟从不同的动物模型及细胞实验进一步证实。
综上所述,Palosuran可以改善肝纤维化大鼠的肝纤维化程度及相关指标,其机制可能是减少肝脏α-SMA阳性细胞,但有待细胞实验进一步证实。
作者贡献:刘殿刚进行文章的构思与设计、撰写论文;张育先进行研究的实施与可行性分析;张若蹊进行数据整理;张超进行统计学处理;王宇进行结果分析与解释;李非负责文章的质量控制及审校。
本文无利益冲突。
[1]AMES R S,SARAU H M,CHAMBERS J K,et al.Human urotensin-Ⅱ is a potent vasoconstrictor and agonist for the orphan receptor GPR14[J].Nature,1999,401(6750):282-286.DOI:10.1038/45809.
[2]KEMP W,KOMPA A,PHROMMINTIKUL A,et al.Urotensin Ⅱ modulates hepatic fibrosis and portal hemodynamic alterations in rats[J].Am J Physiol Gastrointest Liver Physiol,2009,297(4):G762-767.DOI:10.1152/ajpgi.00127.2009.
[3]马雪梅,刘殿刚,白志刚.血浆尾加压素Ⅱ水平与CCl4大鼠肝纤维化程度的关系[J].国际外科学杂志,2010,37(10):667-670,封3.DOI:10.3760/cma.j.issn.1673-4203.2010.10. 008. MA X M,LIU D G,BAI Z G.Correlation between plasma levels of urotensin Ⅱ and severity of liver fibrosis in CCl4rats[J].International Journal of Surgery,2010,37(10):667-670, cover 3.DOI:10.3760/cma.j.issn.1673-4203.2010.10.008.
[4]ONAT A M,TURKBEYLER I H,PEHLIVAN Y,et al.The efficiency of a urotensin Ⅱ antagonist in an experimental lung fibrosis model[J].Inflammation,2012,35(3):1138-1143.DOI:10.1007/s10753-011-9421-6.
[5]ONAT A M,PEHLIVAN Y,TURKBEYLER I H,et al.Urotensin inhibition with palosuran could be a promising alternative in pulmonary arterial hypertension[J].Inflammation,2013,36(2):405-412.DOI:10.1007/s10753-012-9559-x.
[6]PEHLIVAN Y,DOKUYUCU R,DEMIR T,et al.Palosuran treatment effective as bosentan in the treatment model of pulmonary arterial hypertension[J].Inflammation,2014,37(4):1280-1288.DOI:10.1007/s10753-014-9855-8.
[7]GIULIANI L,LENZINI L,ANTONELLO M,et al.Expression and functional role of urotensin-Ⅱ and its receptor in the adrenal cortex and medulla:novel insights for the pathophysiology of primary aldosteronism[J].J Clin Endocrinol Metab,2009,94(2):684.DOI:10.1210/jc.2008-1131.
[8]CLOZEL M,HESS P,QIU C,et al.The urotensin-Ⅱ receptor antagonist palosuran improves pancreatic and renal function in diabetic rats[J].J Pharmacol Exp Ther,2006,316(3):1115-1121.DOI:10.1124/jpet.105.094821.
[9]VAUDRY H,LEPRINCE J,CHATENET D,et al.International union of basic and clinical pharmacology.XCⅡ.Urotensin Ⅱ,urotensin Ⅱ-related peptide,and their receptor:from structure to function[J].Pharmacol Rev,2015,67(1):214-258.DOI:10.1124/pr.114.009480.
[10]ZHAO X Y,WANG B E,LI X M,et al.Newly proposed fibrosis staging criterion for assessing carbon tetrachloride-and albumin complex-induced liver fibrosis in rodents[J].Pathol Int,2008,58(9):580-588.DOI:10.1111/j.1440-1827.2008.02274.x.
[11]LIU D G,WANG J,ZHANG Z T,et al.The urotension Ⅱ antagonist SB-710411 arrests fibrosis in CCl4cirrhotic rats[J].Mol Med Rep,2009,2(6):953-961.DOI:10.3892/mmr_00000198.
[12]梁冬雨,娄晓丽,侯彦强.血清尾加压素Ⅱ在3种肝脏疾病中的临床应用价值[J].检验医学与临床,2013,10(18):2359-2360.DOI:10.3969/j.issn.1672-9455.2013.18.003. LIANG D Y,LOU X L,HOU Y Q.Application value of serum UⅡ in chronic hepatitis B,liver fibrosis and liver cirrhosis[J].Lab Med Clin,2013,10(18):2359-2360.DOI:10.3969/j.issn.1672-9455.2013.18.003.
[13]LIU D,CHEN J,WANG J,et al.Increased expression of urotensin Ⅱ and GPR14 in patients with cirrhosis and portal hypertension[J].Int J Mol Med,2010,25(6):845-851.
[14]TSOUKAS P,KANE E,GIAID A.Potential clinical implications of the urotensin Ⅱ receptor antagonists[J].Front Pharmacol,2011,2:38.DOI:10.3389/fphar.2011.00038.
[15]TREBICKA J,LEIFELD L,HENNENBERG M,et al.Hemodynamic effects of urotensin Ⅱ and its specific receptor antagonist palosuran in cirrhotic rats[J].Hepatology,2008,47(4):1264-1276.DOI:10.1002/hep.22170.
[16]LEE Y A,WALLACE M C,FRIEDMAN S L.Pathobiology of liver fibrosis:a translational success story[J].Gut,2015,64(5):830-841.DOI:10.1136/gutjnl-2014-306842.
[17]MARRONE G,SHAH V H,GRACIA-SANCHO J.Sinusoidal communication in liver fibrosis and regeneration[J].J Hepatol,2016,65(3):608-617.DOI:10.1016/j.jhep.2016.04.018.
(本文编辑:毛亚敏)
Mechanism of Palosuran in the Improvement of CCl4-induced Liver Fibrosis in Rats
LIUDian-gang1*,ZHANGYu-xian2,ZHANGRuo-xi1,ZHANGChao1,LIFei1,WANGYu3
1.DepartmentofGeneralSurgery,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China2.DepartmentofGastroenterology,BeijingMoslemHospital,Beijing100054,China3.DepartmentofGeneralSurgery,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100069,China
Objective To investigate the effects of urotensin Ⅱ receptor antagonist palosuran on the improvement of CCl4-induced liver fibrosis in rats.Methods This study was conducted between January and December 2015.Thirty-two SPF/VAF grade male Wistar rats were randomly divided into four groups,normal control group〔receiving intragastric administration of sodium chloride solution (0.9%) 0.2 ml/100 g for 8 weeks〕;4-week CCl4cirrhotic model group(receiving intragastric administration of CCl4solution 0.2 ml/100 g for 4 weeks),8-week CCl4cirrhotic model group (receiving intragastric administration of CCl4solution 0.2 ml/100 g for 8 weeks) and palosuran-treated group (receiving intraperitoneal injection of CCl40.2 ml/100 g for 4 weeks,then intragastric administration of palosuran 300 mg·kg-1·d-1for another 4 weeks) with 8 rats in each.After the intervention,the rats in all groups were sacrificed and the liver tissues were taken out.The pathological manifestations in the liver tissue specimens with sirius red staining were detected,and semiquantitative scores of hepatic fibrosis was recorded.Hydroxyproline(Hyp) content in the liver tissue specimens was determined.Collagen type Ⅰ (ColⅠ) mRNA levels in the liver tissue specimens were assessed by RT-qPCR.Serum levels of ColⅠ were assessed by ELISA.The expressions of α-SMA-positive cells in liver tissue specimens were determined by means of immunohistochemistry.Results The pathological manifestations found:the normal control group exhibited only a small amount of collagen expression in the surrounding area of hepatic portal vein and hepatic portal area;the 4-week cirrhotic model group presented disordered structure of liver,proliferation of fibrous tissue and formation of pseudolobuli;the 8-week cirrhotic model group displayed destroyed hepatic lobular structure,marked proliferation of fibrous tissues,liver cell clusters separating the hepatic lobules into different sizes,diffusely arranged hepatic cords,massive balloon-like liver cells appearing in the central vein area,loosened and slightly colored cell cytoplasm,and narrowed liver sinusoid due to compression;the palosuran-treated group showed tiny fiber interval and significantly reduced proliferation of fibrous tissue.Compared with the 8-week cirrhotic model group,the palosuran-treated group had much lower degree of liver fibrosis showed by the semiquantitative scores 〔(8.6±2.5)vs.(16.1±2.2),P<0.05〕,significantly lower Hyp content〔(135.6±20.9)ng/g vs.(332.4±2.6)ng/g,P<0.05〕,obviously lower ColⅠ mRNA levels 〔(103.63±7.96) vs.(160.00±17.85),P<0.05 〕,substantially lower serum ColⅠ levels〔(8.75±1.67) vs.(16.13±2.03),P<0.05 〕,much less α-SMA-positive cells in liver〔(110.35±11.09)vs.(210.57±38.09),P<0.05〕.Conclusion Paolsuran could relieve the CCl4-induced liver fibrosis in rats.The mechanism may be associated with the reduction of expressions of α-SMA-positive cells in liver.
Liver cirrhosis,experimental;Urotensin Ⅱ antagonist;Carbon tetrachloride
国家自然科学基金资助项目(81170408);中国博士后科学基金(2012M510094)
R 575.2
A
10.3969/j.issn.1007-9572.2017.18.013
2017-02-05;
2017-05-03)
1.100053北京市,首都医科大学宣武医院普外科
2.100054北京市回民医院消化科
3.100069北京市,首都医科大学附属北京友谊医院普外科
*通信作者:刘殿刚,副主任医师,副教授;E-mail:liudiangang01@gmail.com
*Correspondingauthor:LIUDian-gang,Associatechiefphysician,Associateprofessor;E-mail:liudiangang01@gmail.com

