在线液相色谱-二极管阵列检测器-串联质谱法检测野生菌中鹅膏毒肽和鬼笔毒肽
徐小民, 张京顺, 蔡增轩, 张 晶, 黄百芬, 许娇娇, 陈 苘
(浙江省疾病预防控制中心, 浙江 杭州 310051)
研究论文
在线液相色谱-二极管阵列检测器-串联质谱法检测野生菌中鹅膏毒肽和鬼笔毒肽
徐小民*, 张京顺, 蔡增轩, 张 晶, 黄百芬, 许娇娇, 陈 苘
(浙江省疾病预防控制中心, 浙江 杭州 310051)
建立了在线液相色谱-二极管阵列检测器-串联质谱技术(LC-DAD-MS/MS)同时测定野生菌中多肽类蘑菇毒素(鹅膏毒肽和鬼笔毒肽)的分析方法。样品经甲醇提取,水稀释后,在碱性条件下用XBridgeTMBEH C18柱(150 mm×3.0 mm, 2.5 μm)分离,并先后用DAD和MS/MS检测。使用碱性流动相能够实现5种多肽类蘑菇毒素在15 min内达到基线分离,同时又能有效抑制质谱加钠峰[M+Na]+的响应信号,保证检测的稳定性和灵敏度。5种蘑菇毒素在0.05~500 mg/kg范围内线性关系良好,相关系数(r)>0.99;检出限为0.005~0.02 mg/kg。通过实际样品检测,证明该法操作简单、快速,灵敏度高,宽的定量检测线性范围能满足实际样品中蘑菇毒素含量变化大的特点。
在线液相色谱-二极管阵列检测器-串联质谱法;宽线性范围定量;蘑菇毒素;鹅膏毒肽;鬼笔毒肽;野生菌
鹅膏毒肽(amanitins)和鬼笔毒肽(phallotoxins)属于致命的环状多肽类蘑菇毒素,小鼠半数致死量(LD50)分别为0.3~0.7 mg/kg和1.5~3 mg/kg[1],前者主要包括α-鹅膏毒肽(α-amanitin)、β-鹅膏毒肽(β-amanitin)和γ-鹅膏毒肽(γ-amanitin),后者主要包括羧基二羟鬼笔毒肽(phallacidin)和二羟鬼笔毒肽(phalloidin)。我国野生菌资源丰富,已报道的有3 800种以上,而有毒的有435种[2]。近年来,我国因有毒蘑菇引起的突发中毒事件频繁发生,2004~2014年的病死率高达21.24%[3],主要由能引起肝肾功能衰竭的多肽类蘑菇毒素引起。
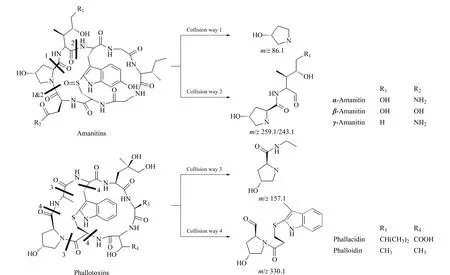
图 1 鹅膏毒肽和鬼笔毒肽的结构式和MS/MS碎裂途径Fig. 1 Structures and MS/MS collision ways of amanitins and phallotoxins
多肽类蘑菇毒素主要存在于鹅膏菌和褐鳞伞等野生菌中[4,5],但不同野生菌中毒素含量水平差异较大,同一野生菌中不同毒素异构体的含量也存在较大差异。陈作红等[4]采用液相色谱-紫外检测法(LC-UV)检测发现灰花纹鹅膏菌Amanitafuliginea中不同毒素的含量范围可达9~9 311 μg/g(干重)。目标化合物含量水平的差异需要检测方法具有较宽的线性范围,以实现单针进样满足不同含量的毒素异构体的定量要求。文献报道的多肽类蘑菇毒素的定性定量检测方法主要有LC-UV[4,5]、液相色谱-二极管阵列检测法(LC-DAD)[6]、液相色谱-串联质谱法(LC-MS/MS)[7-9]和液相色谱-飞行时间质谱法(LC-TOF MS)[10,11]。LC-UV或LC-DAD对含量较高的蘑菇毒素的定量有优势,但含量较低时容易产生假阴性结果,不利于毒素异构体的检出,而此类异构体对于多肽类蘑菇毒素的生物合成或代谢研究意义重大。LC-MS/MS适用于低含量水平的蘑菇毒素的定量检测,但对于高浓度且异构体含量差异较大的样品,需要多步稀释才能得到准确的结果。本研究基于在线LC-DAD-MS/MS联用技术,建立了一种宽线性范围的野生菌中多肽类蘑菇毒素的定性定量检测方法。
1 实验部分
1.1 仪器与试剂
LC-MS 8050液相色谱-串联质谱仪和SPD-M30A 二极管阵列检测器(日本岛津公司);超纯水装置(美国Millipore公司); T25组织匀浆机(德国IKA公司); HC-3018高速离心机(安徽中科中佳科学仪器有限公司); KQ-500E超声波清洗器(江苏昆山超声仪器有限公司)。
甲醇为色谱纯(德国Merck公司);氨水为分析纯(国药集团化学试剂有限公司);α-鹅膏毒肽、β-鹅膏毒肽、γ-鹅膏毒肽、羧基二羟鬼笔毒肽和二羟鬼笔毒肽标准品纯度均大于90%(美国Alexis公司),具体化学结构式见图1。野生菌样品由杭州及周边地区自行采集得到。
1.2 标准溶液的配制
分别准确称取5种蘑菇毒素标准品于10 mL容量瓶中,用甲醇溶解并定容至刻度,配制质量浓度为100 mg/L的标准储备液,于-20 ℃避光保存;分别移取1 mL标准储备液,用甲醇稀释并配制质量浓度为10 mg/L的混合标准使用液;移取适量混合标准使用液,用25%(v/v)甲醇水溶液配制质量浓度为0.001~25 mg/L的系列混合标准溶液。
1.3 分析条件
色谱柱:XBridgeTMBEH C18柱(150 mm×3.0 mm, 2.5 μm,美国Waters公司);流动相:(A)0.03%(v/v)氨水(pH 10.7)和(B)甲醇。梯度洗脱程序:0~4.0 min, 5%B~35%B; 4.0~6.0 min, 35%B; 6.0~9.0 min, 35%B~90%B; 9.0~11.0 min, 90%B; 11.0~11.5 min, 90%B~5%B; 11.5~15.0 min, 5%B。流速:0.35 mL/min;进样量:5.0 μL。 DAD检测扫描范围:200~450 nm(各毒素的具体定量检测波长见表1);阀切换时间:0~4.0 min,洗脱液通过切换阀排入废液槽,4.0~15.0 min,洗脱液切换至质谱仪。
离子源:电喷雾离子(ESI)源;正离子模式;离子源接口电压:4.5 kV;雾化气:氮气,3.0 L/min;干燥气:氮气,10 L/min;加热气:空气,10 L/min;碰撞气:氩气;脱溶剂管温度:250 ℃;加热块温度:350 ℃;接口温度:250 ℃;多反应监测(MRM)模式。5种多肽类蘑菇毒素的其他质谱条件见表1。

表 1 5种多肽类蘑菇毒素的保留时间(tR)、母离子、子离子和其他分析参数
CE: collision energy; DAD: diode array detector; *quantitation ion.
1.4 样品前处理
将新鲜野生菌切成小块,组织匀浆机匀浆后,置于-20 ℃保存。准确称取匀浆后的试样约2 g(精确至0.01 g),置于15 mL聚丙烯刻度离心管中,加入8 mL甲醇,涡旋混匀1 min,超声提取15 min,待冷却至室温后,用甲醇定容至10 mL,混匀,以4 000 r/min离心2 min,移取1 mL上清液,加入3 mL纯水,涡旋混匀,过0.22 μm滤膜,供检测。
2 结果与讨论
2.1 质谱碎裂途径
电喷雾技术被广泛应用于多肽和蛋白质的定量检测[12,13]。多肽类蘑菇毒素的二级质谱碎裂途径见图1。鹅膏毒肽类物质通过碎裂途径1可以得到相对丰度较强的质谱峰(m/z86.1);通过碎裂途径2可以得到相对丰度强的α-鹅膏毒肽、β-鹅膏毒肽质谱峰(m/z259.1)和γ-鹅膏毒肽质谱峰(m/z243.1)。其中,γ-鹅膏毒肽相较另两种鹅膏毒肽少一个氧原子,其质谱图如出现相差1个氧原子的质谱峰,则可以佐证碎裂途径2的存在。羧基二羟鬼笔毒肽和二羟鬼笔毒肽存在共同的碎裂途径3和4,可得到相同的碎片离子峰(m/z157.1和m/z330.1)。
2.2 DAD定量检测波长的选择
鹅膏毒肽和鬼笔毒肽的DAD特征检测波长由结构式中共同的吲哚母核(苯并吡咯结构)产生(见图1),而取代基的不同使两者的最大特征吸收波长不同,分别为308 nm和290 nm,羟基和亚砜取代基的存在使得鹅膏毒肽类的最大特征吸收波长比鬼笔毒肽类高18 nm。本文在308 nm和290 nm波长下分别定量检测鹅膏毒肽和鬼笔毒肽,标准溶液的DAD色谱图见图2,鹅膏毒肽和鬼笔毒肽在各自的最大吸收波长下表现出更高的响应值;同时,对于出峰最早的β-鹅膏毒肽,在308 nm的检测波长下,抗干扰能力比在290 nm波长下强,能够保证定量检测的准确性。

图 2 蘑菇毒素标准溶液在290 nm和308 nm波长下的LC-DAD色谱图Fig. 2 Chromatograms of the mushroom toxins in standard solutions analyzed by LC-DAD at 290 nm and 308 nm1. β-amanitin; 2. α-amanitin; 3. phallacidin; 4. γ-amanitin; 5. phalloidin.
2.3 色谱条件的优化
基于DAD检测的液相色谱方法需要被测物与干扰物、样品基质完全分离。多肽类蘑菇毒素多采用C18柱在酸性流动相条件下分离,为得到最佳的分离效果,文献[5]采用规格为250 mm×4.6 mm(5 μm)的色谱柱,分析时间通常需要30~60 min。本文尝试采用规格为150 mm×3.0 mm(2.5 μm)的色谱柱进行分离,并采用碱性流动相分离野生菌中的多肽类蘑菇毒素,考察不同体积分数(0.020%、0.025%、0.030%和0.035%)的氨水对5种蘑菇毒素分离效果的影响。结果表明,当氨水的体积分数高于0.025%时,5种蘑菇毒素能在15 min内达到基线分离。考虑到氨水的挥发性与碱性,本文采用0.030%(v/v)的氨水作为流动相中的水相,此时流动相的pH值为10.7。XBridgeTMBEH C18色谱柱的容许pH范围为1~12,完全能承受本文所选择的流动相条件。
2.4 碱性条件下质谱检测
文献[14,15]报道在酸性流动相条件下,多肽类蘑菇毒素的质谱检测存在[M+Na]+峰,会导致[M+H]+峰的比例降低,从而影响检测的灵敏度。本文在多肽类蘑菇毒素的检测中同样发现了[M+Na]+和[M+K]+峰(见图3),相对于[M+H]+峰,[M+Na]+峰的m/z增加了22,[M+K]+峰的m/z增加了38。对比分析流动相中pH值为5.0和10.7时各蘑菇毒素母离子的全扫描质谱图,发现在弱酸性(pH 5.0)条件下,α-鹅膏毒肽和γ-鹅膏毒肽存在强[M+Na]+峰(m/z941.35和m/z925.35),使得[M+H]+峰(m/z919.35和m/z903.35)的响应强度极弱。而在本文所选择的弱碱性(pH 10.7)条件下,这两种物质[M+H]+峰的响应强度得到极大增强,其他3种组分的[M+H]+峰也有所改善。
2.5 基质效应的考察
蘑菇毒素作为剧毒物质,发生急性中毒时需要以最快的速度进行定性和定量检测,所以此类物质不宜采用固相萃取等前处理时间较长的净化方法。而野生菌中蘑菇毒素的含量分布较宽,采用二极管阵列检测器和串联质谱检测时,前者易受基质的影响产生干扰峰,后者易产生基质抑制效应,从而影响定量分析。
本文将单个样品的前处理时间控制在20~30 min内,并通过下列措施减少因基质产生的定量不准确的问题:1)参考文献[16]的报道,将样品稀释20倍以降低质谱检测的基质效应,此时DAD检测的线性上限可达500 mg/kg,使方法的线性范围满足野生菌中多肽类蘑菇毒素含量范围大的要求;2)阀切换在线去除易干扰质谱离子化效率的水溶性基质,如盐、蛋白质、糖类和氨基酸等;3)将β-鹅膏毒肽的保留时间控制在5 min之后,以尽可能地降低DAD检测时的基质干扰;4)通过碱性色谱洗脱条件改善[M+H]+峰的离子化效率。

图 3 在pH 5.0和pH 10.7的流动相条件下5种多肽类蘑菇毒素的质谱图Fig. 3 Mass spectra of the five polypeptide mushroom toxins under pH 5.0 and pH 10.7 of mobile phases
本文考察了空白样品提取液添加0.1 mg/kg标准物质时的基质效应(见图4)。采用pH 5.0的流动相分离时,α-鹅膏毒肽和γ-鹅膏毒肽的质谱检测存在较强的基质抑制效应;采用pH 10.7的流动相分离时,质谱检测的基质效应能控制在15%以内。且样品采用二极管阵列检测器检测时基本未见干扰峰(见图2)。
2.6 方法学考察
2.6.1 线性范围和检出限
5种蘑菇毒素采用二极管阵列检测器检测时,在2~500 mg/kg范围内线性良好,相关系数(r)为0.9985~0.9998;采用MS/MS检测时,5种蘑菇毒素在0.05~2 mg/kg范围内线性良好,r为0.9961~0.9997(见表2)。目标化合物经色谱分离后先经过DAD检测,再进入MS/MS检测,含量低于2 mg/kg的可以采用质谱定量,高于2 mg/kg的采用DAD定量。以定性离子3倍信噪比对应的含量为检出限,其中二羟鬼笔毒肽的检出限为0.005 mg/kg,其他4种蘑菇毒素的检出限均为0.02 mg/kg。

表 2 5种多肽类蘑菇毒素的线性范围、相关系数和检出限

图 4 不同流动相条件下5种多肽类蘑菇毒素的基质效应(n=6)Fig. 4 Matrix effects of the five polypeptide mushroom toxins under different pH values of mobile phase (n=6)
2.6.2 回收率和精密度
采用MS/MS和DAD检测时,分别在空白野生菌样品中添加0.05、0.2、2 mg/kg和5、20、200 mg/kg的混合标准物质,每个水平做6个平行试验,考察方法的准确度(回收率)和精密度,结果见表3和表4。其中,MS/MS检测时,空白野生菌样品的加标回收率为72.4%~111.8%,相对标准偏差(RSD)为4.8%~10.2%; DAD检测时,空白野生菌样品的加标回收率为77.1%~117.5%, RSD为5.0%~10.6%。
2.7 实际样品测定
采集杭州及周边地区的86份野生菌,包括鹅膏菌、褐鳞伞、牛肝菌、环柄菇、白乳菇等,只有1份白鹅膏菌和1份小褐鳞伞(Lepiotabrunneo-incarnata)检出了多肽类蘑菇毒素,结果见表5。小褐鳞伞中只检测出γ-鹅膏毒肽、β-鹅膏毒肽和α-鹅膏毒肽,含量分别为0.203 mg/kg(MS/MS)、54.3 mg/kg(DAD)和148 mg/kg(DAD);白鹅膏菌中同时检出3种鹅膏毒肽和2种鬼笔毒肽,含量范围为0.142~47.9 mg/kg。阳性高浓度毒素可以通过DAD直接定量,而低浓度毒素则通过MS/MS测定。建立的在线LC-DAD-MS/MS法能实现宽含量范围的蘑菇毒素的定量检测。LC-MS/MS检测阳性白鹅膏菌中多肽类蘑菇毒素的色谱图见图5。

表 3 MS/MS检测5种多肽类蘑菇毒素在3个加标水平下的回收率和相对标准偏差(n=6)

表 5 实际样品中多肽类蘑菇毒素的检测结果
ND: not detected; a: dilution folds.

图 5 LC-MS/MS检测阳性白鹅膏菌中多肽类蘑菇毒素的色谱图Fig. 5 Chromatograms of the polypeptide mushroom toxins in a positive Amanita sample by LC-MS/MS Peaks 1-5 were the same as in Fig. 2.
3 结论
本研究建立了在线LC-DAD-MS/MS检测野生菌中鹅膏毒肽和鬼笔毒肽的分析方法。该方法适用于不同含量的多肽类蘑菇毒素的定性、定量检测,也适用于野生菌中毒事件中相关毒素的快速筛选和确证。
[1] Karlson-Stiber C, Persson H. Toxicon, 2003, 42(4): 339
[2] Tolgor B, Bao H Y, Li Y. Mycosystema, 2014, 33(3): 517
图力古尔, 包海鹰, 李玉. 菌物学报, 2014, 33(3): 517[3] Zhou J, Yuan Y, Lang N, et al. Chinese Journal of Emergency Medicine, 2016, 25(6): 724
周静, 袁媛, 郎楠, 等. 中华急诊医学杂志, 2016, 25(6): 724
[4] Chen Z H, Hu J S, Zhang Z G, et al. Mycosystema, 2003, 22(4): 565
陈作红, 胡劲松, 张志光, 等. 菌物系统, 2003, 22(4): 565
[5] Sgambelluri R M, Epis S, Sassera D, et al. Toxins, 2014, 6(8): 2336[6] Kaya E, Yilmaz I, Sinirlioglu Z A, et al. Toxicon, 2013, 76: 225
[7] Zhang X Y, Cai X X. Chinese Journal of Analytical Chemistry, 2010, 38(1): 39
张秀尧, 蔡欣欣. 分析化学, 2010, 38(1): 39
[8] Leite M, Freitas A, Azul A M, et al. Anal Chim Acta, 2013, 799: 77
[9] Nomura M, Suzuki Y, Kaneko R, et al. Forensic Toxicol, 2012, 30: 185
[10] Ishii A, Tada M, Kusano M, et al. Forensic Toxicol, 2014, 32: 342[11] Liu J, Ding W J, He B Y, et al. Chinese Journal of Analytical Chemistry, 2013, 41(4): 500
柳洁, 丁文婕, 何碧英, 等. 分析化学, 2013, 41(4): 500
[12] Zhou Y, Shan Y C, Zhang L H, et al. Chinese Journal of Chromatography, 2013, 31(6): 496
周愿, 单亦初, 张丽华, 等. 色谱, 2013, 31(6): 496
[13] Feng X Y, Zhang J, Lü M L, et al. Chinese Journal of Chromatography, 2013, 31(6): 510
冯小燕, 张津, 吕美玲, 等. 色谱, 2013, 31(6): 510
[14] Clarke D B, Lloyd A S, Robb P. Anal Methods-UK, 2012, 4(5): 1298
[15] Chung W C, Tso S C, Sze S T. J Chromatogr Sci, 2007, 45(2): 104
[16] Ferrer C, Lozano A, Aguera A, et al. J Chromatogr A, 2011, 1218(42): 7634
Science Research Foundation Program of Zhejiang Provincial Medicine and Health (No. 2015DTA006).
Determination of amanitins and phallotoxins in wild mushrooms by online liquid chromatography-diode array detector-tandem mass spectrometry
XU Xiaomin*, ZHANG Jingshun, CAI Zengxuan, ZHANG Jing,HUANG Baifen, XU Jiaojiao, CHEN Qing
(ZhejiangProvincialCenterforDiseaseControlandPrevention,Hangzhou310051,China)
A fast and wide linear range method was established for the determination of mushroom toxins amanitins (α-amanitin,β-amanitin andγ-amanitin) and phallotoxins (phallacidin and phalloidin) in wild mushrooms by online liquid chromatography-diode array detector-tandem mass spectrometry (LC-DAD-MS/MS). The mushroom toxins were extracted with methanol, and diluted with water. The extracts were separated on an XBridgeTMBEH C18column (150 mm×3.0 mm, 2.5 μm) under pH 10.7, measured by DAD and then analyzed by MS/MS. Basic mobile phase conditions were applied to improve the ionization efficiency of hydrogen ion adducts. The baseline separation of the analytes was obtained within 15 min. The limits of detection (LODs) of the sample matrix were 0.005-0.02 mg/kg. The toxins were quantified by the results measured by MS/MS when the toxin contents less than 2 mg/kg, and quantified by the results obtained from DAD when the contents more than 2 mg/kg. The linear range was 0.05-500 mg/kg for the whole method in one injection. The method was successfully applied to the analyses of amanitins and phallotoxins inLepiotabrunneoincarnataand whiteAmanita.
online liquid chromatography-diode array detector-tandem mass spectrometry (LC-DAD-MS/MS); wide linear range quantification; mushroom toxins; amanitins; phallotoxins; wild mushrooms
10.3724/SP.J.1123.2017.02008
2017-02-09
浙江省医药卫生科技计划项目(2015DTA006).
O658
A
1000-8713(2017)06-0613-07
* 通讯联系人.Tel:(0571)87115265,E-mail:chemxuxm@163.com.

