茶角胸叶甲高毒力球孢白僵菌菌株的筛选
王定锋,李良德,黎健龙,李慧玲,张辉,王庆森,吴光远*
1. 福建省农业科学院茶叶研究所,福建 福安 355015;2. 广东省农业科学院饮用植物研究所/广东省茶树资源创新利用重点实验室,广东 广州 510640
茶角胸叶甲高毒力球孢白僵菌菌株的筛选
王定锋1,李良德1,黎健龙2,李慧玲1,张辉1,王庆森1,吴光远1*
1. 福建省农业科学院茶叶研究所,福建 福安 355015;2. 广东省农业科学院饮用植物研究所/广东省茶树资源创新利用重点实验室,广东 广州 510640
茶角胸叶甲(Basilepta melanopusLefevre)是一种茶树上常见的食叶性害虫,其发生为害严重影响茶叶的产量和品质。近年来,该虫在局部茶园,尤其是有机茶园中常爆发成灾。如何有效防治该害虫,已成为亟待解决的问题。本研究选择原寄主为茶园鞘翅目害虫的9个球孢白僵菌(Beauveria bassiana)菌株,依据菌落形态、菌株生长速率、产孢量、孢子萌发率、耐热力和抗紫外能力等生物学性状初步筛选出Bb338、Bb346和Bb2-1等3个生物学性状优良的菌株;在此基础上,利用浸虫法研究了3个菌株对茶角胸叶甲成虫的杀虫毒力。生测结果表明,用每毫升1×107个孢子的孢悬液处理后,球孢白僵菌Bb2-1对茶角胸叶甲成虫的累计校正死亡率达100%,僵虫率达86.11%;LT50仅为3.32 d。综合上述各生物学特性和杀虫毒力表明,筛选到的Bb2-1菌株具有生长速率快、产孢量大、耐热力和抗紫外能力强,以及对茶角胸叶甲杀虫毒力最强和杀虫速率最快等优点,在今后茶角胸叶甲的生物防治中将发挥重要的作用。
茶角胸叶甲;球孢白僵菌;生物学特性;毒力;菌株筛选
茶角胸叶甲(Basilepta melanopusLefevre)又名黑足角胸叶甲,属鞘翅目(Coleoptera)肖叶甲科(Eumolpidae),是茶树[Camellia sinensis(L.)O. Kuntze]上一种常见的食叶性害虫,主要分布于福建、江西、湖南、广东和广西等产茶省。该虫成虫咬食茶树嫩梢芽叶或成叶,形成不规则缺刻或孔洞,致叶片千疮百孔,破烂不堪,严重影响茶叶的产量和品质[1-3]。除茶树外,它还为害油茶Camellia oleifera[4]和珍珠菜Lysimachia clethroides[5]。自1979年在江西发现以来,该虫在赣西北北部、南部,赣南西部发生严重,常导致夏茶减产48%以上[6]。汪荣灶的调查发现,角胸叶甲对茶丛的为害率达100%,对茶叶的为害率达70%以上,被害叶的取食孔达5~47个不等[5]。谭济才等[7]发现自1979年以来该虫在湖南多个产茶县为害成灾;其中郴州地区70%以上的茶园发生严重。而何学友等对福建省清流县、邵武市油茶林样地的调查发现油茶株受害率为100%,叶片受害率15%~90%,危害均较为严重[4]。对该虫的防治除了农业防治[5,7-9]、物理防治[5,7-9]以外,尚以化学防治为主[5,7-11]。化学农药的长期大量使用所产生的农业3R问题(抗性、残留和再猖獗),严重破坏生态环境、危害人类健康。近年来,随着人们对茶叶食品安全问题的日益关注和有机茶种植的兴起,在茶叶生产过程中如何安全、有效地防治该害虫,已成为亟待解决的问题。
球孢白僵菌(Beauveria bassiana)具有寄主范围广、易于培养、可持续控制害虫和对环境友好等优点,已被用于防治多种农林害虫[12]。而截至2008年,全球先后有182个真菌杀虫剂产品问世,其中35.16%以球孢白僵菌为有效成分[13-15]。何学友等[16]通过测定白僵菌(B. bassiana)和绿僵菌(Metarrhizium anisopliae)菌株的生长速率、产孢量和对角胸叶甲的室内毒力,筛选出了两株生物学性状优良且杀虫活性强的白僵菌菌株。曾明森等[17]对分离至茶角胸叶甲的2个白僵菌分离株开展室内毒力测定和茶园小区寄生率的调查研究,发现菌株I对茶角胸叶甲的室内寄生效果较好,每毫升2×107个孢子处理后15 d的寄生率为66.65%;菌粉用量15 kg·hm-2时,对茶角胸叶甲的田间寄生率最高可达45.21%。前人研究发现从原寄主或其近缘种上分离的虫生真菌菌株对靶标昆虫具有更强的毒力[18-19]。因此,为进一步丰富茶角胸叶甲生防菌资源,获得高效的生防菌株,我们从本实验室保存的、茶树鞘翅目害虫上分离获得的球孢白僵菌菌株中挑选出9个株系;并以菌落形态、生长速率、产孢量、孢子萌发率、耐热力和抗紫外能力等指标为参数筛选优良菌株,继而采用浸虫法对筛选到的优良菌株进行室内生物测定。最终筛选出1株生物学性状优良,且对茶角胸叶甲毒力高的球孢白僵菌Bb2-1菌株。本研究以期为今后田间大规模应用白僵菌防治茶角胸叶甲奠定基础。
1 材料与方法
1.1 供试虫源
于角胸叶甲成虫发生高峰期,从茶园中采集成虫带回实验室,用扦插在花泥上的无农药污染的新鲜茶梢饲养2 d,选取健康活跃、大小基本一致的成虫(不分雌雄)用于生物测定。
1.2 供试菌株
9株供试球孢白僵菌菌株信息详见表1,用SDAY试管斜面保存于本实验室4℃冰箱中。
1.3 培养基
萨氏培养基(SDAY):4%葡萄糖、1%酵母、1%蛋白胨、2%琼脂,pH7.0。高压灭菌锅121℃灭菌20 min。
孢子萌发液:2%蔗糖、0.5%蛋白胨,0.05%吐温–80。灭菌条件同SDAY培养基。
1.4 菌株生长速率、产孢量和孢子萌发率测定
菌株生长速率测定:采用菌块接种法,参照文献[20]的方法。用三角玻璃棒将各菌株的分生孢子悬液均匀涂布在SDAY平板上培养
5 d,然后用直径为8 mm的打孔器从上述平板中打出新鲜菌块,并接种于SDAY平板上,于培养箱内培养(25℃,光照条件12L/12D),每个菌株3次重复。用直尺十字交叉法测量培养5 d、10 d和15 d的菌落直径。产孢量和孢子萌发率测定:参照雷妍圆等[21]方法测定产孢量和孢子萌发率。用直径为8 mm的打孔器从在SDAY平板上培养14 d的菌落中心至边缘1/2处随机打取1个菌块,放入装有10 mL萌发液的三角瓶(50 mL)中,用磁力搅拌器充分搅拌,然后置于130 r·min-1、25℃摇瓶培养18 h。用血球计数板计数,计算产孢量和孢子萌发率。每菌株为1个处理,重复3次。

表1 供试菌株Table 1 Fungal strains used in this study
1.5 不同菌株孢子耐热性测定
参照俞佳和冯明光方法测定分生孢子耐热力[22],并稍做修改。具体操作如下:从SDAY平板培养14 d的各菌株中刮取分生孢子,用0.05%吐温-80配成浓度为每毫升1.0×107个孢子的孢悬液,用移液枪移取100 μL孢悬液于装有4 mL孢子萌发液的试管中,涡旋振荡混匀。将上述试管置于48℃恒温水浴锅中水浴12 min后立即取出,继而放于摇床中25℃,150 r·min-1,振荡培养24 h。各菌株孢子的萌发率用血球计数板计数,并以未经水浴处理的相同条件下培养的孢子萌发率为对照(CK)。每个菌株3次重复。不同菌株孢子的耐热性用孢子萌发抑制率来表示,抑制率越弱,表明菌株的耐热力越强。孢子萌发抑制率计算公式如下:
孢子萌发抑制率(%)=(1-处理组孢子萌发率/对照组孢子萌发率)×100。
1.6 不同菌株孢子抗紫外能力测定
用胶头滴管取1滴孢悬液(每毫升1.0×107个孢子)滴于载玻片上,于室温下自然风干后,置于8 W紫外灯下,距离44 cm,照射10 min。接着往载玻片菌斑处加入100 mL萌发液,用移液器枪头在菌斑上刮3~5次,然后反复吹吸萌发液5次,以便洗下孢子,最后把萌发液连同洗下的孢子转移到4 mL孢子萌发液中,涡旋振荡混匀。并在25℃,150 r·min-1,黑暗条件下,振荡培养24 h。最后,用血球计数板对各菌株孢子的萌发率进行计数,并以未经紫外光处理、相同培养条件的孢子萌发率作为对照(CK)。每个菌株重复3次。孢子萌发抑制率的计算方法参照步骤1.5。孢子萌发抑制率越弱,表明菌株的抗紫外能力越强。
1.7 菌株对茶角胸叶甲成虫毒力测定
1.7.1 菌株准备
将前面筛选到3个优良菌株(Bb338、Bb346和Bb2-1)的孢悬液(每毫升1.0×107个孢子),用移液器取5 μL分别点植于SDAY平板上,25℃下培养14 d,收集新鲜的分生孢子,用0.05%吐温-80溶液配成每毫升1.0×107个孢子的孢悬液。
1.7.2 毒力测定
参照文献[20]的方法进行浸虫处理,角胸叶甲成虫接菌后置于1L塑料杯中,用基部包有湿润的无菌脱脂棉的新鲜茶梢饲养。用纱网封住塑料杯口,置于25℃、95%湿度、光周期12L/12D的人工气候箱饲养,每2 d更换1次新的茶梢。每个菌株为1个处理,每个处理12头茶角胸叶甲成虫,重复3次,以0.05%吐温-80溶液为对照。接菌处理后第2天开始,每天调查1次叶甲的死亡情况。如发现死虫,将其移出塑料杯并置于无菌培养皿内保湿培养,观察死虫上是否长出菌丝。死亡率、校正死亡率和僵虫率(虫尸上长出肉眼可见的菌丝及孢子)的计算公式如下:
累计死亡率(%)=死亡虫口数/处理总虫数×100
累计校正死亡率(%)=(处理组累计死亡率-对照组累计死亡率)/(1-对照组累计死亡率)×100
僵虫率(%)=死亡后形成僵虫的虫数/处理总虫数×100
1.8 统计分析
采用SPSS 17.0软件中单因素方差分析对试验数据进行处理。利用邓肯氏新复极差法对试验数据进行多重比较分析;采用probit方法计算致死中时(LT50)。
2 结果与分析
2.1 培养形态
从表2可以看出,供试的9个白僵菌菌株的菌落形态差异较大,大致可分A型(粉质型菌落)、B型(紧密型菌落)和C型(疏松型菌落)。其中,C型生长速度较慢,且产孢量较少的;A型生长速率较快,且产孢量较大;而B型菌落生长速度和产孢量介于A型和C型之间(表2,表3)。
2.2 不同菌株的平均生长速度、产孢量和孢子萌发率比较
由表3可见,供试的9个白僵菌菌株的菌落生长速率存在较大差异。Bb2-1、Bb338、Bb346和Bb317 4个菌株生长最快,15 d时菌落直径为49.83~51.67 mm,显著大于其他5个菌株(P<0.05),4个菌株的生长速度之间不存在显著差异。供试的9个白僵菌菌株的产孢量之间也存在较大差异,Bb2-1、Bb338和Bb346 3个菌株的产孢量明显优于其他6个菌株;菌株Bb2-1的产孢量是菌株Bb4-86的3.9倍。此外,供试的9个白僵菌菌株的孢子萌发率都超过90%,且各菌株产孢量之间不存在显著差异。
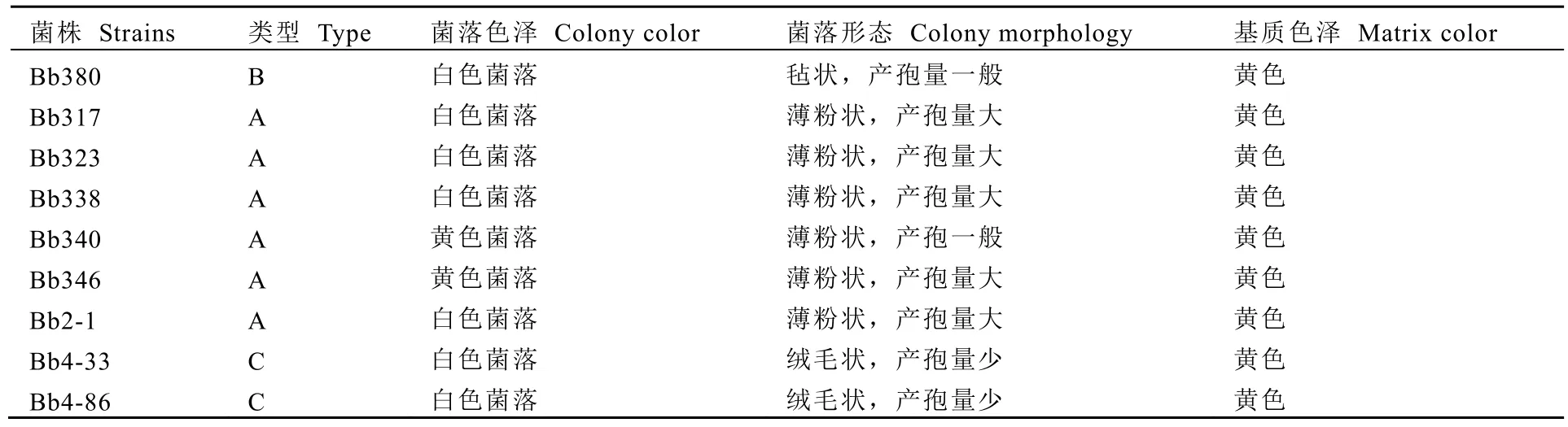
表2 不同菌株在SDAY上的形态特征Table 2 Colony morphological characteristics of the tested strains on SDAY medium

表3 白僵菌不同菌株的生长速率、产孢量及孢子萌发率情况Table 3 Growth, sporulation and conidia germination of the tested strains on SDAY medium
2.3 不同菌株孢子耐热力比较
从图1可以看出,经48℃水浴热激处理后,各菌株之间的孢子萌发抑制率存在显著差异。其中,菌株Bb4-86和Bb2-1孢子萌发抑制率分别为30.09%和34.40%,显著低于其他菌株,显示出最强的耐热力。菌株Bb338和Bb4-33也显示出较强的耐热力。
2.4 不同菌株孢子抗紫外能力比较
从图2可以看出,紫外辐射处理后,不同菌株抗紫外能力分化明显;且紫外处理对各菌株的孢子萌发抑制率都较高,从72.11%~100.00%不等。其中,Bb338的孢子萌发抑制率最小,其次是Bb2-1和Bb346。

图1 不同菌株分生孢子热激处理后孢子萌发抑制率Fig. 1 Inhibition rate of conidia germination ofB. bassianaafter exposure to thermal stress
2.5 生物测定
在生物学指标测定的基础上,我们选取了3个生物学性状优良的菌株Bb338、Bb346和Bb2-1进行生物测定。实验结果表明,3个菌株对茶角胸叶甲成虫的致病力强弱顺序为Bb2-1>Bb338>Bb346。其中菌株Bb2-1杀虫毒力最强,在每毫升1.0×107个孢子的孢悬液处理7 d,该菌对茶角胸叶甲成虫的累计校正死亡率达100%,僵虫率达86.11%,LT50为3.32 d(表4)。
3 讨论
近年来,随着人们对茶叶食品安全问题的日益关注,选择一种绿色安全的害虫防治手段来防治茶树害虫(如茶角胸叶甲)已成为当前亟待解决的问题。虫生真菌具有对环境安全、容易大量培养和可持续控制害虫等优点,在当前农林害虫生物防治中发挥重要的作用。获得对靶标害虫高毒力的虫生真菌菌株是开展害虫生物防治的先决条件。前人对靶标害虫高毒力菌株的筛选常通过直接开展室内生测来完成[23-25]。但该方法需要使用大量靶标昆虫,这对于许多未实现室内规模化人工饲养的昆虫来说,要完成生测试验的难度很大。而从与生防菌株毒力密切相关的生物学性状(如菌落形态、生长速率、产孢量和孢子萌发率等)入手,先初步筛选出生物学性状优良的菌株,再对初筛到的优良菌株开展生物测定,进一步筛选出高毒力菌株的方法正受到越来越多研究者的青睐[26-28]。
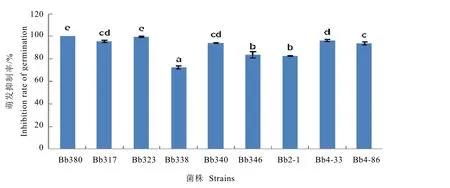
图2 紫外辐射对不同菌株分生孢子的萌发抑制率Fig. 2 Inhibition of conidia germination ofB. bassianaafter exposure to ultraviolet radiation
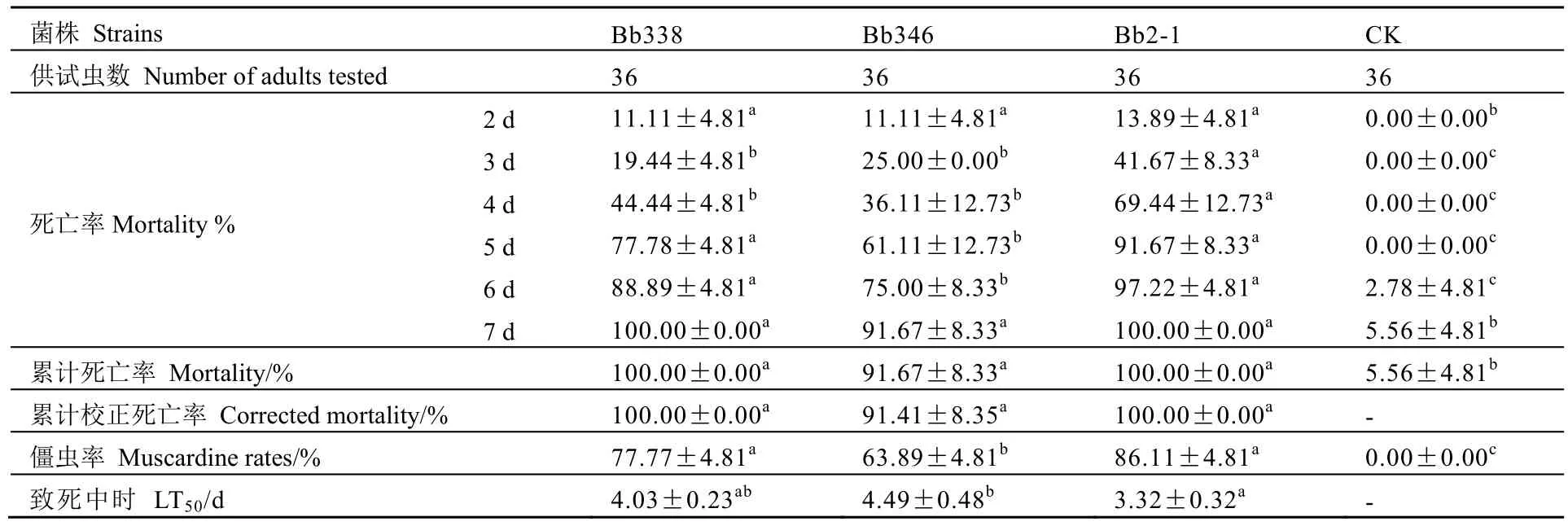
表4 球孢白僵菌菌株对茶角胸叶甲成虫的杀虫毒力Table 3 Pathogenicity of the testedB. bassianastrains against the adults ofB.melanopus
前期的研究发现虫生真菌的菌落形态、菌株生长速率、产孢量和孢子萌发率等生物学性状与菌株的毒力有很大关联性,呈现薄粉状质地的菌落一般具有较强的毒力,而生长速率快、产孢量大的菌株也往往表现出较强的杀虫活性[26-28]。本研究的结果也基本支持了菌株生物学性状与毒力密切相关这一观点,即菌株Bb2-1和Bb338呈粉质型菌落、生长速率快、产孢量高,且对茶角胸叶甲成虫的杀虫活性也很强。
虫生真菌的耐热力和抗紫外能力是衡量其抗逆性能的两个重要指标。高温不仅会严重阻碍白僵菌的孢子萌发[29-30]、菌丝生长[31]和侵染毒力[32-33],而且还会缩短真菌孢子的储藏寿命[34]。茶角胸叶甲一般在5月上旬开始羽化出土,并于5月中旬到6月中旬进入为害盛期,此时田间气温正逐渐上升。因此,筛选出耐热力强的白僵菌菌株,对今后菌剂的生产和田间应用具有重要的意义。本研究中我们通过48℃水浴热激处理(12 min),从9个白僵菌菌株中筛选出Bb4-86和Bb2-1具有最强的耐热力,孢子萌发抑制率分别为30.09%和34.40%,显著低于其他菌株。该结果与李鸿文等[35]研究发现12株球孢白僵菌对48℃热胁迫的LT50平均为12.6 min较一致。除了来自高温的胁迫外,阳光中的紫外线产生的紫外辐射也是限制真菌制剂在田间应用的一大因素。阳光中的紫外线(尤其是短波紫外线)能够穿透孢子壁产生高活性的游离基[36],会抑制白僵菌孢子的萌发或直接杀死孢子[37]。筛选出抗紫外能力强的菌株,将为今后真菌制剂的生产和田间应用提供有力的保障[38]。本研究中我们从9个白僵菌菌株中筛选出Bb338、Bb2-1和Bb346等3个具有较强抗紫外能力的菌株,将为今后抗紫外能力强的真菌制剂的生产及田间应用奠定基础。
本研究先通过测定菌落形态、菌株生长速率、产孢量、孢子萌发率、耐热力和抗紫外能力等生物学性状,初步筛选出Bb338、Bb346和Bb2-1等3个生物学性状优良的白僵菌菌株。在此基础上,对筛选到的3个生物学性状优良的菌株进行过生物测定。最终筛选出菌株Bb2-1不仅生长速率快、产孢量高、耐热力强和抗紫外能力强,而且对茶角胸叶甲成虫具有最强的杀虫毒力和最快的杀虫速率。用每毫升1×107个孢子孢悬液处理后,该菌对茶角胸叶甲成虫的校正死亡率达100%,僵虫率达86.11%,LT50仅为3.32 d,在今后茶角胸叶甲的田间防治中将发挥巨大的生防潜力。
[1] 张汉鹄, 谭济才. 中国茶树害虫及其无公害治理[M]. 合肥: 安徽科学技术出版社, 2004: 241-242.
[2] 羊柏娥, 王沅江. 茶角胸叶甲研究进展[J]. 茶叶通讯, 2008, 35(3): 24-26.
[3] 曾明森, 吴光远. 福建茶树病虫害与天敌图谱[M].北京:中国农业科学技术出版社,2014: 83-85.
[4] 何学友, 蔡守平, 吴智才. 油茶的一种新害虫——黑足角胸叶甲[J]. 中国森林病虫, 2011(3): 16-17.
[5] 汪荣灶. 黑足角胸叶甲发生与危害的初步考查[J]. 福建茶叶,1989(2): 40-41.
[6] 汪荣灶, 胡勇. 江西黑足角胸叶甲成虫的盛发期与防治[J].江西植保, 2004, 27(4): 175.
[7] 谭济才, 刘贵芳, 王德兴, 等. 茶角胸叶甲的发生与防治[J]. 中国茶叶, 1987, 9(1): 15-16.
[8] 林阿祥. 茶角胸叶甲的发生与防治初报[J]. 茶叶科学技术,1991(4): 43-44.
[9] 谭济才, 刘贵芳, 王德兴, 等. 茶角胸叶甲生物学特性及防治研究[J]. 湖南农学院学报, 1986(4): 51-60.
[10] 李先文, 谭济才, 陈建芝, 等. 5%锐劲特悬浮剂防治茶角胸叶甲试验[J]. 现代农业科技, 2007(1): 52.
[11] 李先文, 谭济才, 柏晓勇, 等. 几种药剂对茶角胸叶甲的室内杀虫活性测定及田间药效试验[J]. 现代农药, 2008, 7(3): 44-47.
[12] 蒲蛰龙, 李增智. 昆虫真菌学[M]. 合肥: 安徽科学技术出版社, 1996: 206-360.
[13] Faria MR de, Wraight SP. Mycoinsecticides andMycoacaricides: A comprehensive list with worldwide coverage and international classification of formulation types [J]. Biology Control, 2007, 43: 237-256.
[14] 林乃铨. 害虫生物防治[M]. 北京: 科学出版社, 2010: 239-265.
[15] 李增智, 黄勃, 陈名君, 等. 分子时代的白僵菌研究[J].菌物学报, 2011, 30(6): 823-835.
[16] 何学友, 蔡守平, 童应华, 等. 球孢白僵菌和金龟子绿僵菌不同菌株对黑足角胸叶甲成虫的致病力评价[J]. 昆虫学报, 2011, 54(11): 1281-1287.
[17] 曾明森, 刘丰静, 王定锋, 等. 茶角胸叶甲综合治理试验示范[J].福建农业学报, 2012, 27(8): 847-852.
[18] Poprawski TJ, Marchal M, Robert PH. Comparative susceptibility ofOtiorhynchus sulcatusandSitona lineatus(Coleoptera: Curculionidae) early stage to five entomopathogenic hyphomycetes [J]. Environmental Entomology, 1985, 14: 247-253.
[19] Soares GG, Marchal M, Ferron P. Susceptibility ofOtiorhynchus sulcatus(Coleoptera: Curculionidae) larvae toMetarhizium anisopliaeandMetarhizium flavoviridae(Deuteromycotina: Hyphomycetes) at two different temperatures [J]. Environmental Entomology, 1983, 12: 1886-1890.
[20] 王定锋, 黎健龙, 李慧玲, 等. 茶丽纹象甲白僵菌广东分离株的鉴定及生物学特性研究[J]. 茶叶科学, 2015, 35(5): 449-457.
[21] 雷妍圆, 吕利华, 何余容, 等. 球孢白僵菌生物学特性与其对小菜蛾致病力相关性分析[J]. 中国生物防治, 2010, 26(2): 143-148.
[22] 俞佳, 冯明光. 基于分生孢子热胁迫反应的球孢白僵菌耐热菌株筛选[J]. 菌物学报, 2006, 25(2): 278-283.
[23] 许齐爱, 李佳颖, 任顺祥. 红火蚁高致病力黄绿绿僵菌菌株的筛选[J]. 中国生物防治学报, 2013, 29(3): 384-388.
[24] 王定锋, 黎健龙, 王庆森, 等. 柑橘灰象甲一株高毒力白僵菌菌株的筛选鉴定及培养特性[J]. 中国生物防治学报, 2014, 30(6): 750-758.
[25] 侯明明, 刘义豪, 王滨. 昆虫病原真菌对梨网蝽防治潜力的室内评测[J]. 中国生物防治学报, 2015, 31(6): 853-859.
[26] 刘玉军, 张龙娃, 何亚琼, 等. 栎旋木柄天牛高毒力球孢白僵菌菌株的筛选[J]. 昆虫学报, 2008, 51(2): 143-149.
[27] 张龙娃, 康克, 刘玉军, 等. 美国白蛾高毒力球孢白僵菌菌株筛选[J]. 昆虫学报, 2016, 59(1): 111-118.
[28] Zhang LW, Liu YJ, Yao J, et al. Evaluation ofBeauveria bassiana(Hyphomycetes) isolates as potential agents for control ofDendroctonus valens[J]. Insect Science, 2011, 18: 209-216.
[29] Luz C, Fargues J. Temperature and moisture requirements for conidial germination of an isolate ofBeauveria bassiana, pathogenic toRhodnius prolixus[J]. Mycopathology, 1997, 138: 117-125.
[30] Devi KU, Sridevi V, Challa MM, et al. Effect of high temperature and water stress on in vitro germination and growth in isolates of the entomopathogenic fungusBeauveria bassiana(Bals.) Vuillemin [J]. J Invertebr Pathol, 2005, 88: 181-189.
[31] Fargues J, Goettle MS, Smits N, et al. Effect of temperature on vegetative growth ofBeauveria bassianaisolates from different origins [J]. Mycologia, 1997, 89: 383-392.
[32] 孙鲁娟, 吴孔明, 郭予元, 不同温、湿度下白僵菌对棉铃虫幼虫的致病力[J]. 昆虫学报, 2001, 44(4): 501-506.
[33] 何余容, 邝灼彬, 冯夏, 等. 不同温湿度下球孢白僵菌对小猿叶甲的致病力[J]. 昆虫学报, 2005, 48(5): 679-686
[34] Hong TD, Gunn J, Ellis RH, et al. The effect of storage environment on the longevity of conidia ofBeauveria bassiana[J]. Mycological Research, 2001, 105: 597-602.
[35] 李鸿文, 冯明光. 球孢白僵菌不同菌株分生孢子的耐热能力[J]. 浙江大学学报: 农业与生命科学版, 2008, 34(2): 158-162.
[36] Ignoffo CM, Garcia C. Influence of conidial color on inactivation of several entomogenous fungi (Hyphomycetes) by simulated sunlight [J]. Environ Entomol, 1992, 21:913–917.
[37] Inglis GD, Goettel MS, Johnson DL. Influence of ultraviolet light protectants on persistence of the entomopathogenic fungus,Beauveria bassiana[J]. Biological Control, 1995, 5(4): 581-590.
[38] Fargus J, Goettel MS, Smits N, et al. Variability in susceptibility to simulated sunlight of conidia among isolates of entomopathogenic Hyphomycetes [J]. Mycopathologia, 1996, 135: 171-181.
Screening of the Beauveria bassiana Strain with High Virulence to Basilepta melanopus (Coleoptera: Chrysomeloidea)
WANG Dingfeng1, LI Liangde1, LI Jianlong2, LI Huiling1, ZHANG Hui1, WANG Qingsen1, WU Guangyuan1*
1. Tea Research Institute, Fujian Academy of Agricultural Sciences, Fu′an 355015, China; 2. Drinkable Plants Institute (Tea Research Center), Guangdong Academy of Agricultural Sciences / Guangdong Provincial Key Laboratory of Tea Plant Resources Innovation & Utilization, Guangzhou 510640, China
The beetle (Basilepta melanopus) is one of the most serious leaf-feeding insects in tea garden, which seriously affects both tea yield and quality. In recent years, the beetle often caused serious damage in some tea gardens, especially organic tea gardens. How to effectively control this pest has become a serious problem. In order to screen high virulence strains ofBeauveria bassianatoB. melanopus, 9 strains ofB. bassianaisolated from the coleoptera pests in tea gardens were selected as candidates. In the preliminary screening, the biological characteristics of these 9 strains, including colony morphology, growth rate, sporulation, spore germination rate, thermotolerance and UV radiation resistance were detected. According to the above biological characteristics, threestrains Bb338, Bb346 and Bb2-1 were selected for further bioassay against the adult ofB. melanopus. Bioassay results showed that the strain Bb2-1 was the most virulent strain to the adults ofB. melanopus, which had the highest corrected mortality rates of 100%, highest cadaver rates of 86.11% and shortest LT50of 3.32 d at a concentration of 1.0×107conidia per milliliter. The strain Bb2-1 has the best biological characteristics and the highest virulent against the adults ofB. melanopus, which would play a very important role in biocontrol ofB. melanopus.
Basilepta melanopus,Beauveria bassiana, biological characteristics, virulence, strain screening
S571.1;S435.711
A
1000-369X(2017)03-229-08
2017-02-10
:2017-02-24
福建省自然科学基金项目(2015J01099)、国家茶叶产业技术体系项目(CARS-23)、福建省农业科学院茶叶研究所重点项目(2014-cys-02)
王定锋,男,硕士,助理研究员,主要从事害虫生物防治研究。*通讯作者:gywupt@163.com

