用于测定黑茶中铅的荧光增强化学传感器
龙立平,孟维,王姣亮,谢丹,贺国文,肖谷清
湖南城市学院化学与环境工程学院,湖南 益阳 413049
用于测定黑茶中铅的荧光增强化学传感器
龙立平,孟维,王姣亮,谢丹,贺国文,肖谷清
湖南城市学院化学与环境工程学院,湖南 益阳 413049
铅(Ⅱ)对固定在增塑的聚氯乙烯(PVC)敏感膜中的红霉素A有可逆荧光增强作用,据此研制了测定铅(Ⅱ)的荧光化学传感器。该传感膜的组成为:50.0 mg PVC、100.0 mg邻苯二甲酸二异辛酯和2.94 mg红霉素A。该传感器在pH 8.0的Tris-HCl缓冲溶液中,测定铅(Ⅱ)的动力学范围为4.00~6.00 mmol·L-1,检出限为0.10 μmol·L-1,响应时间小于50 s。该传感器具有良好的重现性、可逆性和选择性,除Cr2O72-和MnO4-外,常见阴离子和阳离子不干扰测定。该传感器应用于黑茶水样中铅(Ⅱ)含量的测定,结果与GB 5009.12—2010法一致。
光化学传感器;荧光增强;铅(Ⅱ);红霉素A
黑茶是中国六大茶类之一,更是西北少数民族不可缺少的日常饮品。由于茶园土壤、水质及汽车尾气等多种原因导致茶叶中含有一定量的铅。饮茶成为人体摄入铅的途径之一。铅是人体非必需的一种累积性极强的有害元素,被列为茶叶卫生检验项目之一。茶叶国家进出口行业标准[1]中铅含量小于2 mg·kg-1。因此,在茶叶生产、销售过程中建立灵敏的铅含量检测方法具有重要意义。国家标准规定食品中铅的测定方法通常采用原子光谱法、高效液相色谱法和二硫腙比色法等[2],但这些方法具有样品用量大、预处理复杂、检测慢、检测价格高、稳定性差及不能在线检测等不足。荧光传感器具有灵敏度高、操作简单和可在线检测等优点[3],本课题组已开发出卟啉类铅离子荧光探针[4],但多是基于荧光熄灭,鲜有荧光增强的报道[5]。红霉素A是一个含14元环内酯的大环内酯类抗生素,目前研究工作大多集中在合成、测定含量及其药理功能方面[6],还未有运用红霉素A作荧光探针的报道。本文将红霉素A制成PVC敏感膜,研究了该敏感膜与铅的反应并制成了测定铅的光化学传感器。该传感器用于黑茶粉末及其浸取液中铅含量的测定,测得铅的回收率为96.4%~108.5%。
1 材料与方法
1.1 实验仪器与试剂
F-4600型荧光光度计(日本日立公司)、FC104电子天平(上海精密仪器有限公司)、PHS-3C精密pH计(江苏江分电分析仪器有限公司)。
红霉素A(标准品,欧洲进口)、高密度聚四氟乙烯(PVC,湖南株洲)、邻苯二甲酸二异辛酯(DIOP)、四氢呋喃(THF)和黑茶(大梅龙泉散茶,湖南城市学院黑茶研发科技有限公司)等。0.5 mol的Tris溶于1 000 mL水中,然后用0.5 mol·L-1HCl或NaOH调节pH制成缓冲溶液。
1.00 ×10-2mol·L-1Pb2+标准储备液:取高纯铅棒,刮去表面氧化层,削成小片状,称取1.0360 g,置于150 mL烧杯中,加入50 mL 6 mol·L-1的HNO3溶解后,移入500 mL容量瓶中,配成1.00×10-2mol·L-1的储备液,于棕色瓶中低温保存,使用时用pH=8.0的Tris/HCl缓冲液稀释配成不同浓度的Pb2+工作液。
实验用水为二次蒸馏水,其余试剂和溶剂均为分析纯且无荧光,使用前未经其他纯化处理,使用时用pH=8.0的Tris/HCl缓冲液稀释配成。实验温度为(20±1)℃。
1.2 敏感膜制备
取50.0 mg PVC、100.0 mg DIOP和2.94 mg(2.0 μmol)的红霉素A溶于2.0 mL新蒸THF中,配成制膜液。将直径为35 mm的洁净石英玻片放在自制的制膜装置上,取0.2 mL制膜液旋转制膜,制得1层厚度约4.0 μm的PVC膜[7],放置1 min后即可使用,所制得的膜不用时置于阴处干燥保存。
1.3 实验方法
将1片附有敏感膜的石英玻片和1块大小相同深色PVC板装入一自制流通测量池中[8],连接蠕动泵,再将测量池以特定位置固定于样品室,选择激发/发射狭缝宽度为5.0 nm/10 nm,最大激发/发射波长为358 nm/409 nm,事先泵入pH=8.0的Tris/HCl缓冲溶液浸泡敏感膜,直至荧光强度稳定不变,再注入样品溶液测定敏感膜荧光强度。完成1次样品测量后,泵入缓冲溶液冲洗敏感膜,直至荧光信号恢复到稳定的最小值后再进行另一样品测定。
1.4 样品制备
黑茶浸取样液1#的制备:准称黑茶样品10.0 g(每个样品平行称取5份)置于烧杯中,加入50 mL新煮的沸水,浸泡5 min后用倾泻法滤出,滤液移至250 mL容量瓶中。再向烧杯中加入50 mL沸水,按上述同样方法重复4次,滤液全移至250 mL容量瓶中,用水定容。
黑茶粉末样液2#的制备:按国标方法[2]进行样品处理。准确称取已粉碎的黑茶样品10.0 g(每个样品平行称取5份)于250 mL凯氏定氮瓶中,加入15 mL硝酸,加热,待作用缓和后冷却,沿瓶壁加入5 mL硫酸,再加热,缓缓加硝酸至有机质完全分解。所得溶液为浅黄色,冷却。加30 mL水煮沸,除去残余硝酸至产生白烟为止。冷却后的溶液移入250 mL容量瓶中。取与消化试样相同量的硝酸和硫酸,按同样方法做空白实验。
2 结果与讨论
2.1 红霉素A对Pb2+识别的竞争性实验
向含红霉素A的敏感膜中分别加入浓度为1.00×10-2mol·L-1的各金属离子的硝酸盐后,测定其在409 nm处的荧光强度,结果如图1。从图中可以看出,加入Pb2+后,敏感膜的荧光强度增强了3倍,而其他金属离子的加入对敏感膜的荧光强度影响不大。同样,加入含K+为1.00×10-2mol·L-1的NO3-、AC-盐后,敏感膜的荧光强度无明显变化,由此说明红霉素A敏感膜可作为潜在的Pb2+传感器。
2.2 敏感膜对Pb2+的荧光响应与测量原理
红霉素A为大环内酯类抗生素,结构中富含电子,具有弱的荧光,可以提供电子与Pb2+形成络合物。图2为敏感膜与不同浓度的Pb2+接触后的荧光发射光谱。从图中可以看出,随着Pb2+浓度增加,敏感膜中红霉素A的荧光强度增大,且峰形和峰位均无变化。由此可见,Pb2+与红霉素A间的结合是非共价键结合[9]。
将红霉素A固定于增塑的PVC膜中,Pb2+能分别从水相进入膜相,并与膜相中的红霉素A生成配合物,按照与文献[10]相似的方法,则下式成立:
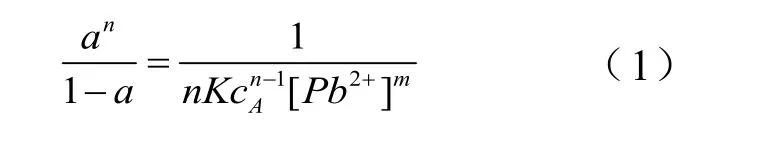
α为膜相中游离的红霉素A浓度与其总浓度之比,同时α亦可用检测到的荧光信号的荧光强度表示:

式(1)中cA、[Pb2+] 分别为红霉素A在膜中的总浓度及Pb2+在水相中的总浓度,m、n为Pb2+与膜相中红霉素A的络合比,当m、n一定时,溶液中待测[Pb2+]与α有确定的函数关系;式(2)中F0、Fs分别为敏感膜中红霉素A全部以游离态存在和以配合物形式存在时的荧光强度。式(1)、(2)可作为本文研制荧光光化学传感器测量Pb2+的定量依据。

图2 PVC敏感膜与不同浓度的Pb2+溶液接触后的荧光发射光谱(λex=358 nm)Fig. 2 Fluorescence emission spectra of sensitive PVC membrane contacted with different concentration of Pb2+(λex=358 nm)
根据式(1)拟合实验数据,得到红霉素A与不同浓度的Pb2+接触的荧光响应值α与的关系如图3所示。由图可知,当配合比为m∶n=2∶1时,实验点能很好地与理论曲线拟合,所得平衡常数K=7.0×108,这也进一步从实验证明Pb2+与红霉素A之间的组成比为2∶1,此曲线(a)可作为测定Pb2+浓度的校准曲线。
2.3 实验条件优化
2.3.1 敏感膜组成的选择
敏感膜中红霉素A的浓度影响敏感膜对Pb2+的荧光响应。图4为红霉素A不同浓度的敏感膜对测定Pb2+的荧光响应情况。设F0为敏感膜与空白缓冲溶液接触时的荧光强度,F为不同浓度的红霉素A敏感膜作用于10.00 μmol·L-1的Pb2+溶液时的荧光强度。从图中可知,当敏感膜中红霉素A浓度增加时,F/F0随之增加。但当红霉素A浓度高于2.0 μmol·L-1时,其F/F0反而降低。故本实验中红霉素A最佳浓度选择为2.0 μmol·L-1,即1.92%。
2.3.2 pH的影响
因为红霉素在酸性和碱性条件下都容易发生降解[11]。红霉素A在膜相溶液中存在游离分子态和离子态的解离平衡。当pH<7时,主要以离子态形式存在,随着pH值升高,膜相溶液中主要以游离分子态形式存在。图5表示pH对相对荧光强度的影响。从图中可知,在pH 6.8~8.9范围内,相对荧光强度F/F0稳定且较大,故可选用pH=8.0为最佳pH条件。
2.3.3 敏感膜响应特性

图3 实验数据点拟合图Fig. 3 Plots of lgc vsa fitted Eq. (1) exp. data line

图4 红霉素A用量的影响Fig. 4 The dosage effects of erythromycin A on fluorescence intensity

图5 pH对配合物相对荧光强度的影响Fig. 5 Effects of pH on fluorescence intensity on complex
图6为最佳敏感膜分别交替测定空白缓冲溶液、20.00 μmol·L-1Pb2+溶液和30.00 μmol·L-1Pb2+溶液的荧光强度对时间的变化关系图。从图中可以看出,当Pb2+浓度为20.00 μmol·L-1时,荧光强度平均为1208.2±8.96(n=5);当Pb2+浓度为30.00 μmol·L-1时,为1876.9±7.39(n=5);pH=8.0的Tris/HCl空白缓冲溶液的荧光强度平均为815.6±3.95(n=6),表明该传感器具有良好的重现性和可逆性。由图中还可以看出,浓度由高到低或从低到高响应时间t95(即荧光强度信号变化95%所需的时间)均小于50 s。
用最佳敏感膜测定浓度为20.00 μmol·L-1的Pb2+溶液,每30 min测定1次荧光强度,共进行10 h,所测得平均荧光强度为1207.2±10.57(n=21)。该敏感膜不用时干放保存,15 d后测上述同一溶液,测得平均荧光强度为1201.3±11.22(n=21)。由此表明,该敏感膜在一定时间内测试Pb2+溶液具有较好的稳定性。

图6 PVC敏感膜交替测定不同浓度Pb2+溶液的荧光强度对时间的响应Fig. 6 The time course response of fluorescence intensity of PVC membrane to different concentration of Pb2+solutions
2.3.4 标准曲线、灵敏度和选择性
图3内插图即为传感器定量测定Pb2+的标准曲线,其线性方程为:
α=-2.584lgc-0.694,r=0.9956
其中c为Pb2+的浓度,r为相关系数。根据0.05≤(1−α)≤0.95[12],其测定Pb2+的动力学范围为4.00~6.00 mmol·L-1,根据3S0/K(S0为空白测定值的标准偏差,K为标准曲线的斜率),检出限为0.10 μmol·L-1。
按1.3实验方法测定10.00 μmol·L-1Pb2+中不加或加单个常见的共存离子实验,并以荧光强度变化的相对误差±5%来评价对Pb2+测定的影响。可允许的共存物质倍率为:Na+、K+、NH4+,1 000倍;Cd2+、Co2+、Cu2+、Mg2+、 Ba2+,500倍;Ni2+、Fe2+,100倍;Cr3+,10倍;Al3+,1.0倍;Fe3+、Mn7+、Cr6+,0.01倍。但在茶叶等食品中Mn7+和Cr6+浓度极小。如当有大量Fe3+干扰时,可加入柠檬酸掩蔽Fe3+再进行样品测定。
3 样品分析及回收率测定
按1.3实验方法取上述1.4样品制备的样品,用pH=8.0的Tris/HCl缓冲液稀释配成后分别测定其荧光强度并进行加标实验,按标准曲线进行定量,结果见表1。由表中可知,该方法与GB 5009.12—2010(AAS法)测定的结果无显著差异,测得Pb2+的回收率为96.4%~108.5%。

表1 样品测定结果(n=5)Table 1 Determination results of the samples (n=5)
4 结论
红霉素A是一类抗生素,在医用临床领域应用广泛,本研究用红霉素A的微弱荧光作为荧光探针,在分析检测中扩展了它的应用。本研究发现红霉素A在PVC膜相中与Pb2+反应,通过非共价键合作用生成2∶1的络合物,该络合物能显著增强其荧光。据此,用以检测溶液中Pb2+的含量,具有较高的灵敏度和良好的选择性,同时,所制光传感器还可以实现在线检测。黑茶因其原料与其他茶类相比较粗老,故其铅含量是产品生产检测中的一个重要指标。本方法样品处理简单,为茶叶企业在茶叶加工生产中铅的监控提供了在线监测的可能。
[1] 国家认证认可监督管理委员会. SN/T 2056—2008 进出口茶叶中铅、砷、镉、铜、铁含量的测定 电感耦合等离子体原子发射光谱法[S]. 2008.
[2] 中华人民共和国卫生部. GB 5009. 12—2010 食品安全国家标准 食品中铅含量的测定[S]. 2010.
[3] 杜保安, 刘澄, 曹雨虹, 等. CdTe量子点作荧光探针检测微量铅的方法研究[J]. 光谱学与光谱分析, 2013, 32(5): 1266-1269.
[4] 龙立平, 聂伟安, 钟桐生, 等. 基于卟啉衍生物荧光熄灭的Pb2+光化学传感器[J]. 应用化学, 2007, 24(7): 806-810.
[5] 赵永席, 齐林, 杨卫军, 等. 基于核酸切割酶与脱氧核酶的荧光循环放大系统检测铅(Ⅱ)[J]. 分析化学, 2012, 40(8): 1236-1240.
[6] 崔凤, 霍瑞娜, 张贵生, 等. 抗癌药物4'-O-(α-L-夹竹桃糖基)柔红霉素与小牛胸腺DNA的相互作用的荧光光谱[J].应用化学, 2012, 29(12): 238-244.
[7] 曾恚恚, 王柯敏, 俞汝勤, 等. 苦味酸荧光光化学传感器在药物分析中的应用[J]. 应用化学, 1994, 11(2): 48-52.
[8] 曾恚恚, 王柯敏, 秦臻, 等. 基于荧光熄灭的二氧化硫选择性光化学敏感膜的研究[J]. 高等学校化学学报, 1993, 14(2): 180-183.
[9] 段云青, 闵顺耕. 溴鼠灵与DNA作用机制的光谱研究[J].光谱学与光谱分析, 2009, 29(4): 999-1003.
[10] YANG Ronghua, WANG Kemin, LONG Liping, et al. A selective optode membrane for histidine based on fluorescence enhancement of meso-meso-linked porphyrin dimer [J]. Anal Chem, 2002, 74(5): 1088-1096.
[11] 金鑫, 朱家文, 陈葵, 等. 缓冲盐溶液反萃分离红霉素A、C的研究[J]. 化学工程, 2013, 41(2): 29-32.
[12] CHOI Martin M F, WU Xiaojun, LI Yourong. Optode membrane for determination of nicotine via generation of its bromoethane derivative [J]. Anal Chem, 1999, 71(7): 1342-1349.
A Sensing PVC Membrane Based on Fluorescence Enhancement of Erythromycin A for Lead (Ⅱ) Detection in FU Tea
LONG Liping, MENG Wei, WANG Jiaoliang, XIE Dan, HE Guowen, XIAO Guqing
College of Chemistry & Environmental Engineering, Hunan City University, Yiyang 413049, China
An optical chemical sensing membrane based on reversible fluorescence enhancement of Erythromycin A immobilized in a plasticized poly (vinyl chloride) (PVC) membrane for Lead (Ⅱ) detection was developed. The membrane of the sensor consists of 50 mg of PVC, 100 mg of Di (2-ethylhexyl) phthalate and 2.94 mg of Erythromycin A. The maximum response of the sensing membrane to Lead (Ⅱ) was obtained in Tris/HCl buffer solution ( pH 8.0). Under optimal conditions, the proposed sensor responded linearly to Lead (Ⅱ) in the range of 4.00-6.00 mmol/L and had a detection limit of 0.10 μmol·L-1. The response time of the sensor was less than 50 s. In addition to the high reproducibility and reversibility of the fluorescence signal, the sensor also exhibited good selectivity. Except for Cr2O72-and MnO4-, it was not interfered by other common metal ions and anions. It was applied for the determination of Lead(Ⅱ) in a sample of FU Tea, which offered a satisfactory result.
optical chemical sensor, fluorescence enhancement, lead(Ⅱ), erythromycin A
TS272.5+4;P618.42
A
1000-369X(2017)03-273-07
2017-01-09
:2017-03-21
国家自然科学基金资助项目(21545003、21502048),湖南省自然科学基金资助项目(2015JJ2023、13JJ3117),湖南省高校科技创新团队支持计划资助项目(湘教通〔2014〕207号),湖南省黑茶金花重点实验室资助项目(湘科规财〔2016〕8号)
龙立平,男,教授,主要从事光化学传感器的研制与应用研究,E-mail:llping401@163.com

