老年患者消化道内镜围术期抗栓药物管理的回顾性研究*
王 浩, 陶 涛, 王海军, 赵晓宁, 郭豫涛, 王玉堂
(中国人民解放军总医院南楼心血管内科, 北京 100853)
老年患者消化道内镜围术期抗栓药物管理的回顾性研究*
王 浩, 陶 涛, 王海军, 赵晓宁, 郭豫涛, 王玉堂△
(中国人民解放军总医院南楼心血管内科, 北京 100853)
目的:研究住院接受消化道内镜术的老年患者围术期抗栓药物管理方案及不良事件,为老年患者消化道内镜围术期抗栓药物使用、管理提供临床指导与借鉴。方法:回顾性研究2008年1月1日-2014年12月31日在中国人民解放军总医院住院接受择期消化道内镜检查/操作的患者,共计3 747例患者入选,其中男性3 601例(96.1%),年龄(46~99)岁,大于等于60岁患者共3 458例(92.3%)。记录患者一般临床情况、心血管疾病及危险因素、用药、围术期抗栓药物调整方案和不良事件发生情况等临床资料。统计术前停用不同抗栓药物的时间以及术后恢复抗栓药物的不同时间患者之间在消化道内镜围术期内发生血栓栓塞及出血事件的差异。结果:本研究人群中,消化道内镜围术期总体血栓栓塞事件发生率和出血事件发生率分别为2.24%和1.89%,其中消化道内镜术前0~7 d停用抗栓药物发生血栓栓塞1.87%、出血2.38%,内镜术后2~7 d恢复抗栓药物发生血栓栓塞2.07%、出血0.63%。在停用抗栓药物期间,未应用低分子肝素抗凝桥接治疗和应用低分子肝素抗凝药物桥接治疗患者的血栓栓塞事件的发生率之间无统计学差异,出血事件的发生率高于未应用抗凝药物桥接治疗的患者,两者之间无统计学差异。结论:老年患者中,在消化道内镜术前停用抗栓药物<7 d,在术后2~7 d以内恢复抗栓药物,可同时减少围术期血栓栓塞事件和出血事件发生的风险,是合理的抗栓药物管理策略。
消化道内镜围术期;抗栓药物;血栓栓塞;出血;老年
随着人口老龄化,缺血性心脑血管疾病患病率不断上升,已逐步成为威胁老年人健康的第一杀手[1,2],在年龄大于65岁的老年人群中,近1/3的人群正在服用抗栓药物[3,4]。随着年龄的增加,消化道肿瘤的发病率也显著上升。从40岁开始,胃肠道恶性肿瘤的发病率开始上升,年龄每增加10岁,发病率增加1倍左右[5]。随着消化道内镜广泛应用于消化道疾病的筛查,越来越多正在服用抗栓药物的老年心脑血管疾病患者接受消化道镜操作[6]。虽然抗栓药物能减少患者的血栓栓塞事件,却会增加患者消化道出血的风险[7]。而在消化道内镜操作围术期中断抗栓药物治疗却有可能增加心脑血管血栓栓塞事件发生的风险[8,9]。胃肠镜围术期抗栓药物的管理问题不仅困扰着消化道内镜医师,也逐步成为困扰心血管医师的难题。
目前全球共发布/更新了四项主要的消化道内镜围术期抗栓药物管理指南,旨在指导医师对正在服用抗栓药物的患者接受消化道内镜操作时如何进行抗栓药物管理。但是四项指南在相关推荐意见方面均有差异,并且四项国际指南都未对老年人群在消化道内镜围术期的抗栓药物管理提出专门的推荐意见。本研究针对老年患者消化道内镜围术期抗栓药物管理现状以及消化道内镜围术期出血及血栓事件发生率和相关危险因素进行研究调查,对指导老年患者消化道内镜围术期抗栓药物管理具有重要的临床实际意义。
1 研究方法
1.1 研究人群
本研究是一项回顾性研究。在中国人民解放军总医院病案管理科检索2008年1月1日至2014年12月31日在中国人民解放军总医院住院接受择期消化道内镜检查/操作的患者的临床资料。排除标准:患者住院天数<7 d的患者,入院行急诊消化道内镜的患者。共计3 747例患者入选。
1.2 患者信息采集
一般情况:采用中国人民解放军总医院电子病历系统阅读患者病历,记录患者入院时间、出院时间、接受消化道内镜操作时间,收集患者相关临床资料:性别、年龄、出生日期、身高、体重、计算体重指数(body mass index,BMI)、BMI=体重(kg)/身高(m2)、当前是否戒烟以及行消化道内镜操作当天晨起的血压值。记录患者消化道内镜围术期抗栓治疗调整方案:消化道内镜术前是否应用抗栓药物及种类、消化道内镜术前停用抗栓药物时间:没有停用抗栓药物、停用抗栓药物0~7 d、停用抗栓药物 ≥7 d。术后恢复抗栓药物种类及时间:没有恢复抗栓药物、<2 d恢复抗栓药物、2~7 d内恢复抗栓药物、大于7 d后恢复抗栓药物。在停用抗栓药物期间是否应用抗凝药物桥接治疗。记录消化道内镜围术期不良事件,消化道内镜围术期定义为术前7 d至术后30 d[10]。不良事件包括血栓栓塞事件和出血事件。血栓栓塞事件:急性冠脉综合征(acute coronary syndrome, ACS)(包括不稳定性心绞痛(Ustable angina,UA),非ST段抬高性心肌梗死(non-ST elevated myocardial infarction,NSTEMI)和ST段抬高性心肌梗死(ST elevated myocardial infarction,STEMI)、缺血性脑卒中(包括短暂性脑缺血发作(Transient ischemic attack,TIA)、脑血栓形成、脑栓塞和腔隙性脑梗塞)、其他系统血栓栓塞事件(肺栓塞、下肢深静脉血栓、其他系统血栓)。出血性事件:出血性卒中、大出血、小出血时间,死亡原因及时间。
1.3 统计学处理
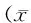
2 结果
2.1 3 747例患者一般临床情况及围术期抗栓药物调整情况
本研究共回顾性纳入3 747例患者,其中男性3 601例(96.1%),平均年龄(76.03±10.3)岁,其中大于等于60岁患者共3 458例(92.3%)。
3 473例患者入院时接受抗栓药物治疗的患者共有2031例(54.2%),其中943例(25.2%)患者服用阿司匹林,862例(23.0%)患者服用和氯吡格雷,203例(5.4%)患者服用双联抗血小板药物(阿司匹林+氯吡格雷),入院时服用华法林的患者23例(0.6%)。其中,消化道内镜术前未停用抗栓药物的患者为20例(0.98%),停用抗栓药物0~7 d的患者为1 654例(81.44%),停用抗栓药物≥7 d的患者为357例(17.58%)。围术期停用抗栓药物后应用低分子肝素抗凝桥接治疗的患者为389例。
消化道内镜术后,未恢复抗栓药物的患者为110例,恢复抗栓药物的患者为1 986例。<2 d恢复抗栓药物的患者为413例(21.30%),2~7 d恢复抗栓药物的患者1 113例(56.04%),>7 d恢复抗栓药物的患者460例(23.16%)。其中, 877例(44.2%,877/1 986)应用阿司匹林,886例(44.6%,886/1986)患者应用氯吡格雷,196例(9.9%,196/1 986)患者应用双联抗血小板药物(阿司匹林+氯吡格雷),27例(1.4%,27/1986)患者应用华法林。
2.2 消化道内镜围术期不良事件
消化道内镜检查术前7 d至术后30 d内,共发生ACS事件63例,消化道内镜术前ACS事件6例,术后57例,其中UA58例,NSTEMI4例,STEMI1例;发生缺血性脑卒中事件16例,其中TIA14例,脑梗塞2例。其他系统血栓栓塞事件5例,其中下肢深静脉血栓2例,上肢静脉血栓2例,颈内静脉血栓1例;出血事件:大出血11例,其中消化道大出血10例,肺出血1例(尸解证实);小出血60例,其中大便潜血阳性47例,胃液潜血阳性9例,呼吸道咯血1例,眼结膜出血1例,皮下出血1例,血尿1例。本研究人群中,在术前1周至术后30 d,共4名患者死亡,死亡原因分别为胰腺癌、胃癌、肺癌和重症肺炎,死亡原因均与胃肠镜操作和围消化道内镜检查期抗栓药物调整无直接原因,为全因死亡。
将ACS、缺血性脑卒中、其他系统血栓栓塞事件合并为血栓栓塞事件,将小出血和大出血合并为出血事件。在消化道内镜围术期内,总体血栓栓塞事件发生率为2.24%,其中ACS事件发生率1.59%,缺血性脑卒中发生率0.43%,其他系统血栓发生率0.13%;总体出血事件发生率为1.89%,其中大出血发生率0.29%,小出血发生率1.6%。
围消化道内镜期不良事件发生的中位时间,可见发生ACS的中位时间为7(3,12)天,发生缺血性脑卒中的中位时间为8(-1,15)天,发生其他系统血栓的中位时间为13(12,13)天,发生大出血的中位时间为7(3,16)天,发生小出血的中位时间为4(1,13)天,全因死亡事件的中位时间为22(13,27)天。
2.3 消化道内镜围术期抗栓药物调整方案与不良事件
对于消化道内镜围术期血栓栓塞事件,在内镜检查术前停用抗栓药物是危险因素(P<0.01),而对于消化道内镜围术期的出血事件,术后恢复抗栓药物则是危险因素(表1)
Tab. 1 Antithrombotic agents and peri-endoscopic adverse events
OR: Odds ratio; CI: Confidence interval; Thromboembolism: ACS+ischemic stroke+other system thromboembolism; Bleeding: Minor bleeding+major bleeding; LMWH: Low-molecular-weight heparin
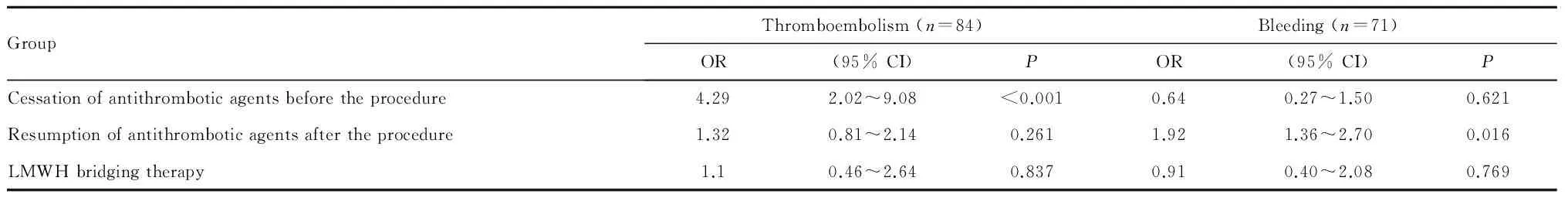
对于消化道内镜围术期血栓栓塞事件,术前未停用抗栓药物、术前停用抗栓药物0~7 d和术前停用抗栓药物≥7 d患者中血栓栓塞事件的发生率分别为0.00%、1.87%和8.12%,三组之间差异具有统计学意义(P<0.01),分别比较各组,术前未停用抗栓药物与术前停用抗栓药物0-7 d的血栓栓塞事件之间无统计学差异,而术前未停用抗栓药物、术前停用抗栓药物0-7 d分别与术前停用抗栓药物≥7 d相比均有统计学差异(P<0.01)。在消化道内镜术后,术后<2 d恢复抗栓药物、术后2-7 d恢复抗栓药物、术后恢复抗栓药物>7 d和术后未恢复抗栓药物患者的血栓栓塞事件的发生率分别为0.73%、2.07%、7.56%和7.27%,四组之间差异具有统计学差异(P<0.01)。而在停用抗栓药物期间未应用抗凝药物桥接和应用抗凝药物桥接患者的血栓栓塞事件的发生率之间无统计学差异(表2)。
对于消化道内镜围术期出血事件,术前未停用抗栓药物、术前停用抗栓药物0~7 d和术前停用抗栓药物≥7d患者中出血事件的发生率分别为0.00%、2.38%和1.68%,三组之间差异无统计学意义,在消化道内镜术后,术后<2 d恢复抗栓药物、术后2~7 d恢复抗栓药物、术后>7d恢复抗栓药物和术后未恢复抗栓药物患者的出血事件的发生率分别为3.15%、0.63%、3.91%和6.36%,四组之间差异具有统计学意义(P<0.01),术后2~7d恢复抗栓药物患者的出血事件发生率最低。而在停用抗栓药物期间未应用抗凝药物桥接和应用抗凝药物桥接患者的出血事件的发生率之间无统计学差异(表2)。
3 讨论
目前欧美的2008年英国胃肠病学学会指南[11]、2009年美国胃肠道内镜学会指南[12]、2011年欧洲胃肠内镜学会指南[13]等3项指南与2014年日本胃肠内镜学会指南[14]将内镜操作相关的出血风险和停用抗栓药物后发生血栓栓塞事件的风险均分为了低危和高危两种。针对不同的操作出血的风险和血栓,四项指南对围术期抗栓药物的调整做出了相关推荐。对于消化道内镜检查围术期出血低危的操作:四项指南均推荐无须停用阿司匹林。BSG、ASGE和JGES推荐无须停用噻吩并吡啶类药物。针对围内镜检查术期出血高危的操作,血栓栓塞低危的情况,四项指南均认可即使在出血高危的情况下,也可以选择不停用阿司匹林,不过ESGE和JGES指南补充说明,面临同时具有出血高危和血栓栓塞低危这一情况的患者,可以选择在内镜操作前停用3~5 d阿司匹林;而ASGE指南[13]推荐对于高出血风险的操作,建议可选择在术前停用阿司匹林5~7 d。四项指南均推荐在内镜操作前停用 5~7 d噻吩并吡啶类药物。可见欧美及日本这四项最新指南推荐意见之间的冲突和模糊地带给临床医师的临床决策造成的困扰,没有统一的推荐意见,让临床医师在面对四项指南的推荐意见常常出现无所适从。
Tab. 2 Management of antithrombotic agents and peri-endoscopic adverse events(%)
Thromboembolism: ACS+ischemic stroke+other system thromboembolism; Bleeding: Minor bleeding+major bleeding; LMWH:Low-molecular-weight heparin
本研究人群主要为围消化道内镜术期接受抗血小板药物治疗的同时合并多种心血管疾病的老年男性。本研究人群中消化道内镜围术期缺血性脑卒中发生率为0.43%,其他系统血栓发生率0.13%,发生率与其他研究结果相类似,发生率均较低。但本研究中ACS事件的发生率较高,为1.59%,考虑与本研究人群中应用抗栓药物中绝大部分为应用抗血小板药物的冠心病患者有关。其他非心脏手术围术期血栓研究显示,患者在置入药物洗脱支架后第1个月停用氯吡格雷者,在随后的11个月内死亡风险可增加9倍。 即使是在PCI手术1 年以后停用阿司匹林仍然存在支架内血栓形成的风险。围术期停用抗血小板药物患者的心血管死亡率比未停用患者高5~10 倍[15]。既往关于非心脏手术围术期血栓栓塞事件的研究显示,停用抗血小板药物后增加围术期死亡及血栓栓塞的风险[16, 17]。而Basel等[18]发现,在177名接受肠镜检查的卒中或TIA患者中,72%的患者服用阿司匹林,23%的患者服用氯吡格雷,12%的患者服用华法林,在肠镜术后四周内,围术期停用抗栓药物和未停用抗栓药物患者的卒中发生率分别为2.4% 和 0%,两组患者中均无心肌梗死发生,静脉血栓的发生率为0% 和 0.7%。在本研究中发现消化道内镜术前停用抗血小板药物<7d的选择是合理的。
消化道内镜术后相关的出血是消化道内镜围术期常见的并发症。70年代一项研究发现,在7 393例接受肠镜下息肉切除术的患者中,术后出血的发生率为1%[19]。之后有数项大型的前瞻性研究探讨了消化道内镜下息肉切除相关的出血风险。其中1987年~1991年美国的一项针对4 751例接受肠镜下息肉切除患者的调查发现息肉切除术后大出血风险为0.42%,大出血发生的中位时间为术后第11天[20];1994年~1997年美国的一项针对1 672例接受肠镜下息肉切除患者的调查发现息肉切除术后大出血风险为0.36%[21];1998~1999年德国的一项针对14 249名患者进行消化道内镜下息肉切除术后(包括上消化道息肉)出血风险的调查,发现大出血风险为0.11%,大出血发生的中位时间为术后第9天[22]。本研究中,消化道内镜围术期总体出血事件发生率为1.89%,其中大出血发生率0.29%,小出血发生率1.6%,大出血发生率(0.29%)与其余研究的大出血发生率相当,本研究中消化道内镜术后大出血发生中位时间为7(3,16),也与国际同类研究相当。
目前国际现行的四项指南[9-12]对于在消化道内镜术后何时恢复抗栓药物仍存在很大的争议,指南的推荐意见尚不明确,尤其是在对于抗血小板药物上,何时恢复为最佳时间仍存在很多分歧。有研究认为在围术期停用阿司匹林3~5 d可以减少围术期早期出血的风险,但是仍存在导致血栓栓塞事件增加的风险[23]。而目前临床操作现状是,东方的内镜医师选择在消化道内镜息肉切除术后停用阿司匹林1~3 d,以避免息肉切除术后出血;而西方的内镜医师则选择在操作当天就恢复阿司匹林[24]。而对于氯吡格雷,目前多数内镜医师推荐在7 d以内恢复,但是另一部分医师却认为氯吡格雷起效慢,可以在内镜操作后第2天便恢复氯吡格雷[25]。至于如果患者同时服用双联抗血小板药物,何时恢复抗栓药物合适,目前四项指南并未提及,相关研究也鲜见报道。
而对于消化道内镜术后何时恢复抗栓药物,在本研究中,术后2 d以内、术后2~7 d、术后7 d以上和术后未恢复抗栓药物这4组患者的血栓栓塞事件呈逐步上升趋势;但是在术后2 d以内、术后2~7 d、术后7 d以上和术后未恢复抗栓药物这4组患者的出血事件则呈现一种V型曲线,术后2~7 d内恢复抗栓药物患者的出血事件发生率最低,处于V型曲线的最低点,而术后7 d以上恢复抗栓药物和术后未恢复抗栓药物患者的出血事件缺位于V型曲线的右侧上升支。分析原因,这与我们这个研究是一项回顾性的研究有关。本研究中,是因为出现了出血事件这个原因,进而导致临床医师推迟了抗栓药物的恢复时间或未恢复抗栓药物。所以,并不是因为推迟恢复抗栓药物时间而导致的出血事件的增加。
结合不同的恢复抗栓药物时间与消化道内镜围术期血栓栓塞事件以及出血事件的发生率,我们认为,对于具有多种心血管疾病的老年共病患者,在消化道内镜术前停用抗栓药物<7 d,在术后2~7 d以内恢复抗栓药物,可同时兼顾血栓栓塞事件和出血事件发生的风险,是一种合理的抗栓药物调整策略。
而对于在消化道内镜围术期停用抗栓药物期间是否需要应用抗凝药物桥接治疗,BSG[11]、ASGE[12]和JGES[14]三项指南仅对应用华法林的患者推荐了抗凝桥接治疗,而对于抗血小板药物的患者,均未提及需要在停用期间应用低分子肝素等药物进行抗凝桥接。本研究人群绝大部分(98.9%)为应用抗血小板药物的患者,消化道内镜围术期是否接受低分子肝素抗凝桥接治疗,两者的血栓栓塞事件发生率之间无统计学差异。所以对于本研究人群,在消化道内镜围术期,停用抗血小板药物后应用低分子肝素对于预防围术期血栓栓塞事件并无作用,反倒在出血事件上,虽然在未应用抗凝药物桥接和应用抗凝药物桥接患者之间无统计学差异,但是应用抗凝药物桥接治疗患者的出血事件发生率均高于未应用抗凝药物桥接治疗的患者。
[1] Ford ES. Trends in predicted 10-year risk of coronary heart disease and cardiovascular disease among U.S. adults from 1999 to 2010[J].JAmCollCardiol, 2013, 61(22): 2249-2252.
[2] 陈伟伟, 高润霖, 刘力生, 等. 中国心血管病报告2013概要[J]. 中国循环杂志, 2014, 29(7): 487-491.
[3] Baigent C, Blackwell L, Collins R,etal. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysisof individual participant data from randomised trials[J].Lancet, 2009, 373 (9678): 1849-1860.
[4] Yusuf S, Zhao F, Mehta SR,etal. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation[J].NEnglJMed, 2001, 345(7): 494-502.
[5] Garcia Rodriguez LA, Lin KJ, Hernandez-Diaz S,etal. Risk of upper gastrointestinal bleeding with low-dose acetylsalicylic acid alone and in combination with clopidogrel and other medications[J].Circulation, 2011, 123(10): 1108-1115.
[6] Hallas J, Dall M, Andries A,etal. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study[J].BMJ, 2006, 333(7571): 726.
[7] Metzler H, Kozek-Langenecker S, Huber K. Antiplatelet therapy and coronary stents in perioperative medicine-the two sides of the coin[J].BestPractResClinAnaesthesiol, 2008, 22(1): 81-94.
[8] Oh HG. Management of Antithrombotic Therapy for Gastroenterological Endoscopy from a Cardio-Cerebrovascular Physician's Point of View[J].ClinEndos, 2014, 47(4): 320-323.
[9] 崔 华, 范 利, 张 梦, 等. 住院老年高血压患者死亡相关因素的分析[J]. 中国应用生理学杂志, 2014, 30(1): 64-68.
[10]Witt DM, Delate T, McCool KH,etal. Incidence and predictors of bleeding or thrombosis after polypectomy in patients receiving and not receiving anticoagulation therapy[J].JThrombHaemost, 2009, 7(12): 1982-1989.
[11]Veitch AM, Baglin TP, Gershlick AH,etal. British Society of Gastroenterology; British Committee for Standards in Haematology; British Cardiovascular Intervention Society. Guidelines for the management of anticoagulant and antiplatelet therapy in patients undergoing endoscopic procedures[J].Gut, 2008, 57(9): 1322-1329.
[12]ASGE Standards of Practice Committee, Anderson MA, Ben-Menachem T,etal. Management of antithrombotic agents for endoscopic procedures[J].GastrointestEndosc, 2009, 70(6): 1060-1070.
[13]Boustière C, Veitch A, Vanbiervliet G,etal. European Society of Gastrointestinal Endoscopy. Endoscopy and antiplatelet agents. European Society of Gastrointestinal Endoscopy (ESGE) Guideline[J].Endoscopy, 2011, 43(5): 445-461.
[14]Fujimoto K, Fujishiro M, Kato M,etal. Japan Gastroenterological Endoscopy Society. Guidelines for gastroenterological endoscopy in patients undergoing antithrombotic treatment [J].DigEndosc, 2014, 26(1): 1-14.
[15]Chassot PG, Delabays A, Spahn DR. Perioperative antiplatelet therapy : the case for continuing therapy in patients at risk of myocardial infarction[J].BrJAnaesth, 2007, 99 (3): 316-328.
[16]Chassot PG, Delabays A, Spahn DR. Perioperative antiplatelet therapy: the case for continuing therapy in patients at risk of myocardial infarction[J].BrJAnaesth, 2007, 99(3): 316-328.
[17]赵晓宁, 王玉堂. 老年患者PICC导管相关性上肢深静脉血栓治疗的影响因素[J]. 中国应用生理学杂志, 2016, (32)2: 124-127.
[18]Assaad B, Sesi VK, Figari R,etal. Antithrombotic management of stroke patients before colonoscopy. Journal of stroke and cerebrovascular diseases[J].JStrokeCerebrovascDis, 2013, 22(6): 733-736.
[19]Smith LE. Fiberoptic colonoscopy: complications of colonoscopy and polypectomy[J].DisColonRectum, 1976, 19(5): 407-412.
[20]Rosen L, Bub DS, Reed JF 3rd,etal. Hemorrhage following colonoscopic polypectomy[J].DisColonRectum, 1993, 36(12): 1126-1131.
[21]Nelson DB, McQuaid KR, Bond JH,etal. Procedural success and complications of large-scale screening colonoscopy[J].GastrointestEndosc, 2002, 55(3): 307-314.
[22]Sieg A, Hachmoeller-Eisenbach U, Eisenbach T. Prospective evaluation of complications in outpatient GI endoscopy: a survey among German gastroenterologists[J].GastrointestEndosc, 2001, 53(6): 620-627.
[23]Sung JJ, Lau JY, Ching JY,etal. Continuation of low dose aspirin therapy in peptic bleeding[J].AnnInternMed, 2010, 152(1): 1-9.
[24]Derogar M, Sandblom G, Lundell L,etal. Discontinuation of low-dose aspirin therapy after peptic ulcer bleeding increases risk of death and acute cardiovascular events[J].ClinGastroenterolHepatol, 2013, 11(1): 38-42.
[25]Carter D, Beer-Gabel M, Eliakim R,etal. Management of antithrombotic agents for colonoscopic polypectomies in Israeli gastroenterologists relative to published guidelines[J].ClinResHepatolGastroenterol, 2013, 37(5): 514-518.
Management of antithrombotic agents for endoscopic procedures in elderly Chinese patients: a retrospective study
WANG Hao, TAO Tao, WANG Hai-jun, ZHAO Xiao-ning, GUO Yu-tao, WANG Yu-tang△
(Geriatric Cardiology Division, Chinese PLA General Hospital, BeiJing 100853, China)
Objective: To investigate the peri-endoscopic management of antithrombotic drugs and adverse events in elderly patients undergoing gastrointestinal endoscopy in order to provide clinical guidance of peri-endoscopic management of antithrombotic drugs for elderly patients. Methods: Between January 1st2008 and December 31st2014, clinical data of 3 747 patients (aged 46~99 years, 96.1% male) who were hospitalized for elective gastrointestinal endoscopy were analyzed retrospectively. The general clinical data, cardiovascular disease and related risk factors, medication, management of peri-endoscopic antithrombotics and adverse events were recorded. The differences of peri-endoscopic adverse events including thromboembolism and bleeding between patients with different management strategies of peri-endoscopic antithrombotics were analyzed. Results: The overall incidences of peri-endoscopic thromboembolism and bleeding were 2.24% and 1.89%, respectively. The incidences of thromboembolism and bleeding when stopping antithrombotics at 0~7 days pre-procedure were 1.87% and 2.38% respectively. The incidences of thromboembolism and bleeding when resuming antithrombotics at 2~7 days after endoscopy were 2.07% and 0.63% respectively. When discontinuing antithrombotics, the differences in peri-endoscopic thromboembolism and bleding between patients who did and did not undergo low-molecular-weight heparin (LMWH) bridging therapy were not significant. The incidence of bleeding in patients who underwent LMWH bridging therapy was higher than that in patients who didn’t undergo LMWH bridging therapy, but the diference was not significant. Conclusion: Our findings suggest that cessation of antithrombotics <7 days pre-procedures and resumption of antithrombotic agents after 2-7 days post-porcedures is optimal in elderly Chinese patients undergoing endoscopy.
peri-endoscopy; antithrombotic agents; thromboembolism; bleeding; elderly
中国人民解放军总医院科技创新苗圃基金(15KMM25)
2017-01-06
2017-02-15
R331.3;R332
A
1000-6834(2017)03-271-06
10.12047/j.cjap.5550.2017.066
△【通讯作者】Tel: 010-66876349; E-mail: wyt301@sina.com

