热休克蛋白A5介导的自噬在小鼠脑缺血/再灌注损伤中的作用*
彭志锋, 孟 健, 张继红
(1. 山西大同大学医学院生理学教研室, 2. 人体解剖学教研室, 大同 037009)
热休克蛋白A5介导的自噬在小鼠脑缺血/再灌注损伤中的作用*
彭志锋1△, 孟 健2, 张继红1
(1. 山西大同大学医学院生理学教研室, 2. 人体解剖学教研室, 大同 037009)
目的:探讨热休克蛋白A5(HSPA5)诱导的自噬在小鼠脑缺血/再灌注损伤中的作用。方法:将36只BALB/c小鼠随机分为sham、缺血再灌注(I/R)、vehicle+I/R、3-甲基腺嘌呤(3-MA)+I/R、scramble siRNA+I/R和HSPA5 siRNA+I/R组(n=6)。Sham组只进行手术操作,不插入线栓。I/R采用大脑中动脉阻塞(MCAO)60 min后再灌注24 h。Vehicle+I/R组和3-MA+I/R将5 μl 0.9% NaCl 或3-MA (30 mg/ml)在MCAO前30 min侧脑室注射。scramble siRNA+I/R组和HSPA5 siRNA+I/R组将5 μl scramble siRNA或HSPA5 siRNA (2 μg/μl)在MCAO前24 h侧脑室注射。检测神经细胞内自噬体、缺血大脑皮层(LC3)-II/LC3-I表达、神经元损伤程度及神经功能缺损。结果:显微镜下sham组小鼠大脑皮层神经细胞形态正常;I/R组小鼠缺血大脑皮层神经元胞质中细胞器减少,自噬体形成。与sham组比较,I/R组缺血大脑皮层LC3-II/LC3-I蛋白表达水平显著增高(P<0.05) ;与I/R组相比,3-MA+I/R组或HSPA5 siRNA+I/R 组缺血大脑皮层LC3-II/LC3-I蛋白表达明显减少(P<0.05);3-MA+I/R组及HSPA5 siRNA+I/R组I/R后脑缺血性损伤及神经系统症状加重(P<0.05)。结论:HSPA5诱导自噬可能在小鼠局灶性I/R损伤中发挥保护作用。
热休克蛋白A5;自噬;缺血/再灌注损伤;小鼠
脑缺血一定时间后恢复血液供应,脑组织损伤
会加重,称为脑缺血/再灌注(ischemia/reperfusion; I/R)损伤,神经细胞死亡与I/R损伤有密切联系[1]。但是I/R损伤机制仍未阐明,临床上也缺乏相应的治疗措施。自噬是存在真核细胞生物细胞中的一种自我吞噬现象,在生理病理情况下,形成自噬溶酶体,对自身细胞质内异物、损伤和衰老细胞器进行吞噬降解的过程,自噬分为大自噬、小自噬和分子伴侣介导的自噬[2]。分子伴侣介导的自噬指通过一些分子伴侣如热休克蛋白70 (heat shock protein 70; HSP70)帮助未折叠蛋白转位入溶酶体,参与自噬[3]。在正常生理情况下,细胞自噬的水平很低;当组织器官发生I/R损伤时,细胞自噬水平上调[1]。近年来研究人员通过透射电子显微镜等方法,从形态学和生物化学等方面证实不同I/R模型中自噬水平增加[4, 5]。本课题组在小鼠大脑中动脉阻塞(middle cerebral artery occlusion; MCAO)后再灌注损伤模型及氧糖剥夺(oxygen and glucose deprivation; OGD)诱导N2A细胞模型中证实miR-181b 通过直接调节热休克蛋白A5 (heat shock protein A5; HSPA5)发挥作用,而且HSPA5在小鼠I/R损伤中表达增高[6, 7]。同时也证实沉默自噬相关基因-5(autophagy related gene -5; Atg5)会加重小鼠MCAO再灌注损伤[8]。然而HSPA5是否诱导自噬及其在小鼠 IR损伤模型中的作用仍不清楚。因此,本研究利用MCAO致小鼠脑缺血模型,探讨HSPA5是否介导自噬及其在小鼠IR损伤中的作用,有助于明确内质网应激与自噬的关系,及其在小鼠局灶性I/R损伤中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 36只健康成年雄性BALB/c小鼠,体重18~22 g,购自首都医科大学动物部,许可证号为SCXK-(军)2007-004。将小鼠随机分为6组(n=6):假手术组(sham组)、缺血/再灌注组(I/R组)、溶剂(vehicle)+I/R组、自噬抑制剂(3-Methyladenine, 3-MA)+I/R组、杂乱(scramble) siRNA+I/R组和HSPA5 siRNA+I/R组。其中sham组是I/R组对照;vehicle+I/R组为3-MA+I/R组对照;scramble siRNA+I/R组是HSPA5 siRNA+I/R组对照。I/R采用大脑中动脉阻塞(MCAO)60 min后再灌注24 h。Vehicle+I/R组和3-MA+I/R将5 μl 0.9% NaCl 或3-MA (30 mg/ml)在MCAO前30 min侧脑室注射。scramble siRNA+I/R group组和HSPA5 siRNA+I/R组将5 μl scramble siRNA或HSPA5 siRNA (2 μg/μl)在MCAO前24 h侧脑室注射。
1.1.2 仪器和试剂 透射电子显微镜(美国Delong Instruments公司;LVEM5);超薄切片机(美国RMC公司);小鼠脑立体定位仪(北京沙东生物有限公司);3-MA(美国Sigma公司);HSPA5 siRNA和scramble siRNA (广州Ribobio公司) ;兔抗(LC3)-II/LC3-I和Beclin-1多克隆抗体、鼠抗β-actin多克隆抗体(美国Santa公司);山羊抗兔二抗(中杉金桥生物技术有限公司); Nissl染料(美国Sigma公司)。
1.2 方法
1.2.1 侧脑室给药 小鼠在MCAO手术前先经1%戊巴比妥钠腹腔注射麻醉后固定于小鼠脑立体定位仪上,按Munoz[9]侧脑室注射方法,以前囟为零点,在前囟后0.5 mm,左侧1.0 mm和3.5 mm深度将5 μl HSPA5 siRNA(2 μg/μl) 、scramble siRNA或 2 μl 3-MA (30 mg/ml) 、0.9% NaCl 在MCAO手术前24 h或30 min分别注入小鼠左侧脑室。
1.2.2 MCAO诱导缺血/再灌模型的建立 按照以往研究的方法[8],自颈部行1 cm长的正中纵切口,钝性分离下颌下腺;手术显微镜下暴露左侧颈动脉鞘并游离出颈总动脉、颈外动脉及颈内动脉,然后用5/0缝合丝线双重结扎颈总动脉近心端和颈外动脉远心端;在颈总动脉上两线结间打一松结并轻轻提起以阻断血流,在颈外动脉远端的动脉壁上用针头扎一个小口,将制备好的线栓从小孔插入颈总动脉至颈内动脉并进而向上到达大脑中动脉(直至遇到轻微阻力,深度约12.0 mm),固定线栓,将下颌下腺归位,60 min 后拔出线栓,缝合皮肤。模型成功的标志是小鼠麻醉清醒后出现手术侧肢体瘫痪,站立不稳,小鼠可存活1周。I/R手术成功率约为70%。Sham组小鼠仅分离颈部血管, 不进行大脑中动脉梗阻, 除不插入栓线外, 其他手术操作步骤同I/R组。
1.2.3 神经行为学评价 I/R 24 h,各组小鼠根据文献报道方法进行神经行为学评分[10],观察性评价指标包括运动减少、姿势侧倾、拖地步态、共济失调等;操作性评分指标包括低反应性、前肢屈曲、肌肉强度降低、身体旋转和运动失调等。评分范围在0~10分之间。轻度0~3分;中度4~7分;重度8~10分。
1.2.4 透射电子显微镜检查缺血大脑皮层自噬体 I/R 24 h后,小鼠经1%巴比妥钠麻醉后,心脏PBS灌注,含4%多聚甲醛的磷酸缓冲液(PB)固定。取出缺血大脑皮层额叶,置入上述相同固定液中后固定过夜。然后在1%四氧化锇中浸泡2 h,乙醇梯度脱水,环氧树脂包裹。组织被超薄切片机切成60~70 nm薄片,通过醋酸双氧铀和柠檬酸铅染色。随后在透射电子显微镜随机选择10个视野,通过对自噬小体或自噬溶酶体计数来判断自噬活化情况。
1.2.5 免疫印迹分析缺血大脑皮层自噬相关蛋白 提取缺血大脑皮层蛋白,取50 μg进行SDS-PAGE电泳,后转至PVDF膜上。经5%脱脂牛奶孵育1 h后,用兔抗(LC3)-II/LC3-I和 Beclin-1(1∶500)和鼠抗β-actin多克隆抗体(1∶5 000)室温孵育3 h。随后用山羊抗兔二抗(1∶5 000)孵育1 h。最后用化学发光扫描系统检测,以β-actin为内参,应用图像分析软件Quantity one进行吸光度分析。
1.2.6 Nissl染色缺血大脑皮层神经元 I/R 24 h后,将小鼠麻醉,并取出大脑皮层缺血区,含4%多聚甲醛的PB溶液固定,冰冻切片机将组织块切成20 μm薄片,载玻片上贴片,按照Nissl染料方法进行染色[11],每组选取3张切片在光学显微镜下观察,每张切片随机取3个视野,计数神经元的数量,然后取平均值。
1.3 统计学处理
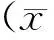
2 结果
2.1 3-MA或HSPA5 siRNA对I/R小鼠神经功能影响
行为学方法检测各组小鼠,可见sham组小鼠神经行为学表现正常,平均行为学评分是2.0。I/R损伤组小鼠表现为活动减少、侧倾、转圈、低反应性、前肢屈曲和运动失调等,行为学评分为8.4±0.3,与sham组相比具有统计学差异(P<0.05)。I/R前侧脑室注射3-MA组或HSPA5 siRNA组小鼠的行为学损伤进一步加重,行为学评分别增加至12.3±0.5和11.9±0.4,与I/R组相比有统计学差异 (P<0.05,图1)。
2.2 I/R对小鼠自噬水平的影响
采用透射电子显微镜观察发现,sham组小鼠大脑皮层神经细胞形态正常;I/R组小鼠缺血大脑皮层神经细胞萎缩、细胞器减少, 小鼠I/R后细胞质中有自噬体、自噬溶酶体明显增加,提示自噬发生(P<0.05,图2)。
2.3 3-MA或HSPA5 siRNA对自噬相关蛋白的影响
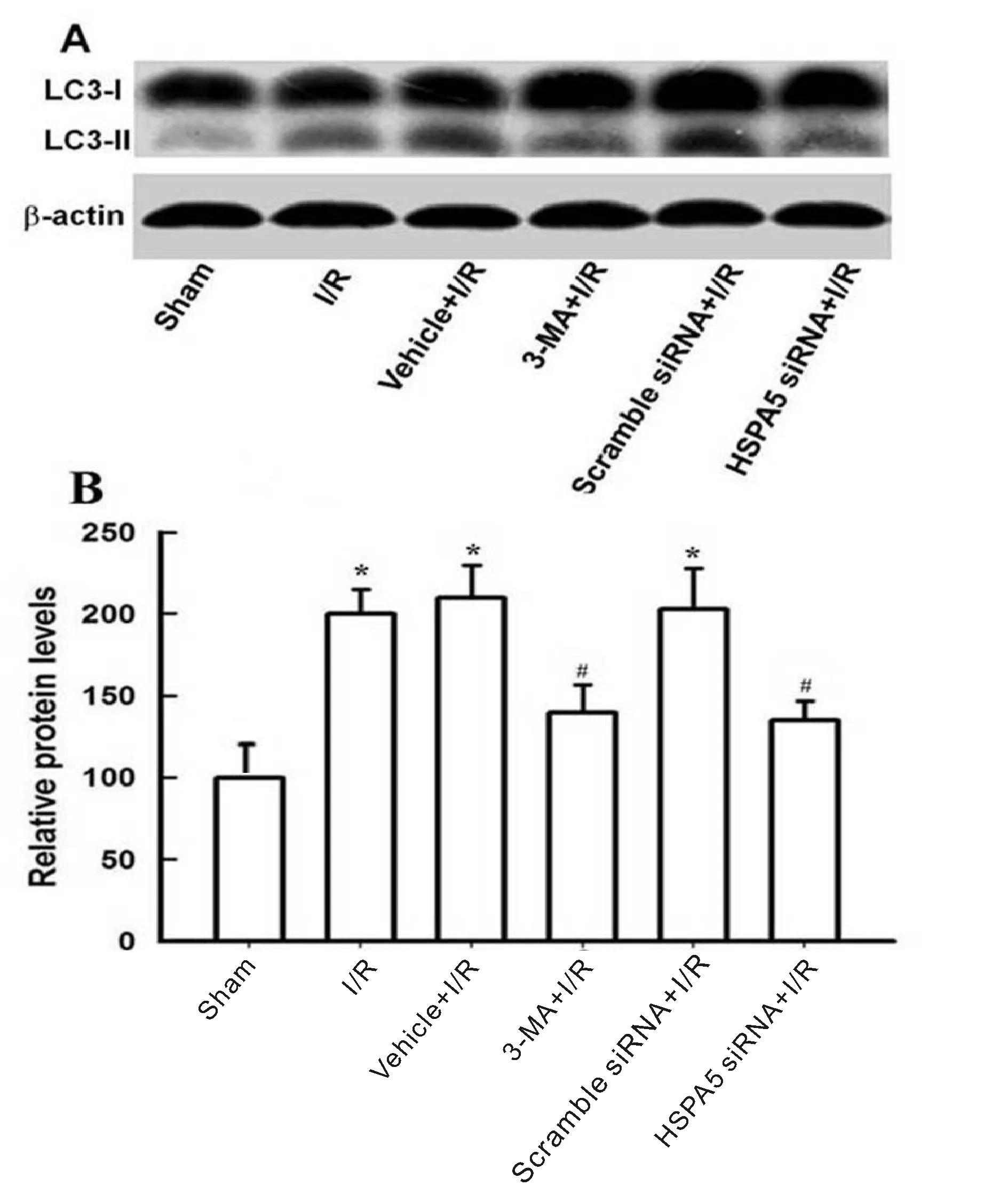
蛋白印迹检测结果显示:sham组、I/R组、vehicle+I/R 组、3-MA+I/R组、scramble siRNA+I/R组和HSPA5 siRNA+I/R组LC3-II蛋白相对灰度值分别是100±0、200±15、210±20、140±17、203±25和135±12,而各组间LC3-I蛋白表达无显著差异。与sham组相比较,I/R组小鼠自噬相关蛋白LC3-II/LC3-I表达显著增高(P<0.05);与I/R组相比,3-MA+I/R组或HSPA5 siRNA+I/R group小鼠缺血大脑皮层LC3-II/LC3-I蛋白表达明显减少(P<0.05,图3)。
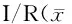
2.4 3-MA或HSPA5 siRNA对I/R大脑额叶神经元损伤的影响
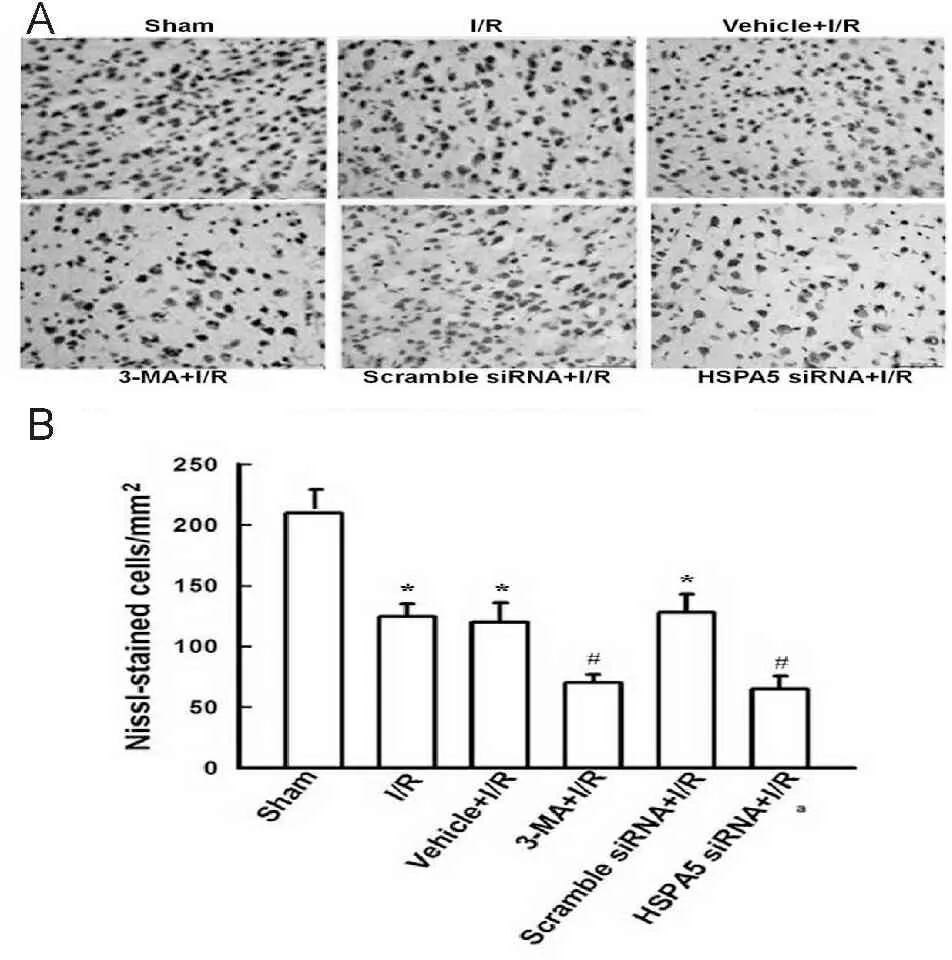
Nissl染色结果显示:sham组、I/R组、vehicle+I/R 组、3-MA+I/R组、scramble siRNA+I/R组和HSPA5 siRNA+I/R组大脑皮层平均神经元数目/视野分别是210±9、125±10、120±16、70±7、128±15和65±11。与sham组比较,I/R组小鼠大脑缺血皮层有一定程度的神经细胞缺失(P<0.05);3-MA+I/R组或HSPA5 siRNA+I/R group小鼠缺血皮层的神经细胞缺失进一步增加,与I/R组比较有统计学差异(P<0.05, 图4)。
3 讨论
本研究表明,小鼠脑I/R损伤后自噬相关蛋白LC3-II/LC3-I表达显著增高,而自噬抑制剂3-MA或HSPA5 siRNA可降低LC3-II/LC3-I蛋白表达。3-MA或HSPA5 siRNA使I/R缺血大脑皮层神经细胞缺失进一步增加;与此同时,神经行为学损伤进一步加重。上述结果提示,HSPA5介导的自噬可能在小鼠脑I/R损伤中具有神经保护作用。
自噬既能够清除细胞内的有害物质,在维持神经细胞稳定中发挥作用;又可以引起细胞器过度损伤导致神经细胞功能障碍甚至死亡[12, 13]。近年来研究报道,新生大鼠缺氧缺血后Beclin-1蛋白水平显著增高,应用自噬抑制剂3-MA可加速神经细胞坏死,而应用自噬激活剂雷帕霉素可减少细胞坏死并减轻脑损伤,提示自噬具有神经元保护作用[14]。Puyal等[15]利用出生后12 d大鼠制作I/R模型发现,缺血区自噬体指标LC3-II水平在再灌注后2~6 h开始升高,24 h时达到峰值,利用透射电镜下可见病灶周围神经细胞内大量自噬溶酶体形成;再灌注后3、6 h,应用自噬抑制剂3-MA可显著下调自噬标志蛋白LC3-II水平和缩小脑梗死体积、减轻脑损伤,提示自噬参与了I/R引起的缺血区域神经细胞的死亡。本研究中,BALB/c小鼠缺血前侧脑室注射3-MA,自噬相关蛋白LC3-II/LC3-I表达明显降低,而且导致小鼠大脑缺血皮层神经细胞缺失及神经行为学损伤进一步加重,提示自噬具有神经保护作用,这与Puyal等人的研究结果不一致。Puyal研究中使用的是刚出生SD大鼠,在MCAO手术后侧脑室注射3-MA;本研究使用的是成年BALB/c小鼠,在MCAO手术前侧脑室注射3-MA。结果的差异可能与Puyal研究中自噬先增高后降低,而本研究中MCAO手术后自噬未被激活有关。近年来,研究已经表明内质网应激可以诱导自噬激活[16]。以往研究已证实在小鼠脑I/R模型中,HSPA5蛋白水平表达增高,且具有神经保护作用[6]。在本研究中,小鼠MCAO前侧脑室注射HSPA5 siRNA,LC3-II/LC3-I表达显著降低,而且也会导致小鼠脑缺血皮层神经细胞缺失及神经行为学损伤加重,与自噬抑制剂3-MA作用相似。上述结果提示HSPA5介导的自噬可能在小鼠I/R中发挥神经保护作用。但下一步仍需要利用HSPA5转基因小鼠,通过透射电子显微镜明确I/R损伤后自噬的变化情况。
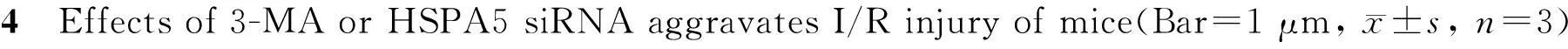
总之,本研究表明,干扰HSPA5后LC3-II/LC3-I表达降低,同时小鼠缺血性损伤加重,提示HSPA5诱导自噬可能在小鼠局灶性I/R损伤中发挥保护作用。
[1] 王光胜, 耿德勤. 脑缺血/再灌注损伤机制研究进展[J]. 医学综述, 2011, 17(24): 3753-3756.
[2] 苏静缘, 赵瑞波. 脑缺血自噬研究进展[J]. 实用医学杂志, 2013, 29(1): 151-153.
[3] 李巍巍, 王 群, 郭安臣, 等. 自噬--脑缺血损伤中的双刃剑[J]. 中国卒中杂志, 2015, 10(4): 320-325.
[4] Zhao G, Zhang W, Li L,etal. Pinocembrin protects the brain against ischemia -reperfusion injury and reverses the autophagy dysfunction in the penumbra area[J].Molecules, 2014, 19(10): 15786-15798.
[5] Zheng Y, Hou J, Liu J,etal. Inhibition of autophagy contributes to melatonin-mediated neuroprotection against transient focal cerebral ischemia in rats[J].JPharmacolSci, 2014, 124(3): 354-364.
[6] Peng Z, Li J, Li Y,etal. Down-regulation of miR-181b in mice brain following ischemic stroke induces neuroprotection against ischemic injury through targeting HSPA5 and UCHL1[J].JNeurosciRes, 2013, 91(10): 1349-1362.
[7] 韩 松, 彭志锋, 李俊发. miRNA-181b在氧-糖剥夺致N2A细胞缺血损伤中的作用及对热休克蛋白A5表达的调节[J]. 解剖学报, 2013, 44(5): 616-620.
[8] 彭志锋, 王喜英, 杨靖辉. 小鼠脑缺血时自噬相关基因5的抗损伤作用[J].中国病理生理杂志, 2016, 32(1): 64-68.
[9] Mu†oz A, Nakazaki M, Goodman JC,etal. Ischemic preconditioning in the hippocampus of knockout mouse lacking SUR1-based K(ATP) channels[J].Stroke, 2003, 34(1): 164-170.
[10]Rodriguez R, Santiagomejia J, Gomez C,etal. A simplified procedure for the quantitative measurement of neurological deficits after forebrain ischemia in mice[J].JNeurosciMethods, 2005, 147(147): 22-28.
[11]顾 兵, 金建波, 李华南, 等. 神经组织染色方法的研究概况[J]. 中国药理学通报, 2011, 27(10): 1472-1475.
[12]Denton D, Nicolson S, Kumar S. Cell death by autophagy: facts and apparent artifacts [J].CellDeathDiffer, 2012, 19(1): 87-95.
[13]Wei K, Wang P, Miao CY. A double-edged sword with therapeutic potential: an updated role of autophagy in ischemic cerebral injury[J].CNSNeurosciTher, 2012, 18(11): 879-886.
[14]Carloni S, Buonocore G, Balduini W. Protective role of antophagy in neonatal hypoxia-ischemia induced brain injury[J].NeurobiolDis, 2008, 32(3): 329-339.
[15]Puyal J, Vaslin A, Mottier V,etal. Postischemic treatment of neonatal cerebral ischemia should target autophagy[J].AnnNeurol, 2009, 66(3): 378-389.
[16]宋乐乐, 刘 浩, 蒋琛琛. 内质网应激与自噬信号通路研究进展[J]. 蚌埠医学院学报, 2014, 39(5): 687-690.
Effects of heat shock protein A5 induced autophagy on cerebral ischemia/reperfusion injury in mice
PENG Zhi-feng1△, MENG Jian2, ZHANG Ji-hong1
(1. Department of Physiology, 2. Department of Anatomy, School of Medicine, Shanxi Datong University, Datong 037009, China)
Objective: To determine the role of heat shock protein A5 (HSPA5) induced autophagy on cerebral ischemia/reperfusion injury in mice. Methods: Thirty-six BALB/c mice were randomly divided into sham group, ischcmia/reperfusion (I/R) group, vehicle+I/R group, 3-Methyladenine(3-MA)+I/R group, scramble siRNA group and HSPA5 siRNA+I/R group(n=6). In sham group, the operation was only performed, did not insert line switch. Focal cerebral ischemia was performed using the method of middle cerebral artery occlusion (MCAO) for 60 min and 24 h reperfusion. In vehicle+I/R group and 3-MA+ I/R group, 2 μl 0.9% NaCl or 3-MA(30 mg/ml) was administered by intracerebroventricular injection 30 min before MCAO; In scramble siRNA+I/R group and HSPA5 siRNA+I/R group, 5 μl scramble siRNA or HSPA5 siRNA(2 μg/μl) was administered by intracerebroventricular injection 24 h before MCAO. Autophagosome in neuron, the expression of microtubule-associated protein light chain 3 (LC3)-II/LC3-I in ischemic cortex, the degree of cerebral ischemic injury and neurological function score were detected. Results: Initial electron microscopy showed that neuronal morphology appeared to be normal in the sham group. At 24 h after I/R, cell shrinkage, loss of cellular organelles and formation of autophagosomes were observed in the ischemic cerebral cortex of I/R group. In addition, autophagosomes were less frequently observed than that in I/R group. The expressions of LC3-II/LC3-I and Beclin-1 protein were increased significantly in I/R group compared with that in sham group(P<0.05). Compare with I/R group, the LC3-II/LC3-I protein levels induced by I/R in 3-MA+ I/R group or HSPA5 siRNA+ I/R group was decreased effectively (P<0.05). In addition, the cerebral ischemic injury and neurological symptoms after I/R in 3-MA+ I/R group or HSPA5 siRNA+ I/R group were exacerbated significantly (P<0.05). Conclusion: These results suggest that HSPA5 induced autophagy may play a protective role in focal I/R damage in mice.
HSPA5; autophagy; ischemia/reperfusion injury; mice
山西省基础研究项目(2015021178);山西大同大学博士科研启动经费(2014-B-01)
2016-07-12
2017-01-23
R363
A
1000-6834(2017)03-234-05
10.12047/j.cjap.5472.2017.058
△【通讯作者】Tel: 15910699956; E-mail: pzf181@126.com

