红花中黄酮类成分对黄嘌呤氧化酶抑制活性的研究
于思慧 宋慧鹏 高 雯* 张 慧*
1. 辽宁中医药大学,辽宁 大连 116600;2. 中国药科大学,江苏 南京 210009
红花中黄酮类成分对黄嘌呤氧化酶抑制活性的研究
于思慧1宋慧鹏2高 雯2*张 慧1*
1. 辽宁中医药大学,辽宁 大连 116600;2. 中国药科大学,江苏 南京 210009
目的:对红花中黄酮类化合物的黄嘌呤氧化酶抑制活性进行研究,并对活性成分的构效关系进行初步探讨,为红花药效物质基础的研究提供依据。方法:运用基于紫外分光光度原理的高通量微孔板筛选的方法,对从红花分离出的12个黄酮类成分进行黄嘌呤氧化酶抑制活性的筛选和测定。结果:从红花所含的黄酮类成分中筛选出7个对黄嘌呤氧化酶具有较好抑制活性的化合物,其中槲皮素、杨梅素和木犀草素抑制活性明显,其IC50分别为4.89,3.03和 7.72 μmol/L。结论:红花中部分黄酮类成分对黄嘌呤氧化酶具有抑制作用,可为红花药效物质基础和作用机制的阐明提供依据。
红花;黄酮类;黄嘌呤氧化酶抑制作用;构效关系
黄嘌呤氧化酶是一种人体核酸代谢的重要酶,与高尿酸血症、糖尿病及缺血再灌注损伤等多种疾病的发生发展有密切关系。黄嘌呤氧化酶抑制剂在临床被广泛用于治疗和缓解痛风患者的高尿酸血症,也常用于保护心功能衰竭的患者,但部分临床常用黄嘌呤氧化酶抑制剂(如别嘌醇)有较为严重的不良反应[1-2]。红花(CarthamiFlos)为菊科植物红花(CarthamustinctoriusL.)的管状花,其化学成分主要包括黄酮类、生物碱类、色素类、亚精胺类、腺苷类、木脂素类、有机酸类及多炔类等化合物[3]。红花是活血散瘀的传统良药,被认为可以促进血液循环、清除血瘀并减轻疼痛,在痛经、闭经、产后腹痛、创伤、关节痛的血瘀综合征等临床治疗中被广泛应用。现代药理学表明,红花具有改善心肌缺氧、扩张冠状动脉、抗凝、抗血栓、抗氧化、抗疲劳等作用,对脏器的缺血再灌注损伤也有一定的保护作用等[4-8]。研究发现机体抗氧化能力降低、氧化与抗氧化失衡,均会导致自由基和活性氧产生过多,而自由基和活性氧具有损伤细胞结构、氧化抗凝血酶、脂质过氧化等作用,因此抑制自由基反应和活性氧生成是缓解许多心血管疾病的重要途径[9]。黄嘌呤是嘌呤降解途径的产物,黄嘌呤氧化酶能催化黄嘌呤氧化生成尿酸, 并产生过氧化物自由基。故抑制黄嘌呤氧化酶很可能可以起到抗氧化的作用。为了阐明红花抗氧化的药效物质基础,笔者从黄嘌呤氧化酶入手[11-17],通过基于紫外分光光度原理的微孔板筛选的方法,对红花中的黄酮类化合物的黄嘌呤氧化酶抑制活性进行研究,以期为今后阐明红花药效物质基础提供实验支撑。
1 仪器与材料
酶标仪Synergy2(美国 Bio-Tek公司),Milli-Q 超纯水系统(美国 Millipore公司),多道移液器(RAININ),96孔板(无锡NEST生物科技公司),KH-500DB型超声波提取器(昆山禾创超声仪器有限公司),涡旋混合器(上海比朗仪器制造公司)。阳性药别嘌醇(上海阿拉丁试剂公司),黄嘌呤氧化酶和黄嘌呤(美国 Sigma 公司),二甲基亚砜(DMSO,分析纯);实验用样品:羟基红花黄色素A(1),山柰素(2),圣草酚(3),芹菜素(4),杨梅素(5),槲皮素(6),芦丁(7),木犀草素(8),木犀草苷(9),野黄芩苷(10),山奈酚-3-O-芸香糖苷(11),槲皮素-7-O-葡萄糖苷(12),结构式如图1。以上实验样品均为本课题组从红花药材中分离制备,并经 MS、1H NMR、13C NMR 等波谱手段确证结构,纯度均大于95%;其他试剂均为国产分析纯。

2 方法
2.1 溶液配制 磷酸盐缓冲液的配制:精密称取磷酸二氢钾0.9560 g,三水合磷酸氢二钾6.9460 g以及乙二胺四乙酸(EDTA)18.62 mg于500mL的烧杯中,倒入适量超纯水超声片刻,取出,置于500 mL的容量瓶中并定容,即得浓度为75 mmol/L PO43-、200 μmol/L EDTA且pH 为7.4的磷酸盐缓冲液;分装并保存于-20℃的冰箱中。
黄嘌呤氧化酶液的配制:原黄嘌呤氧化酶(10U/mL)保存在-70℃的冰箱中以备用,实验时在超净台用磷酸盐缓冲液稀释酶至0.08U/mL,置于冰盒中并尽快实验,并避免酶反复冻融而降低活性。
底物的配制:精密称取底物黄嘌呤3.65 mg放置于烧杯中,加入磷酸盐缓冲液适量超声促溶,取出,定容至50 mL,摇匀;置于水浴锅里逐渐加热至澄清透明,得0.48 mmol/L底物溶液。底物溶液应现用现配制。
2.2 样品的配制 精密称取各样品适量,用DMSO分别配制成10 mmol/L 储备液,保存在-20℃的冰箱中并用锡箔纸包好避光。实验时用磷酸盐缓冲液对半稀释至6~8个浓度并涡旋混匀。
2.3 测定方法与数据处理 底物黄嘌呤在黄嘌呤氧化酶的催化下生成产物尿酸,其最大吸收波长为295nm。根据此原理建立的紫外分光光度-高通量微孔板筛选的方法[18]可用于黄嘌呤氧化酶抑制活性的快速测定,黄嘌呤氧化酶抑制率用样品组和空白组吸光度值(A)的变化速率(dA/dt)进行计算。具体方法如下:吸取待测样品100μL置于96孔板相应孔中,向其加入黄嘌呤氧化酶液50μL,混匀后在酶标仪上于37℃孵育3min;加入配制好的黄嘌呤底物溶液50μL,立即在295nm波长下测定,每隔15s读数一次,记录5min内吸光度值A的变化;空白组以100μL磷酸盐缓冲液代替样品溶液,与样品组平行操作。每个样品平行设置4个复孔。抑制率按照下列公式计算:
抑制率( % ) =[(dA/dt)空白-(dA/dt)样品]/(dA/dt)空白×100。
其中dA为反应终了与反应起始时吸光度的差值,dt为反应时间,该时间根据吸光度变化斜率选择。每组实验平行重复3次。本实验以别嘌醇作为阳性对照药。
2.4 统计学分析 首先在100μmol /L浓度下进行活性筛选,将筛选得到的具有较好的化合物(4个复孔的平均抑制率大于50%)分别对半稀释至8个浓度,再次进行梯度筛选。数据采集采用Gen5软件,IC50值通过酶抑制剂的浓度和平均抑制率利用软件GraphPad Prism 6.0进行计算。
3 结果
3.1 红花中的12种成分抑制酶活性测定 对红花中12个黄酮类化合物(100μmol /L)进行了黄嘌呤氧化酶抑制活性测定,结果显示,化合物2~化合物10均具有一定的黄嘌呤氧化酶抑制作用,化合物2、4、5、6、7、8、9等7种化合物抑制率均超过50%,其中化合物5、6、8,即杨梅素、槲皮素和木犀草素抑制活性最强,约90%,化合物11、12抑制活性不明显。结果见表1。
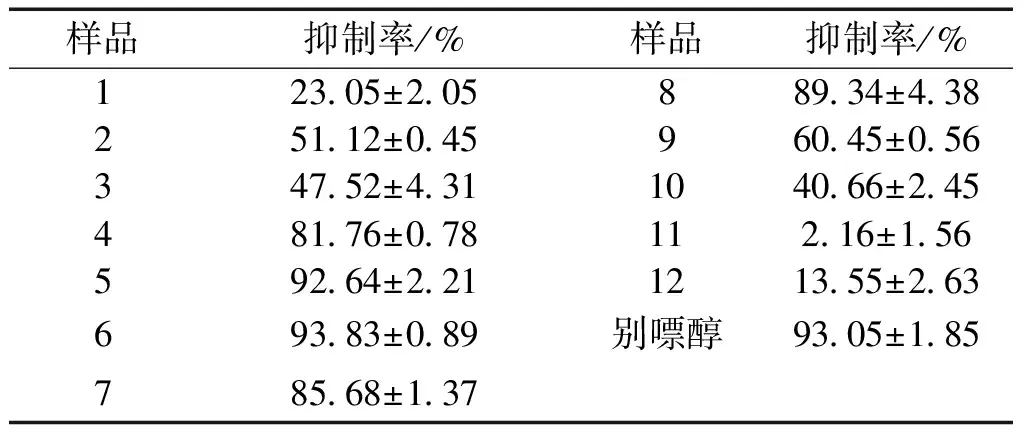
表1 红花中12种黄酮类成分的黄嘌呤氧化酶抑制活性测定结果
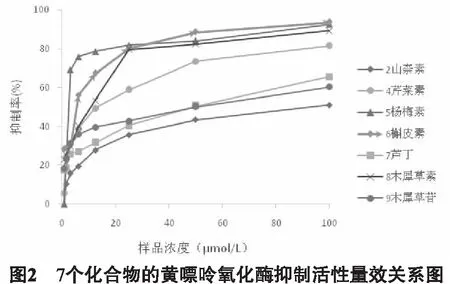
3.2 红花中7种成分抑制酶活性量效关系测定 上述试验表明,化合物2、4、5、6、7、8、9等7种化合物(100μmol /L)对黄嘌呤氧化酶抑制活性超过50%,为此设置了100μmol/L、50μmol/L、25μmol/L、12.5μmol/L、6.25μmol/L、3.125μmol/L、1.5625μmol/L、0.78125μmol/L 8个浓度,对其量效关系进行研究,并计算IC50。结果显示,7个化合物均呈现良好的量效关系(图2),7个化合物IC50值排序由低到高分别是杨梅素、槲皮素、木犀草素、芹菜素、木犀草苷、芦丁、山柰素(图3)。

3.3 红花中黄酮类成分与抑制酶活性的构效关系分析 黄酮类成分根据结构可分为两大类,即苷类和苷元类。通过上述研究发现,苷元的黄嘌呤氧化酶抑制活性普遍都大于苷的活性,例如木犀草素的IC50为7.72μmol/L,而木犀草苷的IC50为40.56μmol/L;槲皮素在100μmol/L浓度下抑制率为93.83%,而槲皮素-7-O-葡萄糖苷抑制率仅为13.55%;山柰素在100μmol/L浓度下抑制率为51.12%,而山奈酚-3-O-芸香糖苷抑制率仅为2.16%。苷元类化合物活性也与结构相关,如芹菜素、杨梅素、槲皮素和木犀草素这四种苷元成分活性均较强,它们在结构上有相似之处,即C-5和C-7均有羟基存在,山柰素则因结构中(4’位)含有一个甲基活性明显降低;圣草酚与木犀草素相比,结构中仅少了C-2和C-3位的一个双键,抑制率却大大降低,在100 μmol/L浓度时抑制率分别为47.52%和89.34%;另外,芦丁与山奈酚-3-O-芸香糖苷相比,只是在3’位多一个羟基,活性却大大增强,由此可见在红花的黄酮类成分中3’位上的羟基对黄嘌呤氧化酶抑制活性起到了一定的作用,因此红花中的黄酮类成分的结构与黄嘌呤氧化酶抑制活性存在一定的构效关系。
4 讨论
本实验抑制率(%)=[(dA/dt)空白-(dA/dt)样品]/(dA/dt)空白×100,该公式是利用黄嘌呤氧化酶催化反应的速率差异来计算抑制率,初速度在相同体系里是相对稳定的,只需控制时间的长短,选择合适的反应时间(酶催化反应的平台期之前),计算所得抑制率相对较稳定。
在实验过程中,样品与酶和底物接触后立即反应,而酶标仪对96孔板每一行复孔数据的读取有微弱的差异,故每一行均要设有空白参比,保证实验的准确性。
从实验的筛选结果看,红花中分离出的12个黄酮类化合物中对黄嘌呤氧化酶抑制作用比较明显的主要为杨梅素、槲皮素、木犀草素、芹菜素、木犀草苷、芦丁和山柰素这7个成分;分析这7个化合物的结构与其对黄嘌呤氧化酶抑制作用的构效关系发现,苷元普遍比苷抑制黄嘌呤氧化酶的活性高,苷元连上糖链后活性明显下降;另外通过分析苷元类化合物的结构与活性,其中活性较好的芹菜素、杨梅素、槲皮素和木犀草素结构相似,推测黄酮结构中C-5和C-7上的羟基可以大大增强黄嘌呤氧化酶的抑制活性;芦丁与山奈酚-3-O-芸香糖苷相比,只是在3’位多一个羟基,推测3’位上的羟基对黄嘌呤氧化酶抑制活性起到了一定的作用;圣草酚与木犀草素的结构相比仅少了C-2和C-3的一个双键,抑制率却大幅度降低,可见C-2和C-3上的双键可以保证其平面结构,该平面结构是一个重要结构,对于黄嘌呤氧化酶抑制活性的作用非常关键。
基于紫外分光光度法的微孔筛选测定方法操作简单、快捷、取样量小,可同时进行多样品平行检测,为从中草药中寻找高效安全的黄嘌呤氧化酶抑制剂提供了一种科研理念和思路,也为中药活性成分的发现提供了一种高通量筛选途径。
在药典中,羟基红花黄色素A在红花中的含量较高,要求不得少于1%,但在本实验中抗黄嘌呤氧化酶的作用并不强,可见在红花中的羟基红花黄色素A并不是起抑制黄嘌呤氧化酶活性的药效成分;孙沂[19]在实验中测得槲皮素在红花中含量为0.2%左右;韩炜[20]在实验中测得木犀草素在红花的平均含量为0.05%;但杨梅素目前无含量方面的报道,但本实验可为中药材红花的抗氧化的药效成分研究提供一定的基础,为其今后的质量控制提供参考依据。
[1]Bulgantuya Bumandorj,Narantsetseg Byambaakhuu,叶日贵,等. 红花的抗氧化活性成分研究[J].内蒙古大学学报,2015,46(3):301-307.
[2] 黎莉,戴丽珍,杨靖,等.中药提取物中黄嘌呤氧化酶抑制剂的筛选[J].武汉工程大学学报,2010,32(3):44-46.
[3] Chang HT,Han HX,Tu PF,et al.Chemical constituents and pharmacological activities of traditional Chinese medicine Carthamus tinctorius L.[J]. World Note sPlant Med,1999,14: 201-203.
[4] 范莉,赵海誉,濮润,等.红花的黄酮类化学成分研究[J].中国中药杂志,2011,46(5):333-337.
[5] 姜建双,夏鹏飞,冯子明,等.红花化学成分研究[J].中国中药杂志,2008,33(24):2911-2913.
[6] 赫军,陈钟,杨桠楠,等.红花水提取物的化学成分研究[J].中国中药杂志,2014,49(6):455-458.
[7]王林艳,唐于平,刘欣,等.基于选择性剔除的红花抗氧化效应物质基础研究[J].中国中药杂志,2014,39(7):1285-1289.
[8]瞿城,乐世俊,林航,等.红花化学成分研究[J].中草药,2015,46(13):1872-1877.
[9]崔剑,李兆龙,洪哮吟.自由基生物抗氧化与疾病[J].清华大学学报,2000,40(6):9-12.
[10]徐婷婷,承志凯,尹莲.土获苓抑制黄嘌呤氧化酶活性的物质基础研究[J].中药材,2012,35(4):582-585.
[11]Nguyen MT,AwaleS,TezukaY,et al.Xanthine oxidase inhibitors from the flowers ofChrysanthemumsinense[J].Planta Med,2006,72(1):46-51.
[12]周佳,张国文,胡明明.红旱莲总黄酮对黄嘌呤氧化酶抑制作用及抗氧化研究[J].食品与生物技术学报,2013,32(4):353-357.
[13]齐万虎,蒋企洲,蒋建勤.黄瑞香中化学成分抑制黄嘌呤氧化酶活性及其机制研究[J].中国实验方剂学杂志,2014,20(5):141-144.
[14]陈艳,堵锡华.黄酮类化合物抑制黄嘌呤氧化酶活性的定量构效关系[J].时珍国医国药,2011,22(5):1095-1097.
[15]杨道茂,欧阳明安.9种中药提取物黄嘌呤氧化酶抑制活性研究[J].天然产物研究与开发,2014,26:597-600,578.
[16] Cristine E.Berry,JoshuaM.Hare.Xanthine oxidoreductase and cardiovascular disease: molecular mechanisms and pathophysiological implications[J].Physiology,2004,555(3):589-606.
[17] DE Van Hoom,RJ Nijveldt,PA VanLeeuwen,et al.Accurate prediction of xanthine oxidase inhibition based on the structure of flavonoids[J].EurJPharmacol,2002,451(2):111-118.
[18] 李英,陈君,李萍.金银花中酚酸类和黄酮类成分的黄嘌呤氧化酶抑制活性[J].药学学报,2011,42(5):407-411.
[19] 孙沂,郭涛,隋因,等.高效毛细管电泳法同时测定红花中腺苷、芦丁和槲皮素的含量[J].中国药科大学学报,2003,38(4):283-285.
[20] 韩炜,杨玉林,康廷国.HPLC法测定红花地上部分中木犀草苷和木犀草素的含量[J].中华中医药学刊,2010,28(6):1315-1316.
Study on the Inhibitory Activity of Flavonoids in Carthami Flos on Xanthine Oxidase
YU Sihui1SONG Huipeng2GAO Wen2*ZHANG Hui1*
1. Liaoning University of Traditional Chinese Medicine, Dalian 116600,China 2. China Pharmaceutical University, Nanjing 210009,China
Objective To supplement the pharmacology and efficacy research of Carthami Flos, the bioactive components of Carthami Flos on the xanthine oxidase inhibitory activity was screened, and the structure-activity relationship was discussed. Methods An in vitro high-throughput screening method based on microplate and spectrophotometer was developed. Then the method was used to evaluate the xanthine oxidase inhibitory activity of flavonoidsisolated from Carthami Flos. Results Among 12 flavonoids, 7 components exhibited more than 50% inhibition at 100 μmol /L, and the most active components werequercetin, myricetinand luteolin with the IC50 value of 4.89,3.03 and 7.72 μmol/L, respectively. Conclusion The results demonstrated that some flavonoids components in Carthami Flos has possessed inhibitory effect on xanthine oxidase, which provided a supplement to clarify the material basis and therapeutic mechanism of Carthami Flos.
Carthami Flos; Flavonoids; Xanthine Oxidase Inhibitors; Structure-activity Relationships
国家自然科学基金项目(81503241)。
于思慧(1992-),女,汉族,硕士研究生在读,研究方向为中药品质评价与创新药物研究。E-mail:yusihui0123@163.com
张慧(1970-),女,汉族,博士,教授,研究方向为中药品质评价与创新药物研究,E-mail:syyycs@163.com;高雯(1986-),女,汉族,博士,讲师,研究方向为中药活性发现与质量评价研究。E-mail:gw_cpu@126.com
R284
A
1007-8517(2017)09-0023-04
2017-03-23 编辑:陶希睿)

