秀珍菇富硒多糖的制备及体外抗氧化活性研究
刘倩,吴悦,方明梦 支小芳,徐小青,孙玉军
( 安徽科技学院生命科学学院,安徽凤阳233100)
秀珍菇富硒多糖的制备及体外抗氧化活性研究
刘倩,吴悦,方明梦 支小芳,徐小青,孙玉军
( 安徽科技学院生命科学学院,安徽凤阳233100)
经液体富硒发酵培养秀珍菇(Pleurotusgeesteranus)硒菌丝体,以此为原料制备富硒多糖(SPMP),通过对羟基自由基、DPPH自由基、亚硝酸盐的清除作用及还原力的测定,研究SPMP的体外抗氧化活性。结果表明,SPMP具有一定的清除羟基自由基、DPPH自由基、亚硝酸盐能力和较强的还原能力,且与多糖的浓度呈明显的量效关系,其清除效果和还原能力均比秀珍菇多糖(PMP)高。由此可见,SPMP具有一定的体外抗氧化活性。
秀珍菇(Pleurotusgeesteranus);富硒;多糖;抗氧化
秀珍菇(Pleurotusgeesteranus)属于担子菌纲伞菌目侧耳科侧耳属,是一种味道鲜美的食用真菌[1]。秀珍菇营养成分丰富,富含蛋白质、粗脂肪、多糖和多种维生素[2]。研究表明,秀珍菇多糖具有抗氧化[3]、抗肿瘤[4]、抑菌[5]、降血脂[6]等多方面的生物功能。
硒是机体生命活动必需的一种微量元素,是过氧化氢酶等氧化酶活性中心的组成成分,能够增强机体的抗氧化能力,抵抗有关疾病的发生。硒不能由机体自主合成,只能从体外摄取[7]。自然界的硒有无机硒和有机硒2种形式,与亚硒酸钠等无机硒相比较,硒多糖等有机硒毒性低、副作用小,易于被机体吸收和利用。同时,硒多糖兼有多糖和硒的活性,具有清除自由基、抗氧化、调节免疫等多种功能[8]。
真菌富硒发酵培养是将无机硒转化为有机硒的有效方法之一。采用添加亚硒酸钠进行秀珍菇富硒培养,经纱布过滤将硒菌丝体与发酵液分开,从硒菌丝体中提取制备秀珍菇富硒多糖,利用紫外光谱和红外光谱对其进行表征,并通过体外实验研究其抗氧化性,旨在为抗氧化药物和保健食品的开发与利用提供参考。
1 材料与方法
1.1 材料、仪器与试剂
秀珍菇菌种由安徽科技学院食用菌研究所提供;DPPH购自美国Sigma公司;亚硒酸钠、三氯乙酸 、邻苯二胺、EDTA等均为分析纯。
主要仪器设备有:TDL5离心机(上海安亭科学仪器厂)、FA2004电子分析天平(上海精密科学仪器有限公司)、R205B型旋转蒸发仪(上海申顺生物科技有限公司)、FUS-50L发酵罐(上海国强生化工程装备有限公司)、FD-1-50冷冻干燥机(北京博医康实验仪器有限公司)、T6新世纪紫外分光光度计(北京普析通用仪器责任有限公司)、Nexus傅里叶红外光谱仪(美国NICOLET公司)、ZHWY-2102C往复式恒温摇床(上海智城分析仪器制造有限公司)、Multiskan Go全波长酶标仪(美国Thermo Scientific公司)。
1.2 方法1.2.1 秀珍菇富硒发酵培养及富硒多糖SPMP的制备
将秀珍菇菌株接种于PDA培养基上,经活化、一级种子液、二级种子液培养,按10%的接种量接种于50L发酵罐中,并添加硒浓度为20μg/mL 的亚硒酸钠(依据最适硒浓度的单因素试验确定亚硒酸钠的添加量),180r/min、25℃条件下发酵培养7d,纱布过滤除去发酵液,硒菌丝体经自来水多次淋洗,冷冻干燥,粉碎机粉碎,过100目筛。称取一定量的硒菌丝体粉末,按1∶20的料液比于70℃温水中浸泡3h,4800r/min离心15min,取上清液,浓缩,3倍体积95%的乙醇沉淀过夜,经乙醚、丙酮洗涤后溶于适当体积的蒸馏水中,冷冻干燥得秀珍菇富硒多糖SPMP(简称SPMP)。同时,以不加亚硒酸钠的培养基进行发酵培养,按相同的方法制备秀珍菇多糖PMP(简称PMP)作对照。
1.2.2 紫外可见光谱扫描
分别称取50mg SPMP、PMP于2个锥形瓶中,各加入5mL混酸(HClO4∶H2SO4∶HNO3=1∶1∶4)于电炉上硝化至澄清,待冷却后转移至100mL容量瓶定容,再称取50mg亚硒酸钠溶解,定容到50mL容量瓶。分别吸取5mL溶液,加蒸馏水至25mL,再加入2mL 0.1%邻苯二胺溶液,用甲酸和氨水调pH 1.5~2.5,阴暗处静置50min。加甲苯10mL萃取,以不含样品的甲苯调零,在200~700nm波长范围内扫描。
1.2.3 红外光谱扫描
取SPMP、PMP各2mg,分别加入适量干燥的KBr粉末,混合均匀,在玛瑙研钵中研磨均匀后压片,于400~4000cm-1波数范围内进行红外光谱扫描。
1.2.4 SPMP多糖及其硒含量测定
SPMP多糖含量的测定采用苯酚-硫酸法[9],SPMP硒含量测定采用邻苯二胺紫外分光光度法[10],具体步骤如下:①硒标准曲线绘制。称取50mg亚硒酸钠定容至50mL得1mg/mL亚硒酸钠溶液,吸取10mL该亚硒酸钠溶液定容到100mL容量瓶得100μg/mL亚硒酸钠标准液。准确吸取0、0.4、0.8、1.2、1.6、2.0mL亚硒酸钠标准液于三角瓶中,添加蒸馏水至25mL,加入2mL0.1%邻苯二胺溶液,用80%甲酸调pH至1.5~2.5,在阴暗处放置50min。加甲苯10mL用力振摇2min萃取,静置10min,吸取上层甲苯层,以不含样品的甲苯为对照,在334nm处测定光密度。以硒的浓度为横坐标,光密度为纵坐标绘制标准曲线。②样品硒含量测定。称取50mg SPMP于锥形瓶中,加入5mL混酸(HClO4∶H2SO4∶HNO3=1∶1∶4)于电炉上加热硝化,硝化至溶液澄清,冷却,转移至100mL容量瓶中定容。吸取25mL于锥形瓶中,加2mL0.1%邻苯二胺溶液,用80%甲酸和浓氨水调pH 1.5~2.5,在阴暗处放置50min,加10mL甲苯萃取,测定光密度。
1.2.5 体外抗氧化活性测定
1)羟基自由基清除率 依次加入2mL不同浓度的样品溶液、6mmol/L FeSO4溶液和6mmol/L 的H2O2溶液于各试管中,混匀,静置15min,再分别加入6mmol/L 的水杨酸溶液3mL,混匀,37℃水浴30min,于510nm波长处测定其光密度(D1),以蒸馏水代替样品作为空白对照,测定其光密度(D0),实验重复3次。羟基自由基的清除率公式[11]如下:
羟基自由基清除率=(D0-D1)/D0×100%
式中,D0表示空白对照的光密度;D1表示样品(SPMP、PMP)光密度。
2)DPPH自由基清除率 依次加入不同浓度的样品溶液1mL、0.2mmol/L 的DPPH乙醇溶液3mL于各试管中,充分混匀,避光静置30min后,4000r/min离心10min,取上清于517nm波长处测定其光密度(D1),以蒸馏水代替样品作为空白对照,测定其光密度(D0),实验重复3次。DPPH自由基的清除率公式[12]如下:
DPPH自由基清除率=(D0-D1)/D0×100%
3)亚硝酸盐清除率 依次加入不同浓度的样品溶液1mL、5μg/mL的NaNO22mL、蒸馏水1mL于各试管中,摇匀,室温静置10min,各管加入0.4 %对氨基苯磺酸1mL,摇匀,静置5min后,再加入0.2%的盐酸萘乙二胺1mL,摇匀,静置15min,于538nm处测定光密度(D1)。以蒸馏水代替样品作为空白对照,测定其光密度(D0),实验重复3次。亚硝酸盐清除率公式[13]如下:
亚硝酸盐清除率=[(D0-D1)/D0]×100%
4)还原力 依次加入不同浓度的样品溶液2mL、0.2mol/L磷酸钠缓冲液(pH=6.6) 2mL、1% K3[Fe(CN)6]溶液2mL于各试管中,混匀,于50℃恒温水浴锅中水浴20min,自来水冷却,再加入10%三氯乙酸溶液2mL,混匀,4000 r/min离心10min,取上清液2mL,再加入蒸馏水2mL和0.1%三氯化铁溶液1mL,混匀,常温10min后,于700nm处测定光密度[14]。光密度的大小反应其还原能力的大小,实验重复3次。
2 结果与分析
2.1 紫外光谱分析
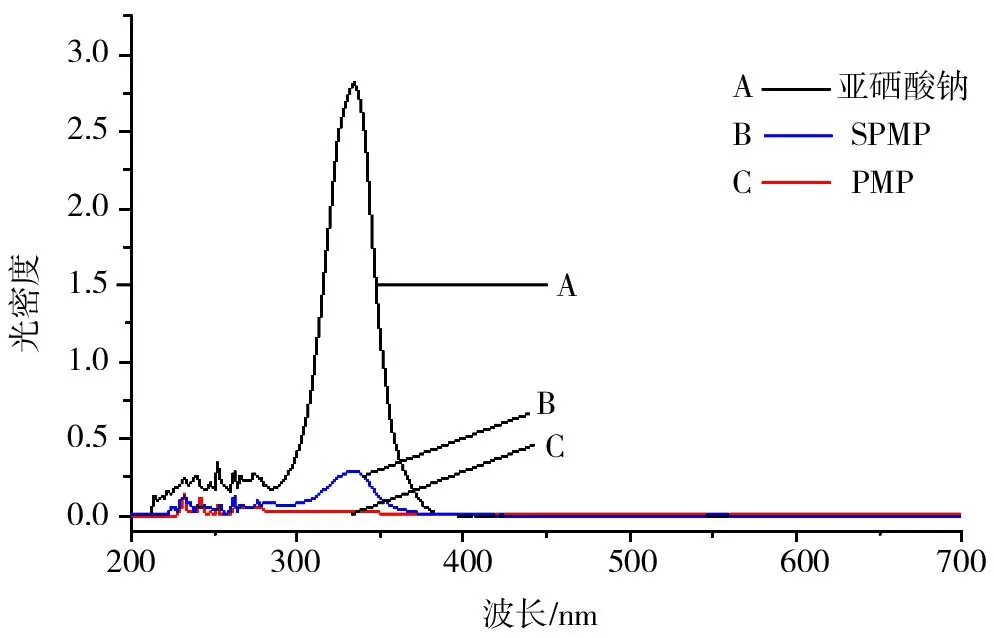
图1 SPMP、PMP紫外扫描结果
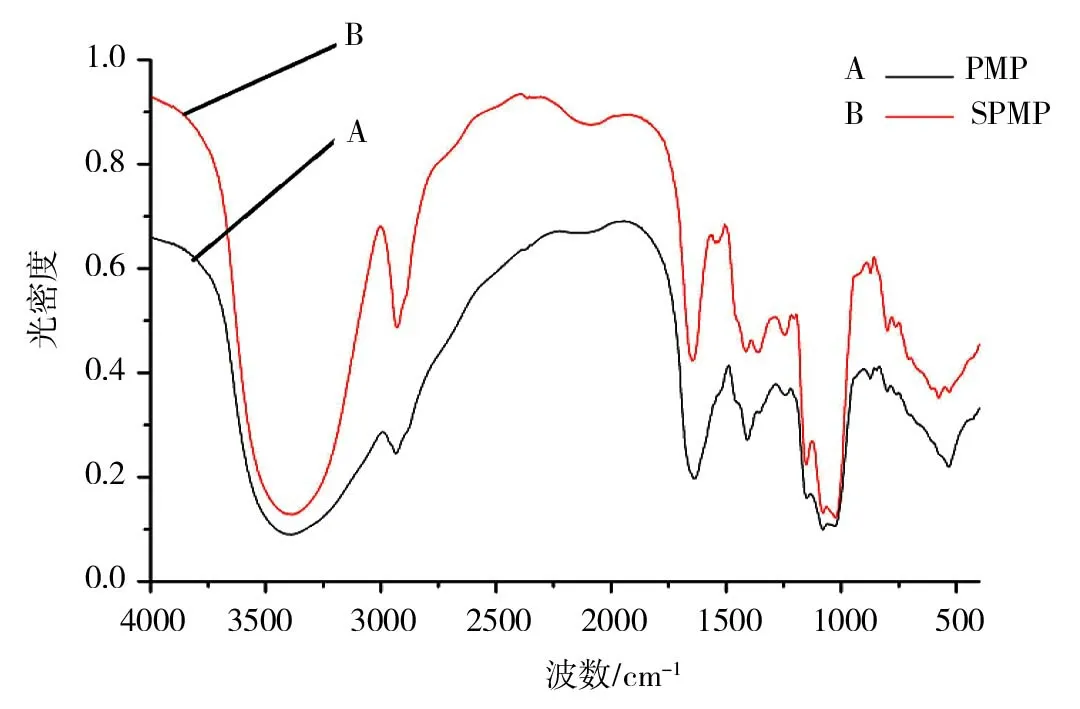
图2 SPMP和PMP红外扫描结果
SPMP、PMP的紫外扫描结果如图1所示。由图1可知,亚硒酸钠在334nm处有很强的吸收峰,这与文献[15]报道相一致;硒多糖在334nm处也有吸收峰,而多糖在334nm处无吸收峰,由此说明通过添加亚硒酸钠进行富硒发酵培养,菌丝体富集了硒元素,以此为原料制备的多糖样品含有硒元素,即通过发酵培养将亚硒酸钠无机硒转化成有机硒多糖SPMP。
2.2 红外光谱分析
SPMP和PMP的红外扫描结果如图2所示。由图2可以看出,SPMP 的主要吸收峰有2998.7cm-1、2382.6cm-1、1568.1cm-1、1498.7cm-1、1389.6cm-1、1287.6cm-1、1215.4cm-1、 1194.1cm-1、1123.3cm-1、1063.8cm-1、888.2cm-1;PMP的主要吸收峰有2998.7cm-1、2391.1cm-1、1490.2cm-1、1389.6cm-1、1283.4cm-1、1219.6cm-1、1133.2cm-1、1061.0cm-1、895.2cm-1。两者红外表征相似,在2998.7cm-1处均有糖类的典型特征吸收峰,这是由糖类C-H伸缩振动引起的吸收。SPMP在1568.1cm-1,1194.1cm-1处有吸收峰,而PMP在此处无吸收峰,说明两者的结构存在一定差异,这主要是SPMP的一些官能团结合硒而引起吸收波长出现一定的偏移造成的[16]。
2.3 SPMP多糖含量及其硒含量
根据绘制葡聚糖标准曲线测得的数据,通过EXCEL得出多糖含量测定的回归方程为y=0.012x-0.001,R2=0.9991(式中:y为光密度值;x为多糖浓度)。根据绘制硒标准曲线测得的数据,通过EXCELL得出硒含量测定的回归方程为y=0.2276x+0.0395,R2=0.9903(式中:y为光密度值,x为硒浓度)。经计算,SPMP中多糖含量为60.81 %,有机硒的含量为8.65mg/g。
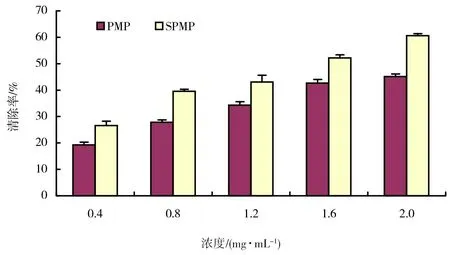
图3 SPMP及PMP对羟基自由基清除作用结果
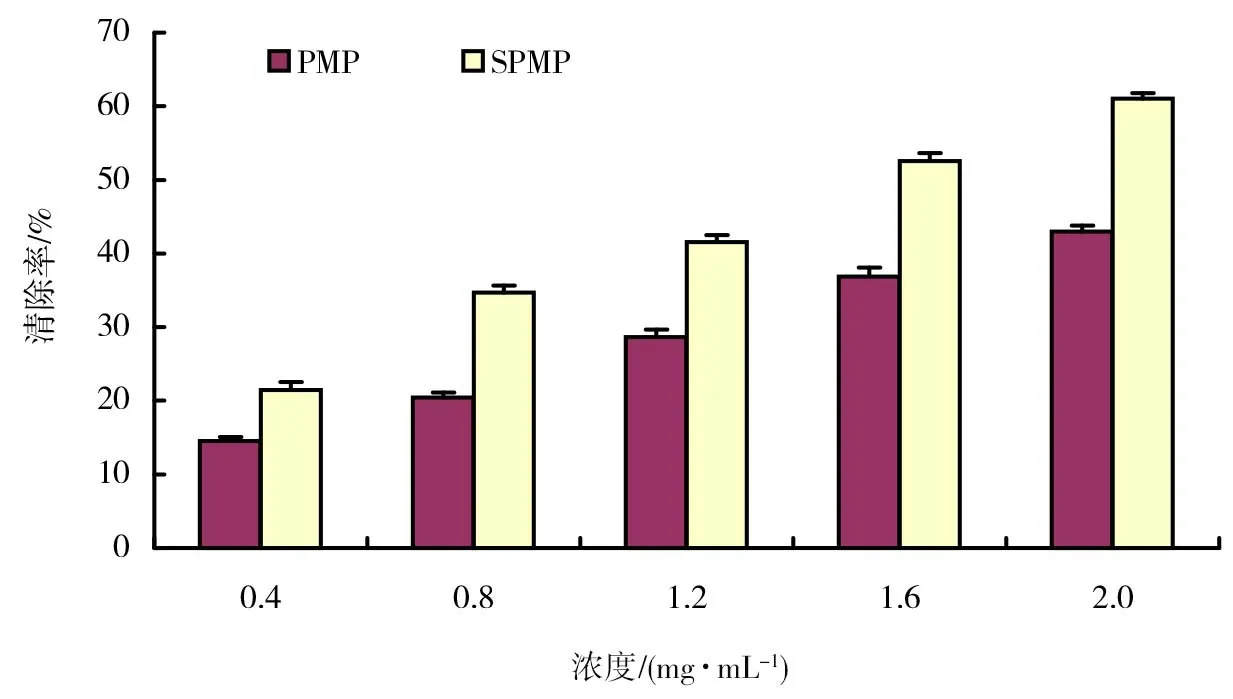
图4 SPMP和PMP对DPPH自由基清除作用结果
2.4 SPMP对羟基自由基的清除效果
羟基自由基是一种对生物机体危害较大、毒性较强的自由基。药物对羟基自由基的清除能力是其抗氧化的重要指标之一。SPMP及PMP对羟基自由基清除作用的结果如图3所示。由图3可以看出,SPMP对羟基自由基具有一定的清除能力,且清除率随着浓度的升高而增大,与浓度存在一定的量效关系;SPMP对羟基自由基的清除率均大于同一浓度的PMP。
2.5 SPMP对DPPH自由基的清除效果
DPPH自由基是一种以氮为中心的自由基,对它的清除,可以表示受试物具有一定的清除羟基自由基、烷自由基的能力和打断脂质过氧化链反应的作用。SPMP和PMP对DPPH自由基清除作用结果如图4所示。由图4可以看出,秀珍菇富硒多糖具有一定的清除DPPH自由基能力;SPMP对DPPH自由基的清除率随着浓度的升高而增大,与浓度存在一定的量效关系;SPMP对DPPH自由基的清除率均比同浓度的PMP高。
2.6 SPMP对亚硝酸盐的清除效果
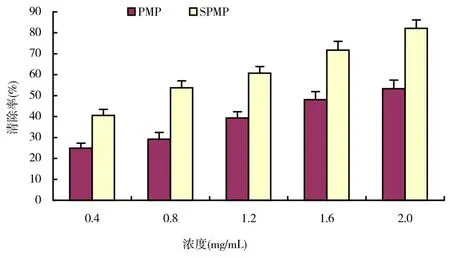
图5 SPMP及PMP对亚硝酸盐清除作用结果
亚硝酸盐在酸性水溶液中能与对氨基苯磺酸重氮化,再与盐酸萘乙二胺偶合反应生成红色化合物,红色化合物颜色的深浅反映溶液中亚硝酸盐浓度的高低。SPMP及PMP对亚硝酸盐清除作用结果如图5所示。由图5可以看出,SPMP对亚硝酸盐具有一定的清除作用,清除能力随着浓度的升高而增大,与浓度存在一定的量效关系;SPMP对亚硝酸盐的清除率均比同浓度的PMP高。
2.7 SPMP的还原能力
抗氧化性物质通过自身的还原作用提供电子清除自由基,其还原能力的强弱反映受试物抗氧化能力的高低。SPMP和PMP的还原能力测定结果如图6所示。由图6可以看出,SPMP具有一定的还原能力,还原能力随着浓度的升高而增大,与浓度存在一定的量效关系;SPMP的还原能力均比同浓度的PMP高。
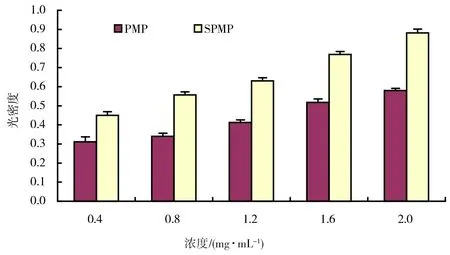
图6 SPMP和PMP的还原能力测定结果
3 结论
通过紫外可见光谱扫描、红外扫描对制备的秀珍菇多糖和硒多糖的结构表征进行分析,发现硒多糖和多糖的基本结构相似,其多糖含量为60.81%,硒含量为8.65mg/g。体外抗氧化实验表明,秀珍菇富硒多糖具有较强的还原能力;对羟基自由基、DPPH自由基和亚硝酸盐具有一定的清除能力。因此,秀珍菇富硒多糖作为天然的抗氧化药物值得进一步开发与应用,有关富硒多糖的化学组成、结构以及体外抗氧化的机理等有待进一步研究。
[1]Hibbett D S,Binder M,Bischoff J F,etal.A higher-level phylogenetic classification of the Fungi [J].Mycological Research,2007,111:509~547.
[2]孙玉军,江昌俊,祝嫦巍,等.秀珍菇多糖PMP-2a的理化性质及其体外抗氧化活性研究[J].现代食品科技,2014,(12):79~84.
[3]Wang Q,Li H,Chen T T,etal.Yield,polysaccharides content and antioxidant properties ofPleurotusabalonus,andPleurotusgeesteranus,produced on asparagus straw as substrate[J].Scientia Horticulturae,2012,134:222~226.
[4] Zhang M,Zhu L,Cui S W,etal.Fractionation,partial characterization and bioactivity of water-soluble polysaccharides and polysaccharide-protein complexes fromPleurotusgeesteranus.[J].International Journal of Biological Macromolecules,2011,48:5~12.
[5]申进文,王瑞瑞,许春平.秀珍菇多糖的硫酸化及其生物活性研究[J].河南农业科学,2014,43(7):102~106.
[6]Duobin M,Yuping M,Lujing G,etal.Fermentation characteristics in stirred-tank reactor of exopolysaccharides with hypolipidemic activity produced byPleurotusgeesteranus5#[J].Anais Da Academia Brasileira De Ciências,2013,85:1473~1481.
[7] Xu X M,Carlson B A,Grimm T A,el al.Rhesus monkey simian immunodeficiency virus infection as a model for assessing the role of selenium in AIDS [J].Acquired Immune Defic Syndr,2006,31:453~463.
[8] Staaf M,Yang Z N,Huttunen E,etal.Structural elucidation of the viscous exopolysaccharide produced by lactobacillus LB161 [J].Carbohydrate Research,2000,32:113~119.
[9]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[10] Hu D,Liu Q,Cui H,etal.Effects of amino acids from selenium-rich silkworm pupas on human hepatoma cells[J].Life Sciences,2005,77:2098~2110.
[11]张俊生,陈莉华,朱士龙,等.节节草多糖的体外抗氧化活性[J].食品科学,2013,34(5):86~89.
[12]严春艳,华雨蕾,黎乃生,等.薄树芝多糖提取工艺优化及抗氧化活性研究[J].中药材,2013,36(5):825~827.
[13]张强,王松华,孙玉军,等.洋葱中黄酮类化合物体外抗氧化活性研究[J].农业机械学报,2009,40(8):139~142.
[14]张泽庆,田应娟,张静.防风多糖的抗氧化活性研究[J].中药材,2008,31(2):268~272.
[15]冯波,赵红卫,傅春蓉,等.微波消解-紫外分光法测定富硒沼泽红假单胞菌中的硒含量[J].四川大学学报(自然科学版),2012,49(2):417~421.
[16]高义霞,袁毅君,周向军,等.罗望子多糖硒酸酯的制备及表征[J].药物分析杂志,2012,(7):1222~1226.
[编辑] 李启栋
2016-12-15
安徽省高等学校省级自然科学研究重点项目(KJ2014A052);安徽省高校优秀青年人才支持计划重点项目(gxyqZD2016221);国家级大学生创新创业训练计划项目(201610879009)。
刘倩(1997-),女,现从事多糖研究。通信作者:孙玉军,sunyujun208@163.com。
Q539
A
1673-1409(2017)10-0056-05
[引著格式]刘倩,吴悦,方明梦,等.秀珍菇富硒多糖的制备及体外抗氧化活性研究[J].长江大学学报(自科版),2017,14(10):56~60.

