NO与缺血性脑卒中患者颈动脉粥样硬化斑块的相关性分析
吴 强
河南新乡市中心医院神经内科 新乡 453000
NO与缺血性脑卒中患者颈动脉粥样硬化斑块的相关性分析
吴 强
河南新乡市中心医院神经内科 新乡 453000
目的 分析NO与缺血性脑卒中患者颈动脉粥样硬化斑块的相关性。方法 采用随机抽样的方法选择2014-06—2015-06在我院治疗的缺血性脑卒中患者100例,其中50例为缺血性脑卒中出现颈动脉粥样硬化斑块的患者,50例为缺血性脑卒中未出现颈动脉粥样硬化斑块的患者,比较2组NO水平,测得观察组颈动脉内膜中层厚度(IMT),分析NO与IMT的相关性。结果 对照组NO水平为(30.19±7.98)mmol/L,观察组为(36.63±9.25)mmol/L,观察组NO水平明显高于对照组(P<0.05);2组HDL、TG以及D-D水平相比无明显差异(P>0.05)。观察组中NO与IMT存在正向相关性(r=0.541,P<0.05)。结论 缺血性脑卒中伴颈动脉粥样硬化斑块的患者NO水平明显高于缺血性脑卒中无颈动脉粥样硬化斑块患者,两者具有密切的相关性,临床诊断中可将NO水平作为一个重要观察指标评估患者是否发生颈动脉粥样硬化,也能够为脑卒中患者的治疗提供指导和依据。
缺血性脑卒中;NO;颈动脉粥样硬化斑块
脑卒中发病机制是大脑血管出现突发性破裂出血或因血管堵塞造成大脑缺血、缺氧,进而导致疾病的发生。临床根据疾病情况可将脑卒中分为两类,一种是出血性,另一种是缺血性,在所有脑卒中患者中,约15%的患者属于出血性脑卒中,其余均为缺血性脑卒中。脑卒中的发病可在任一年龄段,不过高龄患者中发病率较高,我国脑卒中的平均发病年龄是66岁左右,其中20%以上患者年龄<45岁。本文探讨NO与缺血性脑卒中患者颈动脉粥样硬化斑块的相关性,以期为临床治疗提供参考和依据,现报道如下。
1 资料与方法
1.1 一般资料 选择100例2014-06—2015-06在我院治疗的缺血性脑卒中患者为研究对象,以第4届全国脑血管病学术会议制定的脑卒中诊断标准[1]为依据,所有患者均经CT或MRI检查证实。其中有颈动脉粥样硬化斑块的50例患者为观察组,无颈动脉粥样硬化斑块的50例患者为对照组。颈动脉粥样硬化斑块的检测指标:颈动脉内膜中层厚度<1.0 mm为正常,1.0~1.2 mm为增厚,>1.2 mm判断为斑块形成。排除标准:年龄>80岁的患者;经治疗后复发的缺血性脑卒中患者;出血性脑血管病以及由于心律不齐、房颤等心脏疾病引起的心源性脑栓塞患者;伴恶性肿瘤及急性感染疾病患者;近期接受过外科手术或有严重创伤者;近期应用对机体凝血或纤溶机制有影响的药物者;存在严重心、肝、肾等功能障碍者。观察组男30例,女20例,年龄46~79(68.5±5.8)岁;对照组男31例,女19例,年龄45~78(69.0±6.2)岁。2组性别、年龄等一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 方法 患者入院后,第3天行彩色多普勒检查,检查双侧颈动脉,取仰卧位,在对一侧颈动脉检测时将患者头向另一侧偏45°,完全显露颈部,用探头依次根据颈动脉走向,将胸锁乳头肌外缘作为起始点,由上向下对横、纵切面进行连续性探查,观察是否存在斑块,并探查管腔的狭窄情况。入院后第3天清晨取患者空腹静脉血2 mL,并及时送检、观察。
1.3 观察指标 检测2组NO水平、HDL、TG及D-D水平,并进行对比。分析NO水平与IMT的相关性。
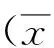
2 结果
2.1 2组NO、HDL、TG及D-D水平比较 2组NO、HDL、TG及D-D水平见表1。观察组NO水平明显高于对照组,差异有统计学意义(P<0.05)。2组HDL、TG及D-D水平相比,差异无统计学意义(P>0.05)。

表1 2组NO、HDL、TG及D-D水平比较
2.2 NO水平与IMT的相关性 观察组IMT为(1.2±0.1)mm,经Pearson线性相关分析发现,观察组NO水平与IMT存在明显的正向相关性(r=0.541,P<0.05)。
3 讨论
缺血性脑卒中是由于脑的供血动脉狭窄或闭塞、脑供血不足引起,是临床上较常见的一种疾病。近年来,随着我国人口老龄化的进展,脑血管病的发病率呈增长趋势,一方面给患者的生命带来严重的威胁,另一方面也使患者家庭及社会的经济负担大大加重。做好脑卒中疾病的早期预防和筛查,可帮助降低脑卒中的发病率。颈动脉是直接向脑组织供应血和氧的组织,颈动脉粥样硬化主要是由于血管动脉弹性减弱或变厚引起,主要表现为动脉血管壁上沉积了一层脂类,导致管腔变窄。如颈动脉硬化会在血管壁上形成斑块,使血液流通不畅,引起头晕、目眩、记忆力差、思维能力明显下降等,长此以往会导致大脑萎缩,且颈动脉粥样硬化斑块会出现脱落,随着血液的流动而在血管中活动,阻塞动脉血管,进而导致脑梗死,出现瘫痪、失明或语言不清等卒中表现,对患者的生命造成很大威胁。
一直以来,颈动脉粥样硬化是缺血性脑卒中发生的一个独立且重要的危险因素,这一观点均得到医学界的一致认可。随着流行病学调查的深入,发现我国颈内动脉颅外段的脑卒中发病率明显高于其他病变位置,引起了相关学者的关注和重视。经病理学研究发现,颈动脉粥样硬化导致缺血性脑卒中的机制主要为:粥样斑块发生后会附着在血管壁上,随着病情的进展,会引起血管壁进行性狭窄;患者出现颈动脉狭窄后,大脑供血量不足,难以满足需求,则会引起分水岭区供血下降,进而导致梗死的发生;不稳定斑块出现继发病变,如脱落、破裂及出血等,会堵塞远端血管[1]。虽导致动脉粥样硬化的危险因素很多,当前发现的高危因素有年龄、性别、种族、遗传因素、高血压、糖尿病、心脏病、血脂代谢异常、短暂性脑缺血发作及吸烟、酗酒、肥胖、膳食结构、高盐饮食、打鼾等,但多数研究指出,其中大多数因素与颈动脉处的病变具有紧密联系,是导致短暂性脑缺血发作或缺血性脑卒中的危险因素[2]。大量研究表明,各种血脂水平对动脉粥样硬化的形成起重要的作用。低密度脂蛋白胆固醇(LDL-C)可导致泡沫细胞的形成,促进动脉粥样硬化,是脑卒中发生的重要危险因素[3]。因此,临床上对颈动脉处的病变进行积极的早期干预,并制定相应的有效干预措施可帮助预防和降低脑卒中的发生率。流行病学调查结果显示,如对人群和个体实施联合早期干预,可使心脑血管疾病的发生率降低约50%。
有学者提出,NO水平可能与脑卒中颈动脉粥样硬化斑块的发生具有一定的联系。也有研究发现,氧化低密度脂蛋白(oxLDL)及一氧化氮(NO)在动脉粥样硬化形成中起关键作用[4]。NO是一种新型细胞内及细胞间的信使因子,其生物作用较广泛。研究表明,NO在人体中的作用是多方面的,一方面可作为血管扩张剂,促进血管的扩张,增加血流量,进而在急性缺血性脑卒中发生之后,对脑组织提供保护作用;另一方面,可作为内源性脑血流调节剂和自身脑血管的保护剂,对脑血管实施保护,并有效调节脑血管的血流量[5-6]。此外,NO还可有效抑制血管平滑肌增殖、血小板聚集及单核细胞黏附等,具有良好的抗血栓、抗增殖以及抗炎效果,对于动脉粥样硬化的病理过程具有积极的影响作用[7]。
Arenillas等[8]发现,粥样硬化的动脉存在NO生成缺陷的现象,且NO水平的降低与心肌梗死和心绞痛都具有相关性。也有报道急性脑血栓期血清NO含量降低,并认为这一结果与脑缺血损伤具有一定的联系,血栓形成对缺血区血管内皮细胞NO合成释放减少[9]。
本研究观察组NO水平明显高于对照组(P<0.05),而2组HDL、TG以及D-D水平相比无明显差异(P>0.05),结果表明,缺血性脑卒中伴颈动脉粥样硬化斑块患者NO水平明显高于缺血性脑卒中无颈动脉粥样硬化斑块患者,NO水平与IMT存在明显的正向相关性。不过也有研究表明,NO在临床应用中也具有一定的缺点,主要表现为:(1)其作用时间短,效果无法持续;(2)NO的用量如超过一定的标准,则会引起细胞内钙超载,导致谷氨酸大量堆积,对机体的能量代谢产生严重干扰,进而使脑损伤加重,且大量的NO 也会刺激内皮细胞的产生,刺激机体释放更多的内皮素,而内皮素具有收缩血管的作用机制,会导致血液黏稠度增加,易诱发微血栓,也会加重脑损伤[10-13]。总之,缺血性脑卒中伴颈动脉粥样硬化斑块患者NO水平明显高于缺血性脑卒中无颈动脉粥样硬化斑块患者,两者具有密切的相关性,临床诊断中,可将NO水平作为一个重要观察指标评估患者是否发生颈动脉粥样硬化,也能够为脑卒中患者的预后治疗提供指导和依据。
[1] 吴长鸿,刘斌.第四届全国脑血管病学术会议[J].中华医学信息导报,1996,3(6):4-4.
[2] 宋娟,肖慧,付丽媛,等.MSCTA在颈动脉粥样硬化与缺血性脑卒中相关性研究中的应用[J].中国医疗设备,2015,30(10):55-58.
[3] Zhao XH,Underhill HR,Hatsukami TS,et al.Discriminating Carotid Atherosclerotic Lesion Severity by Luminal Stenosis and Plaque Burden:A Comparison Utilizing High-Resolution Magnetic Resonance Imaging at 3.0 Tesla[J].Stroke,2011,11(2):908-909.
[4] 李洋洋.水蛭微粉防治动脉粥样硬化作用机制的研究[D].天津:天津医科大学,2016.
[5] 段丹丹,于秋丽,赵颖馨,等.氧化型低密度脂蛋白对剪切力诱导的人主动脉内皮细胞一氧化氮合酶表达的影响[J].中华老年心脑血管病杂志,2017,19(1):13-15.
[6] Cheng C,Tempel D,Haperen RV,et al.Shear Stress-induced changes in atherosclerosis plaque composition are modulated by chemokines[J].J Clin Invest,2007,9(10):565-566.
[7] 孙佳艺,赵冬,刘静,王薇,等.中国缺血性脑卒中住院患者颈动脉粥样硬化病变性别差异的分析[J].心肺血管病杂志,2016,5(2):81-86.
[8] 王竹瑶.氯化锂抑制血管平滑肌细胞增殖和迁移以及抗神经细胞损伤的分子机制研究[D].南京:南京师范大学,2014.
[9] Arenillas JF,Alvarez2Sabin J,Molina CA,et al.C-reac-tive protein pre2dicts further is chemicevents in first 2 evertransient ischemic attack ostroke patients withintra cranial large 2 arteryocclusive disease[J].Stroke,2003, 8(9):1 253-1 254.
[10] Zhang WL,Xiao Y,Liu JP,et al.Structure and remodeling behavior of drug-loaded high density lipoproteins and their atherosclerotic plaque targeting mechanism in foam cell model[J].Int J Pharma,2011,7(1):79-80.
[11] 董正妮,云彩霞,田立俊.姜黄素对血管紧张素Ⅱ刺激下内皮细胞的保护作用与机制研究[J].中药新药与临床药理,2016,27(1):6-10.
[12] Nambi V,Hoogeveen RC,Ballantyne CM,et al.Lipoprotein-Associated Phospholipase A2 and High-Sensitivity C-Reactive Protein Improve the Stratification of Ischemic Stroke Risk in the Atherosclerosis Risk in Communities(ARIC)Study[J].Stroke,2009,6(2): 1 108-1 109.
[13] 金晶.吡格列酮对胰岛素抵抗血管内皮细胞保护机制的研究[D].长春:吉林大学,2015.
(收稿2016-12-08)
R743.33
B
1673-5110(2017)11-0097-03

