青贮用产纤维素酶菌株3X-10的产芽孢条件优化
郭 威,郭晓军,武红敏,2,董丽华,朱宝成
(1.河北农业大学生命科学学院,河北保定 071000;2.河北众邦生物技术有限公司,河北保定 071000)
青贮用产纤维素酶菌株3X-10的产芽孢条件优化
郭 威1,郭晓军1,武红敏1,2,董丽华1,朱宝成1
(1.河北农业大学生命科学学院,河北保定 071000;2.河北众邦生物技术有限公司,河北保定 071000)
本试验旨在通过将单因素、Plackett-Burman(PB)筛选与响应面分析3种方法相结合来优化产纤维素酶菌株3X-10产芽孢发酵条件。以单因素试验为基础,PB试验确定了影响菌株芽孢产量的主要因素,最后通过响应面法确定当发酵时间为67 h、接种量为7.00%、装液量为61 mL/250 mL时菌株的芽孢产量达到最大,为3.22×109cfu/mL,较优化前的8.07×108cfu/mL增加了2.99倍。
纤维素酶;芽孢杆菌;条件优化
青贮饲料就是在新鲜饲草中加入青贮剂进行厌氧发酵得到的饲料。青贮饲料添加剂可以通过调节青贮料内微生物区系,调控青贮发酵进程,促进乳酸菌繁殖,将粗纤维与多糖分解,从而改善青贮饲料品质(赵士萍,2016)。乳酸菌类添加剂在生物青贮剂中应用最多,但由于乳酸菌添加剂不易保存,且不能降解纤维素,限制了其应用。纤维素酶产生菌通过产生纤维素酶,降解饲料中难以利用的纤维素为单糖或双糖等可溶性糖,为乳酸菌、酵母菌的发酵提供更多的糖分,从而有助于其在青贮中发挥自身有益作用,促进青贮发酵。
芽孢具有较强的抗逆性,对其在不良环境中的存活具有重要作用,也有利于将芽孢杆菌加工成微生物菌剂。生长环境、营养物质等因素能够影响芽孢的形成,但芽孢的形成并不是芽孢杆菌生活史必要的环节(张冬冬,2014)。所以产芽孢发酵条件的优化对于芽孢杆菌菌剂的产业化十分必要(孔少元,2016)。本试验通过单因素试验与响应面试验结合对产纤维素酶株菌B.methylotrophicus 3X-10进行产芽孢条件优化,以期为中试生产工艺提供参考。
1 材料与方法
1.1 供试菌株 B.methylotrophicus 3X-10,由大熊猫粪便中筛选得到。
1.2 培养基 种子培养基:蛋白胨1.0%、葡萄糖1.0%、NaH2PO4·H2O 0.03%、MnSO4·H2O 0.02%、Na2HPO40.06%,pH值7.2~7.4。
发酵培养基:葡萄糖2.0%、蛋白胨1.0%、NaH2PO4·H2O 0.03%、Na2HPO40.06%、MnSO4·H2O 0.02%,pH值7.2~7.4。
牛肉膏蛋白胨培养基参照微生物学实验(1999)配制。
1.3 种子液培养 活化菌株3X-10,将菌株接种于50 mL/250 mL种子培养基,于180 r/min、37℃摇床培养12 h后作为种子液。
1.4 发酵液培养 按6.0%接种量,将种子液接种到50 mL/250 mL发酵培养基,在180 r/min、37℃条件下摇床培养48 h,测定芽孢产量。
1.5 单因素试验 以芽孢产量为测定指标,采用单因素试验确定发酵培养基中最佳的碳源、氮源和无机盐。
1.6 发酵培养条件优化试验设计
1.6.1 Plackett-Burman试验 在单因素试验的基础上,以芽孢产量为测定指标,通过 Plackett-Burman试验设计,筛选对芽孢产量影响较大的因素。对影响产芽孢的碳源、氮源、无机盐、接种量、摇床转速、装液量、培养温度、初始pH值、培养时间9个影响因素进行筛选,另设2个虚拟列,以考察试验误差,共12组试验。Plackett-Burman试验因素和水平设置及设计方案分别见表1和表2。
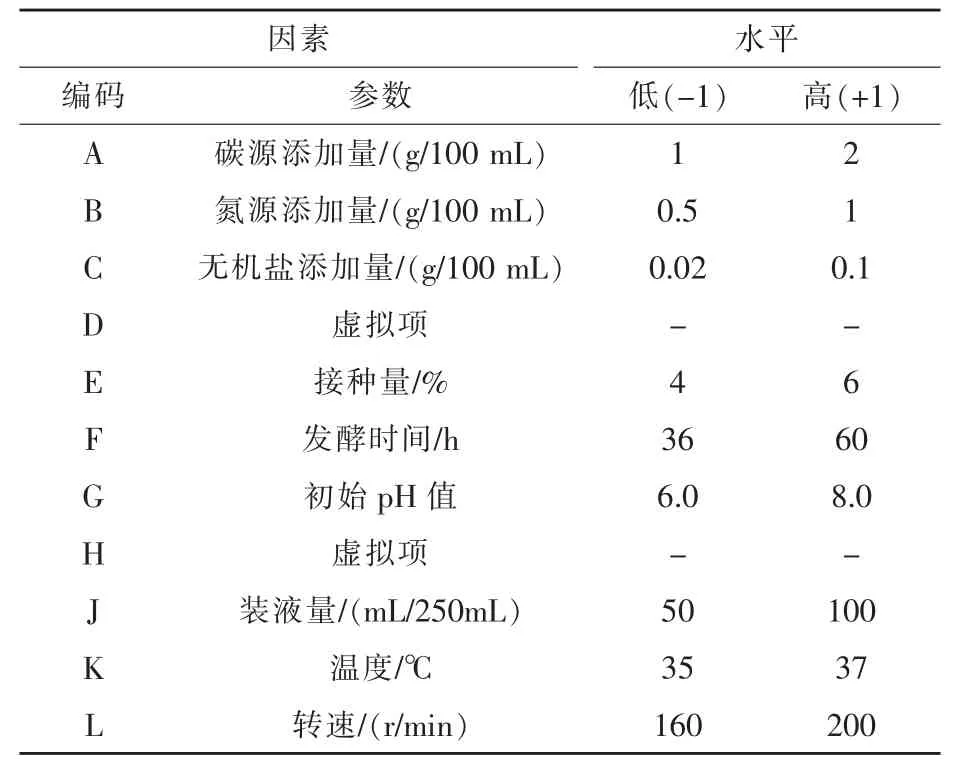
表1 Plackett-Burman试验因素及水平设置
1.6.2 最陡爬坡试验 最陡爬坡试验的起点设置在Plackett-Burman试验的较低水平,步长和上升路径根据Plackett-Burman试验得到的3个主效应因素的比例关系设定,最终确定最陡爬坡试验设计各因子的浓度范围。

表2 Plackett-Burman试验设计方案
1.6.3 响应面分析试验 菌株的产芽孢发酵条件采用响应面分析法中的Box-Behnken试验进行优化设计,根据试验数据拟合得到二阶响应面模型,得到最优试验条件,并进行验证(彭静珊等,2015)。利用Design-Expert 8.0统计分析软件处理和分析Plackett-Burman和Box-Behnken试验的设计结果(徐向宏和何明珠,2010)。
1.6.4 芽孢产量测定方法
芽孢产量=生物量×芽孢形成率;
生物量测定采用细菌计数板计数。芽孢形成率测定采用芽孢染色法(沈萍,1999)。
2 结果与分析
2.1 单因素试验
2.1.1 碳源对菌株芽孢产量的影响 如图1所示,当碳源为玉米粉时,菌株3X-10的芽孢产量达到最高值,为1.70×109cfu/mL。因此,选取玉米粉为菌株3X-10的最佳碳源。
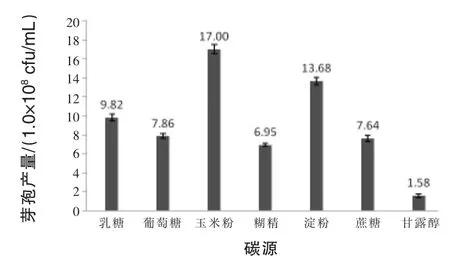
图1 碳源对菌株3X-10芽孢产量的影响
2.1.2 氮源对菌株芽孢产量的影响 氮源对菌株芽孢产量的影响见图2,当氮源为黄豆饼粉时,菌株3X-10的芽孢产量达到最高值,为1.52×109cfu/mL。因此,菌株3X-10的最适氮源选取黄豆饼粉。
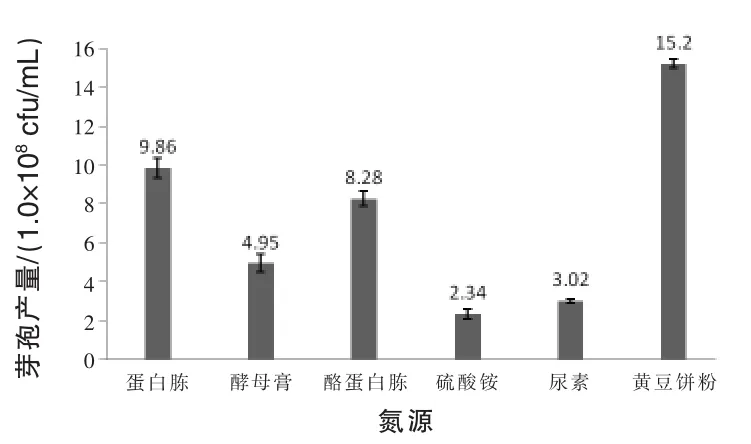
图2 氮源对菌株芽孢产量的影响
2.1.3 无机盐对菌株芽孢产量的影响 从图3可以看出,当无机盐选MgSO4·7H2O时,菌株芽孢产量达到1.61×109cfu/mL,同比其他无机盐种类芽孢产量最大,故菌株3X-10的最适无机盐被确定为MgSO4·7H2O。
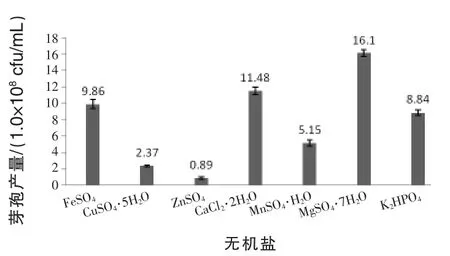
图3 无机盐对菌株芽孢产量的影响
2.2 发酵培养条件优化试验设计
2.2.1 Plackett-Burman试验结果 以芽孢产量为测定指标,对影响菌株培养基的重要因素进行筛选(徐向宏和何明珠,2010),菌株芽孢产量测定结果见表3,通过回归分析,对于菌株3X-10进行试验获得多元一次回归方程Y=12.82-0.46A-1.61B+0.52C+2.08E+5.65F-0.91G-2.33J+ 0.76K-1.10L,式中Y为芽孢产量预测值,A-L代表各因素编码水平。Plackett-Burman试验各因素参数主效应分析见表4,3X-10回归模型的P值为0.0152(P<0.05),由此说明株菌的模型在进行试验的全部回归区域内具有较好的拟合性。同时得出菌株 3X-10的发酵时间 (P= 0.0221)、装液量(P=0.0148)、接种量(P=0.0185)是主要影响因素,为后续爬坡路径试验以及响应面分析试验提供依据。
2.2.2 最陡爬坡试验 只有在临近最佳值的区域内,响应面拟合得出的方程才能最接近实际情况,因此有效的响应面拟合方程必须建立在最佳值区域内(贺强礼等,2016)。利用最陡爬坡试验测定影响菌株芽孢产量的3个主要因素的中心点。由表5可知,芽孢产量在发酵时间为60 h、装液量为60 mL/250 mL、接种量为5.6%时达到最大值,因此以此作为Box-Behnken试验的中心点。
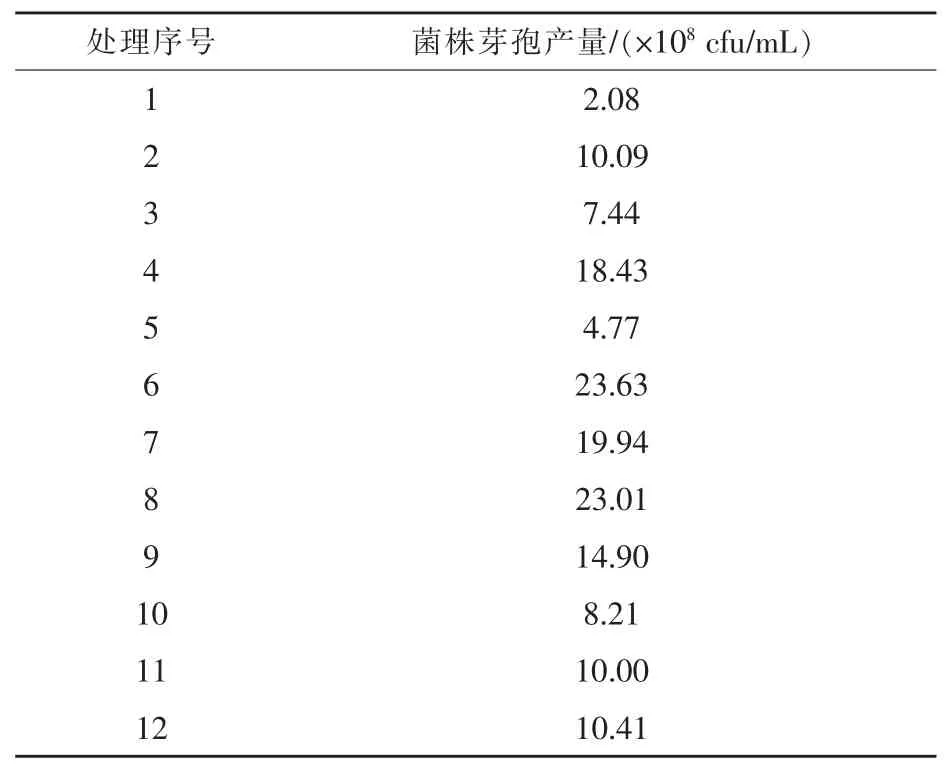
表3 Plackett-Burman试验结果
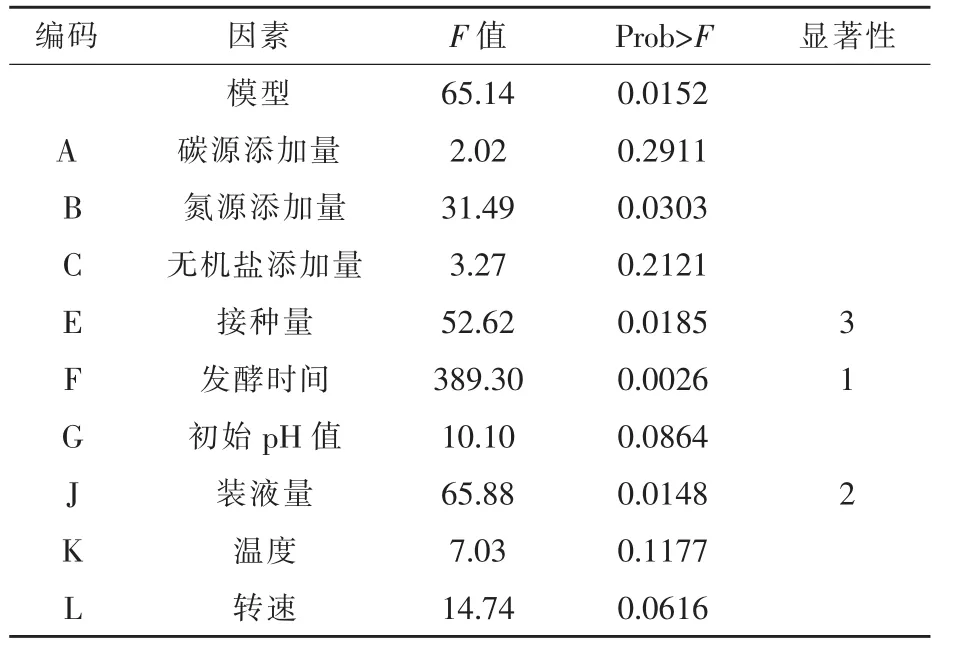
表4 Plackett-Burman试验各因素参数分析(菌株3X-10)
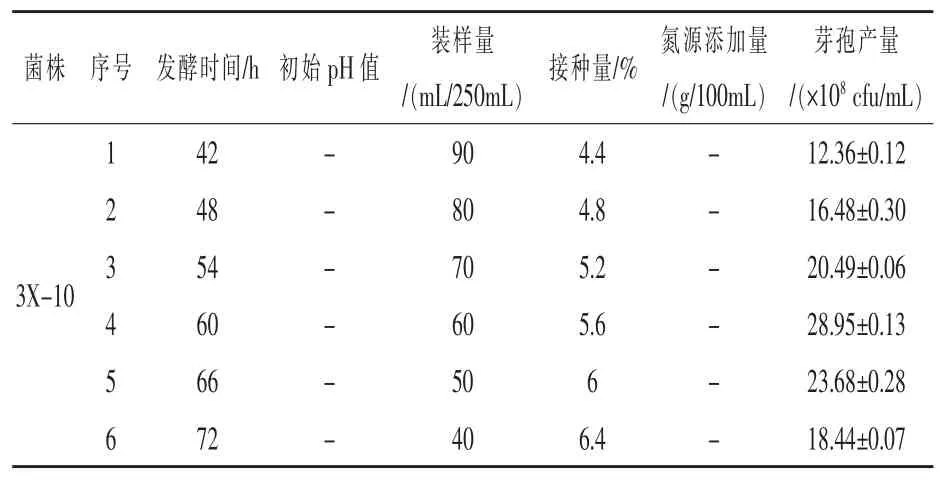
表5 最陡爬坡试验结果
2.2.3 响应面分析结果 响应面分析法是一种寻找多因子系统中最佳条件的数学统计方法,其中Box-Behnken和Central Composite中心组合设计是两种主要的响应面分析法 (RSA)(Ghatnur,2015)。本研究采用 Box-Behnken试验设计法(Ghatnur,2015;Ji等,2015)进行响应面分析,Box-Benhnken具体因子水平和编码值见表6,结果见表7。

表6 Box-Benhnken设计各因子及其编码值
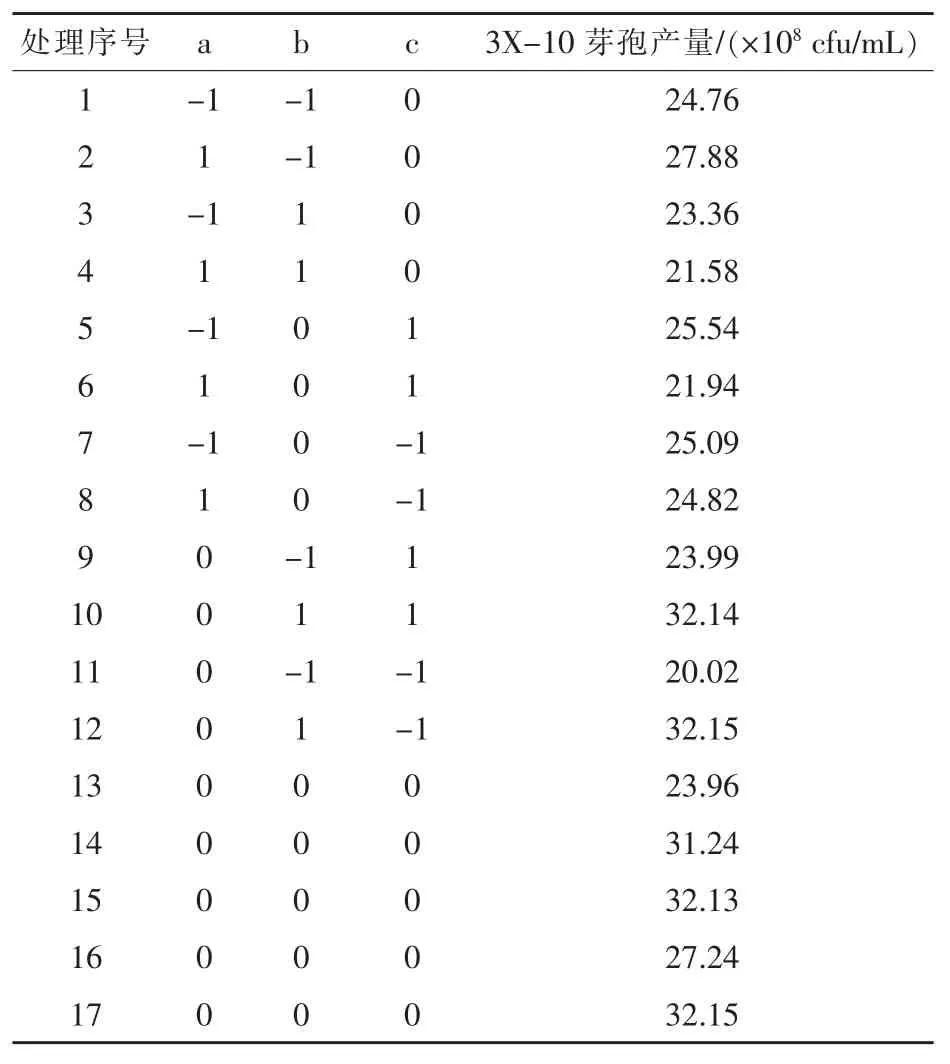
表7 Box-Behnken响应面优化试验结果
运用Design Expert 8.06软件对17个试验点的响应面值进行回归分析,结果见表8,获得芽孢产量对三主因素的二次多项式回归方程为:Y= 31.96+1.20A+1.44B+0.044C-0.58AB-0.055AC+ 0.67BC-2.26A2-5.56B2-3.73C2,式中 Y为菌株3X-10芽孢产量的预测值,A为接种量,B为发酵时间,C为装样量。
模型回归P值为<0.0001(P<0.01),失拟项P值为0.0686>0.05,说明回归方程的显著性和可靠性较高;因此模型可以用于菌株3X-10芽孢产量发酵优化的理论分析和预测。另外,二次响应面回归模型的R2值为0.9876,说明回归方程的拟合度较高,可用于芽孢产量的理论预测。
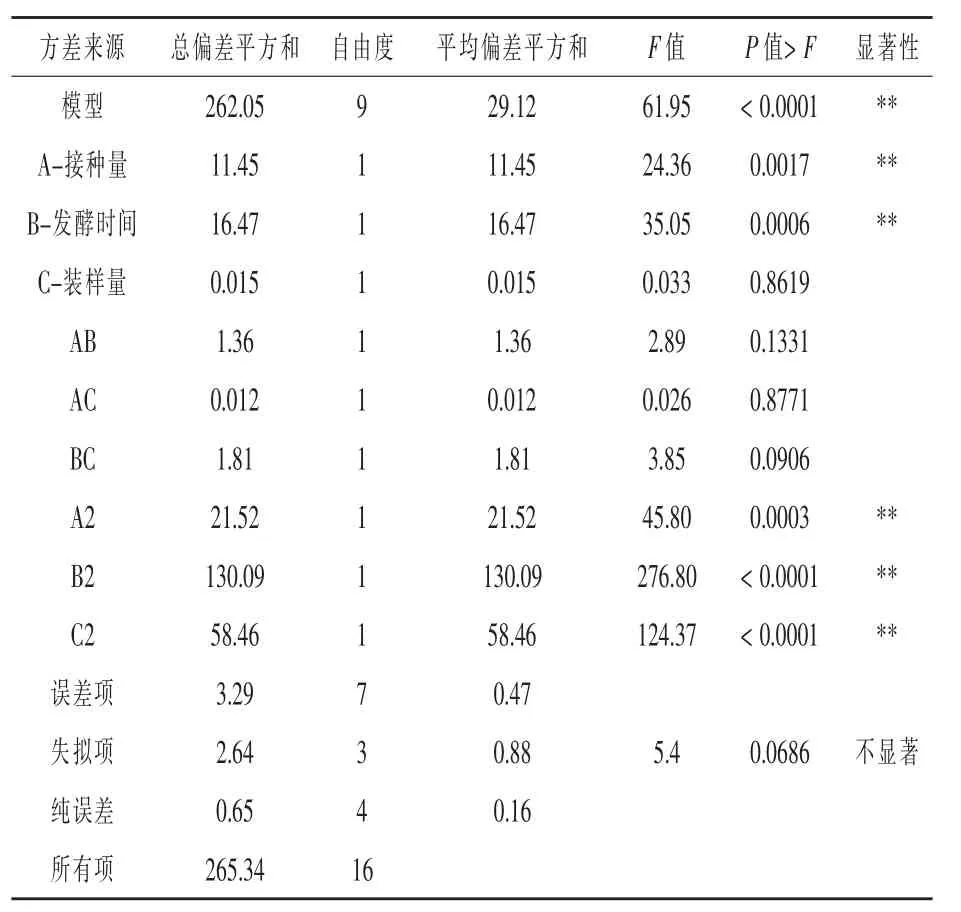
表8 3X-10菌株芽孢产量响应面试验的方差分析
通过上述拟合回归方程,通过Design Expert 8.06软件分析得到相应的响应面分析图和相应的等高图,即所选取的3个因素中各因素的交互作用见图4~图6。每个响应面分别代表2个独立变量之间的相互作用,此时第3个变量保持在0水平。等高线图越接近椭圆,说明这两个因素之间的交互作用越显著,反之,若等高线图接近圆形则说明这两个因素之间的交互作用不显著(陈涛等,2014)。
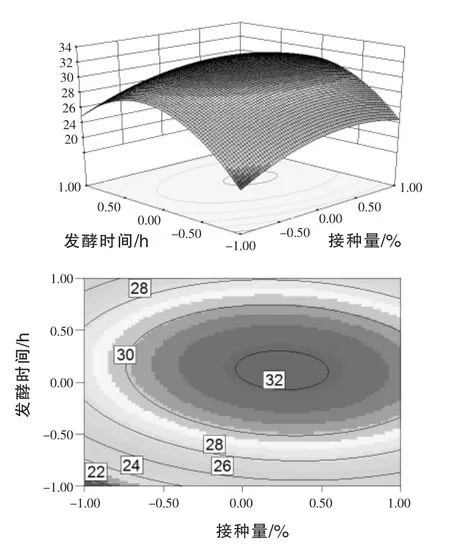
图4 接种量和发酵时间对3X-10菌株芽孢产量交互影响的三维曲面图和相应等高线图(装样量=0)
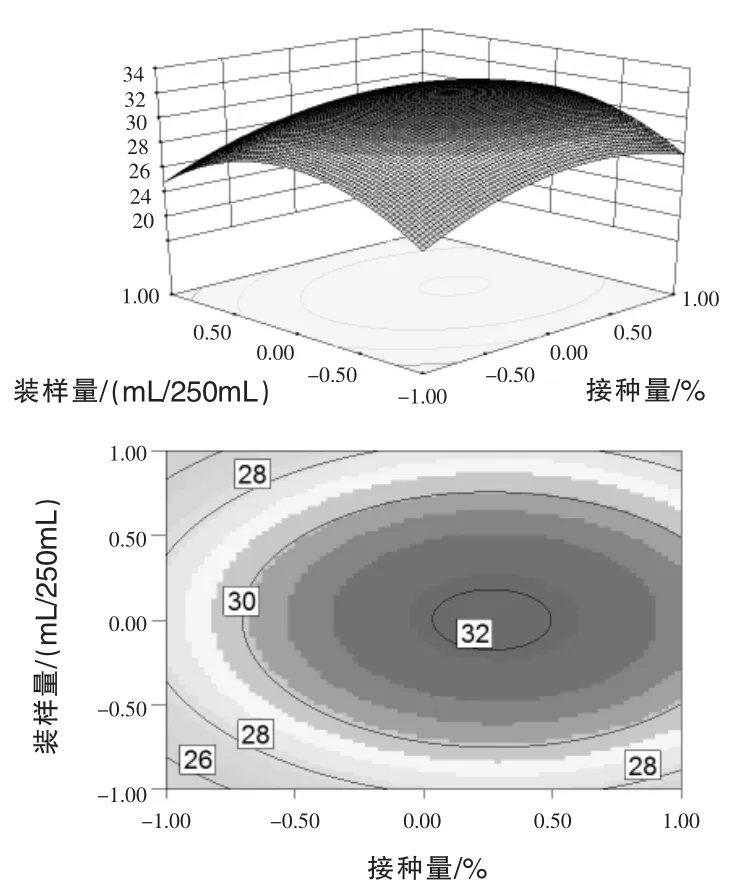
图5 接种量和装样量对3X-10菌株芽孢产量交互影响的三维曲面图和相应等高线图(发酵时间=0)
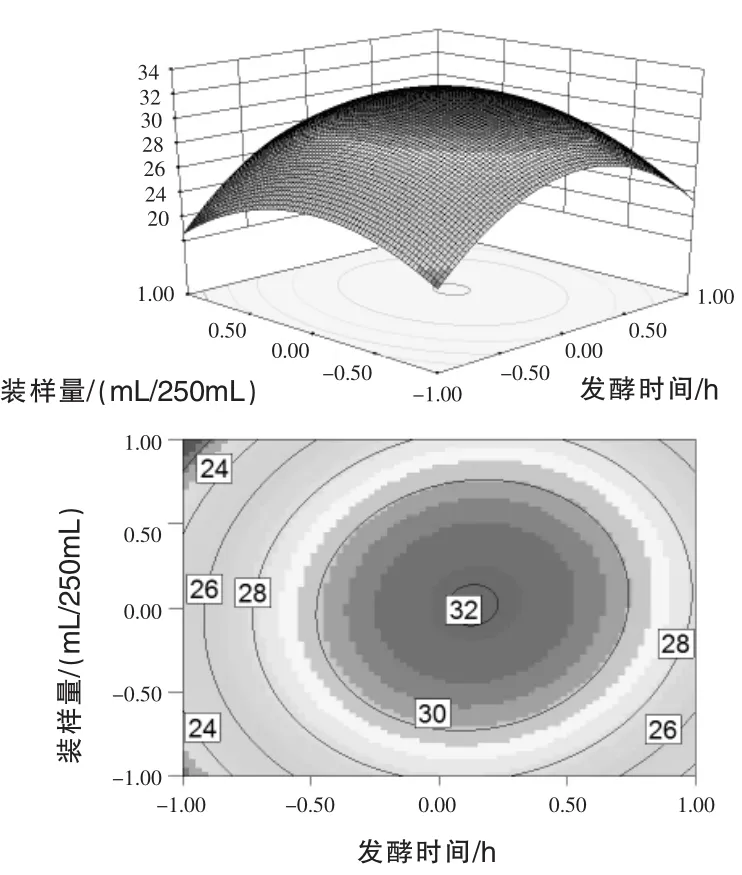
图6 发酵时间和装样量对3X-10菌株芽孢产量交互影响的三维曲面图和相应等高线图(接种量=0)
由此可知,发酵时间和装样量之间的交互作用最显著,图6的响应面立体显示的曲面顶点即为预测的菌株3X-10芽孢产量最大值,为32.20× 108cfu/mL,此时接种量为7.00%,发酵时间为67.20 h,取67 h,装样量为61.20 mL/250 mL,取61 mL/250 mL。对模型得出的产芽孢量最大值水平,进行6批次发酵试验验证,发酵产芽孢数平均值分别为(31.80±0.13)×108cfu/mL、(25.20±0.08)× 108cfu/mL、(32.22±0.20)×108cfu/mL,试验值与预测值相差甚微,它们之间较好的吻合性显示了各模型的精确性与可靠性。
3 讨论
与正交设计试验相比,响应面法优化菌株的产芽孢发酵条件,可以缩短试验用时,并且可以筛选理论上的最佳发酵条件(Chen等,2005)。此法可以在较短周期内利用较少的试验次数高精准地建立连续变量的曲面模型;还能对各影响因子水平及相互间的交互作用进行优化和评价(代志凯,2010)。王西祥等(2015)优化了枯草芽孢杆菌NS178的产芽孢发酵工艺,优化后菌落数和芽孢产率分别达到 34.50×108cfu/mL和 75.8%。Ben Khedher等使用响应面法对苏云金杆菌的发酵条件进行了优化(Ben Khedher等,2011)。印杨(2013)和刘清术 (2013)分别对巨大芽孢杆菌RB10和1013进行了发酵产芽孢优化,均获得显著效果,菌株1013的芽孢产量比基础培养提高了3.35倍。Luisa等(2015)利用响应面法对枯草芽孢杆菌菌株EA-CB0575产芽孢的培养基成分和培养基条件进行了优化,优化后芽孢产量达到8.78×109cfu/mL,相比优化前增加了17.2倍,较Plackett-Burman试验增加了1.9倍。
4 结论
本研究通过对菌株3X-10产芽孢发酵条件进行优化,确定当发酵时间为67 h,接种量为7%,装液量为61 mL/250 mL时菌株的芽孢产量最大,优化后菌株3X-10的芽孢产量比优化前增加2.99倍,效果显著。
[1]陈涛,张漫莉,李晶虹,等.响应面法优化重组枯草芽孢杆菌生产纤维素酶EGA的研究[J].浙江理工大学学报,2014,7:451~455.
[2]代志凯,张翠,阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报,2010,6:894~903.
[3]贺强礼,刘文斌,杨海君,等.一株苯酚降解菌的筛选鉴定及响应面法优化其降解[J].环境科学学报,2016,1:112~123.
[4]孔少元,吕纪涛,张冬冬,等.小麦全蚀病菌拮抗菌Bacillus methylotrophicus Z-9菌株产芽孢条件优化[J].河南农业科学,2016,1:88~91.
[5]刘清术,郭照辉,刘前刚,等.响应面法优化巨大芽胞杆菌发酵培养基[J].中国农学通报,2013,18:142~146.
[6]彭静珊,李宁浙,吴道艳,等.响应面法优化干酪乳杆菌试生产菌株T1发酵条件[J].草业与畜牧,2015,6:15~19.
[7]沈萍,范秀容,李广武.微生物学实验[M].第三版.北京:高等教育出版社,1999.
[8]王西祥,丁延芹,杜秉海,等.响应面法优化枯草芽孢杆菌NS178产芽孢发酵工艺[J].山东农业科学,2015,4:59~65.
[9]徐向宏,何明珠.实验设计与Design-Expert,SPSS应用[M].第一版.北京:科学出版社,2010,7.
[10]印杨,伊艳杰,李瑞芳,等.响应面法优化巨大芽孢杆菌RB10的发酵培养条件[J].生物技术,2013,2:84~88.
[11]张冬冬,高同国,朱宝成.小麦全蚀病生防芽孢杆菌产芽孢培养基的响应面法优化[J].麦类作物学报,2014,3:418~424.
[12]赵士萍,周敏,蒋林树.青贮饲料添加剂的研究进展[J].中国农学通报,2016,32(20):6~10.
[13]Aouadhi C,Simonin H,Maaroufi A,et al.Optimization of nutrient-induced germination of Bacillus sporothermodurans spores using response surface methodology[J].Food Microbiol,2013,36:320~326.
[14]Ben Khedher S,Kamoun A,Jaoua S,et al.Improvement of Bacillus thuringiensis bioinsecticide production by sporeless and sporulating strains using response surface methodology[J].New Biotechnology,2011,28(6):705~712.
[15]Ghatnur S M,Parvatam G,Balaraman M.Culture conditions for production of biomass,adenosine,and cordycepin from Cordyceps sinensis CS1197:optimization by desirability function method [J].Pharmacogn Magazine,2015,11(S3):448~456.
[16]Ji S,Li W,Xin H,et al.Improved production of sublancin 168 biosynthesized by Bacillus subtilis 168 using chemometric methodology and statistical experimental designs[J].Biomed Research International.2015:687915.
[17]Luisa F.Posada-Uribe,Magally Romero-Tabarez,et al.Effect of medium components and culture conditions in Bacillus subtilis EA-CB0575 spore production[J].Bioprocess and Biosystems Engineering,2015,38(10):1879~1888.
[18]Xin Chen,Yin Li,Guocheng Du,et al.Application of response surface methodology in medium optimization for spore production of Coniothyrium minitans in solid-state fermentation[J].World Journal of Microbiology and Biotechnology,2005,21,593~599.
This study was conducted to optimize the spore production fermentation conditions of strain 3X-10 producing Cellulase using the methods of single factor and Plackett-Burman(PB)combining with response surface methodology.On the basis of single factor,PB was used to screen and determine the main influential factors,and spore producing conditions were optimized by response surface analysis.Finally,fermentation time 67 h,inoculum density 7.00%and loading volum 61 mL/250 mL were determined as the optimum fermentation conditions.After optimizing,spore yield of 3X-10 increased by 2.99 times(from 8.07×108cfu/mL to 3.22×109cfu/mL).
Cellulase;Bacillus;optimization
S816.3
A
1004-3314(2017)10-0023-05
10.15906/j.cnki.cn11-2975/s.20171006
河北省重点研发计划农业关键共性技术攻关专项(16226604D);河北省技术创新引导计划科技型中小企业技术创新资金专项(15C1303121015);保定市科学技术研究与发展计划项目(16ZN007);沧州市科技支撑计划项目(161201007D)

