山葡萄花青素超高压提取工艺优化及其组分分析
杜月娇,贺 阳,文连奎
山葡萄花青素超高压提取工艺优化及其组分分析
杜月娇,贺 阳,文连奎*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
以‘双红’山葡萄为原料采用超高压法提取花青素,通过响应面法优化提取工艺,并应用高效液相色谱法分析‘双红’山葡萄水解液中花青素的种类及含量。结果表明:‘双红’山葡萄花青素最佳提取工艺参数为液料比8.5∶1(mL/g)、压力200 MPa、保压时间2 min,在此条件下,花青素得率最高为(0.304±0.007) g/100 g,较传统热浸提法(0.24±0.005) g/100 g提高了26.7%;‘双红’山葡萄花青素主要包括飞燕草素、矢车菊素、矮牵牛素、芍药素、锦葵素,含量分别为51.03、19.30、13.54、3.00、99.91 mg/100 g。高效液相色谱法分析花青素组分为‘双红’山葡萄色素的进一步开发利用提供理论依据。
山葡萄;花青素;超高压提取;组分分析
山葡萄(Vitis amurensis Rupr.)为葡萄科葡萄属植物,原产于中国东北、朝鲜和俄罗斯部分地区[1],具有种质资源丰富[2]、抗寒性强[3-4]、花青素含量高[5]的特点,主要品种有‘双优’、‘双红’、‘北冰红’等。
花青素又称花色素,属于生物类黄酮物质,是一种水溶性色素[6],主要分布于各种绿色植物的花、果实中[7],具有抗氧化、抗炎、缓解视疲劳等多项生理功能[8-11]。目前,存在于植物中的花青素主要有六大类:天竺葵色素、飞燕草色素、矢车菊色素、牵牛花色素、芍药色素和锦葵色素[12]。花青素传统提取方法主要有浸提法[13-14]、微波-超声波辅助提取法[15-18]、高压脉冲电场法[19-20]、超临界萃取法[21]。近几年,超高压法得到广泛应用[22],与其他方法相比,该法具有提取时间短、能耗低、有效成分提取率高的优点[23]。
至今为止,‘双红’山葡萄花青素的报道较少,赵权等[24-25]研究了双红果皮和酒中总花色苷、非花色苷酚的种类及含量,王新伟等[26]对双红果皮和种子原花青素动态含量进行了测定。本实验以‘双红’山葡萄为原料,采用超高压法提取‘双红’山葡萄花青素,通过响应面法确定最佳提取工艺参数,并应用高效液相色谱(high performance liquid chromatography,HPLC)鉴定‘双红’山葡萄水解液中花青素组分,为‘双红’山葡萄色素的深度开发提供依据。
1 材料与方法
1.1 材料与试剂
‘双红’山葡萄由吉林省通化市葡萄酒研究所提供,冻果,备用。
无水乙醇(色谱纯) 法国Cleman公司;甲酸、甲醇(均为色谱纯) 赛默飞世尔科技有限公司;盐酸(优级纯) 天津市光复精细化工研究所;飞燕草色素、矮牵牛色素、锦葵色素(纯度≥96%)、芍药素、矢车菊色素(纯度≥98%) 美国Chromadex公司;甲酸、甲醇、乙醇、浓盐酸均为国产分析纯。
1.2 仪器与设备
HPP600MPa/30L超高压食品处理装置 包头科发高压科技有限责任公司;SPX-250B-D振荡培养箱 上海博迅实业有限公司医疗设备厂;LXJ-IIB低速大容量多管离心机 上海安亭科学仪器厂;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;RE 5298A旋转蒸发器 上海亚荣生化仪器厂;Ultimate 3000 HPLC仪 赛默飞世尔科技有限公司。
1.3 方法
1.3.1 ‘双红’山葡萄花青素超高压提取
室温条件下,取‘双红’山葡萄,解冻、打浆,精确称取一定量‘双红’山葡萄浆,将其与提取剂(65%乙醇-1%盐酸溶液)混匀装入真空包装袋,封口,放入超高压设备中进行提取,经快速升压及瞬时降压,样品温度(20±1)℃无明显变化,提取后,用提取剂定容至相同体积,离心,取其上清液测吸光度。
1.3.2 单因素试验设计
1.3.2.1 液料比对‘双红’山葡萄花青素提取效果的影响
固定提取压力200 MPa,保压时间3 min,液料比设计为5∶1、7∶1、9∶1、11∶1、13∶1(mL/g),以花青素提取液吸光度为评价指标,研究液料比对‘双红’山葡萄花青素提取效果的影响。
1.3.2.2 压力对‘双红’山葡萄花青素提取效果的影响
固定液料比9∶1(mL/g),保压时间3 min,压力设计为100、150、200、250、300 MPa,以花青素提取液吸光度为评价指标,研究压力对‘双红’山葡萄花青素提取效果的影响。
1.3.2.3 保压时间对‘双红’山葡萄花青素提取效果的影响
固定液料比9∶1(mL/g),压力200 MPa,保压时间分别为1、2、3、4、5 min,以花青素提取液吸光度为评价指标,研究保压时间对‘双红’山葡萄花青素提取效果的影响。
1.3.3 响应面优化试验设计
在单因素试验基础上,确定液料比、压力、保压时间的取值范围,进行Box-Behnken试验设计,因素水平见表1。以‘双红’山葡萄花青素提取液吸光度为响应值,利用Design-Expert 7.0软件对数据进行分析,得出超高压法提取‘双红’山葡萄花青素的最佳工艺条件。
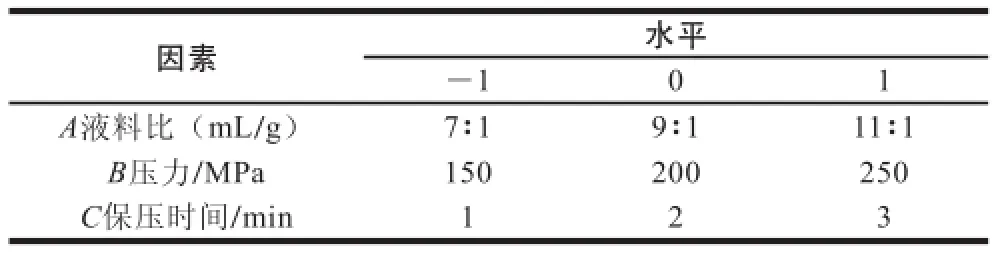
表 1 响应面试验因素与水平Table 1 Factors and levels used in Box-Behnken design for response surface analysis
1.3.4 ‘双红’山葡萄花青素热浸提
采用最佳提取条件,精确称取一定量的‘双红’山葡萄浆液,加入一定量的65%乙醇-1%盐酸溶液,在55 ℃条件下,以100 r/min振荡提取30 min,用提 取 剂定容至相同体积后离心,取上清液测其吸光度。
1.3.5 花青素含量的测定
参照国食健字G20130303中直接分光光度法测定花青素含量,并稍作修改,精确称取矢车菊素-3-O-葡萄糖苷标准品5 mg,用0.1%盐酸-80%乙醇(15∶85,V/V)混合液溶解并定容至5 mL,配制成1 mg/mL的标准溶液,测定该标准溶液于535 nm波长处测定吸光度A标。按下式计算花青素得率:
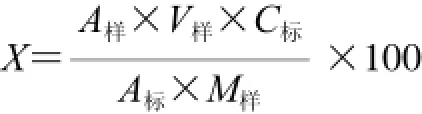
式中:X为‘双红’山葡萄花青素得率/(g/100 g);A样为样品溶液吸光度;V样为样品溶液总体积/mL;C标为标准溶液质量浓度/(mg/mL);A标为标准溶液吸光度;M样为样品质量/mg。
1.3.6 HPLC法分析‘双红’山葡萄花青素组成成分1.3.6.1 花色苷水解
参照NY/T 2640—2014《植物源性食品中花青素的测定》中的HPLC法,取响应面优化最佳条件下提取的花青素液,加入浓盐酸,在90 ℃条件下水浴1 h,取出冷却后,用提取液定容至25 mL,经0.45 μm微孔滤膜过滤后用于HPLC分析。
1.3.6.2 标准品溶液的制备
分别精确称取花青素标准品1 mg,溶解于1 mL溶剂(1%盐酸-甲醇溶液)中,配制成1 mg/mL的母液,取适量花青素标准品母液进行混合,再用1%盐酸-甲醇溶液稀释成不同质量浓度的标准使用液。以标准品质量浓度X为横坐标,峰面积Y为纵坐标制作标准曲线。
1.3.6.3 色谱条件
色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5 μm);流动相A为2%甲酸-水(V/V)溶液;流动相B为甲醇;采用UV-VIS紫外检测器检测,检测波长530 nm;流速1.0 mL/min;柱温35 ℃;进样量20 μL,梯度洗脱见表2。
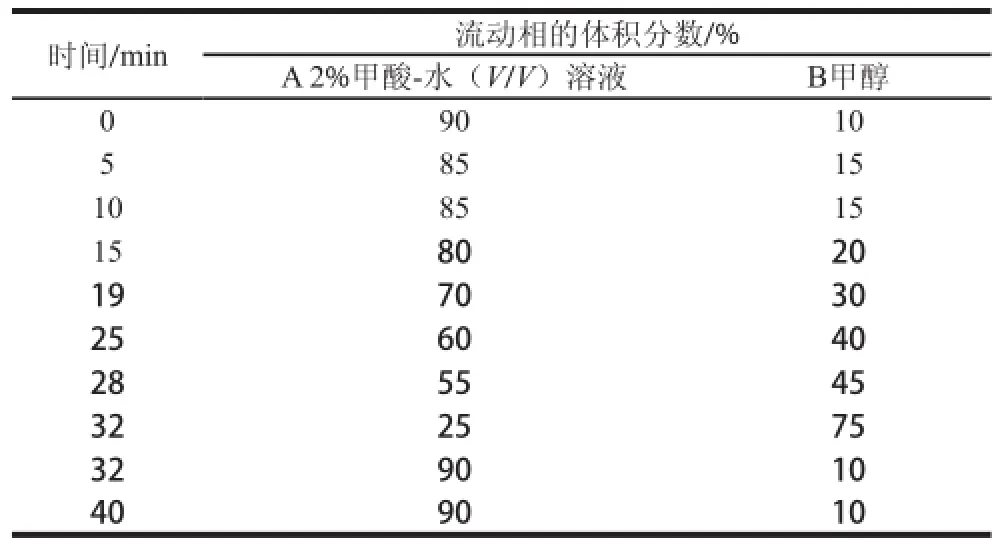
表 2 梯度洗脱程序Table 2 Gradient elution procedure
2 结果与分析
2.1 单因素试验结果
2.1.1 液料比对‘双红’山葡萄花青素提取效果的影响
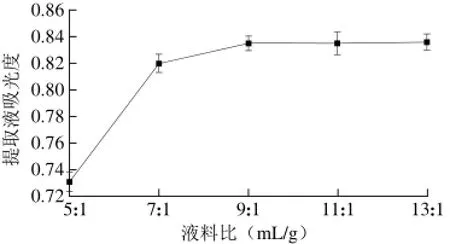
图 1 液料比对花青素提取效果的影响Fig. 1 Effects of liquid to solid ratio on the yield of anthocyanins
由图1可知,当液料比在5∶1~9∶1(mL/g)范围内,提取液吸光度随液料比的增加逐渐升高,液料比在9∶1 (mL/g)时,提取效果最佳,在9∶1~13∶1(mL/g)范围内,吸光度小幅度下降后维持稳定。考虑到提高液料比不但会增加不必要的溶剂成本,还会给后续浓缩提纯带来不便,因此,选择液料比为7∶1、9∶1、11∶1(mL/g)进行响应面试验。
2.1.2 压力对‘双红’山葡萄花青素提取效果的影响
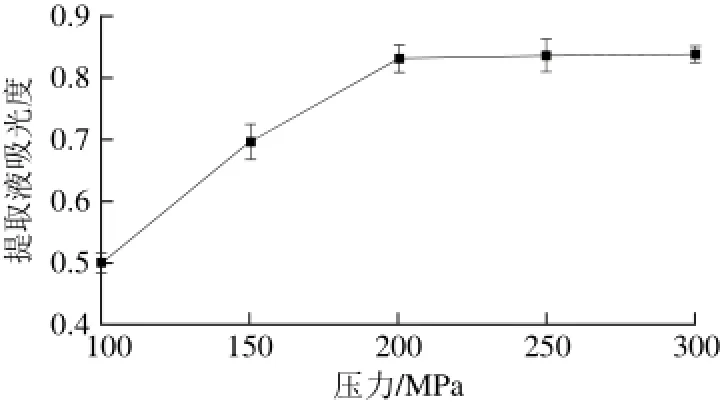
图 2 压力对花青素提取效果的影响Fig. 2 Effect of pressure on the yield of anthocyanins
由图2可知,压力在100~200 MPa范围内,提取液吸光度随压力的增加而增加,当压力升至200 MPa时,吸光度达到最大,压力再升高,吸光度并没有显著变化,原因可能是压力增加,使细胞内外渗透压增大,促进有效成分溶出,当压力增加至200 MPa时,有效成分已充分溶出并在溶剂内达到饱和状态,此后再增大压力,提取液吸光度不会有显著变化[27],因此,选择压力为150、200、250 MPa进行响应面试验。
2.1.3 保压时间对‘双红’山葡萄花青素提取效果的影响
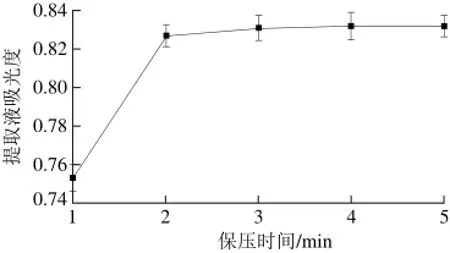
图 3 保压时间对花青素提取效果的影响Fig. 3 Effect of pressure-holding time on the yield of anthocyanins
由图3可知,保压时间在1~3 min范围内,提取液吸光度随时间延长而增加,3 min时,提取液吸光度达到最大,当保压时间在3~5 min 范围内,吸光度基本不变,说明此时系统已达到平衡状态,延长保压时间,有效成分不会向周围扩散,体现在提取液吸光度再无明显升高,因此,保压时间选择1、2、3 min进行响应面试验。
2.2 响应面优化试验结果及方差分析
2.2.1 响应面试验结果
结合单因素试验结果,选取对花青素提取液吸光度影响显著的3个因素液料比(A)、压力(B)和保压时间(C),采用三因素三水平的Box-Behnken试验设计及分析方法进行提取条件的优化,试验设计方案及结果见表3。
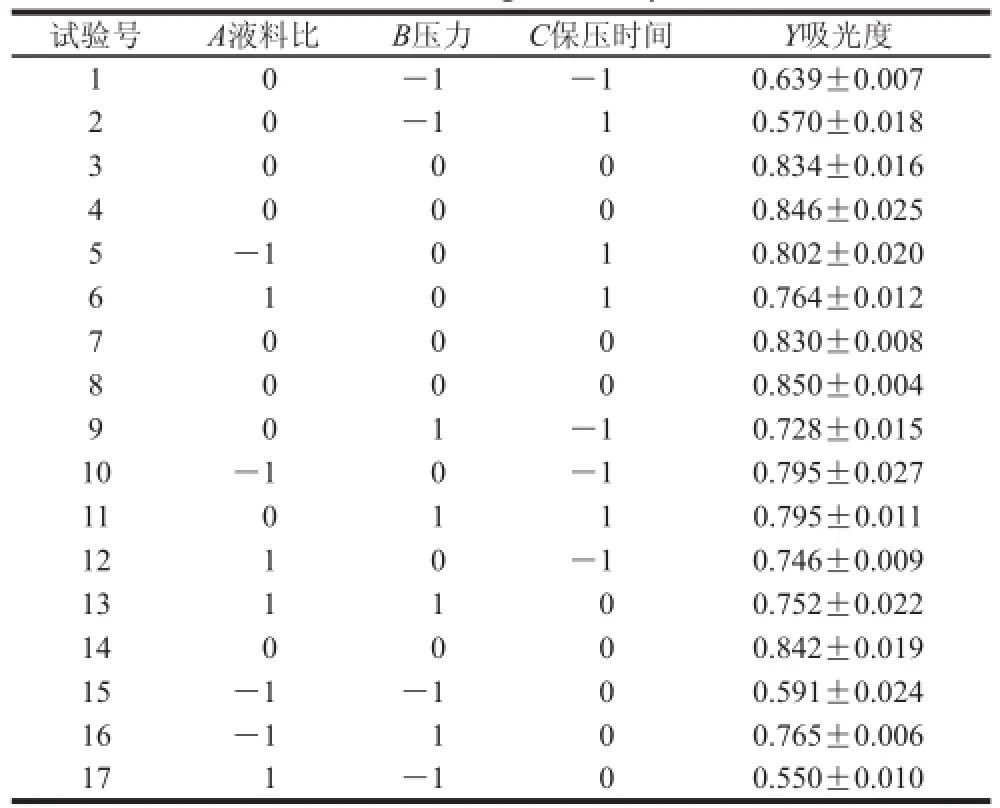
表 3 Box-Behnken试验设计及结果Table 3 Box-Behnken design with experimental results
利用Design-Expert 7.0.0软件对表3试验数据进行线性拟合,获得花青素提取液吸光度(Y)对液料比(A)、压力(B)、保压时间(C)的二次回归模型方程为:Y0.84-0.018A+0.086B+2.875×10-3C+7.000×10-3AB+ 2.750×10-3AC+0.034BC-0.041A2-0.13B2-0.023C2
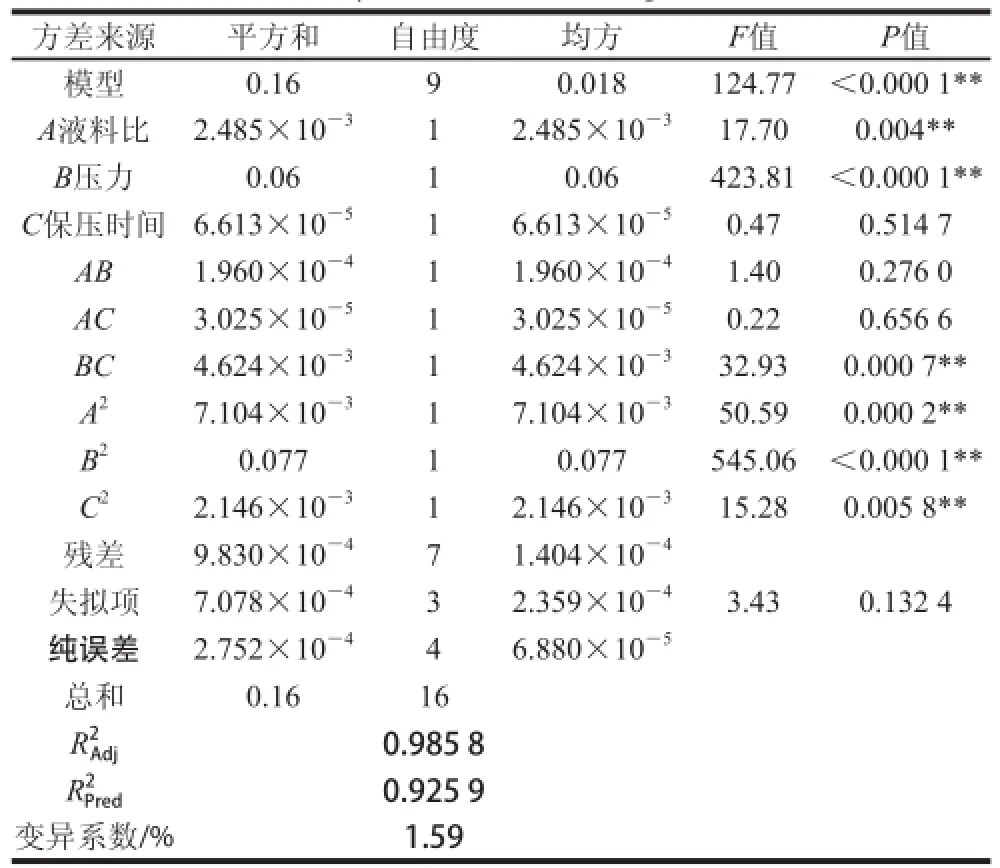
表 4 回归模型方差分析Table 4 Analysis of variance of regression model
如表4所示,回归模型极显著(P<0.01),失拟项不显著(P0.132 4>0.05),表明回归方程拟合程度良好,未知因素对试验模型影响较小;决定系数R2为0.993 8,调整决定系数0.985 8均说明该模型可信度较高;为0.925 9,说明该模型预测性良好。由表4可知,一次项A对提取效果影响极显著(P<0.01),B对提取效果影响极显著(P<0.01),而C对提取效果影响不显著(P>0.05)。从F值可知,以上三因素对花青素提取效果影响的顺序为:B压力>A液料比>C保压时间。
两因素交互作用中,BC对提取效果影响极显著(P<0.01),AB、AC对提取效果的影响不显著(P>0.05)。二次项A2、B2、C2对提取效果均有极显著影响(P<0.01),进一步说明各具体试验因素对响应值的影响不是简单的线性关系。
2.2.2 响应面分析
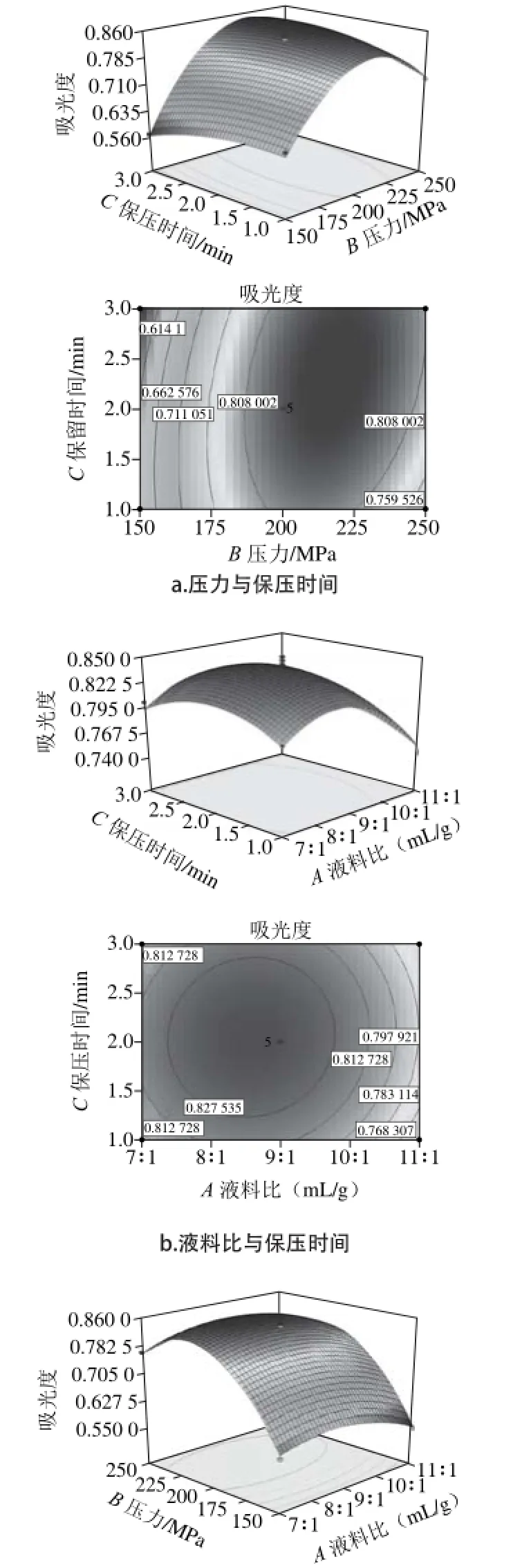
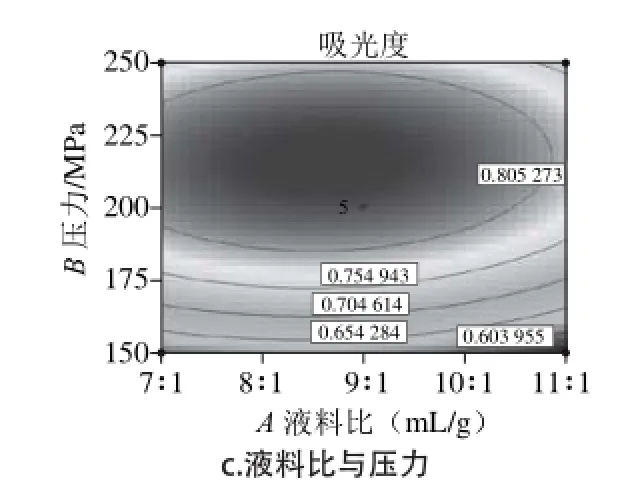
图 4 各交互因素对花青素提取量影响的响应面及等高线图Fig. 4 Response surface plots showing the effects of interaction between various factors on the yield of anthocyanins
如图4所示,在压力、液料比方向的坡面较陡,表明压力、液料比对花青素提取效果影响较为显著,随着压力和液料比的增加,提取液吸光度呈现先升高后下降的趋势,并在200 MPa、9∶1(mL/g)附近,提取液吸光度最高。随着保压时间的延长,提取液吸光度也呈现先升高后降低的趋势,但吸光度升高的趋势不明显,表现为保压时间方向的坡面较平滑,说明保压时间对花青素提取效果影响不显著。压力和保压时间等高线图呈椭圆形,说明两者交互作用明显,而液料比和保压时间的等高线图接近圆形,说明两者交互作用不明显。
2.2.3 最佳工艺条件及验证
经Design-Expert 7.1.3分析得到的预测工艺条件为液料比8.65∶1(mL/g)、保压时间2.32 min、压力217.82 MPa,预测吸光度为0.857,得率为0.294 g/100 g。根据实际操作,对工艺条件进行规范化处理,在温度为室温,液料比8.5∶1(mL/g)、保压时间2 min、压力200 MPa条件下花青素提取液吸光度为0.886±0.021,实际得率为(0.304±0.007) g/100 g,与预测理论值接近,说明此模型有效且优化结果可靠。
2.3 超高压法与热浸提法提取‘双红’山葡萄花青素的比较
按照1.3.4节方法提取‘双红’山葡萄花青素提取时间为30 min,得率为(0.240±0.005) g/100 g,而超高压法提取花青素提取时间仅为2 min,得率为(0.304± 0.007) g/100 g,较热浸提法提高了26.7%,可见,超高压法不仅缩短了提取时间,还提高了花青素得率。
2.4 HPLC分析结果

表 5 花青素标准品标准曲线、相关系数、线性范围Table 5 Standard curves, correlation coefficients and linear ranges for five anthocyanin standards
分别将5 个花青素标准品的质量浓度X(μg/mL)与峰面积Y进行线性回归分析,如表5所示,相关系数均达到0.999,说明花青素的质量浓度与峰面积的线性关系良好。
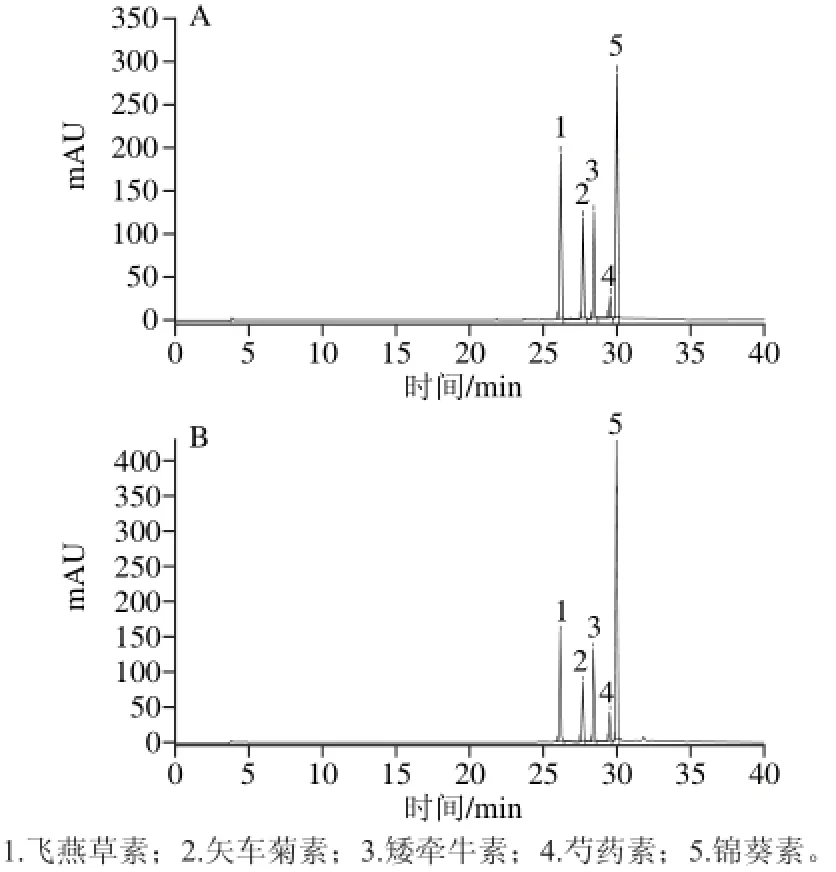
图 5 5 种花青素标准品(A)和‘双红’山葡萄花青素(B)的HPLC图谱Fig. 5 HPLC chromatograms of mixture of five anthocyanin standards and anthocyanins in ‘Shuanghong’ Amur grapes
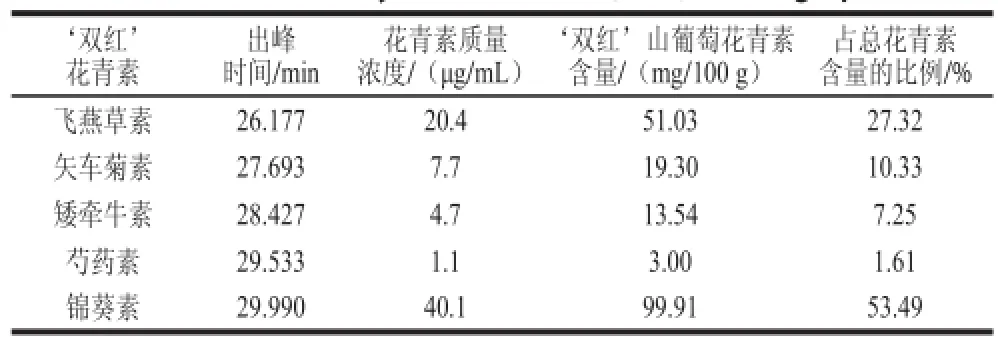
表 6 ‘双红’山葡萄花青素出峰时间、质量浓度、含量及比例Table 6 Peak time, mass concentration, and total and individual contents of anthocyanins in ‘Shuanghong’ Amur grapes
由图5及表5、6的出峰时间可判断,图5B中出现的5 个峰依次是飞燕草素、矢车菊素、矮牵牛素、芍药素、锦葵素,对应含量分别为51.03、19.30、13.54、3.00、99.91 mg/100 g,总计186.78 mg/100 g。由此可知,‘双红’山葡萄所含5 种花青素,锦葵素含量最高,占53.49%,其次为飞燕草素,占27.32%,矢车菊素占10.33%,矮牵牛素占7.25%,含量最少为芍药素,仅占1.61%。
3 讨论与结论
花青素基本结构单元为α-苯基苯并吡喃型阳离子,由于B环各碳位的取代基不同(羟基或甲氧基),形成不同种类的花青素[28],花青素上的羟基被糖基取代,形成各种各样的花色苷[29]。欧亚种葡萄中的花色苷主要由5 种花青素单体组成,分别为花翠素、花青素、甲基花翠素、甲基花青素和二甲花翠素[30],因此,本实验选择以上5 种标准品鉴定‘双红’山葡萄花青素,经HPLC分析共出现5 个特征峰,峰形良好,并无杂峰,与上述结果一致。但赵权等[24]研究指出‘双红’山葡萄果皮中检测出13 种花色苷,其中花青素类2 种,花翠素类2 种,甲基花青素类3 种,甲基花翠素类3 种,二甲花翠素类2 种,还检测到1 种花葵素类花色苷,表明‘双红’山葡萄中含有花葵素,产生这种差异的原因可能是原料来源不同、果实采摘时期不同,导致‘双红’山葡萄花青素种类存在差异,也可能是由于花青素不稳定[31],在提取过程中,某类花青素B环上的取代基发生改变,产生花葵素类花色苷。
本研究在单因素试验结果的基础上,经响应面试验优化,确定各因素对花青素提取效果影响的主次顺序为压力>液料比>保压时间;超高压法提取花青素的最佳工艺条件为液料比8.5∶1(mL/g)、压力200 MPa、保压时间2 min,该条件下花青素得率为(0.304±0.007) g/100 g,较传统热浸提法得率提高26.7%;应用HPLC鉴定‘双红’山葡萄花青素主要包括五类,含量由高至低依次为锦葵素99.91 mg/100 g、飞燕草素51.03 mg/100 g、矢车菊素19.30 mg/100 g、矮牵牛素13.54 mg/100 g、芍药素3.00 mg/100 g。
[1] 葛玉香, 沈育杰, 李晓红, 等. 山葡萄种质资源评价与利用研究现状[J]. 中外葡萄与葡萄酒, 2000(4): 16-20. DOI:10.13414/j.cnki. zwpp.2000.04.006.
[2] 李晓艳, 杨义明, 范书田, 等. 山葡萄种质资源收集、保存、评价与利用研究进展[J]. 河北林业科技, 2014(5/6): 115-121. DOI:10.16449/ j.cnki.issn1002-3356.2014.z1.057.
[3] LI Jitao, WANG Nian, XIN Haiping, et al. Overexpression of VaCBF4, a transcription factor from Vitis amurensis, improves cold tolerance accompanying increased resistance to drought and salinity in Arabidopsis[J]. Plant Molecular Biology Reporter, 2013, 31(6): 1518-1528. DOI:10.1007/s11105-013-0627-7.
[4] WU Jiao, ZHANG Yali, ZHANG Huiqin, et al. Whole genome wide expression profiles of Vitis amurensis grape responding to downy mildew by using solexa sequencing technology[J]. BMC Plant Biology, 2010, 10: 234. DOI:10.1186/1471-2229-10-234.
[5] 崔长伟, 刘丽媛, 王华, 等. 山葡萄综合开发利用研究进展[J].食品科学, 2015, 36(13): 276-282. DOI:10.7506/spkx1002-6630-201513051.
[6] 钟兰兰, 屠迪, 杨亚, 等. 花青素生理功能研究进展及其应用前景[J]. 生物技术进展, 2013, 3(5): 346-352. DOI:10.3969/ j.issn.2095-2341.2013.05.07.
[7] 徐春明, 庞高阳, 李婷. 花青素的生理活性研究进展[J]. 中国食品添加剂, 2013(3): 205-210. DOI:10.3969/j.issn.1006-2513.2013.03.028.
[8] BOIVIN D, BLANCHETTE M, BARRETTE S. Inhibition of cancer cell proliferation and suppression of TNF-induced activation of NF kappa B by edible berry juice[J]. Anticancer RES, 2007, 27(2): 37-48. DOI:10.1006/jabr.1996.0233.
[9] 邹宇晓, 刘学铭, 廖森泰, 等. 荔枝壳花青素对大鼠佐剂性关节炎的治疗作用研究[J]. 营养学报, 2010, 32(3): 257-260. DOI:10.13325/ j.cnki.acta.nutr.sin.2010.03.012.
[10] 陈玮, 凌文华, 李茂全, 等. 黑米花青素在大鼠视网膜光化学损伤中的抗氧化作用研究[J]. 营养学报, 2010, 32(4): 341-344; 349. DOI:10.13325/j.cnki.acta.nutr.sin.2010.04.020.
[11] 孙晓, 王正, 阮杰, 等. 紫甘薯花青素对LPS致炎小鼠学习记忆能力的保护作用[J]. 医学研究杂志, 2011, 40(11): 111-113. DOI:10.3969/ j.issn.1673-548X.2011.11.035.
[12] 王秋霜, 凌彩金, 刘淑媚, 等. 花青素分离纯化及其组分鉴定研究进展[J]. 食品工业科技, 2013, 34(3): 358-364. DOI:10.13386/ j.issn1002-0306.2013.03.054.
[13] 潘利华, 王建飞, 叶兴乾, 等. 蓝莓花青素的提取工艺及其免疫调节活性[J]. 食品科学, 2014, 35(2): 81-86. DOI:10.7506/spkx1002-6630-201402015.
[14] 陈健, 孙爱东, 高雪娟, 等. 蓝莓花青素的提取及抗氧化性的研究[J].北京林业大学学报, 2011, 33(2): 126-129. DOI:10.13332/j.1000-1522.2011.02.015.
[15] 杨华, 赖青青, 陈林松, 等. 采用微波辅助提取紫甘薯色素的工艺研究[J]. 食品工业科技, 2009, 20(4): 282-284. DOI:10.13386/ j.issn1002-0306.2009.04.067.
[16] 裴志胜, 张海德, 袁腊梅, 等. 超声-微波协同萃取紫参薯花青素工艺[J].食品科学, 2012, 33(2): 78-83.
[17] 李新莹, 姚舜. 响应面法优化甘蔗梢提取物中花青素的分离工艺[J]. 食品科学, 2015, 36(2): 7-11. DOI:10.7506/spkx1002-6630-201502002.
[18] FANG Chen, YANG Zhaosun, GUANG Huazhao, et al. Optimization of ultrasound-assisted extraction of anthocyanins in red raspberries and identication of anthocyaninsin extract using high-performance liquid chromatography-mass spectrometry[J]. Ultrasonics Sonochemistry, 2007, 14(6): 767-778. DOI:10.1016/j.ultsonch.2006.12.011.
[19] 张燕, 徐茜, 王婷婷, 等. 不同工艺提取树莓花青素的品质比较[J]. 食品与发酵工业, 2011, 37(6): 201-205. DOI:10.13995/ j.cnki.11-1802/ts.2011.06.010.
[20] PUÉRTOLAS E, CREGENZÁN O, LUENGO E, et al. Pulsedelectric- eld-assisted extraction of anthocyanins from purple- eshed potato[J]. Food Chemistry, 2013, 136(3/4): 1330-1336. DOI:10.1016/ j.foodchem.2012.09.080.
[21] LAROZE L E, DÍAZ-REINOSO B, MOURE A, et al. Extraction of antioxidants from several berries pressing wastes using conventional and supercritical solvents[J]. European Food Research and Technology, 2010, 231(5): 669-677. DOI:10.1007/s00217-010-1320-9.
[22] 岳亚楠, 岳田利, 袁亚宏. 超高压提取苹果渣中多酚的研究[J].西北农林科技大学学报, 2013, 41(3): 179-186. DOI:10.13207/j.cnki. jnwafu.2013.03.008.
[23] 江东文, 黄佳佳, 杨公明, 等. 响应面法优化超高压辅助提取茶多酚的工艺研究[J]. 现代食品科技, 2013, 29(6): 1316-1320. DOI:10.13982/j.mfst.1673-9078.2013.06.035.
[24] 赵权. 不同品种山葡萄果皮中花色苷种类及含量比较[J]. 湖北农业科学, 2015, 54(13): 3171-3173. DOI:10.14088/j.cnki.issn0439-8114.2015.13.026.
[25] 赵权, 王军, 杨成君. 不同品种山葡萄果皮和酒中非花色苷酚的成分分析[J]. 东北林业大学学报, 2012, 40(3): 72-78. DOI:10.13759/ j.cnki.dlxb.2012.03.015.
[26] 王新伟, 秦红艳, 赵滢, 等. 山葡萄种质资源原花青素分布及其含量动态变化[J]. 北方园艺, 2011(11): 12-16.
[27] 高峰, 张守勤, 刘静波, 等. 超高压技术提取北虫草多糖的工艺研究[J]. 食品科学, 2009, 30(16): 41-43. DOI:10.3321/ j.issn:1002-6630.2009.16.002.
[28] 王锋, 邓洁红, 谭兴和, 等. 花色苷及其共色作用研究进展[J]. 食品科学, 2008, 29(2): 472-476. DOI:10.3321/j.issn:1002-6630.2008.02.104.
[29] 孙磊, 樊秀彩, 张颖, 等. 部分中国野生葡萄果皮花色苷组分分析[J].果树学报, 2015, 32(6): 1143-1151. DOI:10.13925/j.cnki.gsxb.20150140. [30] 李华, 王华, 袁春龙, 等. 葡萄酒化学[M]. 北京: 科技出版社, 2005: 106-110.
[31] GIUSTI M M, WROLSTAD R E. Acylated anthocyanins from edible sources and their applications in food systems[J]. Biochemical Engineering Journal, 2003, 14(3): 217-225. DOI:10.1016/S1369-703X(02)00221-8.
Optimization of Ultra-High Pressure Extraction of Anthocyanins from Vitis amurensis Rupr. and Analysis of Its Anthocyanin Composition
DU Yuejiao, HE Yang, WEN Liankui*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The fruits of Vitis amurensis cv. ‘Shuanghong’ were extracted using ultra-high pressure technique to obtain anthocyanins. The extraction process was optimized by response surface methodology. High performance liquid chromatography (HPLC) was applied to analyze the types and contents of anthocyanidins. The optimal extraction parameters that provided maximum yield of anthocyanins of (0.304±0.007) g/100 g were determined as follows: liquid/material ratio of 8.5:1 (mL/g), extraction pressure of 200 MPa and pressure-holding time of 2 min, which was 26.7% higher than that ((0.24±0.005) g/100 g) obtained with the traditional heat extraction method. The anthocyanins in Amur grapes mainly included delphinidin, cyanidin, petunidin, peonidin and malvidin. Their contents were 51.03, 19.30, 13.54, 3.00, and 99.91 mg/100 g, respectively. The HPLC analysis of anthocyanins components provided a theoretical basis for further development and utilization of pigment from Vitis amurensis.
Vitis amurensis; anthocyanins; ultra-high pressure extraction; component analysis
10.7506/spkx1002-6630-201710042
TS255.1
A
1002-6630(2017)10-0258-06
杜月娇, 贺阳, 文连奎. 山葡萄花青素超高压提取工艺优化及其组分分析[J]. 食品科学, 2017, 38(10): 258-263.
DOI:10.7506/spkx1002-6630-201710042. http://www.spkx.net.cn
DU Yuejiao, HE Yang, WEN Liankui. Optimization of ultra-high pressure extraction of anthocyanins from Vitis amurensis Rupr. and analysis of its anthocyanin composition[J]. Food Science, 2017, 38(10): 258-263. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201710042.http://www.spkx.net.cn
2016-10-27
杜月娇(1991—),女,硕士研究生,研究方向为食品生物化学工程与功能性食品。E-mail:923809229@qq.com
*通信作者:文连奎(1962—),男,教授,博士,研究方向为长白山野生资源开发。E-mail:wenliankui@163.com

