UPLC和Q-Exactive高分辨质谱仪联用鉴定大黄鱼中的甘油三酯分子组成
翁丽萍,赵 芸,张 乐,王宏海
UPLC和Q-Exactive高分辨质谱仪联用鉴定大黄鱼中的甘油三酯分子组成
翁丽萍1,赵 芸1,张 乐1,王宏海2,*
(1.杭州市农业科学研究院,浙江 杭州 310024;2.浙江工商大学环境科学与工程学院,浙江 杭州 310018)
应用超高效液相色谱和电喷雾/四极杆 -静电场轨道阱的质谱联用技术,分析大黄鱼脂肪中甘油三酯的组成。采用Hypersil Gold C18柱(150 mm×4.6 mm,2.1 μm),流动相为82%甲醇(含0.1%甲酸)溶液和18%异丙醇溶液,混合后添加0.05%乙酸铵溶液,以等度洗脱方式分离大黄鱼脂肪中的甘油三酯组分,柱后流出液采用电喷雾离子源,以正离子模式采集一级质谱分子离子和二级质谱的碎片离子信息,然后与Lipidblast数据库中甘油三酯信息进行比对。研究结果显示,超高效液相色谱和Q-Exactive高分辨质谱仪联用技术快速、准确鉴定出大黄鱼脂质中含有28 种甘油三酯。PoOL、PoSO、PPO、PPoO、PSO、MPO、POL、PoSA 8 种甘油三酯占总量的87.87%以上,其中PoOL(C16:1、C18:1、C18:2)相对含量最丰富,占35.261%。
大黄鱼;脂质;脂肪酸;甘油三酯;电喷雾离子源
大黄鱼(Pseudosciaena crocea)属鲈形目,石首鱼科,俗称黄花鱼,是我国养殖规模最大的海水鱼类,因肉质细嫩鲜美、金鳞朱唇、体形优美而深受消费者的青睐[1]。水产品肌肉的脂肪组织主要是中性脂质,其中90%以上是甘油三酯(triacylglycerols,TAGs)[2]。现代营养医学研究表明,脂质对心血管疾病的形成具有重要影响,并且TAGs酰化位置的不同,脂质的吸收代谢会有很大差异,会影响脂质的营养和应用价值,比如高含量二十碳五烯酸/二十二碳六烯酸(eicosapentaenoic acid/ docosahexenoic acid,EPA/DHA)具有改善脂质代谢和胰岛素抵抗的作用[3]。吴芮等[4]的研究还表明甘油三酯和中华绒螯蟹中关键挥发性风味物质的形成有关。但是目前关于甘油三酯结构的研究主要集中在植物油脂[5-7],对大黄鱼脂质的研究主要集中在甘油三酯含量变化和脂肪酸组成的影响[8-9],甚至海洋生物也仅有少数关于南极磷虾油和海洋微藻中甘油三酯结构的研究[10-11]。
电喷雾离子源串联质谱在脂质组学应用中具有样品前处理简单,所需样品量少、速度快、灵敏度高,可实现脂质的高通量分析的优点[12]。Han Xianlin等[13]提出了电喷雾离子化分析脂质的方法,随后,Cheng Changfu[14]和Kalo[15]等对TAGs在电喷雾离子源串联质谱中的碎裂机理进行了详细的研究,发现存在[M+NH4-Rn-COONH4]+、[RnCO+128]+、[RnCO+74]+、[RnCO]+四种碎片离子。此后,Yang Kui[12]、Hsu[16]、李双[17]等利用该技术进行不同样品中TAGs分子结构的鉴定。为了解大黄鱼肌肉中脂质的组成、结构和营养,本实验采用Q-Exactive四极杆-静电场轨道阱高分辨质谱仪中的一级扫描(MS1)和数据依赖性二级质谱扫描(dd-MS2)模式对大黄鱼肌肉脂肪中中性脂质分子组成进行分析,建立大黄鱼中甘油三酯分子组成的快速分析方法。同时,采用气相色谱-质谱来分析大黄鱼中脂肪酸的组成,进一步验证了电喷雾离子源和轨道阱串联质谱联用分析甘油三酯的准确性,完善了大黄鱼中脂质组成的数据,同时为水产品中脂质组成的研究提供借鉴。
1 材料与方法
1.1 材料
冰冻深水网箱养殖大黄鱼,购于温州市水产供销公司水产精品商场,平均体长25~30 cm,平均体质量250~300 g,体态完好,鱼体新鲜。
1.2 仪器与设备
GC-QQQ气相色谱-质谱联用仪 美国安捷伦公司;Q-Exactive四极杆-静电场轨道阱高分辨质谱仪 美国Thermo公司;Eppendorf 5810R高速台式离心机 德国艾本德公司;Hei-VAP Precision真空旋转蒸发仪 德国Heidolph公司;N-EVAP 112氮吹仪 美国Organomation公司。
1.3 方法
1.3.1 脂质提取
将大黄鱼鱼肉绞碎,精确称取一定量处理好的样品,按Folch等[18]的方法,用氯仿-甲醇(2∶1,V/V)溶液溶液提取。在真空条件下,提取液用旋转蒸发仪进行干燥,含量以g/100 g样品表示。
1.3.2 中性脂质分离
参照Kaluzny等[19]的方法,称取100 mg提取脂质,用1 mL氯仿复溶,然后经SPE硅胶小柱分离。首先用3 mL的正己烷活化SPE硅胶小柱,在1 mL/min流速条件下,用3 mL氯仿-异丙醇(2∶1,V/V)溶液洗脱中性脂质,在氮气吹干,放置-20 ℃冰箱中保存。
1.3.3 脂肪酸样品的甲酯化
取1.3.2节处理所得甘油酯样品100 mg于10 mL的玻璃试管中,加入1 mL 0.5 mol/L氢氧化钾-甲醇溶液,用涡旋混匀器混匀后在60 ℃水浴中加热20 min直至油珠完全溶解,取出冷却至室温后,加入1 mL 15%三氟化硼-甲醇溶液在60 ℃水浴中酯化20 min,取出冷却后,加入3 mL正己烷溶液,充分混匀,静置片刻后取上层正己烷溶液,过0.22 μm有机滤膜,氮气吹干溶剂,用正己烷定容,-20 ℃冰箱中保存,待气相色谱-质谱联用仪分析测定。
1.3.4 气相色谱-质谱联用仪条件
气相色谱条件:TR-5MS色谱柱(30 m×0.2 mm,0.25 μm);进样量1.0 μL;分流比100∶1;进样口温度250 ℃;升温程序:40 ℃保持1 min,以10 ℃/min升至150 ℃保持2 min,以10 ℃/min升至220 ℃,之后以5 ℃/min升至280 ℃,保持3 min;氦气作为载气,流速1.0 mL/min。
质谱条件:离子源温度230 ℃;电子电离源;电子能量70 eV;质量扫描范围是35~450 u;脂肪酸组成以峰面积归一法计算相对含量。
1.3.5 甘油酯超高效液相色谱-串联质谱的测定
1.3.5.1 样品的制备
取1.3.2节处理所得甘油酯样品50 mg于干净的玻璃试管中,加入2 mL丙酮溶液,然后再加入2 mL流动相(82%甲醇(含0.1%甲酸)溶液和18%异丙醇溶液,混合后添加0.05%乙酸铵溶液),待测。
1.3.5.2 液相色谱参数
色谱柱:Hypersil Gold C18(150 mm×4.6 mm,2.1 μm);采用等度洗脱方式,流动相:82%甲醇(含0.1%甲酸)溶液和18%异丙醇溶液,混合后添加0.05%乙酸铵溶液,分离时间18 min;流速0.2 mL/min;进样量5 μL;柱温30 ℃。
1.3.5.3 质谱参数
四极杆-静电场轨道阱质谱条件:鞘气流速35 arb,辅助气流速10 arb,喷雾电压3.0 kV,毛细管温度320 ℃,加热器温度250 ℃,全扫描条件(MS1):分辨率70 000,质量扫描范围m/z 100~1 000;二级扫描条件(dd-MS2):分辨率17 500,碎裂离子选择Top 5,归一化碰撞能量12 eV;电离源为电喷雾离子源,采用正离子模式采集数据,采集时间为18 min。
1.4 数据处理
Lipidblast是一个通过计算机模拟和实际实验数据结合的二级质谱数据库,包含约200 000 个二级质谱[20]。先将通过Q-Exactive获得的二级质谱数据Raw格式转换成mgf格式,然后用NIST-MS-GUI进行搜索匹配。母离子参数设置为0.4 D,子离子参数设置为0.8 D。Lipidblast搜索结果中Reverse dot product代表着实验质谱数据和Lipidblast数据库的匹配程度,得分在400以上的定性结果,被认为是可信的。
2 结果与分析
2.1 大黄鱼的总脂含量和脂肪酸组成

表 1 大黄鱼甘油三酯的脂肪酸组成Table 1 Fatty acid composition of TAGs in Pseudosciaena crocea lipids
采用1.3.1节脂肪的提取方法,测得大黄鱼中脂肪含量平均值为(8.41±0.02)g/100 g。取1.3.3节方法的甲酯化样品,采用1.3.4节气相色谱-质谱联用方法对脂质样品的脂肪酸组成进行测定,同时采用C4~C24不同碳链长度的37 种脂肪酸甲酯作对照标准,进一步验证鉴定准确性,对样品中的脂肪酸进行定性,以峰面积归一化法计算每种脂肪酸的相对含量,结果见表1。大黄鱼脂肪中最主要的脂肪酸为C16:0、C16:1、C18:1、C18:0、C18:2、C18:3和C22:6,其中棕榈油酸C16:1大量存在于海产油脂中,大黄鱼中性脂质中还含有C20:5(EPA)和C22:6(DHA)等多不饱和脂肪酸,不饱和脂肪酸总量达到53.98%,脂肪酸种类、含量与文献[21-22]测定结果一致。
2.2 大黄鱼中甘油三酯的组成
通过二级质谱扫描的方法,得到了大量的二级质谱信息,如图1所示。一般的定性方法是通过这些二级质谱信息来搜索仪器自带的二级质谱数据库,例如LMSD、LipidBank、LIPIDAT等,但是这些数据库所含有的二级质谱信息不是很全面,通过搜索这些数据库无法得到全面的定性结果。本研究中首先采用Lipidblast数据库进行甘油三酯的定性分析,然后逐一评估Lipidblast数据库定性的结果,提高鉴定的准确性。采用Alarm等[23]方法,即流动相为82%甲醇(含0.1%甲酸)溶液和18%异丙醇溶液,混合后添加0.05%乙酸铵溶液,采用等度洗脱使得大黄鱼肉中中性脂质在C18柱中得到了很好的预分离,见图1A。在Q-Exactive系统中,本实验中全扫描模式下获得质谱图是混合物中[M+NH4]的加合物离子,范围在760~1 030 D,如图1B所示。部分实验数据和Lipidblast数据库的比对结果,如图2所示。

图 1 大黄鱼甘油三酯在正离子全扫描模式下总离子流图(A)和质谱图(B)Fig. 1 TIC chromatogram (A) and full scan mass spectrum (B) under the positive mode of TAGs Pseudosciaena crocea in lipids
一般情况下,甘油三酯的质谱图中同时存在信号强度较大的分子离子峰[M+1]或[M+NH4]和分子失去1 个脂肪酸的碎片离子峰[M+1-SN-1脂肪酸]。当甘油三酯含2 种或3 种脂肪酸时,可失去2 种或3 种脂肪酸,因此可同时存在2 种或3 种[M+1-脂肪酸]的碎片离子峰。如保留时间为11.71 min的色谱峰的质谱图显示分别存在4 种碎片离子866.82 [M+NH4]、593.56 [M+1-SN-1]、565.52 [M+1-SN-2]和579.54 [M+1-SN-3],可以确定为PMaS(C16:0、C17:0、C18:0)。又如POL即棕榈酸亚油酸油酸甘油酯,因棕榈酸、亚油酸或油酸均可能失去,所以可能有[M+NH4]为874.79,[M+1-棕榈酸]为601.5,[M+1-油酸]为575.5,[M+1-亚油酸]为577.5等碎片信号。其中保留时间为7.94 min的化合物的质谱图中,存在质量数为874.79、601.52、575.51和577.52四个强峰,子离子来源于分别失去P、O、L,即得601为LO,575为PL。Mottram等[24]研究了在化学电离条件下[M+H]的前级离子分离所产生的甘油二酯离子及脂肪酸的位置。根据SN-1(3)位的脂肪酸比SN-2位的容易丢失,所以研究表明在含有A、B离子的情况下,AAB比ABA更有可能,而AC在ABC中是最不可能出现的。大量实验表明:根据碎片离子强度和离子比率可以用作确定碎片位置[25-27]。因此根据不同SN位脂肪酸丢失的难易,保留时间为7.94 min的化合物可确定为PLO,棕榈酸亚油酸油酸甘油酯。因此由上述质谱碎片信号可对甘油三酯进行鉴定,测定结果见表2。
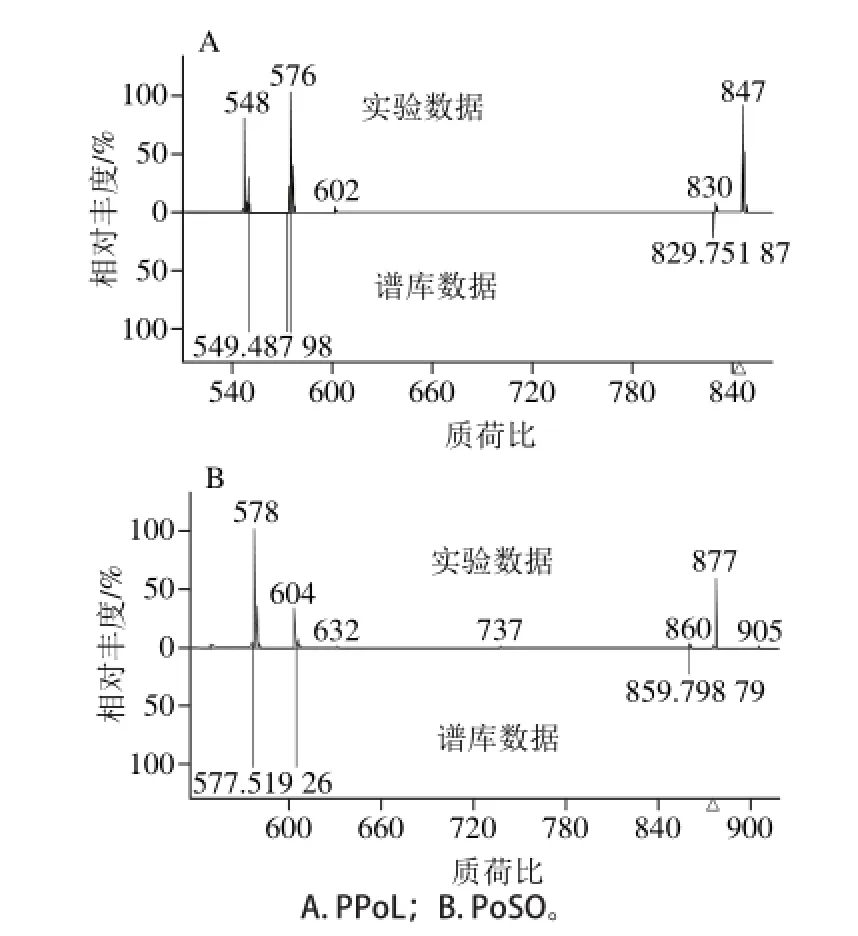
图 2 2 种大黄鱼甘油三酯在正离子模式下的二级质谱数据与Lipidblast数据库的匹配Fig. 2 Annotation of two TAGs in Pseudosciaena crocea lipids by matching experimental dd-MS2data acquired under positive modes with the Lipidblast library
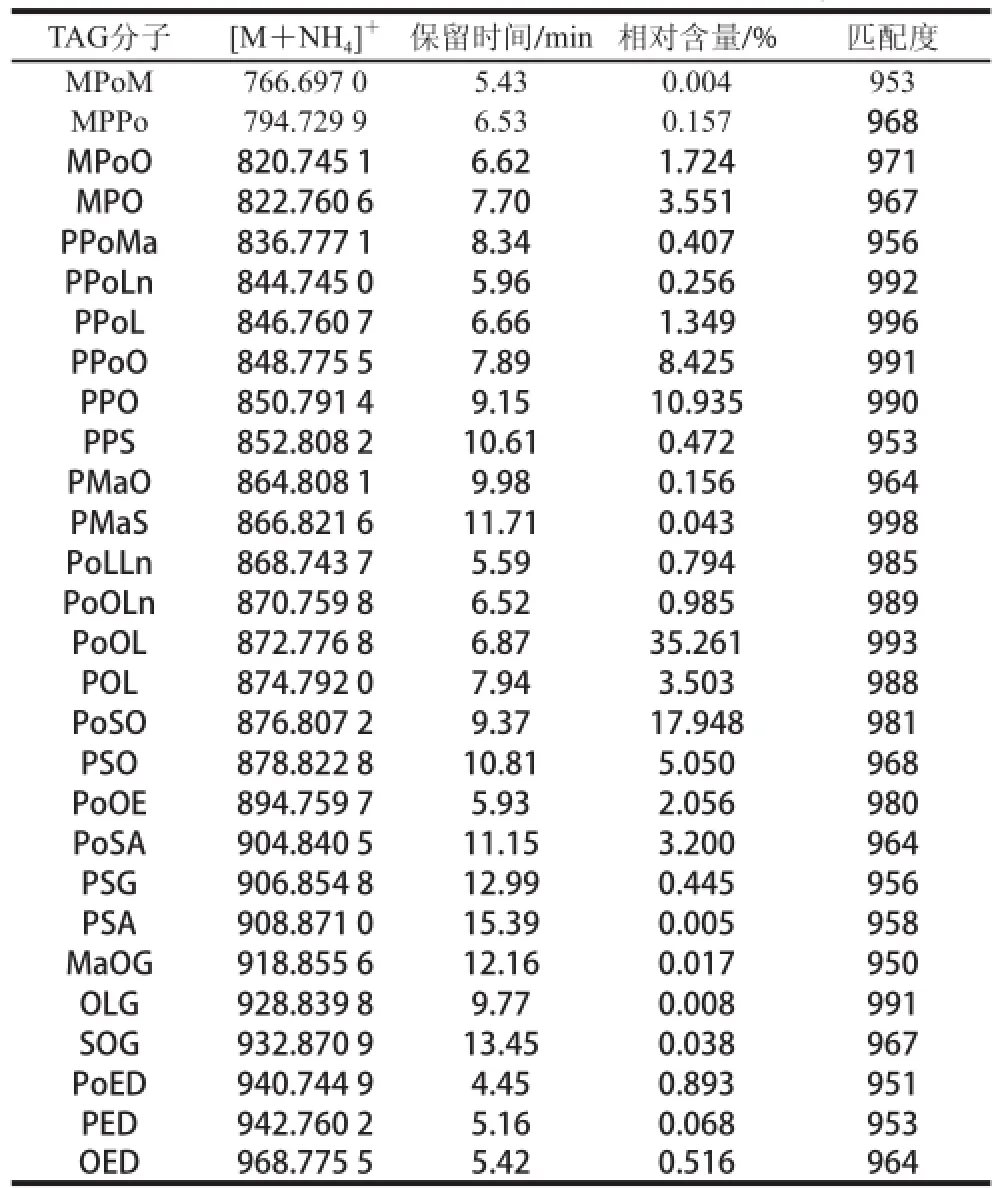
表 2 Lipidblast定性分析大黄鱼甘油三酯Table 2 Identified TAGs in Pseudosciaena crocea lipids by Lipidblast
甘油三酯中脂肪酸链的长度、不饱和度、甘油酰基化的位置不同,导致甘油三酯具有不同的生理功能。如棕榈酸(C16:0)在SN-2位能促进人体对脂肪酸的吸收[28];高含量的DHA/EPA甘油三酯型鱼油能显著抑制肝脏脂肪合成和促进β-氧化两方面来改善脂肪肝[3]。最新研究表明通过干预人体摄入不同结构的脂质可以改变血清中脂质组学轮廓,从而影响心血管病的发展[29-30]。因此研究水产品脂质组成和结构,了解其功能,在营养研究和脂质代谢相关疾病的治疗中具有积极的作用。
3 结 论
本研究基于电喷雾离子源全自动喷雾进样联用超高效液相色谱和Q-Exactive四极杆-静电场轨道阱高分辨质谱仪快速分析大黄鱼中性脂质分子组成,利用Lipidblast数据库快速准确定性出甘油三酯分子组成。共有28 种甘油三酯得到鉴定,其中相对含量大于3%的有PoOL、PoSO、PPO、PPoO、PSO、MPO、POL、PoSA,8 种甘油三酯占总量的87.87%以上,其中PoOL(C16:1、C18:1、C18:2)相对含量最丰富,占35.261%。采用此方法能快速、有效地解决水产品中甘油三酯的鉴定分析,为水产品脂肪的指纹图谱提供了定性依据。
[1] 翁丽萍, 戴志远, 赵芸, 等. 养殖大黄鱼和野生大黄鱼特征滋味物质的分析与比较[J]. 中国食品学报, 2015, 15(4): 254-261. DOI:10.16429/j.1009-7848.2015.04.034.
[2] SHIRO H, KONDO N, KIBUNE N, et al. Direct method for quanti cation of glycidol fatty acid esters in edible oils[J]. European Journal of Lipid Science and Technology, 2011, 113(3): 356-360. DOI:10.1002/ejlt.201000395.
[3] 朱昱哲. 高含量DHA/EPA甘油三酯调节脂质代谢和改善胰岛素抵抗作用的研究[D]. 青岛: 中国海洋大学, 2013: 74-76. DOI:10.7666/ d.D327980.
[4] 吴芮, 吴娜, 王锡昌, 等. 固相萃取-气相色谱法测定蒸制前后中华绒螯蟹性腺中甘油三酯和磷脂脂肪酸组成[J]. 中国食品学报, 2016, 16(6): 259-265. DOI:10.16429/j.1009-7848.2016.06.034.
[5] 李桂华, 谢朝顺, 李珺. 葡萄籽油甘油三酯组成及结构分析研究[J]. 粮食与油脂, 2009(10): 43-45. DOI:10.3969/ j.issn.1008-9578.2009.10.014.
[6] FASCIOTTI M, NETTO A D P. Optimization and application of methods of triacylglycerol evaluation for characterization of olive oil adulteration by soybean oil with HPLC-APCI-MS-MS[J]. Talanta, 2010, 81(3): 1116-1125. DOI:10.1016/j.talanta.2010.02.006.
[7] NAVARRO-REIG M, JAUMOT J, van BEEK T A, et al. Chemometric analysis of comprehensive LC×LC-MS data: resolution of triacylglycerol structural isomers in corn oil[J]. Talanta, 2016, 160: 624-635. DOI:10.1016/j.talanta.2016.08.005.
[8] 徐继林, 严小军, 罗瑜萍, 等. 岱衢族野生大黄鱼与养殖大黄鱼肌肉脂类和脂肪酸组成的比较研究[J]. 中国食品学报, 2008, 8(1): 108-114. DOI:10.3969/j.issn.1009-7848.2008.01.021.
[9] 陈文娟, 陈建福. 大黄鱼鱼卵脂质含量及脂肪酸组成分析[J]. 肉类工业, 2012(4): 21-23. DOI:10.3969/j.issn.1008-5467.2012.04.010.
[10] ARAUJO P, ZHU H, BREIVIK J F, et al. Determination and structural elucidation of triacylglycerols in krill oil by chromatographic techniques[J]. Lipids, 2014, 49(2): 163-172. DOI:10.1007/s11745-013-3855-6.
[11] SAMBUROVA V, LEMOS M S, HIIBEL S, et al. Analysis of triacylglycerols and free fatty acids in algae using ultra-performance liquid chromatography mass spectrometry[J]. Journal of Oil and Fat Industries, 2013, 90(1): 53-64. DOI:10.1007/s11746-012-2138-3.
[12] YANG K, ZHAO Z D, GROSS R W, et al. Systematic analysis of choline-containing phospholipids using multi-dimensional mass spectrometry-based shotgun lipidomics[J]. Journal of Chromatography B, 2009, 877(26): 2924-2936. DOI:10.1016/j.jchromb.2009.01.016.
[13] HAN X L, GROSS R W. Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: a bridge to lipidomics[J]. Journal of Lipid Research, 2003, 44(6): 1071-1079. DOI:10.1194/jlr.R300004-JLR200.
[14] CHENG C F, GROSS M L, PITTENAUER E. Complete structural elucidation of triacylglycerols by tandem sector mass spectrometry[J]. Analytical Chemistry, 1998, 70(20): 4417-4426. DOI:10.1021/ ac9805192.
[15] KALO P J, OLLILAINEN V, ROCHA J M, et al. Identification of molecular species of simple lipids by normal phase liquid chromatography-positive electrospray tandem mass spectrometry, and application of developed methods in comprehensive analysis of low erucic acid rapeseed oil lipids[J]. Mass Spectrometry, 2006, 254(1/2): 106-121. DOI:10.1016/j.ijms.2006.05.022.
[16] HSU F F, TURK J. Toward total structural analysis of cardiolipins: multiple-stage linear ion-trap mass spectrometry on the [M-2H+3Li]+ions[J]. Journal of the American Society for Mass Spectrometry, 2010, 21(11): 657-669. DOI:10.1016/j.jasms.2010.07.003.
[17] 李双. 海洋微藻中甘油三酯的液质分析[D]. 宁波: 宁波大学, 2014: 16-25.
[18] FOLCH J, LEES M, SLOANE STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biochemistry, 1957, 226(1): 497-509.
[19] KALUZNY M, DUNCAN L, MERRITT M, et al. Rapid separation of lipid classes in high yield and purity using bonded phase columns[J]. Journal of Lipid Research, 1985, 26(1): 135-140.
[20] 杨大伟, 范晓蕾, KIND T, 等. 基于芯片的直接进样质谱法和气相色谱-质谱测定莱茵衣藻中的极性脂类[J]. 化学学报, 2013, 71(4): 663-669. DOI:10.6023/A13010152.
[21] 段青源, 钟惠英, 斯列钢. 网箱养殖大黄鱼与天然大黄鱼营养成分的比较分析[J]. 浙江海洋学院学报(自然科学版), 2000, 19(2): 125-128. DOI:10.3969/j.issn.1008-830X.2000.02.006.
[22] 林利民, 王秋荣, 王志勇, 等. 不同家系大黄鱼肌肉营养成分的比较[J]. 中国水产科学, 2006, 13(2): 286-291. DOI:10.3321/ j.issn:1005-8737.2006.02.019.
[23] ALARM Z, MICHAEL M. Analysis of triacylglycerols in refined edible oils by isocratic HPLC-ESI-MS[J]. European Journal of Lipid Science and Technology, 2010, 112(8): 844-851. DOI:10.1002/ ejlt.201000064.
[24] MOTTRAM H R, WOODBURY S E, EVERSHED R P. Identification of triacylglycerol positional isomers present in vegetable oils by high performance liquid chromatography/atmospheric pressure chemical ionization mass spectrometry[J]. Rapid Communication Mass Spectrometry, 1997, 11(12): 1240-1252. DOI:10.1002/(SICI)1097-0231(199708)11:12<1240::AID-RCM990>3.0.CO;2-5.
[25] DUFFIN K L, HENION J D, SHIEH J J. Electrospray and tandem mass spectrometric characterization of acylglycerol mixtures that are dissolved in nonpolar solvents[J]. Analytical Chemistry, 1991, 63(17): 1781-1788. DOI:10.1021/ac00017a023.
[26] DORSCHEL C A. Characterization of the TAG of peanut oil by electrospray LC-MS-MS[J]. Journal of the American Oil ChemistsSociety, 2002, 79(8): 749-753. DOI:10.1007/s11746-002-0553-z.
[27] MARZILLI L A, FAY L B, DIONISI F, et al. Structural characterization of triacylglycerols using elctrospray ionization-MSnion-trap MS[J]. Journal of the American Oil Chemists Society, 2003, 80(3): 195-202. DOI:10.1007/s11746-003-0676-2.
[28] 商允鹏, 生庆海, 王贞瑜, 等. 三酰甘油Sn-2位上棕榈酸生理功能及研究概况[J]. 中国粮油学报, 2010, 25(10): 119-123.
[29] LAMAZIERE A, WOLF C, BARBE U, et al. Lipidomics of hepatic lipogenesis inhibition by omega 3 fatty acids[J]. Prostaglandins Leukotrienes and Essential Fatty Acids, 2013, 88(2): 149-154. DOI:10.1016/j.plefa.2012.12.001.
[30] 陈宇欢, 李静, 范亚苇, 等. 脂质组学及其在营养与健康研究中的应用研究进展[J]. 食品科学, 2014, 35(15): 272-276. DOI:10.7506/ spkx1002-6630-201415055.
Identification of Triacylglycerols in the Lipids of Pseudosciaena crocea by UPLC and Q-Exactive High-Resolution Mass Spectrometer
WENG Liping1, ZHAO Yun1, ZHANG Le1, WANG Honghai2,*
(1. Hangzhou Academy of Agricultural Sciences, Hangzhou 310024, China; 2. School of Environmental Science and Engineering, Zhejiang Gongshang University, Hangzhou 310018, Ch ina)
The triglyceride composition of Pseudosciaena crocea lipids was analyzed by ultra performance liquid chromatography-electrospray ionization/quadrupole/electrostatic field orbit trap high resolution mass spectrometry (UPLCESI/Orbitrap-MS). The chromatographic separation was performed on a Hy persil Gold C18column (150 mm × 4.6 mm, 2.1 μm) using a mobile phase consisting of methanol (including 0.1% formic acid)-isopropyl alcohol (82:18, V/V) and 0.05% ammonium acetate. The analytes were detected by ESI/Orbitrap-MS in the positive ion mode to obtain mass and tandem mass spectra together and then the results obtained were compared with those from the Lipidblast database. A total of 28 triacylglycerols were identified by UPLC-ESI/Orbitrap-MS). Among these, PoOL was the most abundant (35.261%), and PoOL, PoSO, PPO, PPoO, PSO, MPO, POL and PoSA together accounted for 87.87% of the total triacylglycerols.
Pseudosciaena crocea; lipid; fatty acid; triacylglycerols; electrospray ionization
10.7506/spkx1002-6630-201710030
S912
A
1002-6630(2017)10-0178-05
翁丽萍, 赵芸, 张乐, 等. UPLC和Q-Exactive高分辨质谱仪联用鉴定大黄鱼中的甘油三酯分子组成[J]. 食品科学, 2017, 38(10): 178-182. DOI:10.7506/spkx1002-6630-201710030. http://www.spkx.net.cn
WENG Liping, ZHAO Yun, ZHANG Le, et al. Identification of triacylglycerols in the lipids of Pseudosciaena crocea by UPLC and Q-exactive high-resolution mass spectrometer[J]. Food Science, 2017, 38(10): 178-182. (in Chinese with English abstract)
10.7506/spkx1002-6630-201710030.http://www.spkx.net.cn
2016-08-17
国家自然科学基金青年科学基金项目(31301463)
翁丽萍(1981—),女,高级工程师,博士,研究方向为食品科学。E-mail:lipingweng@163.com
*通信作者:王宏海(1976—),男,高级工程师,硕士,研究方向为食品科学。E-mail:wanghh1@163.com

