山药果蔬在乳酸菌发酵过程中组分及生物活性变化
李亚辉,马艳弘,*,张宏志,黄开红,殷剑美,魏建明
山药果蔬在乳酸菌发酵过程中组分及生物活性变化
李亚辉1,马艳弘1,*,张宏志1,黄开红1,殷剑美2,魏建明3
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.江苏省农业科学院经济作物研究所,江苏 南京 210014;3.江苏博达生物科技有限公司,江苏 徐州 221000)
通过对山药果蔬乳酸菌发酵液理化指标、微生物指标、酶活性、抗氧化性及抑菌活性的测定,研究其发酵过程中组分和生物活性的变化。结果显示:pH值和总酸含量在2~4 d变化最快,8 d后趋于稳定;总糖含量先下降、后上升、最后又下降,12 d后达到最低并趋于稳定;亚硝酸盐含量第4天最高,10 d后降至最低;前6 d是微生物主要增殖期,随着时间延长,乳酸菌逐渐成为优势菌种,并抑制其他杂菌生长;超氧化物歧化酶(superoxide dismutase,SOD)、淀粉酶、蛋白酶和脂肪酶随着时间延长,活性逐渐增强,SOD活性最高,脂肪酶活性最低;DPPH自由基、羟自由基、超氧阴离子自由基清除率和总抗氧化活性随着时间延长逐渐增强,10 d后最高且趋于稳定;对大肠杆菌和金黄色葡萄球菌的抑制率随时间延长逐渐增强,12 d后最高。本研究为果蔬乳酸菌发酵的工艺和功能研究提供了一定的理论依据。
山药是一种多年蔓生草本植物薯蓣科薯蓣的块茎,广泛分布于我国河南、河北、江苏、山东、江西等地[1-2]。山药根茎肉质洁白,营养丰富,兼食、药为一体,在我国具有悠久的种植和食用历史[3-4]。山药含有丰富的功能活性成分,主要有山药多糖、薯蓣皂苷元、糖蛋白、多酚氧化酶、多巴胺、尿囊素以及山药碱、胆碱等,具有重要的药用价值、营养价值和保健价值[5-6]。山药多糖和山药皂苷是山药中主要的生物活性物质,具有广泛的药理活性。中医认为山药可以养脾益胃、助消化、滋肾益精、益肺止咳、降血糖、治疗冠心病、延年益寿等[7-9]。
乳酸菌是一群能发酵碳水化合物产生乳酸的革兰氏阳性细菌的通称,广泛存在于人、畜、禽肠道,以及众多食品和物料中[10-11]。乳酸菌发酵制品如酸奶、纳豆、豆豉、泡菜等是我国的传统食品,具有悠久的历史[12]。乳酸菌发酵制品富含多种酶活性和特殊功能活性物质,具有比一般原料更丰富的营养成分和更高的营养保健价值,为人体构成新生组织、修补损伤组织以及肌体内部氧化还原提供了所必需的酶和激素等重要物质[13-14]。乳酸菌发酵食品属于营养保健食品,其特殊的生理活性和营养保健功能正日益受到人们的重视,具有强大的生命力和广阔的前景[15]。
目前山药的深加工产品主要有山药饼、山药罐头、山药脆片、山药粉、山药饮料、山药果脯和山药酒等[16],而山药的乳酸菌发酵制品还鲜有报道。本研究以山药为主要原料,果蔬汁为辅料,接种乳酸菌进行发酵,研究了其发酵过程中组分和生物活性的变化。
1 材料与方法
1.1 材料与试剂
水山药(江苏沛县)、西红柿、苹果 南京菜市场;植物乳杆菌M1、大肠杆菌、金黄色葡萄球菌实验室保藏。
亚硝酸钠 成都市科龙化工有限公司;淀粉酶试剂盒长春汇力生物技术有限公司;酪素、酪氨酸 美国Sigma公司;NaOH标准液 深圳市博林达科技有限公司;VC、FeSO4、邻苯三酚 天津科密欧试剂公司;其他试剂均为市售分析纯。
1.2 仪器与设备
打浆机 美的公司;均质机 上海比朗仪器制造有限公司;冰箱 海尔公司;pH酸度计 梅特勒-托利多公司;UV-3802H紫外-可见分光光度仪 上海尤尼柯仪器有限公司;LRH-150生化培养箱 上海一恒科技有限公司;超净工作台 苏州苏净净化设备厂;DSX-280B手提式蒸汽灭菌器 上海申安医疗器械厂;SUPER T21高速冷冻离心机 美国Sorvall公司;Model680多孔酶标仪 美国Bio-Rad公司;HH-2数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 发酵工艺流程
山药→清洗→去皮→切片→护色→清洗→打浆→山药浆
西红柿(苹果)→清洗→破碎→打浆→过滤→西红柿汁(苹果汁)
植物乳杆菌→MRS培养基37 ℃活化→发酵母液
山药浆60%、苹果汁20%、西红柿汁20%混合均匀→均质→接种→发酵→冷藏→过滤→成品
操作要点:母液接种量为原料体积的1%~2%,发酵温度为37~40 ℃,发酵时间14 d,发酵为无氧发酵,冷藏温度0~4 ℃,过滤为除菌膜除菌过滤。
取样:每2 d取样一次,除测定微生物指标外,其余样品低温离心取上清液。
1.3.2 理化指标测定
pH值采用酸度计进行测定。总酸含量参照GB/T 12456—2008《食品中总酸的测定》进行检测。总糖含量测定采用苯酚-硫酸法,以无水葡萄糖为标品绘制标准曲线得线性回归方程:y=7.111 4x-0.001 1,R2=0.999 3;根据样品吸光度和标准曲线计算样品中总糖含量。亚硝酸盐含量测定参照马艳弘等[17]所述方法,以亚硝酸钠为标品绘制标准曲线得线性回归方程:y=0.680 2x+ 0.000 2,R2=0.999 4;根据样品吸光度和标准曲线计算样品中亚硝酸盐含量。以上每个样品均重复3 次。
1.3.3 微生物指标测定
乳酸菌总数测定:参照GB 4789.35—2010《乳酸菌检验》;菌落总数测定:参照GB 4789.2—2010《菌落总数测定》;大肠菌群数测定:参照GB 4789.3—2010《大肠菌群计数》;金黄葡萄球菌数测定:参照GB 4789.10—2010《金黄色葡萄球菌检验》。
1.3.4 酶活性测定
1.3.4.1 超氧化物歧化酶(superoxide dismutase,SOD)活性测定
参照于晓艳等[18]所述邻苯三酚自氧化法测定SOD活性:首先以3 组平行实验测定邻苯三酚的自氧化速率平均值,取样品0.5 mL测定样品吸光度变化速率,重复3 次求平均值,计算如式(1)、(2)所示:
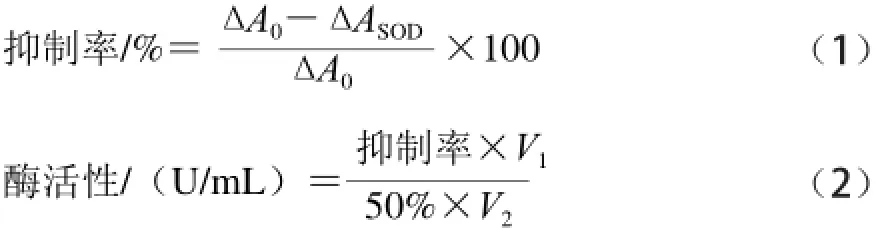
式中:ΔA0为邻苯三酚的自氧化速率平均值;ΔASOD为样品吸光度变化速率;V1为反应液总体积/mL;V2为添加样品体积/mL。
1.3.4.2 淀粉酶活性测定
参照李杰等[19]所述碘-淀粉比色法测定淀粉酶活性:使用淀粉酶测定试剂盒在半自动生化分析仪上进行。
1.3.4.3 蛋白酶活性测定
参照于晓艳等[18]所述方法测定蛋白酶活性:以样品1 min水解酪素生成1 μg酪氨酸为一个酶活性单位,以U/mL表示。以酪氨酸含量为横坐标,570 nm波长处吸光度为纵坐标,绘制标准曲线得线性回归方程:y=0.005x+ 0.038 5,R2=0.998 7;根据样品吸光度和回归方程计算样品中酪氨酸含量,并由此计算蛋白酶活性。每个样品重复3 次。
1.3.4.4 脂肪酶活性测定
参照QB/T 1803—1993《工业酶制剂通用试验方法》,采用滴定法测定脂肪酶活性:脂肪酶催化橄榄油乳化液酯键水解,生成脂肪酸,用0.05 mol/L NaOH溶液滴定脂肪酸,以酚酞为指示剂,根据NaOH用量来计算脂肪酶活性。每个样品重复3 次。
1.3.5 抗氧化活性测定
1.3.5.1 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定
参照Atoui等[20]所述方法:取1 mL样品进行实验,空白组用纯水代替样品,对照组用0.4 mg/mL的VC溶液代替样品,每个样品重复3 次。DPPH自由基清除率计算如式(3)所示:
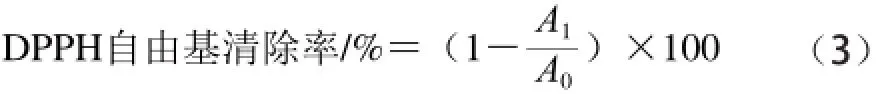
式中:A1为样品组的吸光度,A0为对照组的吸光度。
1.3.5.2 超氧阴离子自由基清除能力测定
参照胡翠珍等[21]所述方法:以Tris-HCl缓冲液作参比,在320 nm波长处测定样品反应液吸光度A1,以等体积的蒸馏水代替样品和邻苯三酚溶液,测对照吸光度A0,计算清除率,如式(4)所示:
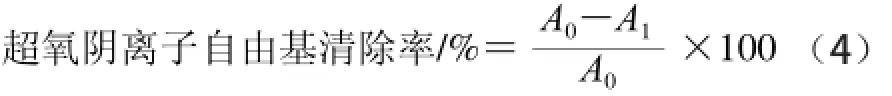
1.3.5.3 羟自由基清除能力测定
参照李亚辉等[22]所述方法:取1 mL样品进行实验,空白组用纯水代替样品,对照组用0.4 mg/mL的VC溶液代替样品,每个样品重复3 次。羟自由基清除率如式(5)所示:
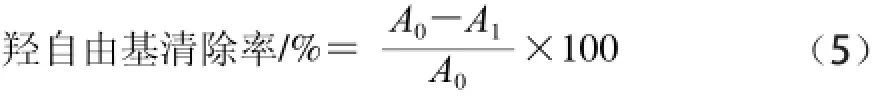
式中:A0为空白组的吸光度;A1为样品组的吸光度。
1.3.5.4 总抗氧化活性测定
参照李亚辉等[23]所述FRAP法。取1 mL样品进行实验,空白组用水代替,对照组用0.4 mg/mL的VC溶液代替,每个样品重复测3 次。以1.0 mmol/L FeSO4溶液为标准,样品总抗氧化活性以达到同样吸光度所需FeSO4的浓度(μmol/L)表示,定义为FRAP值。
1.3.6 抑菌活性测定
参照李亚辉等[22]所述方法,研究发酵液对金黄色葡萄球菌和大肠杆菌生长的影响:将金黄色葡萄球菌和大肠杆菌在LB液体培养基中分别培养至对数生长中期,取对数生长中期菌液,按5%接种量分别接种于添加20%山药果蔬发酵液和添加等体积无菌水的LB液体培养基中作为实验组和对照组。37 ℃培养24 h,600 nm波长处测定其OD值。每个样品重复3 次。抑制率计算如式(6)所示:

1.4 数据分析
利用SPSS 18.0 和Design-Expert V8.0数据处理软件进行数据处理及统计分析。
2 结果与分析
2.1 发酵过程中理化指标的变化
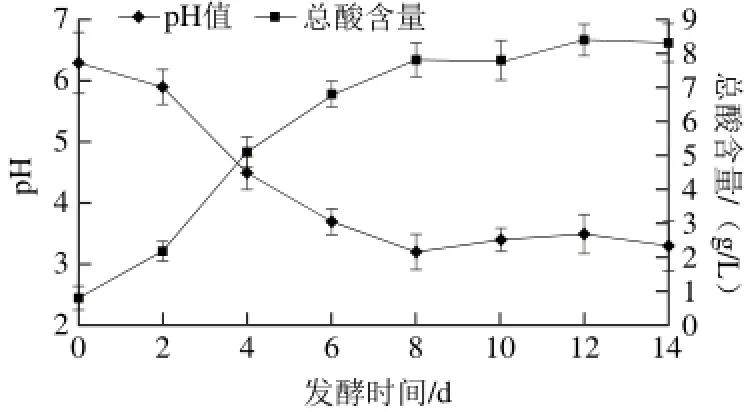
图 1 发酵过程中pH值和总酸含量的变化Fig. 1 Changes in pH value and total acid content during fermentation
pH值和总酸含量是判断发酵程度的重要指标,pH值的高低直接影响微生物的生长、代谢和产品的保质期,总酸含量直接影响发酵液的口感、风味和整体品质[22]。由图1可知,发酵液的pH值在前8 d快速从6.30下降到3.40,之后有较小变化并稳定在3.40左右,其中2~4 d下降最快;总酸含量在前8 d从0.81 g/L快速上升到7.98 g/L,之后有较小幅度的上升并稳定在8.20 g/L左右,其中2~4 d上升最快。此结果说明山药果蔬乳酸菌发酵8 d内基本完成,8 d后进入缓慢发酵阶段,其中2~4 d发酵速度最快。pH值的下降是发酵过程中发酵液中有机酸浓度的增加引起的,主要是乳酸含量的增加。pH值随着有机酸浓度的增加而逐渐降低,因此pH值的下降和总酸含量的上升在时间上表现出一致性。8 d后总酸含量有较小幅度的升高,但pH值变化较小并趋于稳定,这是因为菌体在生长和代谢中产生了大量CO2,CO2产生碳酸氢根离子,碳酸氢根离子从有机酸上结合1 个氢离子防止氢离子浓度进一步升高,从而使发酵液具有一定的缓冲能力[24]。
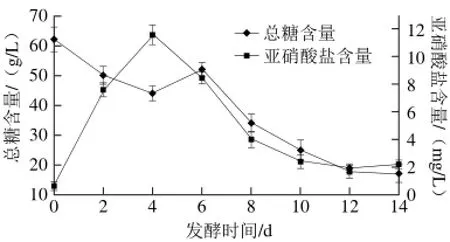
图 2 发酵过程中总糖和亚硝酸盐含量的变化Fig. 2 Changes in total sugar and nitrite contents during fermentation
由图2可知,总糖含量在前4 d迅速下降,4~6 d含量上升,第6天后又迅速下降,12 d后达到最低18.0 g/L并趋于稳定;亚硝酸盐含量在发酵前4 d迅速升高至11.6 mg/L,之后逐渐降低,10 d后降至最低并稳定在2.0 mg/L左右。糖是发酵过程中微生物生长和代谢的主要碳源,本实验主要对发酵液中可溶性总糖含量的变化进行了测定。总糖含量前4 d下降是因为发酵初期乳酸菌大量繁殖消耗大量糖,且此时酶分泌量较少;4~6 d含量上升是因为乳酸菌分泌大量的酶降解原料中淀粉等碳水化合物产生大量可溶性糖,且其产生量大于乳酸菌对糖的消耗量;6 d后再次下降是因为乳酸菌数量逐渐增多,对糖的消耗量大于可溶性糖的产生量。亚硝酸盐是有害菌在发酵过程中还原硝酸盐产生的,它在人体中可生成具有致癌性的亚硝胺,直接危害人体健康[25]。4~10 d亚硝酸盐含量迅速降低,说明所接种乳酸菌对亚硝酸盐具有明显的转化作用;10 d后其含量远低于我国对食品中亚硝酸盐含量10 mg/L的要求。
2.2 发酵过程中微生物指标的变化
乳酸菌是果蔬发酵中的主要微生物,是加速产品成熟和形成风味的重要因素,菌落总数则可直观反映出发酵液中微生物总量及其他杂菌的数量。由图3可知,发酵前6 d乳酸菌数量逐渐升高,之后有较小幅度的升高,10 d后趋于稳定;菌落总数发酵前6 d逐渐升高,之后趋于稳定;发酵第2天大肠杆菌数达最高,第6天金黄色葡萄球菌数达最高,之后两者逐渐减低并趋于0;发酵前10 d菌落总数大于乳酸菌总数,且随着时间的延长两者之差越来越小,10 d后两者基本相等。此结果说明前6 d是乳酸菌和其他微生物的主要增殖期,之后处于平稳期;发酵初期乳酸菌和部分杂菌同时生长,随着发酵时间的延长,乳酸菌逐渐成为优势菌种,其生长和代谢抑制了其他有害菌的生长,并最终成为发酵液中主要微生物。
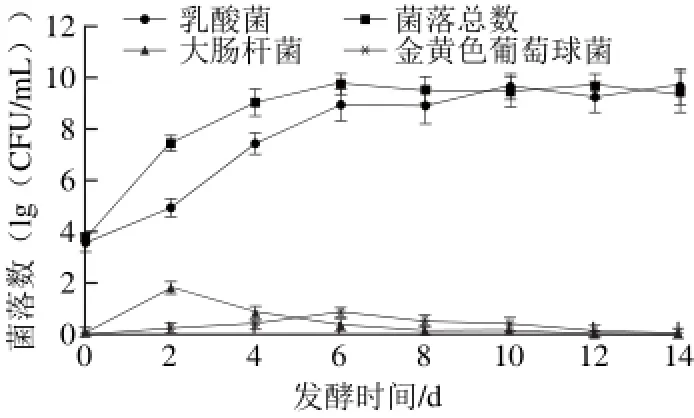
图 3 发酵过程中微生物数量的变化Fig. 3 Changes in microbial quantities during fermentation
2.3 发酵过程中生物活性的变化
2.3.1 酶活性的变化
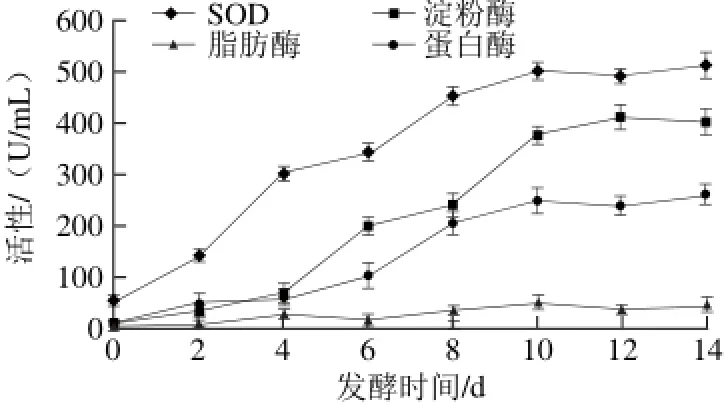
图 4 发酵过程中功能酶活性的变化Fig. 4 Changes in functional enzyme activities during fermentation
乳酸菌发酵果蔬汁不但保留了原料中原有的营养成分,还会产生大量生物功效酶,这些酶赋予发酵液极强的保健功能,主要包括SOD、淀粉酶、蛋白酶和脂肪酶[26]。由图4可知,SOD、淀粉酶、蛋白酶和脂肪酶在山药果蔬发酵液中均存在,且4 种酶活性均随发酵时间的延长逐渐升高,10 d后趋于稳定;淀粉酶活性和蛋白酶活性发酵前4 d变化较小,之后增加较快;发酵过程中SOD活性最高,其次是淀粉酶、蛋白酶,脂肪酶活性最低;发酵末期SOD活性达510 U/mL,淀粉酶活性达400 U/mL,蛋白酶活性为240 U/mL,脂肪酶活性为40 U/mL。SOD是一种特殊的金属酶,能有效清除机体内超氧阴离子自由基,具有抗辐射、抗氧化、防衰老等多种功效;淀粉酶
催化淀粉水解,具有促进人体消化的功能;蛋白酶可催化蛋白质水解,以及分解一些快要死亡的细胞,具有促消化和美容的功效;脂肪酶是一类水解油脂的酶类,在减肥食品和保健品中已得到广泛应用[27]。此结果表明山药果蔬乳酸菌发酵液具有较好的抗氧化、抗衰老等保健和美容功效,且具有一定的助消化功能,但分解脂肪能力不高,减肥效果有限。另外,淀粉酶活性先缓慢增长后快速增长的变化规律解释了2.1节中总糖含量先降低后升高的原因。
2.3.2 抗氧化性的变化
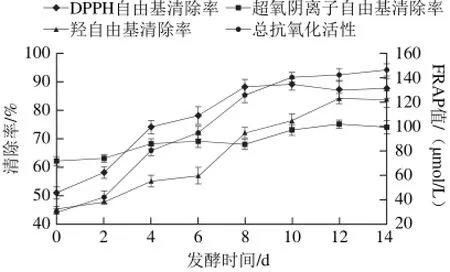
图 5 发酵过程中抗氧化性的变化Fig. 5 Changes in antioxidant properties during fermentation
果蔬发酵液可以清除体内过剩自由基,具有美容、养颜、防衰老等多种功效,这些都是其抗氧化的作用,抗氧化是果蔬发酵液的重要功能[28]。由图5可知,DPPH自由基清除率、羟自由基清除率、超氧阴离子自由基清除率和总抗氧化活性随着发酵时间的延长逐渐升高,DPPH自由基清除率8 d后趋于稳定,超氧阴离子自由基清除率10 d后趋于稳定,羟自由基清除率12 d后趋于稳定,总抗氧化活性10 d后趋于稳定,FRAP值达142 μmol/L;发酵过程中DPPH自由基清除率和羟自由基清除率增加较快,DPPH自由基清除率2~8 d增加最快,羟自由基清除率2~12 d增加最快,而超氧阴离子自由基清除率增加较慢,但原料中超氧阴离子自由基清除率较高达62%;发酵末期DPPH自由基清除率最高达88%,其次是羟自由基清除率达84%,超氧阴离子自由基清除率最低为74%。此结果表明山药果蔬乳酸菌发酵液具有较高的自由基清除率和较强的总抗氧化活性,说明此发酵液具有较好的美容、养颜和防衰老等功效。
2.3.3 抑菌活性的变化
乳酸菌发酵果蔬汁产生大量生物活性物质,使其具有一定的抑菌活性,消炎抗菌是果蔬发酵液的另一重要功能[28]。由图6可知,发酵液对大肠杆菌和金黄色葡萄球菌的抑制率随发酵时间的延长逐渐增强,2~12 d抑制率增加较快,12 d后达最高且趋于稳定;发酵过程中对大肠杆菌的抑制率显著高于对金黄色葡萄球菌的抑制率,发酵末期对大肠杆菌的抑制率达50%,对金黄色葡萄球菌的抑制率为31%。果蔬发酵液的抑菌机理为生物拮抗作用,微生物及其产生的分泌物是导致生物拮抗的主要原因,乳酸菌产生的有机酸、抗生素、细菌素等代谢产物对病原菌有广谱的抑制作用[29]。此结果说明山药果蔬乳酸菌发酵液具有一定的抑菌活性,与之前报道的其他果蔬发酵液一致[27,30]。

图 6 发酵过程中抑菌活性的变化Fig. 6 Changes in antibacterial activity during fermentation
3 结 论
本实验通过对山药果蔬乳酸菌发酵液理化指标、微生物指标、酶活性、抗氧化性及抑菌活性的测定,研究了其发酵过程中组分和生物活性的变化。结果表明:山药果蔬乳酸菌发酵8 d后基本结束;亚硝酸盐含量发酵结束后处于较低水平,在安全食用范围内;随着发酵时间延长乳酸菌逐渐成为优势菌种,并抑制其他杂菌生长;SOD、淀粉酶、蛋白酶和脂肪酶在发酵过程中均存在,SOD活性最高,脂肪酶活性较低,说明发酵液具有较好的抗氧化、防衰老等功效,具有一定的助消化功能,但分解脂肪能力有限;发酵10 d后发酵液具有较高的DPPH自由基清除率、羟自由基清除率、超氧阴离子自由基清除率和较强的总抗氧化活性;发酵液对大肠杆菌和金黄色葡萄球菌有一定的抑制作用,且随发酵时间的延长抑制力逐渐增强。
[1] 李丽微, 谷新晰, 卢海强, 等. 发酵山药酸奶益生乳酸菌菌株的筛选[J]. 中国食品学报, 2015, 15(11): 78-82. DOI:10.16429/j.1009-7848.2015.11.012.
[2] 王彦平, 田春丽, 孙瑞琳, 等. 紫山药的营养保健功能及开发利用研究进展[J]. 食品研究与开发, 2017, 38(1): 200-203. DOI:10.3969/ j.issn.1005-6521.2017.01.046.
[3] 贺永朝, 吴枭锜, 宋洪波, 等. 高压均质改性淮山药淀粉及其消化性的研究[J]. 现代食品科技, 2016, 32(5): 227-233. DOI:10.13982/ j.mfst.1673-9078.2016.5.035.
[4] 景娴, 江海, 杜欢欢, 等. 我国山药研究进展[J]. 安徽农业科学, 2016, 44(15): 114-117. DOI:10.13989/j.cnki.0517-6611.2016.15.040.
[5] MA F Y, ZHANG Y, WEN Y R. et al. Emulsification properties of polysaccharides from Dioscorea opposita Thunb[J]. Food Chemistry, 2017, 221(1): 919-925. DOI:10.1016/j.foodchem.2016.11.073.
[6] YANG M H, CHIN Y W, CHAE H S, et al. Anti-adipogenic constituents from Dioscorea opposita in 3T3-L1 Cells[J]. Biological & Pharmaceutical Bulletin, 2014, 37(10): 1683-1688.
[7] 徐皓, 刘水英. 湿法消解-原子吸收光谱法测定紫山药中矿质元素[J].食品科学, 2015, 36(16): 192-196. DOI:10.7506/spkx1002-6630-201516035.
[8] OLIVEIRA D E, PEREIRA A, BANDEIRA D S, et al. Maximum productivity and economic of yam in function of potassium rates[J]. Revista Caatinga, 2013, 26(3): 110-115.
[9] JU Y, XUE Y, HUANG J L, et al. Antioxidant Chinese yam polysaccharides and its pro-proliferative effect on endometrial epithelial cells[J]. International Journal of Biological Macromolecules, 2014, 66(5): 81-85. DOI:10.1016/j.ijbiomac.2014.01.070.
[10] HSU C K, YEH J Y, WEI J H. Protective effects of the crude extracts from yam (Dioscorea alata) peel on tert-butylhydroperoxide-induced oxidative stress in mouse liver cells[J]. Food Chemistry, 2011, 126(2): 429-434. DOI:10.1016/j.foodchem.2010.11.004.
[11] 赵玲艳, 邓放明, 杨抚林. 乳酸菌的生理功能及其在发酵果蔬中的应用[J]. 中国食品添加剂, 2004(5): 77-80; 100.
[12] 张国华, 何国庆. 传统发酵食品中乳酸菌多样性及其功能特性[J].中国食品学报, 2013, 13(9): 174-180. DOI:10.16429/j.1009-7848.2013.09.035.
[13] NAKAMURA K, OKITSU S, ISHIDA R. Identification of natural lactoylcholine in lactic acid bacteria-fermented food[J]. Food Chemistry, 2016, 201: 185-189. DOI:10.1016/ j.foodchem.2016.01.055.
[14] WANG W, WANG H K. The effect of lactic acid bacteria in food and feed and their impact on food safety[J]. International Journal of Food Engineering, 2014, 10(2): 203-210. DOI:10.1515/ijfe-2013-0042. [15] DOUILLARD F P, de VOS W M. Functional genomics of lactic acid bacteria: from food to health[J]. Microbial Cell Factories, 2014, 13(1): S8. DOI:10.1186/1475-2859-13-S1-S8.
[16] 陈桂星, 于东, 施海敏, 等. 山药加工方法的研究进展[J]. 包装与食品机械, 2010(5): 35-38. DOI:10.3969/j.issn.1005-1295.2010.05.010. [17] 马艳弘, 魏建明, 侯红萍, 等. 发酵方式对山药泡菜理化特性及微生物变化的影响[J]. 食品科学, 2016, 37(17): 179-184. DOI:10.7506/ spkx1002-6630-201617030.
[18] 于晓艳, 任清, 卢舒娴, 等. 微生物酵素主要功效酶活性的测定[J]. 食品科技, 2008, 33(7): 193-197. DOI:10.13684/j.cnki. spkj.2008.07.004.
[19] 李杰, 赵声兰, 陈朝银, 等. 核桃青皮果蔬酵素的成分组成及体外抗氧化活性研究[J]. 食品工业科技, 2016, 37(10): 117-122. DOI:10.13386/j.issn1002-0306.2016.10.014.
[20] ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions: their antioxidant activity and phenolic profile[J]. Food Chemistry, 2005, 89: 27-36. DOI:10.1016/j.foodchem.2004.01.075.
[21] 胡翠珍, 李胜, 马绍英, 等. 响应面实验优化葡萄籽油提取工艺及其抗氧化性[J]. 食品科学, 2015, 36(20): 56-61. DOI:10.7506/spkx1002-6630-201520010.
[22] 李亚辉, 马艳弘, 黄开红, 等. 超声波辅助酶法提取黑莓酒渣中花色苷工艺优化及其生物活性[J]. 食品科学, 2015, 36(6): 63-68. DOI:10.7506/spkx1002-6630-201506012.
[23] 李亚辉, 马艳弘, 黄开红, 等. 响应面优化复合酶提取芦荟多糖工艺及其抗氧化活性分析[J]. 食品科学, 2014, 35(18): 44-49. DOI:10.7506/spkx1002-6630-201418012.
[24] JAYABALAN R, SUBATHRADEVI P, MARIMUTHU S, et al. Changes in free-radical scavenging ability of kombucha teaduring fermentation[J]. Food Chemistry, 2008, 109(1): 227-234. DOI:10.1016/j.foodchem.2007.12.037. [25] SPENCER J P E, WHITEMAN M, JENNER A, et al. Nitriteinduced deamination and hypochlorite-induced oxidation of DNA in intact human respiratory tract epithelial cells[J]. Free Radical Biology and Medicine, 2000, 28(7): 1039-1050. DOI:10.1016/S0891-5849(00)00190-8.
[26] 毛建卫, 吴元锋, 方晟. 微生物酵素研究进展[J]. 发酵科技通讯, 2010, 39(3): 42-44. DOI:10.16774/j.cnki.issn.1674-2214.2010.03.009.
[27] 刘加友, 王振斌. 微生物酵素食品研究进展[J]. 食品与发酵工业, 2016, 42(1): 273-276. DOI:10.13995/j.cnki.11-1802/ts.201601048.
[28] 陈历水, 丁庆波, 吴伟莉, 等. 发酵果蔬汁的功能特性研究进展[J].食品工业科技, 2012, 33(11): 418-421; 425. DOI:10.13386/ j.issn1002-0306.2012.11.104.
[29] 马霞, 韩迪, 张吉, 等. 乳酸菌在发酵果蔬中的应用[J]. 中国乳品工业, 2013, 41(1): 40-42; 64.
[30] 董银卯, 于晓艳, 潘妍, 等. 微生物酵素抑菌功效研究[J]. 香料香精化妆品, 2008(4): 27-29.
Variations in Composition and Bioactivities during Fermentation of a Mixture of Chinese Yam, Apple and Tomato by Lactic Acid Bacteria
LI Yahui1, MA Yanhong1,*, ZHANG Hongzhi1, HUANG Kaihong1, YIN Jianmei2, WEI Jianming3
(1. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. Institute of Economic Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 3. Jiangsu Boda Biotechnology Co. Ltd., Xuzhou 221000, China)
Changes in the composition and bioactivities of a mixture of Chinese yam pulp, apple juice and tomato juice during fermentation by lactic acid bacteria were assessed through the determination of its physicochemical and microbial properties, enzyme activities, and antioxidant and antibacterial activities. Results showed that pH and total acid content changed fast from the second day to the fourth day of fermentation, and then remained stable after 8 days. Total sugar content declined firstly, then increased, and finally declined again, reaching and maintaining a minimum level after 12 days. Nitrite content reached the highest value on the fourth day but reduced to a minimum level 10 days later. The microbial growth mainly occurred during the first 6 days, and lactic acid bacteria gradually became the dominant bacteria during the fermentation, inhibiting the growth of other bacteria. The activities of superoxide dismutase, amylase, protease and lipase were increased gradually with fermentation time. Superoxide dismutase activity was highest whereas lipase activity was lowest. DPPH radical scavenging, hydroxyl radical scavenging, superoxide anion radical scavenging and total antioxidant activity were increased gradually during fermentation until reaching a plateau after 10 days. The inhibition percentages against Escherichia coli and Staphylococcus aureus were increased gradually during fermentation, reaching the highest value after 12 days of fermentation. This study ma y provide a theoretical basis for the development of functional products based on lactic acid fermentation of fruit and vegetable blends.
yam; lactic acid bacteria; fermentation; composition; bioactivity
10.7506/spkx1002-6630-201710023
S567.2
A
1002-6630(2017)10-0137-06
2016-05-27
江苏省苏北科技发展计划项目(BN2014087);江苏省农业科技自主创新资金项目(CX(16)1019)
李亚辉(1985—),男,助理研究员,博士,研究方向为食品发酵与生物技术。E-mail:liqianhao217@126.com
*通信作者:马艳弘(1972—),女,副研究员,博士,研究方向为食品功能因子开发利用。E-mail:mayhhyy@126.com
李亚辉, 马艳弘, 张宏志, 等. 山药果蔬在乳酸菌发酵过程中组分及生物活性变化[J]. 食品科学, 2017, 38(10): 137-142.
DOI:10.7506/spkx1002-6630-201710023. http://www.spkx.net.cn
LI Yahui, MA Yanhong, ZHANG Hongzhi, et al. Variations in composition and bioactivities during fermentation of a mixture of Chinese yam, apple and tomato by lactic acid bacteria[J]. Food Science, 2017, 38(10): 137-142. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710023. http://www.spkx.net.cn
山药;乳酸菌;发酵;组分;生物活性

