抗荧光假单胞菌Carnobacterium spp. LB1培养发酵条件的优化
董韩博,谢 晶,钱韻芳,杨胜平,苟 怡
(上海水产品加工及贮藏工程技术研究中心,上海海洋大学食品学院,上海 201306)
抗荧光假单胞菌Carnobacterium spp. LB1培养发酵条件的优化
董韩博,谢 晶*,钱韻芳,杨胜平,苟 怡
(上海水产品加工及贮藏工程技术研究中心,上海海洋大学食品学院,上海 201306)
为了改善和优化海产品源肉食杆菌(Carnobacterium)spp. LB1产有效抑菌代谢产物的培养发酵条件,提高对荧光假单胞菌(Pseudomonas fluorescens)的抑菌效果。基于单因素试验,从对Carnobacterium spp. LB1抑菌效果有影响的5 个因素中筛选出3 个显著影响因素,运用Design-Expert软件的Box-Behnken试验设计原则研究3 个显著影响因素的重要水平和交互作用。结果表明:Carnobacterium spp. LB1的最佳培养发酵条件:初始pH 6.22、温度28.6 ℃、葡萄糖质量分数3%。在最优培养条件下,Carnobacterium spp. LB1的浓缩发酵液在15 h和18 h对P.uorescens的抑菌率分别为80.7%、86.3%,其抑菌机理是Carnobacterium spp. LB1破坏了P.uorescens的细胞壁,导致其通透性增大,碱性磷酸酶大量溢出,使其代谢紊乱,从而抑制了P. fluorescens的生长。同时,最优发酵条件下获得的实验结果平均值与模型预测值基本吻合,进而说明所建立回归模型是可靠的。
荧光假单胞菌(Pseudomonas fluorescens)是一种革兰氏阴性杆状嗜冷微生物,具有分布范围广、营养需求单一、竞争定植力强等特点,在4 ℃条件下能够快速繁殖;水产品由于捕捞、贮藏和运输等过程中的人为操作不当或者机械损伤,鱼体易被该菌侵入引起致腐,它是水产品的主要优势致病菌和腐败菌[1-4]。
乳酸菌是一种新型的微生物源生物保鲜剂,通过生态位竞争、营造酸性环境和产生H2O2、细菌素等抑菌性物质抑制食品中铜绿假单胞菌、单增李斯特菌、金黄色葡萄球菌等常见腐败菌和致病菌的生长和繁殖[5-9]。傅容辉等[10]研究乳酸菌对荧光假单胞菌、金黄色葡萄球菌等水产品常见的腐败菌和致病菌的抑菌机理时,其中有3 株植物乳杆菌ACCC10171、ACCC11095和ACCC1118,2 株干酪乳杆菌ACCC11052和ACCC11050对荧光假单胞菌抑菌作用显著,抑菌圈基本上都达到17.95 mm左右。高鹏等[11]从自制酸菜中分离得到的植物乳杆菌HLJ-174,对大肠杆菌、荧光假单胞菌等有明显抑菌效果。Liu Hui等[12]从奶酪中分离得到一株植物乳杆菌Q7,产生一种新颖的植物乳杆菌素Q7,不仅能够抑制荧光假单胞菌AS1.1802的生长繁殖,同时对恶臭假单胞菌AS1.1819、铜绿假单胞菌CICC21636等有良好的抑制作用。Vaz-Velho等[13]从水产品肠道中分离得到的Carnobacterium divergens V41使单增李斯特菌降低了1 个对数值。目前,一些乳酸菌产代谢产物和抑菌制剂已应用于食品防腐和动物饲料[14-17],但是现已有的乳酸菌产有效抑菌代谢产物的量普遍较低,抑菌效果有限。从海产品肠道中Carnobacterium最适生长温度相对较低[18-19],协同低温贮藏保鲜水产品,对水产品中的条件优势腐败菌会有更好的抑菌效果,因此优化培养从环境中所筛选得到的菌株以应用的水产品低温贮运是相对有效可行的方法。
本研究以从带鱼肠道中筛选得到的抑菌效果最明显的Carnobacterium spp. LB1作为供试菌,做后续优化实验,为提升其抑菌效果,以本实验室保藏的荧光假单胞菌作为指示菌,采用微量法通过单因素试验初筛显著影响因素,采用响应面法的Box-Behnken设计对显著影响因素的重要水平和交互作用进行研究和分析,以确定Carnobacterium spp. LB1抑菌性最优的培养发酵条件和营养成分,提高其抑菌效果,为其在水产品保鲜上的研究和使用提供一定的参考依据。
1 材料与方法
1.1 菌株
菌株Carnobacterium spp. LB1为带鱼肠道中获取;荧光假单胞菌为上海海洋大学上海水产品加工及贮藏工程技术研究中心保存。
1.2 培养基与试剂
胰酪胨大豆琼脂培养基(soybean-casein digest agar,TSA)、胰酪胨大豆肉汤(trypticase soy broth,TSB)培养基、脑心浸液肉汤(brain heart influsion,BHI)培养基、含0.6%酵母膏的胰酪胨大豆肉汤(trypticase soybrothyeast extract,TSB-YE)培养基青岛海博生物技术有限公司;葡萄糖、蔗糖、果糖、尿素、酵母膏、氯化铵 国药集团化学试剂有限公司;碱性磷酸酶(alkaline phosphomonoestesase,AKP)试剂盒 南京建成生物工程研究所。
1.3 方法
1.3.1 预处理
指示菌的活化:将本实验室-80 ℃保藏的荧光假单胞菌(P.uorescens)在TSA固体培养基上划线,37 ℃培养48 h,挑单菌落于液体培养基37 ℃过夜摇床培养,活化传代培养3~4 次。
供试菌的活化:将-80 ℃保藏菌株Carnobacterium spp. LB1在TSA固体培养基上划线,挑单菌落接种到BHI液体培养基中,30 ℃静置培养24 h,反复传代接种培养3~4 次。
浓缩发酵液的获取:将活化的Carnobacterium spp. LB1接种到TSB-YE液体培养基中,静置培养一定时间,10 000 r/min离心15 min,用0.22 μm的微孔滤膜过滤去除菌体,置于-80 ℃冰箱中冷冻12 h,经真空冷冻干燥得10 倍浓缩发酵液[20],4 ℃保存备用。
1.3.2 抑菌性物质的单因素试验
微量法测抑菌性物质的抑菌率[21]。无菌条件下,在96微孔板上添加100 μL的指示菌菌悬液,取100 μL浓缩发酵液添加到含有100 μL指示菌菌悬液的96 孔板上,以添加同体积的无菌水的孔作为空白对照,以添加100 μL浓缩发酵液的100 μL无菌液体培养基为参比溶液,将96微孔板用保鲜膜包好以防止外界污染。包好的96 孔板置于37 ℃摇床培养,每间隔3 h用酶标仪在600 nm波长处测定并记录菌悬液的吸光度,按照下式计算抑菌率:

式中:A样品为浓缩发酵液、指示菌菌悬液混合后的吸光度;A参比为浓缩发酵液、无菌液体培养基混合后的吸光度;A空白为无菌水、指示菌菌悬液混合后的吸光度。
1.3.2.1 培养温度对抑菌率的影响
将活化后传代培养2 次的Carnobacterium spp. LB1接种TSB-YE液体培养基中,在25、30、37 ℃条件下静置培养36 h,采用微量法以P. fluorescens为指示菌检测不同培养温度对抑菌率的影响。
1.3.2.2 初始pH值对抑菌率的影响
调节TSB-YE的初始pH值为5.0、5.5、6.0、6.5、7.0,将活化后的肉食杆菌接种到不同pH值液体培养基中,在最适温度下静置培养,得到浓缩发酵液。采用微量法以P.uorescens为指示菌检测不同初始pH值对抑菌率的影响。
1.3.2.3 接种量对抑菌率的影响
将活化后传代培养两次的Carnobacterium spp. LB1以1%、2%、3%、4%、5%的接种量接种TSB-YE液体培养基中,根据以上试验结果,在最佳的初始pH值和温度下静置培养,得到浓缩发酵液,采用微量法以P.uorescens为指示菌检测不同接种量对抑菌率的影响。
1.3.2.4 碳源对抑菌率的影响
取葡萄糖、果糖、蔗糖添加到TSB-YE液体培养基中,使其终质量分数为2%,采用微量法抑菌实验以获取抑菌效果最好的碳源,以P.uorescens为指示菌采用微量法从1%、2%、3%、4%和5%中筛选最佳碳源的最优终质量分数。
1.3.2.5 氮源对抑菌率的影响
取尿素、酵母膏、氯化铵添加到TSB-YE液体培养基中,使其终质量分数为2%,采用微量法抑菌实验以获取抑菌效果最好的氮源,以P.uorescens为指示菌采用微量法从1%、2%、3%、4%和5%中筛选最佳氮源的最优终质量分数。
1.3.3 响应面法和数据分析
根据单因素水平试验结果,最终优选出3 个主要影响因素,进而确定数值范围。按照响应面试验的Box-Behnken试验设计方案进行。
1.3.4 最佳抑菌效果优化结果验证和浓缩发酵液抑菌特性初步分析
1.3.4.1 对细胞膜通透性的影响
将P. fluorescens于37 ℃条件下摇床培养,取适量菌液,加入一定量的浓缩发酵液,用蒸馏水代替发酵液作为对照组,分别于0、2、4、6、8、10、12 h测定培养液的电导率值,从而确定金属离子的渗出变化趋势。
1.3.4.2 对细菌菌体内AKP酶的影响
活化得到P.uorescens菌悬液,加入浓缩发酵液。使用摇床将其置于37 ℃条件下培养16~18 h,对照组不添加保鲜剂,空白为未接种的培养液。分别于0、2、4、6、8、10、12 h取上清液,按照ATP酶测试试剂盒中操作说明进行测试。
2 结果与分析
2.1 不同培养发酵条件对Carnobacterium spp. LB1抑菌活性的影响
由图1a可知,在温度为30 ℃时,其所得到的发酵液在15 h和18 h时的抑菌率相比对照组较高,这与Sip等[19]抑菌研究培养发酵条件一致。当初始pH值为6.5时,得到的浓缩发酵液对P. fluorescens的抑菌率达到最大,15 h的抑菌率达到93%,18 h为89%,初始pH值影响了发酵液中有效抑菌产物的产生[22],也有一些研究表示pH值对乳酸菌的抑菌能力影响不大,只是和接种量呈现负相关[19]。当接种量小于3%时,抑菌活性随着接种量的增加而加强,接种量为3%时抑菌活性最强,当接种量大于3%时,抑菌活性随着接种量的增加而降低,后续实验采用接种量3%作为Carnobacterium spp. LB1的培养发酵条件。

图 1 温度(a)、初始pH值(b)、接种量(c)对Carnobacteriumspp. LB1抑菌能力的影响Fig. 1 Effect of temperature (a), initial pH (b), inoculum amount (c) on antimicrobial activity of fermentation broth of Carnobacterium spp. LB1
2.2 不同营养成分对Carnobacterium spp. LB1抑菌活性的影响。
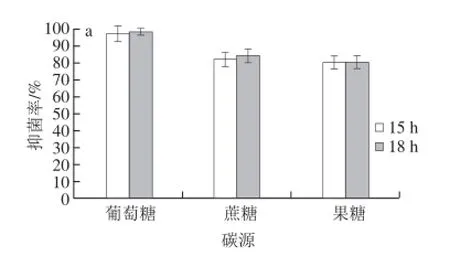
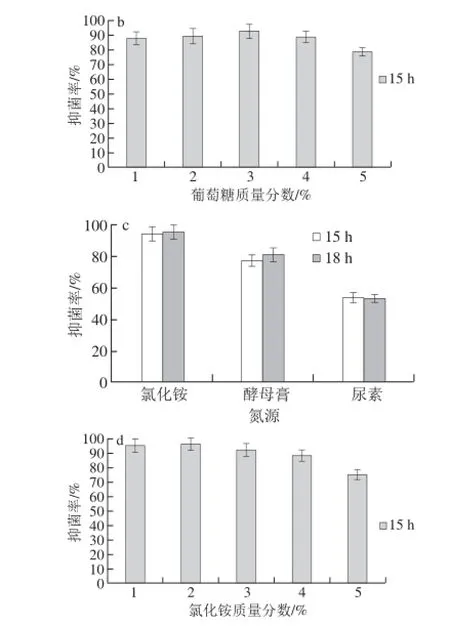
图 2 碳源(a、b)和氮源(c、d)对Carnobacterium spp. LB1抑菌能力的影响Fig. 2 Effects of carbon sources (a, b) and nitrogen sources (c, d) on antimicrobial activity of fermentation broth of Carnobacterium spp. LB1
如图2所示,不同的碳源对Carnobacterium spp. LB1浓缩发酵液的抑菌效果有明显的影响,3 种碳源之间具有明显差异,在15 h和1 8h时的抑菌活性依次为:葡萄糖>蔗糖>果糖,添加葡萄糖为碳源时,得到的浓缩发酵液对P. fluorescens的抑菌率明显高于其他碳源,葡萄糖质量分数从1%开始,Carnobacterium spp. LB1浓缩发酵液的抑菌活性随着葡萄糖质量分数的升高而增大,当葡萄糖质量分数为3%时出现峰值,此时Carnobacterium spp. LB1浓缩发酵液抑菌活性较强,这与杨云喜等[23]研究结果相似,其从酸菜中筛选出一株对革兰氏阳性和革兰氏阴性菌都有明显抑菌效果的植物乳酸杆菌9-4,结果表明葡萄糖是植物乳酸杆菌9-4合成抗菌肽的最优碳源,当葡萄糖质量分数为2.5%,抑菌效果出现峰值,达到最佳。
选择氯化铵为氮源,当其质量分数为1%时,其对指示菌的抑菌效果较好。这与吴大华[24]研究结果相似,1%氯化铵促进了枯草芽孢杆菌CS27的细胞生长,有效地促进了其发酵过程中代谢产物的产生。Carnobacterium spp. LB1的浓缩发酵液的抑菌活性随着氯化铵终质量分数的增长反而降低,可能由于氯化铵质量分数过大,在微生物利用降解过程中产生大量氨类物质,导致培养液的pH值升高,不利于Carnobacterium spp. LB1的生长和繁殖,导致Carnobacterium spp. LB1数量减少,进而影响有效抑菌代谢物的产生。
2.3 响应面试验
2.3.1 预测模型建立及显著性检验
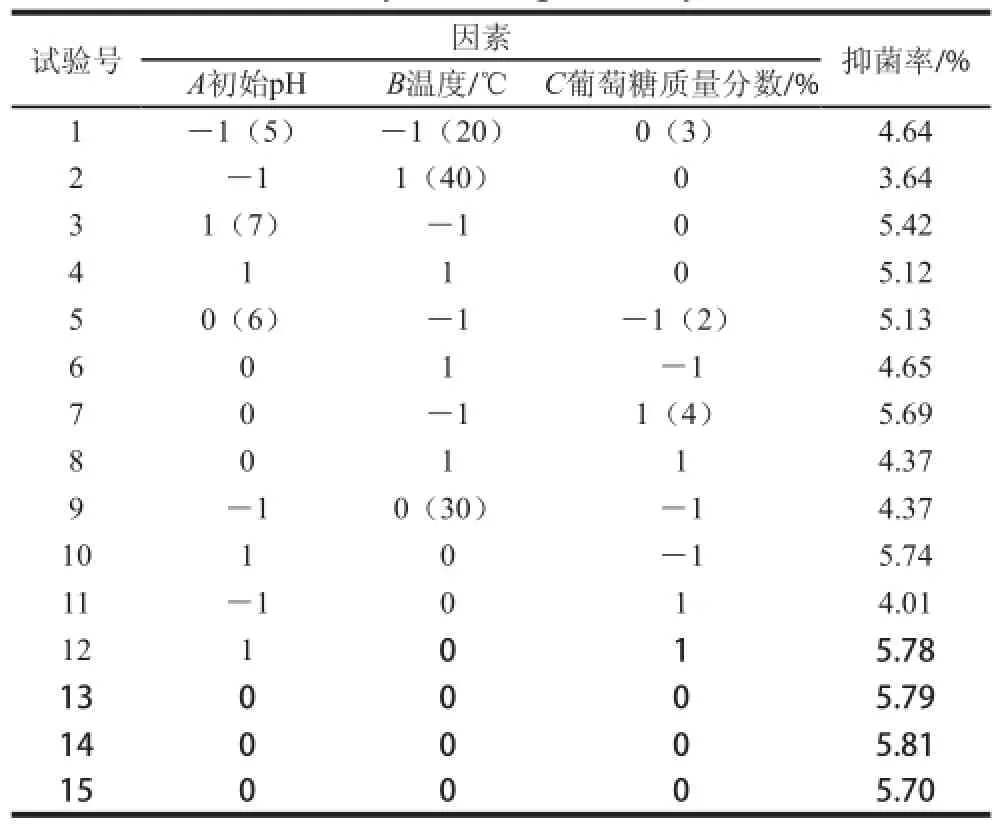
表 1 中心组合试验设计方案和结果Table 1 Central composite design with experimental results
根据单因素试验结果,筛选对Carnobacterium spp. LB1的浓缩发酵液的抑菌活性有明显影响效果的初始pH值、温度、葡萄糖质量分数为3 个显著影响因素。采用Box-Behnken试验设计,试验方案和结果见表1。通过以不同条件下得到的浓缩发酵液对P.uorescens的抑菌率为响应值,根据表1中的试验数据,运用Design Expert 8.0统计软件进行处理,对Box-Behnken设计试验结果进行二次多项回归拟合,建立抑菌率(Y)与初始pH值(A)、温度(B)和葡萄糖质量分数(C)3 个因素的多项回归方程:Y=5.840+0.670A-0.390B-0.005C+0.180AB+ 0.100AC-0.210BC-0.560A2-0.580B2-0.310C2。
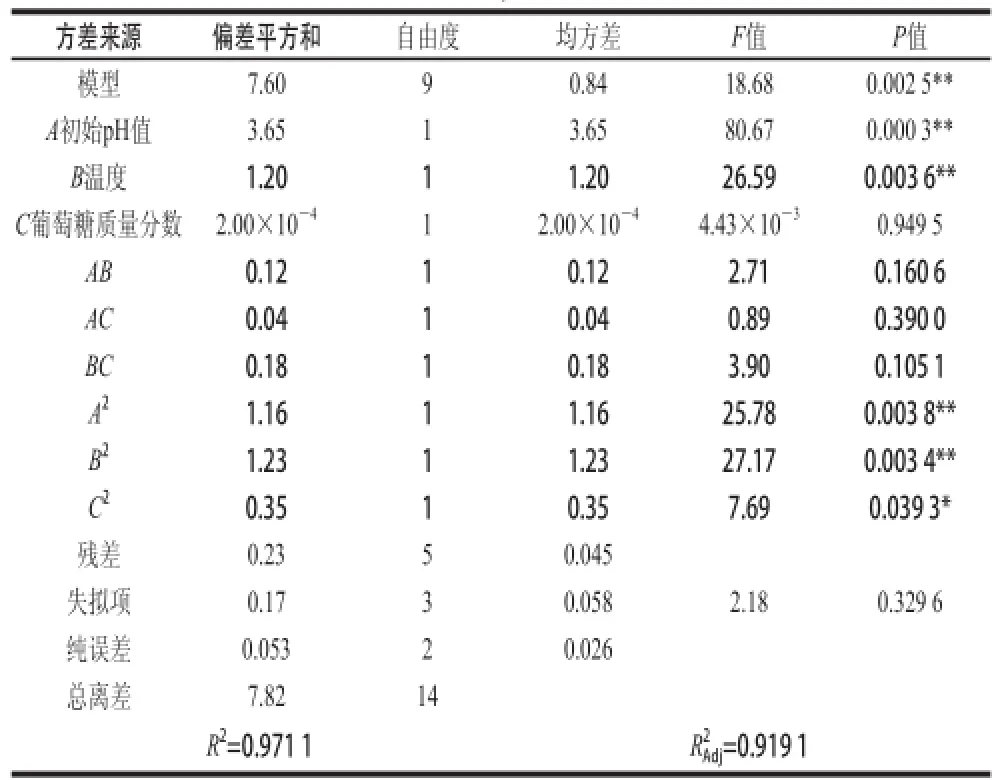
表 2 方差分析Table 2 Analysis of variance
对上述回归方程进行方差分析,结果表2所示,该模式回归显著(F=18.68),回归方程的失拟性检验表示不显著(P=0.329 6>0.05)。回归方程的R2Adj为0.919 1,说明该方程能够解释91.91%响应值的变化,决定系数R2为0.971 1,说明Carnobacterium spp. LB1的有效代谢产物对P.uorescens的抑菌率的实测值和预测值具有良好的拟合性。回归方程中3 种显著影响因素对响应值影响的显著程度通过检验F值来判定,所对应变量的P值和其显著程度呈负相关,即P值越小,对应变量的显著程度反而越高。模型一次项A、B极显著,C不显著;交互项AB、AC和BC不显著,二次项A2、B2极显著,C2显著。
由上述多项回归模型得到的立体响应面图(图3),分别体现了对Carnobacterium spp. LB1浓缩发酵液的抑菌性有明显影响效果的3 个显著因素两两之间交互作用。通过回归方程发现,二次项系数均为负值,表示其形成的抛物面开口朝下,具有极大值点。利用Design Expert 6.0软件对Carnobacterium spp. LB1浓缩发酵液抑菌效果的3 个显著影响因素进一步优化分析,所对应的3 个显著因素最佳条件分别为初始pH 6.22、温度28.6 ℃、葡萄糖质量分数3%,此时浓缩发酵液对指示菌的抑菌率最高,达到85.4%。根据实验室实际操作的方便性和方差分析结果,确定Carnobacterium spp. LB1最佳培养发酵条件为:初始pH 6.2、温度28 ℃、葡萄糖质量分数为3%。
2.3.2 验证实验结果
以初始pH 6.2、温度28 ℃、葡萄糖质量分数3%为Carnobacterium spp. LB1发酵培养条件,测定Carnobacterium spp. LB1浓缩发酵液对P. fluorescens的抑菌率。浓缩发酵液对指示菌的抑菌率在15 h和18 h时的平均值分别为80.7%、86.3%。说明上述回归方程的拟合性良好,能够很好地反映培养条件和营养成分对Carnobacterium spp. LB1浓缩发酵液抑菌活性的影响。
2.4 Carnobacterium spp. LB1浓缩发酵液对P.uorescens的抑菌机理研究
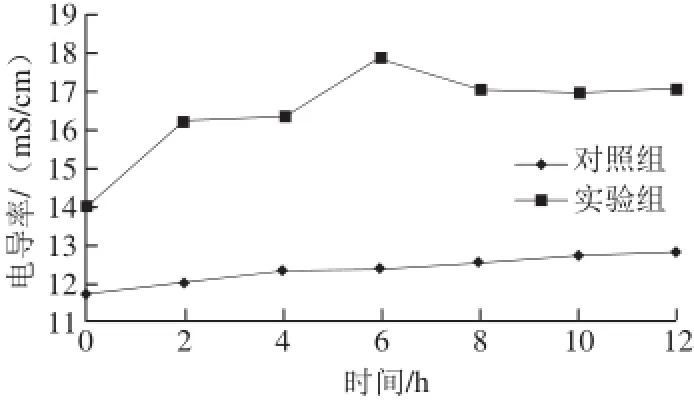
图 4 浓缩发酵液对荧光假单胞菌菌液电导率的影响Fig. 4 Effects of concentrated fermentation broth of Carnobacterium spp. LB1 on electric conductivity of P.uorescens cell suspension
2.4.1 对P.uorescens细胞膜通透性的影响结果当微生物细胞膜因为外界不利环境或者抑菌剂而遭到破坏时,其胞内电解质如Na+、K+等离子会大量漏出,渗入到培养液中,导致培养液的电导率升高。因此,通过监测培养液的电导率的变化可以间接反映细胞膜通透性的变化状况[25-27]。以P. fluorescens为指示菌,由图4可知,浓缩发酵液处理的实验组的电导率明显高于对照组,说明Carnobacterium spp. LB1浓缩发酵液对荧光假单胞菌的影响作用较大,破坏其细胞膜结构,使其通透性增大,造成大量电解质外渗。6 h时,实验组达到最大(17.84 mS/cm),之后略有降低,可能由于随着时间的延长,浓缩发酵液浓度降低等因素条件,对细胞膜的破坏作用有限,在静电作用下,使菌液中其他金属离子和细胞膜结合,从而导致菌液电导率略有降低[20]。
2.4.2 对P.uorescens菌体内AKP的影响
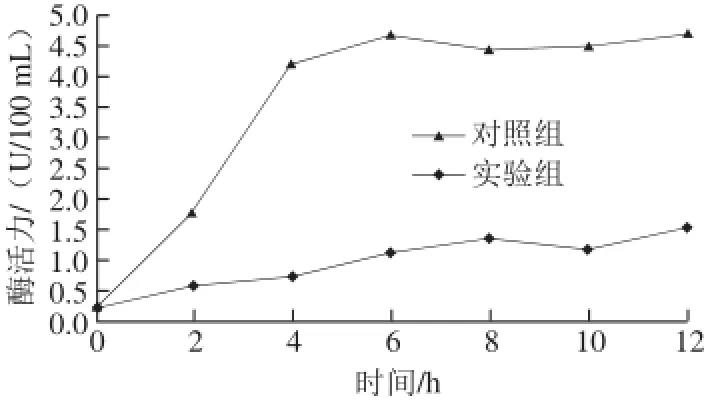
图 5 浓缩发酵液对荧光假单胞菌AKP酶活力的影响Fig. 5 Effect of concentrated fermentation broth of Carnobacterium spp. LB1 on AKP activity in P.uorescens
AKP是存在于细菌细胞膜和细胞壁之间的一种非特异性磷酸单酯酶,在细菌代谢过程中起到至关重要的作用[28]。微生物正常生长状态下测得细菌内AKP难度很大,但当细菌细胞壁由于外界因素破损,胞体通透性增大,AKP大量渗透到胞外,因此,通过测定培养液中AKP的变化可以很好反映菌体细菌壁通透性的变化情况[29]。由图5可知,经Carnobacterium spp. LB1浓缩发酵液处理后的荧光假单胞菌菌液的AKP含量从第2上升速率达最快,之后上升幅度缓慢,6 h后呈现平稳趋势。而对照组从0~12 h始终处于低AKP含量的平稳增长趋势。Carnobacterium spp. LB1浓缩发酵液破环P. fluorescens的胞体完整性,使大量AKP溢出,导致细胞的代谢循环受阻,从而抑制P.uorescens的生长。
3 结 论
单因素试验初步优化培养发酵条件和营养成分结果:Carnobac terium spp. LB1的最佳接种量3%、最佳初始pH 6.5,最佳培养温度30 ℃、最佳碳源为3%葡萄糖、最佳氮源为1%无机氮。
在单因素试验结果基础上,选取对Carnobacterium spp. LB1的抑菌效果有明显效果的初始pH值、温度和葡萄糖质量分数作为3 个显著影响因素。采用微量法以P.uorescens为指示菌利用Design expert 6.0软件处理Box-Behnken设计试验结果,建立了抑菌率同初始pH值、温度和葡萄糖质量分数3 个显著因素的二次多项回归方程,经验证后该模型可靠。
确定Carnobacterium spp. LB1的最佳培养发酵条件为:初始pH 6.22、温度28.6 ℃、葡萄糖质量分数3%,此时得到的浓缩发酵液对指示菌的抑菌率最高,达到85.4%。考虑到实验室实际操作的方便性和方差分析结果,确定Carnobacterium spp. LB1最佳培养发酵条件为:初始pH 6.2、温度28 ℃、葡萄糖质量分数为3%。验证实验时,Carnobacterium spp. LB1在最佳发酵条件下获得的浓缩发酵液,对指示菌在15 h和18 h时的抑菌率的平均值分别为80.7%、86.3%。
在最佳发酵培养条件获得的Carnobacterium spp. LB1浓缩发酵液,能够破坏P. fluorescens的细胞膜,菌体内AKP大量溢出,浓缩发酵液刚加入时,增大速率较大,6 h后呈平稳趋势,此时,P.uorescens细胞通透性达到最大,导致胞内电解质大量漏出,导致其代谢紊乱,抑制P.uorescens的生长和繁殖。
[1] 张伟琼, 聂明, 肖明. 荧光假单胞菌生防机理的研究进展[J]. 生物学杂志, 2007, 24(3): 9-11. DOI:10.3969/j.issn.2095-1736.2007.03.003.
[2] 蓝蔚青, 谢晶, 周会, 等. 不同时期鲳鱼冷藏期间优势腐败菌的多样性变化[J]. 食品科学, 2015, 36(2): 226-231. DOI:10.7506/spkx1002-6630-201502044.
[3] 高琳, 陈万义, 任婧. 食品中荧光假单胞菌的危害及其快速检测方法研究进展[J]. 食品工业科技, 2015, 36(16): 373-377. DOI:10.13386/j.issn1002-0306.2015.16.068.
[4] 王玲. 大西洋鲑荧光假单胞菌感染症的病原学及病理学研究[D].雅安: 四川农业大学, 2010: 8-11.
[5] 缪璐欢, 杜静芳, 马欢欢, 等. 淡水鱼肠道中抗大肠杆菌O157:H7乳酸菌的筛选及抑菌作用研究[J]. 食品与发酵工业, 2015, 41(10): 7-13. DOI:10.13995/j.cnki.11-1802/ts.201510002.
[6] BARBOSA M D S, TODOROV S D, IVANOVA I, et al. Improving safety of salami by application of bacteriocins produced by an autochthonous Lactobacillus curvatus isolate[J]. Food Microbiology, 2015, 46: 254-262. DOI:10.1016/j.fm.2014.08.004.
[7] MALHEIROS P S, CUCCOVIA I M, FRANCO B D G M. Inhibition of Listeria monocytogenes in vitro and in goat milk by liposomal nanovesicles containing bacteriocins produced by Lactobacillus sakei subsp. sakei 2a[J]. Food Control, 2015, 63: 158-164. DOI:10.1016/ j.foodcont.2015.11.037.
[8] 吕欣然, 李莹, 马欢欢, 等. 辽西传统发酵食品中抗单增李斯特菌乳酸菌的筛选与鉴定[J]. 食品工业科技, 2016, 37(3): 143-148. DOI:10.13386/j.issn1002-0306.2016.03.022.
[9] 缪璐欢, 杜静芳, 马欢欢, 等. 淡水鱼肠道中抗芽孢杆菌性乳酸菌的筛选与鉴定[J]. 食品工业科技, 2015, 36(16): 188-192. DOI:10.13386/j.issn1002-0306.2015.16.030.
[10] 傅容辉, 张晓霞, 梁运祥. 生物保鲜乳酸菌的筛选及 抑菌物质性质的初步研究[J]. 食品与发酵工业, 2007, 33(11): 72-74.
[11] 高鹏, 韩金志, 陆兆新, 等. 广谱抗菌乳酸菌的分离鉴定及细菌素的提取和纯化[J]. 食品科学, 2016, 37(11): 160-166. DOI:10.7506/ spkx1002-6630-201611028.
[12] LIU H, ZHANG L, Yi H, et al. Identification and characteriz ation of plantaricin Q7, a novel plantaricin produced by Lactobacillus plantarum Q7[J]. LWT-Food Science and Technology, 2016, 71: 386-390. DOI:10.1016/j.lwt.2016.04.009.
[13] VAZ-VELHO M, TODOROV S, RIBEIRO J, et al. Growth control of Listeria innocua 2030c during processing and storage of coldsmoked salmon-trout by Carnobacterium divergens V41 culture and supernatant[J]. Food Control, 2005, 16(6): 540-548. DOI:10.1016/ j.foodcont.2004.05.012.
[14] 马美湖, 娄爱华, 葛长荣, 等. 冷却肉生产中保鲜技术的研究: 溶菌酶、Nisin、山梨酸钾保鲜正交试验[J]. 食品科学, 2005, 3: 235-243. DOI:10.3321/j.issn:1002-6630.2003.04.017.
[15] KAKATKAR A S, GAUTAM R K, SHASHIDHAR R. Combination of glazing, nisin treatment and radiation processing for shelflife extension of seer fish (Scomberomorous guttatus) steaks[J]. Radiation Physics and Chemistry, 2016, 130: 303-305. DOI:10.1016/ j.rad physchem.2016.09.017.
[16] 罗欣, 朱燕. Nisin在牛肉冷却肉保鲜中的应用研究[J]. 食品科学, 2000, 21(3): 53-57. DOI:10.3321/j.issn:1002-6630.2000.03.021.
[17] LI C, BLENCKE H M, Smith L C, et al. Two recombinant peptides, SpStrongylocins 1 and 2, from Strongylocentrotus pu rpuratus, show antimicrobial activity against Gram-positive and Gram-negative bacteria[J]. Developmental and Comparative Immunology, 2010, 34(3): 286-292. DOI:10.1016/j.dci.2009.10.006.
[18] HAMMES W P, HERTEL C. The Genera Lactobacillus, and Carnobacterium[M]. Berlin: Springer, 2006: 320-403.
[19] SIP A, GRAJEK W, BOYAVAL P. Enhancement of bacteriocin production by Carnobacterium divergens AS7 in the presence of a bacteriocinsensitive strain Carnobacterium piscicola[J]. International Journal of Food Microbiology, 1998, 42(1/2): 63-69. DOI:10.1016/S0168-1605(98)00062-2.
[20] 李院, 魏新元, 王静, 等. 抑制青霉菌乳酸菌的分离、鉴定及抑菌物质分析[J]. 食品科学, 2015, 36(21): 150-155. DOI:10.7506/spkx1002-6630-201521029.
[21] 倪文杰. 山西老陈醋类黑精的抑菌作用研究[D]. 太原: 山西大学, 2015: 9-11.
[22] MIAO J Y, XU M B, GUO H X, et al. Optimization of culture conditions for the production of antimicrobial substances by probiotic Lactobacillus paracasei subsp. tolerans FX-6[J]. Journal of Functional Foods, 2015, 18: 244-253. DOI:10.1016/j.jff.2015.07.011.
[23] 杨云喜, 李佩, 徐岳松, 等. 产抗菌肽乳酸菌的分离、鉴定及培养条件优化[J]. 应用与环境生物学报, 2014, 20(5): 817-824.
[24] 吴大华. 枯草芽孢杆菌CS27高密度培养及保藏研究[D]. 福州: 福建农林大学, 2011: 37-54.
[25] 钱丽红, 陶妍, 谢晶. 茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J]. 微生物学通报, 2010, 37(11): 1628-1633.
[26] 宁初光, 杨洋, 吴小勇. 电导率法快速检测食品细菌总数的研究[J]. 现代食品科技, 2012, 28(2): 237-240. DOI:10.3969/j.issn.1673-9078.2012.02.027.
[27] 谢丽, 孙瑞珠, 马玉龙. 应用电导率仪测定微生物生物量的研究[J]. 安徽农业科学, 2011, 39(31): 19048-19050. DOI:10.3969/ j.issn.0517-6611.2011.31.007.
[28] 王秋颖. 碱性磷酸酶特性及其应用的研究进展[J]. 中国畜牧兽医, 2011, 38(1): 157-161.
[29] KARA S, YAMAKAWA M. Moricin, a novel type of antibacterial peptide isolated from the silkworm, Bombyx mori[J]. The Journal of Biological Chemistry, 1995, 270(50): 29923-29927. DOI:10.1074/jbc.270.50.29923.
Optimization of Culture Conditions of Carnobacterium spp. LB1 for Enhanced Production of Anti-Pseudomonasuorescens Metabolites
DONG Hanbo, XIE Jing*, QIAN Yunfang, YANG Shengping, GOU Yi
(Shanghai Engineering Research Center of Aquatic Product Processing and Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
This study aimed to optimize the culture conditions for Carnobacterium spp. LB1, isolated from the ribbon sh intestine, to produce anti-Pseudomonas fluorescens metabolites. By using one-factor-at-a-time method, three of the five factors were selected for their significant influences on the antibacterial activity. A Box-Behnken design was applied to evaluate the effects of interaction among the chosen variables and optimize them. The optimum culture conditions obtained were as follows: initial pH, 6.22; temperature, 28.6 ℃; and glucose concentration, 3%, where the percentage inhibition of concentrated fermentation broth harvested after 15 and 18 h against Pseudomonasuorescens were 80.7% and 86.3%, respectively. The antibacterial mechanism was due to increased cell wall permeability and leakage of a large amount of alkaline phosphatase (AKP) after the destruction of the cell wall of Pseudomonasuorescens, leading to metabolic disorders. Finally, the experimental results obtained under the optimized fermentation conditions were in good agreement with the model predictions, indicating that the established model in this study was feasible.
Carnobacterium spp. LB1; Pseudomonasuorescens; antibacterial activity; response surface methodology
10.7506/spkx1002-6630-201710010
Q93-331
A
1002-6630(2017)10-0055-06
董韩博, 谢晶, 钱韻芳, 等. 抗荧光假单胞菌Carnobacterium spp. LB1培养发酵条件的优化[J]. 食品科学, 2017, 38(10): 55-60. DOI:10.7506/spkx1002-6630-201710010. http://www.spkx.net.cn
DONG Hanbo, XIE Jing, QIAN Yunfang, et al. Optimization of culture conditions of Carnobacterium spp. LB1 for enhanced production of anti-Pseudomonas fluorescens metabolites[J]. Food Science, 2017, 38(10): 55-60. (in Chinese with English abstract)
10.7506/spkx1002-6630-201710010. http://www.spkx.net.cn
2016-09-03
国家自然科学基金面上项目(31571914);上海市科技兴农重点攻关项目(沪农科攻字(2016)第1-1号);上海市科委平台能力提升项目(16DZ2280300)
董韩博(1991—),男,硕士研究生,研究方向为食品科学与工程。E-mail:donghanbo2015@163.com
*通信作者:谢晶(1968—),女,教授,博士,研究方向为食品工程。E-mail:jxie@shou.edu.cn
肉食杆菌;荧光假单胞菌;抑菌;响应面

