白鲢鱼肌肉脂肪氧合酶提取条件优化及酶学性质研究
王帮国,林 琳,余振宇,李 洋,姜绍通
(合肥工业大学农产品加工研究院,合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽合肥 230009)
白鲢鱼肌肉脂肪氧合酶提取条件优化及酶学性质研究
王帮国,林 琳,余振宇,李 洋,姜绍通*
(合肥工业大学农产品加工研究院,合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽合肥 230009)
本文以白鲢鱼肌肉为原料,通过单因素实验对白鲢鱼肌肉脂肪氧合酶(LOX)提取条件进行优化;用圆二色谱法和荧光光谱法对其贮藏稳定性、热稳定性、最适pH进行研究;探讨磷酸盐缓冲液pH、离子强度、二硫苏糖醇(DTT)和乙二胺四乙酸(EDTA)添加量对白鲢鱼肌肉LOX提取工艺的影响。结果表明,白鲢鱼肌肉LOX适宜提取条件为磷酸盐缓冲液pH7.8、离子强度50 mmol/L、EDTA和DTT添加量均为2 mmol/L,在此条件下提取白鲢鱼肌肉LOX的酶液浓度为(1.98±0.037) mg/mL,活力为(244.44±5.93) U。通过对LOX酶学性质研究可知,白鲢鱼肌肉LOX在常温条件下0~2 d内酶活性较为稳定,最适作用温度为40 ℃,最适pH为7.8。
白鲢鱼,脂肪氧合酶,提取条件,酶学性质
我国是世界淡水渔业第一大国,2015年我国淡水产品产量3290.04万t,占我国水产品总产量的49.11%。白鲢生长周期短、抗病能力强、产量高,而且肉质鲜嫩、营养丰富,养殖产量位居淡水鱼类第二,是四大家鱼之一[1-3]。近年来白鲢鱼主要以鲜销为主,工业化加工发展缓慢,其中土腥味是制约鲢鱼加工发展的重要因素之一[4]。
白鲢鱼在贮藏与加工过程中,会出现腥味明显增强的现象,大大影响了消费者对白鲢鱼及其制品的喜爱。据已有报导,导致白鲢鱼在贮藏和加工过程中腥味增加的原因主要是有两个方面,一是由于自身不饱和脂肪酸严重氧化生成的挥发性成分,二是来源于白鲢鱼养殖过程中饮食和周围环境中物质在体内的堆积[5]。目前认为导致白鲢鱼腥味加重主要是因为白鲢鱼体内的脂肪氧合酶催化降解不饱和脂肪酸产生的各种醛类物质引起的,不同种鱼的特征性风味物质均是由其体内的LOX所决定的。Fu等[6-7]研究表明,白鲢鱼体内主要含有12-LOX,其能快速催化分解不饱和脂肪酸,产生和鲢鱼腥味密切相关的醛类物质。
脂(肪)氧合酶(LOX,EC1.13.11.12)是一种氧化还原蛋白酶,能催化含顺,顺-1,4-戊二烯结构的不饱和脂肪酸,生成具有共轭双键的不饱和脂肪酸的氢过氧化物[8-9],目前普遍认为LOX的催化中心与Fe离子有关,其活化态为高自旋的氧化型Fe3+,非活化态为高自旋的还原型Fe2+[10-13]。白鲢鱼肌肉LOX氧化会造成不饱和脂肪酸含量下降,降低鱼肉营养价值,大大影响鲢鱼肉在贮藏和加工过程中的品质,为了更好地研究白鲢腥味物质的产生机理和途径,研发新型脱腥工艺,保持白鲢鱼加工过程中的品质和营养价值,本文以白鲢鱼肉为原料,从中提取LOX,对酶的提取条件进行优化,并对LOX的酶学性质进行初步研究,为白鲢的土腥味控制和精深加工提供技术和数据支持。
1 材料与方法
1.1 材料与仪器
鲜活白鲢鱼 合肥市马鞍山路家乐福超市,条重(1100±200) g。磷酸二氢钾、磷酸氢二钾、氢氧化钠、DTT、EDTA、硫酸铵、亚油酸、硼酸、硼砂、吐温20 分析纯试剂。
JJ-2型组织捣碎机 江苏省金坛市城西峥嵘实验仪器厂;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;T6新世纪紫外可见光分光光度计 北京普析通用仪器有限责任公司;HH-4数显恒温水浴锅 江苏省金坛市白塔新宝仪器厂;Jasco-810-CD圆二色谱仪 日本Jasco公司;SHIMADZU RF-5301PC荧光分光光度计 岛津(香港)有限公司。
1.2 实验方法
1.2.1 白鲢鱼肌肉LOX的提取 参照Gata等[14]方法稍加修改,将鲜活白鲢鱼宰杀,于冰袋中带回实验室,然后置于装满冰的冰盒中去头尾和内脏,用冷水洗净,去脊骨和鱼皮,手工采集背部白色肌肉;将新鲜肌肉置于组织捣碎机中,添加4倍体积的50 mmol/L pH7.4 磷酸缓冲液(含1 mmol/L DTT、1 mmol/L EDTA,4 ℃),12000 r/min匀浆1.5 min;匀浆后缓冲液进行冷冻离心(10000×g,60 min),上清液加入13.4 g/100 mL研碎无水硫酸铵,冷冻离心(10000×g,30 min),取上清液加入14.3 g/100 mL研碎无水硫酸铵冷冻离心,沉淀等量溶于磷酸盐缓冲液(50 mmol/L,pH7.4)中,即粗酶液。
1.2.2 白鲢鱼肌肉LOX酶活、酶液浓度的测定 采用紫外分光光度法[3]测定酶活:用Tween-20(最终浓度0.1 mL/100 mL)做为乳化剂,将亚油酸(最终浓度10 mmol/L)分散在10 mmol/L硼酸缓冲液(pH9.0)中,置于4 ℃冰箱中备用。250 μL上述底物和50 μL LOX酶液添加到1.7 mL磷酸盐缓冲液(50 mmol/L,pH7.4),立刻计时,测定其在234 nm吸光度的增加值。吸光度增加0.001/min定义为1酶活力单位。
酶液浓度采用考马斯亮蓝法测蛋白质浓度,标准品选用牛血清蛋白。
1.2.3 白鲢鱼肌肉LOX圆二色谱检测方法 采用圆二色谱法(CD)对LOX的二级结构进行测定。以磷酸盐缓冲液(50 mmol/L,pH7.8)作为空白对照,先将LOX粗酶液稀释至0.1~0.2 mg/mL,CD光谱扫描范围190~250 nm,样品池光程1 mm,扫描速度100 nm/min,常温(25 ℃)下重复扫描4次,得到LOX粗酶液CD光谱,用平均摩尔椭圆率[θ]表示CD色性,单位deg·cm2/mol。
1.2.4 白鲢鱼肌肉LOX荧光强度的检测 蛋白质中的芳香族氨基酸具有内源荧光性,此类蛋白在外加光源激发情况下会发射内源荧光,荧光光谱会随着芳香族氨基酸基团位置和微环境的变化而发生改变,所以通过荧光光谱的变化可以用来分析蛋白三级结构的变化趋势[15-16]。以磷酸盐缓冲液(50 mmol/L,pH7.8)作为空白对照,先将LOX粗酶液稀释至0.01~0.05 mg/mL,用荧光光谱仪进行扫描,激发波长为295 nm,扫描波长为220~700 nm,速度240 nm/min,常温(25 ℃)下重复扫描3次。
1.3 实验内容
1.3.1 白鲢鱼肌肉LOX提取条件优化 缓冲液pH对酶的提取至关重要,首先应保证在蛋白质稳定的范围内,即选择在偏离等电点两侧,以增大蛋白质的溶解度,提高提取效果,另外选择合适的pH可以使蛋白质在缓冲液中的共稳定性及溶解度均有所增加[17]。缓冲液离子强度对蛋白质提取同样重要,离子强度较低时,盐析作用不明显,会造成蛋白质无法充分溶解到缓冲液中,较高时则会造成大量杂蛋白提取到缓冲液中[18]。
EDTA作为金属离子螯合剂,能和碱金属、稀土元素和过渡金属等形成稳定的水溶性络合物,可以有效消除蛋白质提取过程中金属离子对蛋白质的影响,减少因为金属离子存在而引起的变性;但是浓度过高时,会影响蛋白质的溶解性,并抑制酶的活性[17-18]。DTT是一种很强的还原剂,可以保持蛋白质中-SH的还原态,对于活性中心含有-SH的酶有保护作用,同时防止体系内氧化类物质氧化作用对酶的影响。但是DTT的作用是还原cys上被氧化的SH,可以把二硫桥拆开,影响蛋白质三级构象,从而影响酶的活性[19-20]。
因此以磷酸缓冲液pH、离子强度以及EDTA添加量和DTT的添加量作为单因素,研究不同因素水平下对白鲢鱼肌肉LOX提取的影响,然后选取合适的因素水平,得到白鲢鱼肌肉LOX提取的最佳条件,以LOX酶活、酶液浓度作为实验指标。
固定离心速率为10000×g、60 min,分别设定pH为6.6、7.0、7.4、7.8、8.2、8.6,离子强度为0、25、50、75、100 mmol/L,EDTA和DTT浓度均为0、1、2、4、8 mmol/L;离心后上清液在4 ℃下收集无水硫酸铵20%~40%饱和度组分,然后重溶于磷酸盐缓冲液(50 mmol/L,pH7.4),得到白鲢鱼肌肉LOX酶液,对其酶活、浓度测定,研究不同单因素对白鲢鱼肌肉LOX提取的影响。
白鲢鱼肌肉LOX提取工艺流程图:新鲜白链鱼→手工采集背部肌肉→加入磷酸盐缓冲液搅碎匀浆→冷冻离心→加入无水硫酸氨收集20%~40%饱和组分→沉淀重溶于磷酸盐缓冲液→粗酶液
1.3.2 白鲢鱼肌肉LOX酶学特性 对白鲢鱼肌肉LOX的贮藏稳定性、热稳定性、pH稳定性进行研究;贮藏稳定性:将酶液分别在常温(25±3) ℃下贮藏1~7 d,热稳定性:在4、20、30、40、50、60、70、80、90、100 ℃下分别恒温水浴加热20 min;pH稳定性:将LOX分别溶于6.6、7.0、7.4、7.8、8.2、8.6的磷酸缓冲液(50 mmol/L)中,分别测定其酶活、二级构象、三级构象变化,研究白鲢鱼肌肉LOX酶学性质。
1.4 数据统计分析
每组实验进行三组平行实验,所有数据采用Microsoft Excel进行整理分析,测定结果以平均值±标准差表示,圆二色谱图和荧光光谱图采用Origin9.0作图软件绘制。
2 结果与分析
2.1 白鲢鱼肌肉LOX提取条件优化
2.1.1 磷酸盐缓冲液pH对白鲢鱼肌肉LOX提取的影响 由图1可知,其在pH7.8提取条件下酶活最高,当pH7.4~pH8.2之间时,LOX酶液浓度较高,说明此时缓冲液pH偏离白鲢鱼肌肉LOX等电点,LOX酶液较为稳定。酸性条件不利于白鲢鱼肌肉LOX的提取。因此得出白鲢鱼肌肉的适宜提取pH为7.8。
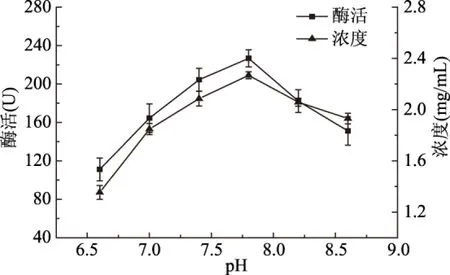
图1 磷酸盐缓冲液pH对白鲢鱼肌肉LOX酶活、浓度的影响Fig.1 The influence of phosphate buffer pH on the activity,concentration of silver carp muscle LOX
2.1.2 磷酸盐缓冲液离子强度对白鲢鱼肌肉LOX提取的影响 由图2可知,当离子强度低于50 mmol/L时,随着缓冲液离子强度的增加,盐析作用逐渐增强,酶液浓度不断增大,酶活也逐渐升高;当离子强度大于50 mmol/L时,盐析作用进一步增强,酶液浓度不断增大,但酶活保持在较高水平,变化较小,此时会有部分杂蛋白被提取到酶液中,影响酶液纯度,因此LOX提取缓冲液适宜的离子强度为50 mmol/L。
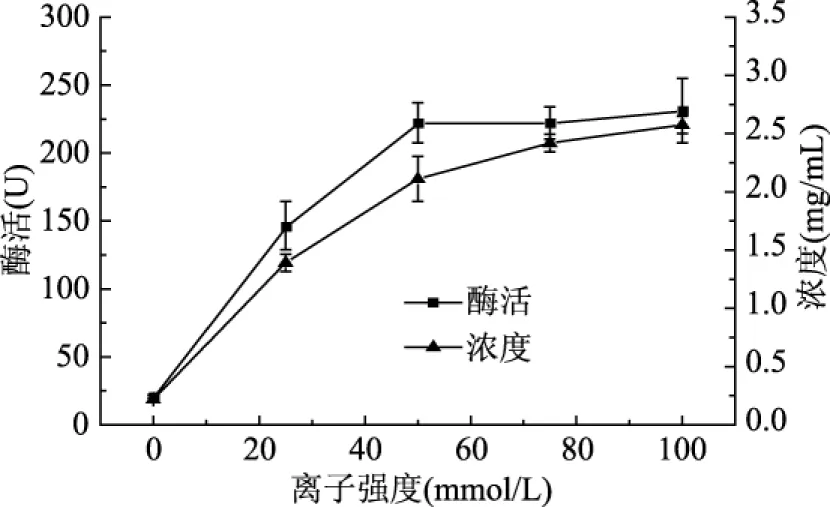
图2 离子强度对白鲢鱼肌肉LOX酶活、浓度的影响Fig.2 The influence of phosphate buffer lonic strength on the activity,concentration of silver carp muscle LOX
2.1.3 EDTA和DTT添加量对白鲢鱼肌肉LOX提取的影响 由图3可知,当EDTA浓度低于2 mmol/L时,酶活呈上升趋势,当浓度在2~8 mmol/L时,酶活变化较小,呈略微下降趋势;DTT浓度为2 mmol/L时,酶活最高,大于2 mmol/L时,酶活明显降低。由于EDTA和DTT浓度均较小,所以对LOX酶液浓度影响较小,无决定作用。因此,白鲢鱼肌肉LOX提取适宜的EDTA和DTT浓度均为2 mmol/L。

图3 EDTA、DTT添加量对白鲢鱼肌肉LOX酶活、浓度的影响Fig.3 The influence of added amount of EDTA, DTT on the activity,concentration of silver carp muscle LOX
在最优提取条件磷酸缓冲液pH7.8、离子强度50 mmol/L、EDTA和DTT添加量均为2 mmol/L下,白鲢鱼肌肉LOX酶活为(244.44±5.93) U、酶液浓度为(1.98±0.037) mg/mL。
2.2 白鲢鱼肌肉LOX酶学特性研究
2.2.1 白鲢鱼肌肉LOX贮藏稳定性 将白鲢鱼肌肉LOX酶液在常温条件下放置1~7 d,每天对LOX进行酶活、CD光谱、荧光光谱测定,结果如图4~图6所示。
由图4可知,随着时间增加,LOX酶活不断降低,在0~2 d时,下降趋势比较小,2 d过后,急剧下降,6 d时,基本完全失活。

图4 贮藏时间对白鲢鱼肌肉LOX酶活的影响Fig.4 The influence of storage time on the activity of silver carp muscle LOX
圆二色谱光谱法(CD)作为分析蛋白质二级结构最常用简便的方法,可以有效分析计算白鲢鱼肌肉LOX的α-螺旋和β-折叠等各组分的含量,进一步研究白鲢鱼肌肉LOX在不同条件下的二级构象变化[21]。蛋白质二级结构中主要的光活性基团是肽链骨架中的肽键,一般认为α-螺旋特征吸收峰在208 nm和222 nm左右,其在208 nm处椭圆率能够反映蛋白质α-螺旋结构变化;典型β-折叠在214 nm左右有一特征吸收负峰;无规则卷曲在220 nm左右有一小而宽的正峰[22-23]。由图5可知,LOX的CD光谱在208 nm和222 nm处均有明显的负峰,在214 nm处有一负峰,还在220 nm左右有一很微弱正峰,说明白鲢鱼肌肉LOX中包含有α-螺旋、β-折叠、无规则卷曲等蛋白质二级结构;随着贮藏时间增加,LOX的CD光谱在208 nm处的负峰和214 nm处的负峰强度都有所下降,在2 d以后下降尤为明显,说明LOX在贮藏过程中二级结构不断变化,在0~2 d,二级结构相对较稳定,2 d以后变化较大。

图5 贮藏时间对白鲢鱼肌肉LOX二级构象的影响Fig.5 The influence of storage time on the secondary conformation of silver carp muscle LOX

图6 贮藏时间对白鲢鱼肌肉LOX三级构象的影响Fig.6 The influence of storage time on the tertiary conformation of silver carp muscle LOX
在295 nm激发波长下,含有芳香族氨基酸残基如色氨酸(tryptophan,Trp)、酪氨酸(tyrosine,Tyr)和苯丙氨酸(phenylalanine,Phe)残基的蛋白质会产生荧光,称为内源性荧光。其中Trp的荧光强度最大,因而内源荧光分析的主要对象为Trp,通常被用来研究蛋白质的三级结构[24-25]。图6是常温下贮藏不同时间的LOX内源荧光光谱图,在344 nm处有很强的Trp荧光峰,随着贮藏时间的增加荧光峰形状及出峰未知无变化,但贮藏时间增加后,荧光强度受到很大影响,这与LOX中Trp所处的微环境有很大关系;随着时间增加,Trp的荧光强度不断增强,说明LOX中的Trp因为蛋白质三级结构的改变不断由分子内部非极性环境逐渐暴露在分子外部极性环境中,因此可以说明,随着时间的推移,LOX的三级结构发生明显变化。

图7 不同温度对白鲢鱼肌肉LOX酶活的影响Fig.7 The influence of temperatures on the activity of silver carp muscle LOX
2.2.2 白鲢鱼肌肉LOX热稳定性 由图7可知,LOX在4~40 ℃时,随着温度升高,脂肪氧合酶的溶解度增大,分散度上升,增加了脂肪氧合酶的活化分子数,与底物的亲和力也逐渐增强,酶活也逐渐增大;40 ℃时酶活最高,当温度大于40 ℃时,高温导致脂肪氧合酶变性,在酶液中的溶解度降低,分散度下降,使酶活迅速降低,70 ℃基本完全失活。图8为白鲢鱼肌肉LOX经不同温度处理后CD光谱图。由图8可知,在4~40 ℃时,208 nm和214 nm处负峰均呈微弱变化,40 ℃以后,208 nm和214 nm处负峰强度急剧降低,至70 ℃以后,208 nm和214 nm特征吸收峰基本消失;因此说明在4~40 ℃之间,LOX二级结构呈微弱变化,40 ℃以后,LOX二级结构被严重破坏,α-螺旋、β-折叠含量急剧下降,70 ℃后,LOX中α-螺旋、β-折叠已基本被完全破坏,LOX完全失活。图9为白鲢鱼肌肉LOX经不同温度处理后荧光光谱图。当温度低于40 ℃时,Trp荧光强度变化较小,说明此时蛋白质中Trp仍处在分子内非极性环境中,LOX的三级构象相对稳定;高于40 ℃时,Trp荧光强度快速增强,说明此时分子内Trp暴露在外部极性环境中,LOX的三级构象破坏,因此可知LOX在温度低于40 ℃的条件下,能保持较高的活性。

图8 不同温度对白鲢鱼肌肉LOX二级构象的影响Fig.8 The influence of temperatures on the secondary conformation of silver carp muscle LOX

图9 不同温度对白鲢鱼肌肉LOX三级构象的影响Fig.9 The influence of temperatures on the tertiary conformation of silver carp muscle LOX
2.2.3 白鲢鱼肌肉LOX pH稳定性 结果如图10~图12所示。

图10 不同pH对白鲢鱼肌肉LOX酶活的影响Fig.10 The influence of different pH on the activity of silver carp muscle LOX
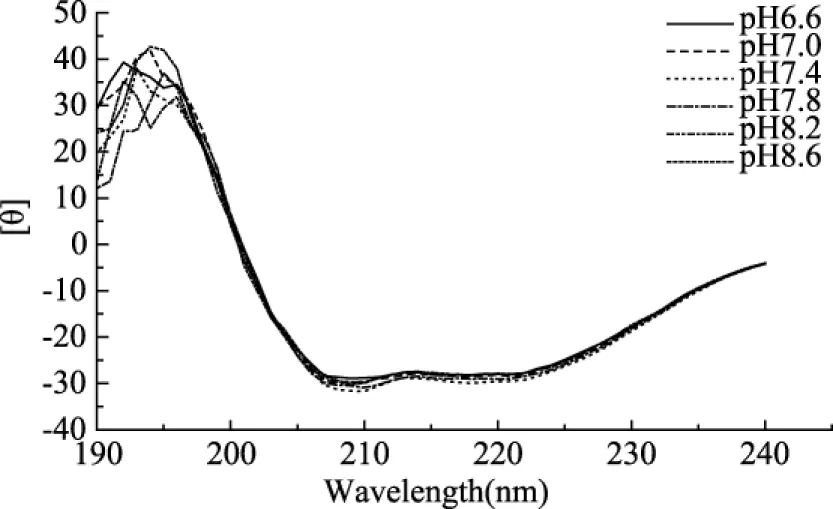
图11 不同pH对白鲢鱼肌肉LOX二级构象的影响Fig.11 The influence of different pH on the secondary conformation of silver carp muscle LOX

图12 不同pH对白鲢鱼肌肉LOX三级构象的影响Fig.12 The influence of different pH on the tertiary conformation of silver carp muscle LOX
由图10可知,当缓冲液过酸或者过碱时,都会使脂肪氧合酶分子侧链上极性基团的状态改变,分子活性中心结构变化,发生变性失活,影响底物与脂肪氧合酶之间的结合与解离,进而影响酶的活性,因此当pH小于7.4或者大于7.8时,酶活都会明显受到抑制。图11为白鲢鱼肌肉LOX在不同pH条件下CD光谱图。由图11可知,白鲢鱼肌肉LOX在不同pH条件下的CD光谱变化较小,呈微弱变化趋势,在pH7.8时208 nm和214 nm处负峰强度最大,pH6.6时最小;因此说明,不同pH对白鲢鱼肌肉LOX二级结构变化影响较小,pH的变化不会造成LOX中α-螺旋、β-折叠含量出现较大变化。图12为白鲢鱼肌肉LOX在不同pH条件下荧光光谱图。当pH为7.8时,Trp荧光强度最小,说明此时蛋白质中Trp仍处在分子内非极性环境中,LOX的三级构象相对稳定,因此可以得到pH7.8为LOX的最适pH。
3 结论
白鲢鱼中LOX对白鲢鱼鱼腥味生成至关重要,因此针对白鲢鱼体内LOX的研究对于白鲢鱼产业特别是白鲢加工的发展很有意义。本文得到白鲢鱼LOX的最优提取条件为磷酸缓冲液pH7.8、离子强度50 mmol/L、EDTA和DTT添加量均为2 mmol/L,此时白鲢鱼肌肉LOX酶活为(244.44±5.93) U、酶液浓度为(1.98±0.037) mg/mL。通过对LOX酶学性质研究可知,白鲢鱼肌肉LOX最适pH为7.8,最适温度为40 ℃,在常温和低温环境中仍保持较高酶活,常温条件下0~2 d内较为稳定。
[1]刘海梅,熊善柏,谢笔钧.钙离子对白鲢鱼糜热诱导凝胶化的影响[J].食品科学,2006,27(8):87-90.
[2]Uresti R.M.,Tellez-Luis Simon J.,Ramirez Jose A..Use of dairy proteinsand microbial transglutaminase to obtain low-salt fish products from filleting waste from silver carp(Hypophthalmichthysmolitrix)[J].Food chemistry,2004,86:257-262.
[3]付湘晋.白鲢鱼脱腥及其低盐鱼糜制备的研究[D].无锡:江南大学,2009.
[4]刘闪.白鲢鱼头综合开发与利用[D].武汉:武汉轻工大学,2014.
[5]邓伟. 低钠复合盐和加热方式对白鲢鱼糜凝胶特性的影响[D].合肥:合肥工业大学,2013.
[6]Fu Xiangjin,Xu Shiying,Wang Zhang,et al.Kinetics of lipid oxidation and off-odor formation in silver carp mince:The effect of lipoxygenase and hemoglobin[J]. Food Research International,2009,42:85-90.
[7]Fu Xiangjin,Lin Qinglu,Xu Shiying,et al.Effect of drying methods and antioxidants on the flavor and lipid oxidation of silver carp slices[J]. LWT-Food Science and Technology,2015,61:251-257.
[8]杨文鸽,薛长湖,何雄.南美白对虾血淋巴脂肪氧合酶的分离纯化及其生化特性研究[J].中国食品学报,2006,6(3):31-37.
[9]何雄,薛长湖,杨文鸽.罗非鱼鳃组织中脂肪氧合酶的性质研究[J].水产科学,2005,24(7):15-19.
[10]Campo MM,Nute JD,Elmore SJ.Modelling the effect of fatty acids in odor development of cooked meatinvitro:part I-sensory perception[J].Meat Science,2003,63:367-375.
[11]Yoshiwa T,Morimoto K,Sokamoto K.Volatile compounds of fishy odour in sardine by simultaneous distillation and extraction under reduced pressure[J]. Nippon Suisan Gakkaishi,1997,63(2):222-230.
[12]陈书婷.脂肪氧合酶的分离纯化及其催化多不饱和脂肪酸的研究[D].无锡:江南大学,2011.
[13]Kuhn H.Structural basis for the positional specificity of lipoxygenases[J]. Prostaglandins and Other Lipid Mediators,2000,62(3):255-270.
[14]Gata JL,Pinto MC,Macias P. Lipoxygenase activity in pig muscle:purification and partial characterization[J].J Agric Food Chem,1996,44:2573-2577.
[15]王雪. 碧螺春脂肪氧合酶的构象与酶学特性研究[D].无锡:江南大学,2013.
[16]Sharma VK,Kalonia DS.Steady-statetry ptophan fluorescence spectroscopy study to probe tertiary structure of proteins in solid powders[J]. Journal of Pharmaceutical Sciences,2003,92(4),890-899.
[17]Wang Y,Regenstein JM. Effect of EDTA,HCl,and citric acid on Ca salt removal from Asian(silver)carp scales prior to gelatin extraction[J]. Journal of Food Sciences,2009,74(6):426-431.
[18]Bhadauria V,Peng YL. Optimization of a protein extraction technique for fungal proteomics[J]. Indian Journal of Microbiology,2010,50(1):127-131.
[19]Ashoub A,Berberich T,Beckhaus T.A competent extraction method of plant proteins for 2-D gel electrophoresis[J]. Electrophoresis,2011,32(21):2975-2978.
[20]Bellido GG,Hatcher DW. Effects of a cross-linking enzyme on the protein composition,mechanical properties,and microstructure of Chinese-style noodles[J]. Food Chemistry,2011,125(3):813-822.
[21]王铮,郭新秋,朱邦尚.利用圆二色光谱检测计算血清白蛋白二级结构[J]. 实验室研究与探索,2013,32(10):294-296.
[22]Kwaambwa HM,Maikokera R.Infrared and circular dichroism spectroscopic characterisation of secondary structure components of a water treatment coagulant protein extracted from Moringa oleifera seeds[J]. Colloids and Surfaces B-Biointerfaces,2008,64(1):118-125.
[23]Ren HW,Zhang WS,Li XY,et al. Effect of pH on circular cichroism and raman spectroscopy of secondary structure of beta-casein from Chinese human milk[J]. Spectroscopy and Spectral Analysis,2015,35(2):384-389.
[24]邱春江.超高压对鲢鱼中关键酶与结构蛋白质构影响的研究[D].无锡:江南大学,2014.
[25]Huang Yechuan,Gan Yi,Li Feng,et al.Effects of high pressure in combination with thermal treatment on lipid hydrolysis and oxidation in pork[J]. LWT-Food Science and Technology,2015,63:136-143.
Optimization of lipoxygenase extraction conditions in silver carp muscle and the study on its enzymatic properties
WANG Bang-guo,LIN Lin,YU Zhen-yu,LI Yang,JIANG Shao-tong*
(Institute of Agricultural Processing,School of Food Science and Engineering,Key Laboratory for Agriculture Processing Product of Anhui Province,Hefei University of Technology,Hefei 230009,China)
The extraction process and enzymatic properties of Lipoxygenase(LOX)from silver carp muscle were evaluated. The extraction conditions of LOX were optimized by single-factor experiment and the storage stability,thermal stability,optimum pH of LOX were studied by circular dichroism and fluorescence spectroscopy. The effects of pH,ionic strength and the addition of EDTA,DTT on the enzyme activity and concentration of LOX were studied respectively. The results showed that the suitable extraction condition parameters were:pH7.8,ionic strength 50 mmol/L,EDTA 2 mmol/L and DTT 2 mmol/L,the enzyme concentration of LOX was(1.98±0.037) mg/mL and the activity was (244.44±5.93) U under that condition. Our present work showed that the enzyme activity of LOX was stable within 0~2 d under room temperature,the optimum pH was 7.8 and the optimum temperature was 40 ℃.
silver carp;lipoxygenase;extraction conditions;enzymatic properties
2016-10-08
王帮国(1992-),男,硕士,研究方向:农产品加工,E-mail: wang_bangguo@163.com。
*通讯作者:姜绍通(1954-),男,硕士,教授,研究方向:农产品加工,E-mail:jstxsgj@163.com。
安徽省重点实验室项目(JZ2014AKSY0401)。
TS254.1
A
1002-0306(2017)09-0113-06
10.13386/j.issn1002-0306.2017.09.013

