免疫组化法和qPCR技术检测FBP1在结直肠腺癌中的表达及临床意义
刘家有,邓世山,朱剑军,侯令密,谢少利,黄波
( 1.川北医学院人体解剖学教研室;2.川北医学院附属医院普外科;3.川北医学院临床技能培训中心,四川 南充 637000)
免疫组化法和qPCR技术检测FBP1在结直肠腺癌中的表达及临床意义
刘家有1,邓世山1,朱剑军1,侯令密2,谢少利2,黄波3
( 1.川北医学院人体解剖学教研室;2.川北医学院附属医院普外科;3.川北医学院临床技能培训中心,四川 南充 637000)
目的:探讨果糖-1,6-二磷酸酶1 (fructose-1,6-bisphosphatase 1,FBP1)基因在结直肠腺癌的表达水平及其与临床病理特征的联系。方法:qPCR技术检测川北医学院附属医院2014年9月至2016年2月 新鲜结直肠腺癌组织及癌旁正常组织46 例中FBP1基因的表达水平。 免疫组化方法检测川北医学院附属医院2015年7月至2016年6月结直肠腺癌及癌旁对照组织的蜡块标本30例中FBP1的表达及分布情况。结果:qPCR技术检测结果表明,FBP1 基因在结直肠腺癌组织中的表达水平低于在癌旁正常组织中的表达水平(t=2.934,P=0.006);FBP1基因在结直肠腺癌组织中的表达水平随着结直肠腺癌肿瘤的恶性程度的增加(F=13.267,P=0.000)、Duke’s 分期的增加(F=15.864,P=0.000)、远处淋巴结的转移(t=14.285,P=0.000)而降低;FBP1基因在男性患者的结直肠腺癌组织中的表达水平高于其在女性患者的表达水平,但差异无统计学意义(t=1.294,P=0.165)。 免疫组化结果显示FBP1在结直肠腺癌组织中低表达甚至缺失,而在癌旁正常组织中高表达,二者差异具有统计学意义(χ2=19.461,P=0.000)。结论:FBP1 基因及蛋白质的低表达可能在结直肠腺癌的发生发展中有着重要的作用,是其潜在的治疗靶标。
结直肠腺癌;果糖-1,6-二磷酸酶1;免疫组化法;qPCR
结直肠腺癌是消化道第二位的常见恶性肿瘤,位居癌症死亡率第四位,严重威胁人类的健康[1],探索与结直肠腺癌发病的相关基因,对结直肠腺癌的早期预防和诊治具有重要意义。果糖-1,6-二磷酸酶1 (fructose-1,6-bisphosphatase 1,FBP1)是葡萄糖异生的关键酶之一,在机体内源性葡萄糖的合成、输出及调控中发挥重要作用[2]。研究发现FBP1与许多肿瘤的发生发展相关,如FBP1基因表达水平的降低或缺失导致肾透明细胞癌的恶性程度增加、患者的预后变差[3];FBP1在乳腺癌中和在肝细胞癌中的表达水平也降低,且随着恶性程度的增加而降低[4-5]。但在结直肠腺癌中FBP1基因的表达情况如何,目前尚未见相关文献报道。本文通过免疫组化方法和qPCR技术检测FBP1在结直肠腺癌中的表达情况,探讨FBP1与临床病理特征之间的关系,为结直肠腺癌早期诊断、治疗及寻找潜在的靶标提供理论基础。
1 材料及方法
1.1 研究对象
收集川北医学院附属医院2014年9月至2016年2月 新鲜结直肠腺癌(该诊断均经病理证实)及对照癌旁正常组织(距肿瘤边缘大于5 cm以上,病理未发现癌细胞)标本46例,年龄37~79岁,平均年龄57.5岁,中位年龄59岁。标本收集后立即置于液氮中速冻,及时提取组织总RNA并进行逆转录。收集川北医学院附属医院2015年7月至2016年6月结直肠腺癌及癌旁正常组织标本30例,年龄28~77岁,平均年龄56.8岁,中位年龄58岁。
1.2 主要试剂
Trizol试剂购自Ambion公司;Revert Aid first strand cDNA Synthesis Kit 反转录试剂盒购自Thermo Scientific公司;SYBR ®Premix ExTMTaq Ⅱ试 剂购 自TaKaRa 公司;琼脂糖购自碧云天公司;Goldenview购自于碧云天公司;Marker Ⅰ 购自 Tiangen 公司;MS anti-FBP1 购自abcom 公司,Goat anti-MS购自abcom 公司,免疫组化(SP)试剂盒与DAB 显色试剂盒均购自北京中杉金桥公司。
1.3 RNA 提取及反转录
取新鲜组织 50~80 mg, 液氮中研磨均匀成末, 按照Trizol说明书操作提取组织总RNA,按照 Revert Aid first strand cDNASynthesis Kit 反转录试剂盒说明书将细胞总RNA逆转录为 cDNA。
1.4 qPCR引物设计
按照qPCR引物设计原则,运用 Primer 3.0 软件设计引物,经验证成功设计的基因序列见表1。qPCR 反应条件:95 ℃预变性3 min, 94 ℃变性10 s,54 ℃退火10 s,72 ℃延伸10 s, 40个循环,每个循环结束后进行荧光信号收集。为判断PCR产物的特异性,在扩增程序结束后,加设一个溶解程序,来形成熔解曲线, 溶解温度设置为65~90 ℃,每0.5 ℃为一个梯度,进行荧光信号收集。每个样本设置3个复孔,取Ct平均值进行计算。ΔCt=Ct FBP1-Ct GAPDH, ΔCt值越小说明该目的基因的表达量越高,反之亦然。2-ΔCt表示目的基因相对于内参基因的表达量;本实验用2-ΔCt来表示46个样本中FBP1基因的表达量。

表1 qPCR引物(5’to 3’)
1.5 免疫组化检测
所有蜡块由川北医学院附属医院病理科代为切片,SP 法染色,按试剂盒说明书操作,其中 一抗和二抗的浓度均为1∶200 ,DAB 显色,苏木素复染。高倍镜下选取 9个视野计数细胞,按着色深浅评分:无显色0分,弱着色1分,中等着色2分和强着色3分。根据阳性细胞数占同类细胞数的百分比评分:<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分。取两项评分的乘积作为总积分,>5分为高表达,≤4分则为低表达。以高表达判为阳性。
1.6 统计学分析
SPSS 19.0 软件对数据进行分析。 卡方检验检测FBP1蛋白在30例结直肠腺癌组织与对照癌旁组织中表达阳性率的差异;配对t检验检测FBP1 基因在结直肠腺癌中与对照癌旁组织中表达水平的差异;独立样本t检验检测FBP1 基因表达水平差异与结直肠腺癌患者的年龄、性别、淋巴结转移的相关性;方差检验检测FBP1表达水平差异与结直肠腺癌患者Duke’s 分期、肿瘤分化类型的相关性。P< 0.05 为差异有统计学意义。
2 结果
2.1 FBP1蛋白在组织中的表达情况
免疫组化的结果(图1)显示,FBP1在结直肠细胞中主要分布于细胞核和细胞膜,其在30例癌旁正常组织中表达为阳性有25例,阳性表达率为83.33%;FBP1在30例结直肠腺癌组织中表达为阳性有8例,阳性表达率为26.67%(表2)。卡方检验检测结果显示,二者阳性率表达差异有统计学意义(χ2=19.461,P=0.000),这提示FBP1的低表达可能与结直肠腺癌的发生有关。

表2 FBP1在结直肠腺癌及癌旁正常组织中的表达情况

组别FBP1的表达阳性阴性总计阳性率(%)结直肠腺癌8223026.67癌旁正常组织2553083.33
2.2 qPCR结果与临床病理特征
2.2.1 扩增曲线及溶解曲线 qPCR实验结果显示,内参基因 GAPDH 及目的基因FBP1 的扩增曲线均有明显的四个时期呈现为S型且Ct值均小于40,提示基因均得到扩增;阴性对照组(CN)Ct值0~40几乎为一条直线,说明阴性对照组没有扩增。扩增曲线符合实验要求(图2A、2B)。内参基因 GAPDH 及目的基因FBP1 的溶解曲线均只有一个峰值,说明扩增产物是单一的,符合实验的要求(图2C、2D)。

2.2.2 qPCR 结果与临床病理特征的关系 qPCR 实验结果显示,FBP1基因在结直肠腺癌组织的表达水平(0.257 5±0.035 7)低于其在癌旁正常组织中的表达水平(0.469 9±0.095 1),配对t检验结果显示二者的差异具有统计学意义(t=2.934,P=0.006),提示FBP1低表达与结直肠腺癌的发生有关。 FBP1 基因在46 例结直肠腺癌组织中及癌旁正常组织中的表达水平见图3;FBP1基因表达水平差异与患者的临床病理特征之间的关系详见表3。
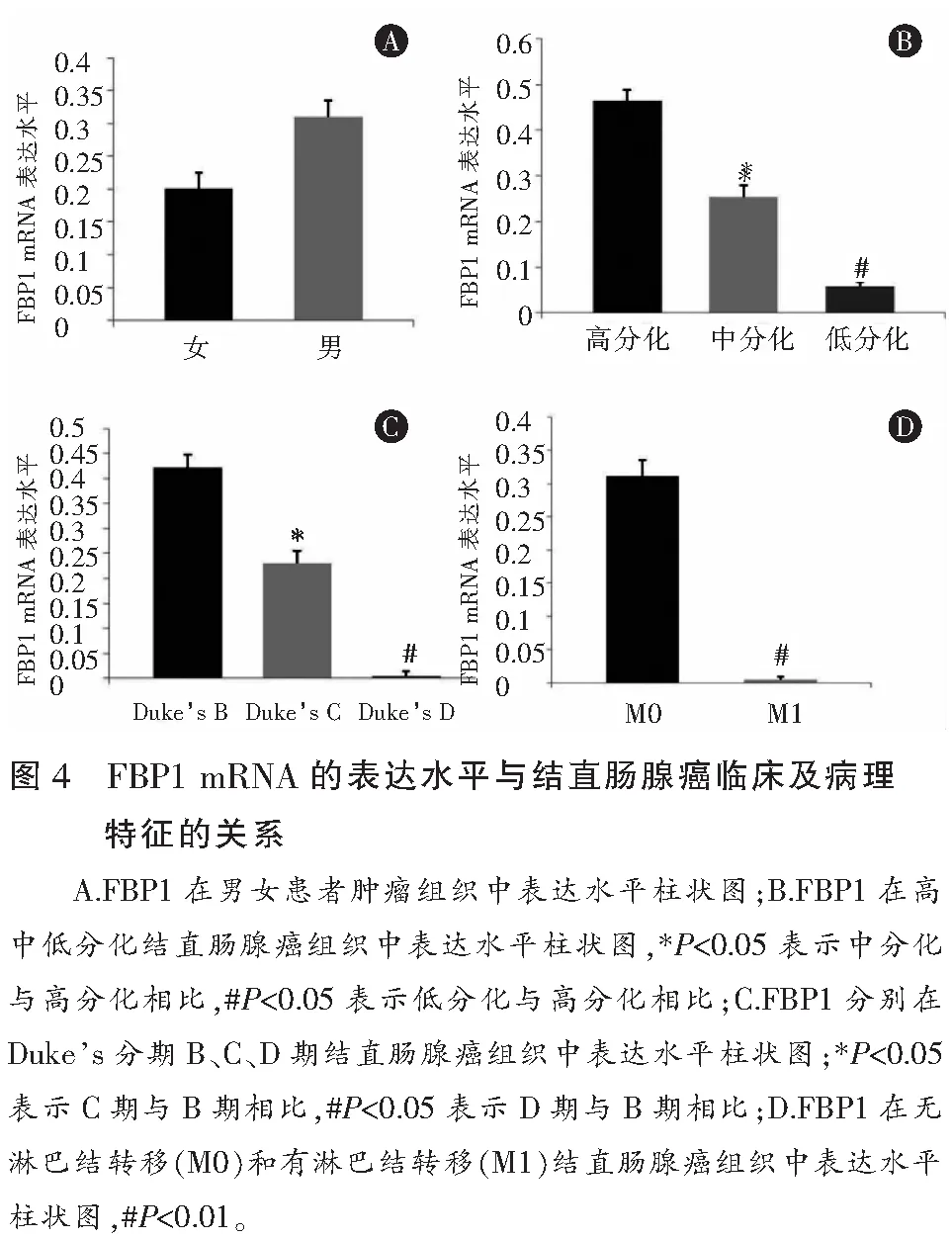
通过检测FBP1 基因在不同分化程度的结直肠腺癌组织中的表达水平发现,FBP1在12例高分化结直肠腺癌组织中表达水平为(0.463±0.036),在22例中分化结直肠腺癌组织中为(0.254±0.023),在12例低分化结直肠腺癌组织中为(0.059±0.009),且其表达水平差异有统计学意义(F=13.267,P=0.000) (图4B),提示FBP1 在结直肠腺癌组织中的表达水平随着结直肠腺癌肿瘤恶性程度的增加而降低 。
FBP1 基因在不同Duke’s 分期的结直肠腺癌中的表达水平如下:Duke’s B 期(16例)中为(0.422±0.034),Duke’s C 期(22例)中为(0.229±0.038),Duke’s D 期(8例)中为(0.004±0.001)。方差检验的结果显示,FBP1 在不同Duke’s 分期的结直肠腺癌中表达水平差异有统计学意义(F=15.864,P=0.000) (图4C), 提示FBP1 在结直肠腺癌组织中的表达水平随着结直肠腺癌肿瘤Duke’s 分期的增加有逐渐降低的趋势。
FBP1 基因在有淋巴结转移结直肠腺癌组织的表达水平低于其在无淋巴结转移的结直肠腺癌组织中的表达水平[(0.004 5±0.000 4)VS(0.310 8±0.021 9)],且差异有统计学意义(t=14.285,P=0.000)(图4D),提示FBP1 基因与肿瘤的淋巴结转移有关。
FBP1 基因与结直肠腺癌患者的年龄无相关性(t=0.622,P=0.547) ,同时,在男性患者的结直肠腺癌组织中FBP1 基因的表达水平有高于女性患者的趋势[(0.309± 0.057)vs.(0.206±0.047)],但其表达水平差异无统计学意义(t=1.483,P=0.165)(图4A)。

表3 FBP1 基因的表达水平与临床病理参数的关系
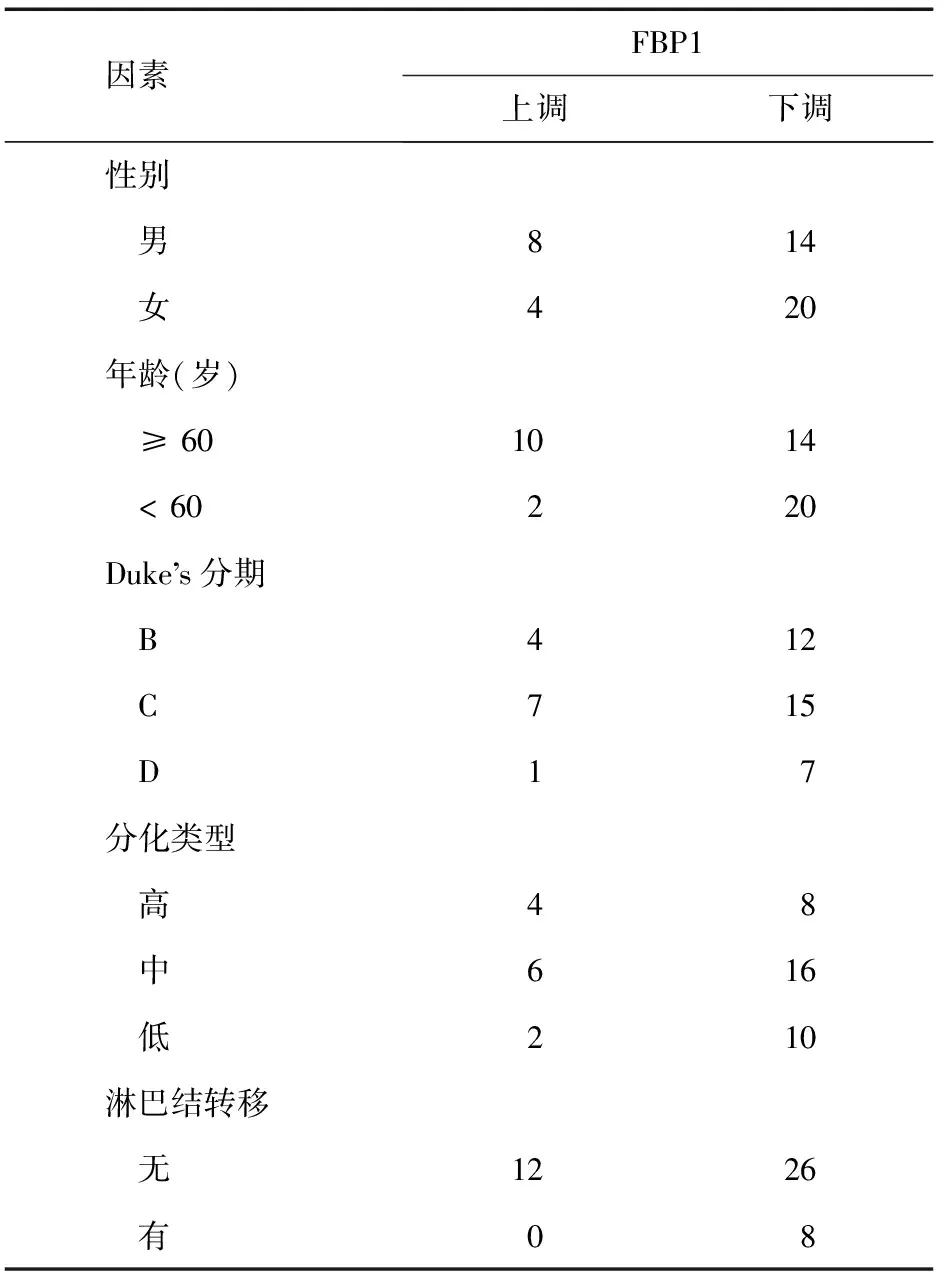
因素FBP1上调下调性别 男814 女420年龄(岁) ≥601014 <60220Duke s分期 B412 C715 D17分化类型 高48 中616 低210淋巴结转移 无1226 有08
3 讨论
结直肠腺癌的早期不易诊断,确诊时多伴有局部淋巴结的转移,导致大部分患者因之复发甚至死亡,严重威胁人类的健康。目前,已经发现部分基因与结直肠腺癌的发生发展有关,如Skep2、Cdc37、p53、HER-2、Ki-67、Cyclin E、P27kipl等基因[1,6-8],但结直肠腺癌的发病机制仍有待阐明,因此,寻找与结直肠腺癌发生发展的相关靶基因具有重要的意义。
肿瘤代谢重组相关基因被认为是寻找新兴肿瘤标志物[9],肿瘤细胞以其糖代谢的改变尤为明显,即由正常细胞的有氧氧化为主变为以产能效率较低的无氧糖酵解为主[4]。FBP1作为葡萄糖异生的限速酶之一,能够将果糖-1,6-二磷酸分解为6-磷酸果糖和磷酸,FBP1在机体葡萄糖的合成、输出及调控中发挥重要作用[2],FBP1基因的缺陷将导致果糖-1,6-二磷酸酶缺乏症,患者表现为严重的低血糖、高乳酸血症、代谢性酸中毒及酮症等一系列症状,FBP1基因突变导致的表达降低在临床病案中也陆续报道[10-11]。FBP1与许多肿瘤的发生发展密切相关。
FBP1基因在超过600例肾透明细胞癌(ccRCC)患者中的表达水平均一致性的降低,在FBP1基因表达缺失的患者中,其肿瘤的恶性程度更高、预后更差,因此FBP1能抑制ccRCC的进展,其机制可能为FBP1抑制了肾小管上皮细胞(被认为是ccRCC的起源)中的糖酵解;其次,FBP1在缺乏VHL的ccRCC中具有的独立催化活性,能够直接作用于细胞核的缺氧诱导因子(HIF)功能区,从而抑制细胞的增值、糖酵解、磷酸戊糖途径等[3];临床病理研究显示,FBP1在ccRCC中的表达水平与患者的年龄、性别、T 分期、 Fuhrman 分级,以及HIF-2α和CA9的表达水平没有相关性,但是与HIF-1α和促红细胞生成素的表达水平显著相关,这表明FBP1与缺氧相关基因的表达具有一定的关联[12]。
研究表明FBP1在基底细胞样乳腺癌(BLBC)细胞中低表达,FBP1表达的降低导致线粒体复合酶I的活性受抑,诱导糖酵解发生、葡萄糖摄取增加、M2型丙酮酸激酶形成、ATP在低氧条件下持续合成,这一系列的代谢重组使BLBC细胞具有干细胞的特点[4]。同时,FBP1与Wnt/β-catenin信号通路也有相关性,当FBP1高表达时Wnt/β-catenin信号通路的活性度较低;当FBP1低表达时Wnt/β-catenin信号通路的活性度较高,其下游的靶点c-myc和MMP7的表达水平也增高[13]。
FBP1基因在肝细胞癌(HCC)中低表达,且与肿瘤分期、总生存率、肿瘤复发率相关[5],沉默FBP1基因后,能显著促进HCC细胞集落的形成,提高肝癌细胞的远处转移和侵润的能力;过表达FBP1基因后,HCC细胞的远处转移和侵润能力受到抑制;Warburg效应特异性抑制剂FX11能够降低FBP1基因缺失介导的HCC细胞远处转移和侵润能力,这提示FBP1可能是HCC的一个抑癌基因[9]。FBP1基因在非小细胞肺癌和胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)中的表达均降低,且与患者的不良预后相关,在PDAC中的机制可能为核仁磷酸蛋白1(nucleophosmin 1,NPM1)通过抑制FBP1的表达从而促进PDAC的发生发展[14-15]。
但FBP1基因在结直肠腺癌组织中的表达情况如何,目前未见相关报道。本文通过免疫组化方法和qPCR技术探讨FBP1在结直肠腺癌中的表达情况,及其与临床病理特征之间的关系。免疫组化结果显示,FBP1在结直肠腺癌中的表达水平明显低于其在癌旁正组织中的表达水(P<0.05),这与前期FBP1相关的报道结果相一致。FBP1在癌旁正常组织标本中有5例(总30例,16.67%)呈阴性表达,这可能是FBP1对肿瘤侵润和远处转移能力的体现,其机制可能为肿瘤的代谢重组波及了周围癌旁正常组织,使这5例癌旁正常组织有潜在的高癌变风险,导致其高复发率[5],FBP1是否导致了结直肠腺癌复发率增高需要进一步的探讨。
FBP1在8例(共30例,26.67%)结直肠腺癌组织标本中呈阳性表达,同时,qPCR技术检测结果显示,FBP1在12例(共46例,26.09%)结直肠腺癌组织中高表达,这可能与FBP1基因的突变相关。FBP1基因在食管鳞状细胞癌中也表现为高表达,但是具体原因还不明确[16];有关FBP1的基因突变导致其表达水平降低已有报道[10-11],但是不排除新的FBP1突变类型,其并不影响抗原抗体反应进行(抗原决定簇和分子空间结构未改变),在代偿性的高表达该基因之后而被检测到,但是在结直肠腺癌在中是否存在新的突变有待进一步的验证。
FBP1在结直肠腺癌中的表达水平随着结直肠腺癌恶性程度、Duke’s分期、远处淋巴结转移的增加呈逐渐降低的趋势(P=0.000),因此我们推测, FBP1的低表达可能与结直肠腺癌的分期分化、肿瘤的侵润转移有关。FBP1的低表达可能在结直肠腺癌的发生发展中有着重要作用,是结直肠腺癌治疗的潜在靶标。
[1] 刘家有,熊东,王卓娜,等.Cdc37在结直肠腺癌中的表达及临床意义的研究[J].实用肿瘤杂志,2014,29(5):436-440.
[2] 张晔.锌指蛋白ZBTB20对胰岛β细胞表达果糖-1,6-二磷酸酶FBP1和分泌胰岛素的调节作用[D].上海:第二军医大学,2013.
[3] Li B,Qiu B,Lee DS,etal.Fructose-1,6-bisphosphatase opposes renal carcinoma progression[J].Nature,2014,513(7517):251-255.
[4] Dong C,Yuan T,Wu Y,etal.Loss of FBP1 by Snail-mediated repression provides metabolic advantages in basal-like breast cancer[J].Cancer Cell,2013,23(3):316-331.
[5] Hirata H,Sugimachi K,Komatsu H,etal.Decreased Expression of Fructose-1,6-bisphosphatase Associates with Glucose Metabolism and Tumor Progression in Hepatocellular Carcinoma[J].Cancer Res,2016,76(11):3265-3276.
[6] 董亮,钱震,施蓉蓉,等.结直肠腺癌组织中p53、HER-2和Ki-67的表达及其临床病理意义[J].诊断病理学杂志,2015,22(1):19-22.
[7] 张庚,李伟,姜国胜.结肠镜取组织联合检测Cyclin E、p27kipl和Ki67的表达在结直肠癌中的临床意义[J].河北医药,2012,34(20):3077-3079.
[8] Bochis OV,Irimie A,Pichler M,etal.The role of Skp2 and its substrate CDKN1B (p27) in colorectal cancer[J].J Gastrointestin Liver Dis,2015,24(2):225-234.
[9] Yang J,Wang C,Zhao F,etal.Loss of FBP1 facilitates aggressive features of hepatocellular carcinoma cells through the Warburg effect[J].Carcinogenesis,2016,37 (3):280-289.
[10]徐可,刘雪芹,张春雨,等.果糖-1,6-二磷酸酶缺乏症基因诊断1例[J].北京大学学报(医学版),2014,46(5):681-685.
[11]Faiyaz-Ul-Haque M,Al-Owain M,Al-Dayel F,etal.Novel FBP1 gene mutations in Arab patients with fructose-1,6-bisphosphatase deficiency[J].Eur J Pediatr,2009,168(12):1467-1471.
[12]Ning XH,Li T,Gong YQ,etal.Association between FBP1 and hypoxia-related gene expression in clear cell renal cell carcinoma[J].Oncol Lett,2016,11(6):4095-4098.
[13]Li K,Ying M,Feng D,etal.Fructose-1,6-bisphosphatase is a novel regulator of Wnt/beta-Catenin pathway in breast cancer[J].Biomed Pharmacother,2016,84:1144-1149.
[14]Zhu Y,Shi M,Chen H,etal.NPM1 activates metabolic changes by inhibiting FBP1 while promoting the tumorigenicity of pancreatic cancer cells[J].Oncotarget,2015,6(25):21443-21451.
[15]Sheng H,Ying L,Zheng L,etal.Down Expression of FBP1 Is a Negative Prognostic Factor for Non-Small-Cell Lung Cancer[J].Cancer Invest,2015,33(5):197-204.
[16]鲍柏军,朱隽雅,李振兴,等.果糖-1,6-二磷酸酶1在食管鳞状细胞癌的表达及意义[J].临床检验杂志,2014,32(7):502-504.
(学术编辑:罗春英)
Immunohistochemistry and qPCR to detect the expression of FBP1 in colorectal adenocarcinoma and its clinical significance
LIU Jia-you1,DENG Shi-shan1, ZHU Jian-jun1,HOU Ling-mi2,XIE Shao-li2,HUANG Bo3
( 1.AnatomyDepartment,NorthSichuanMedicalCollege;2.GeneralSurgeryDepartment,AffiliatedHospitalofNorthSichuanMedicalCollege;3.ClinicalSkillsTrainingCenterofNorthSichuanMedicalCollege,Nanchong637000,Sichuan,China)
Objective:To explore the expression of FBP1 in colorectal adenocarcinoma and its clinical significance.Methods:46 pairs of fresh human colorectal adenocarcinoma tissues and its adjacent normal tissues were collected from the Affiliated Hospital of North Sichuan Medical College from September 2014 to February 2016 ,Quantitative RT-PCR was used to detect the expression level of FBP1 mRNA in tissues.30 specimens of human colorectal adenocarcinoma tissues and its adjacent normal tissues were collected from the Affiliated Hospital of North Sichuan Medical College from July 2015 to June 2016,immunohistochemical was used to exam the level of FBP1.Results:Quantitative RT-PCR show that the expression level of FBP1 mRNA in colorectal adenocarcinoma tissues was remarkably lower than that in adjacent normal colorectal tissues (t=2.934,P=0.006) .The expression level of FBP1 decreased as the increase of malignancy degree and Duke’s stages and distant lymph metastases in colorectal adenocarcinoma (P=0.000).The expression level of FBP1 mRNA in male patients was higher than that in those females,but the difference was not significant (t=1.294,P=0.165).Immunohistochemical results show that the expession level of FBP1 in colorectal adenocarcinoma tissues was lower than that in adjacent normal colorectal tissues (χ2=19.461,P=0.000).Conclusion:The decreased expression level of FBP1 mRNA and its protein may act a critical role in colorectal adenocarcinoma and may be used as a potential therapeutic target for colorectal adenocarcinoma.
Colorectal adenocarcinoma;Fructose-1,6-bisphosphatase 1;Immunohistochemistry;qPCR
10.3969/j.issn.1005-3697.2017.02.004
四川省教育厅基金项目(13ZB0242);川北医学院科研发展计划项目(CBY12-A-QN01)
2016-08-02
刘家有(1986-) , 男, 硕士,助教。
黄波, E-mail:88207635@qq.com
时间:2017-5-5 16∶46
http://kns.cnki.net/kcms/detail/51.1254.R.20170505.1646.008.html
1005-3697(2017)02-0167-05
R735.3
A

