黄瓜绿斑驳花叶病毒外壳蛋白基因原核表达及抗血清制备
刘锦 李亦晴 黄显德 房乐+李向东+田延平

摘要:将黄瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus,CGMMV)的外壳蛋白(coat protein,CP)基因克隆到原核表达载体pEHISTEV上获得pEHISTEV-CGMMV-CP,转化大肠杆菌Rosetta,经IPTG诱导,表达出分子量为19.5 kD的CGMMV CP融合蛋白。切胶回收诱导表达的CGMMV CP免疫家兔,制备抗血清。Western Blotting检测发现,制备的抗血清能与CGMMV CP发生特异性免疫反应,与同属的烟草花叶病毒(Tobacco mosaic virus,TMV)无反应。琼脂双扩散试验测定,制备抗血清的效价为1∶16,ELISA测定效价为1∶1024。该血清特异性强、效价高,可用于CGMMV的检测。
关键词:黄瓜绿斑驳花叶病毒;外壳蛋白基因;原核表达;抗血清
中图分类号:S436.421.1:Q784文献标识号:A文章编号:1001-4942(2017)05-0010-04
Prokaryotic Expression and Antiserum Preparation of Cucumber
green mottle mosaic virus Coat Protein Gene
Liu Jin1, Li Yiqing2, Huang Xiande1, Fang Le1, Li Xiangdong1, Tian Yanping1
(1. Department of Plant Pathology, College of Plant Protection, Shandong Agricultural University,
Taian 271018, China; 2. College of Biological Science and Technology, Beijing Forestry University, Beijing 100083, China)
AbstractThe coat protein (CP) gene of Cucumber green mottle mosaic virus (CGMMV) was cloned into the prokaryotic expression vector pEHISTEV to produce pEHISTEV-CGMMV-CP, which was transformed into competent cells of Escherichia coli Rosetta. Upon induction with IPTG, a fusion protein of 19.5 kD was expressed from the vector pEHISTEV-CGMMV-CP. The fusion protein was recovered from the gel and used to immunize rabbit for antiserum preparation. The resultant antiserum showed strong positive reaction with CP of CGMMV, but not with that of Tobacco mosaic virus, in Western Blotting assay. The titter of antiserum was 1∶16 in agarose immuno diffusion and 1∶1024 in ELISA. The antiserum prepared in this research had high titer and specificity and could be used in the detection of CGMMV.
KeywordsCucumber green mottle mosaic virus; CP gene; Prokaryotic expression; Antiserum
黃瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus,CGMMV)属于烟草花叶病毒属(Tobamovirus)帚状病毒科(Virgaviridae)[1]。该病毒主要侵染黄瓜(Cucumis sativus)、葫芦(Lagenaria siceraria)、甜瓜(Cucumis melo)、丝瓜(Luffa cylindrica)、苦瓜(Momordica charantia)、西瓜(Citrullus lanatus)等葫芦科作物,常造成重大的经济损失。此外,CGMMV还侵染莧色藜(Chenopodium amaranticolor)等藜科植物以及模式植物本氏烟(Nicotiana benthamiana)等[2-7]。CGMMV粒子呈直杆状,约300 nm×18 nm,基因组为线性正单链RNA,全长约6 400个核苷酸,主要由两端的非翻译区(untranslated region,UTR)和中间的4个开放阅读框(open reading frame,ORF)组成,其中ORF4编码17.3 kD的外壳蛋白(coat protein,CP)[8]。
CGMMV在田间主要通过汁液接触传播,也可通过种子携带传播[9]。种植无病毒种苗及早期检测是防治CGMMV的关键。血清学方法具有操作简便、灵敏度高和适合检测大量样品等特点,广泛用于瓜类病毒病的检测中。本研究选用质粒pEHISTEV构建CGMMV济南分离物CP基因的原核表达载体,在大肠杆菌中高效表达CGMMV外壳蛋白,并以此为抗原制备抗血清,所得到的抗血清可用于CGMMV检测。
1材料与方法
1.1试验材料
供试西瓜叶片样品(感染CGMMV)采自济南市济阳县[10]。纯化后的CGMMV和烟草花叶病毒(Tobacco mosaic virus,TMV)分别在本氏烟和普通烟上保存。原核表达载体pEHISTEV由英国圣安德鲁斯大学刘焕庭教授馈赠;大肠杆菌菌株DH5α、大肠杆菌Rosetta均由本实验室保存;反转录酶、Taq DNA聚合酶、 限制性内切酶 (EcoRⅠ、XhoⅠ)、T4 DNA连接酶、dNTP、无RNase水等购自TaKaRa公司;RNeasy Plant Mini Kit购自Qiagen;DNA回收试剂盒、质粒小提试剂盒、DNA 分子量标准DL2000 Plus和蛋白分子量标准购自北京全式金公司;其它生化试剂及普通化学试剂均为进口或国产分析纯。
1.2基因扩增及原核表达载体构建
利用RNeasy Plant Mini Kit提取西瓜叶片总RNA,以CGMMV CP基因下游引物5′-CCCTCGAGCTAAGCTTTCGAGGTGGTAGCCT-3′(下划线部分为Xho Ⅰ酶切位点)进行反转录,利用CP基因上游引物5′-CGGAATTCATGGCTTACAATCCGATCACAC-3′(下划线部分为EcoRⅠ酶切位点)和下游引物进行PCR,扩增CGMMV CP基因。PCR产物经1%低熔点琼脂糖凝胶电泳后回收,用EcoRⅠ、XhoⅠ双酶切后,与同样酶处理的载体pEHISTEV在4℃连接过夜。将连接产物pEHISTEV-CGMMV-CP转化大肠杆菌DH5α,对经 PCR扩增的阳性克隆进行测序,以确保序列正确。
1.3蛋白表达和SDS-PAGE分析
将pEHISTEV-CGMMV-CP转化大肠杆菌Rosetta。挑取单菌落接种于5 mL LB液体培养基中(含50 μg/mL卡那霉素),37℃活化过夜,次日按1∶100稀释到20 mL含卡那霉素的LB液体培养基中,37℃、220 r/min培养3 h (OD600为0.4~0.6),加IPTG至终浓度0.2 mmol/L,继续于25℃、220 r/min培养5 h。
离心收集菌体,加适量TE溶液(pH值8.0),振荡悬浮,再加入等体积的2×SDS上样缓冲液,100℃煮沸5 min,冰冻5 min,12 000 r/min离心10 min后进行SDS-PAGE。
1.4抗血清制备
将原核表达产物经12% SDS-PAGE电泳后,用预冷的0.25 mol/L KCl和1 mmol/L DTT染色,切取含有目的蛋白的胶条,按1∶1比例(W/V)加入0.9%生理盐水在预冷的研钵中研磨。将获得的目的蛋白加入等体积的弗氏不完全佐剂乳化后,经背部和皮下多点注射免疫家兔,共免疫3次。第一次免疫剂量为1 mg,之后每隔10天进行加强免疫,免疫剂量为0.6 mg,最后一次免疫后7天耳静脉取血测定抗血清效价。抗血清加入0.02%的叠氮化钠于-20℃保存。
1.5抗血清特异性、效价和灵敏度分析
利用Western Blotting[11]测定制备的抗血清与CGMMV及同属的TMV有无反应,评价抗血清的特异性。利用琼脂免疫双扩散和 ACP-ELISA测定抗血清的效价[12]。制备的抗血清按1∶20~1∶213进行梯度稀释。ELISA测定中,显色后用酶标仪读取405 nm的OD值,I(待测样品读数-空白读数)/H(阴性样品的读数-空白读数)≥3判断为阳性反应。将感染CGMMV的本氏烟叶片病汁液进行梯度稀释(1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256),然后进行Western Blotting分析,检测抗血清的灵敏度。
2结果与分析
2.1CGMMV CP基因原核表达载体的构建
用CGMMV CP基因的上游和下游引物进行RT-PCR扩增,得到486 bp的片段。将PCR产物回收纯化后用EcoRⅠ、XhoⅠ双酶切,与同样酶处理的pEHISTEV载体连接,获得重组质粒pEHISTEV-CGMMV-CP。对其进行PCR鉴定(图1),并通过测序证明其序列和阅读框正确。
2.2CGMMV CP的诱导表达和SDS-PAGE分析
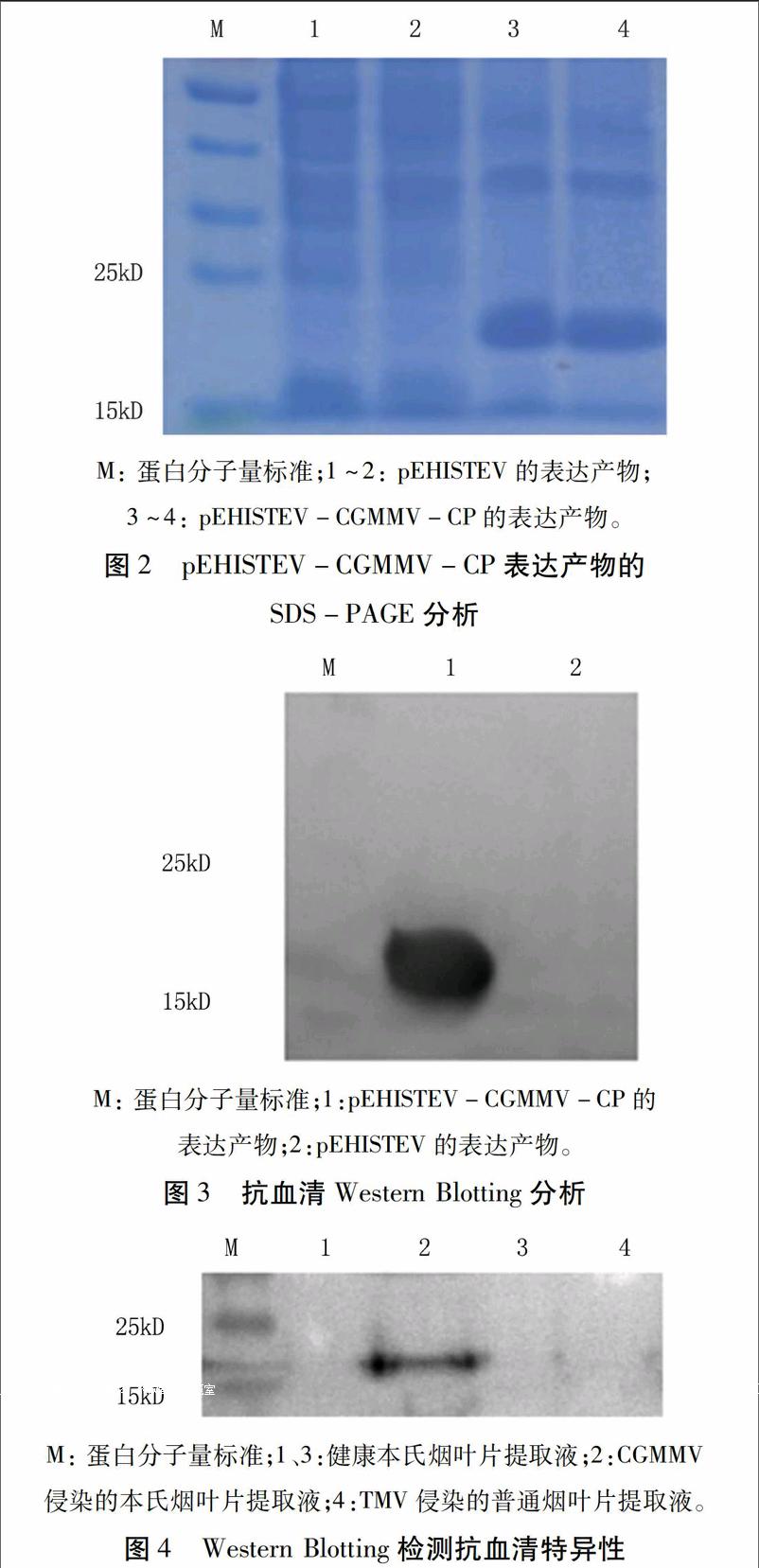
将pEHISTEV-CGMMV-CP转化大肠杆菌Rosetta,经0.2 mmol/L的IPTG诱导后进行SDS-PAGE电泳。结果显示,在19.5 kD附近有一条蛋白带(图2),这是CGMMV CP基因与载体pEHISTEV上的His-Tag、TEV蛋白酶酶切位点基因融合表达的蛋白。结果与预期相符,表明CGMMV CP在大肠杆菌中得到了正确的表达。
2.3抗血清特异性
经Western Blotting分析,在用含pEHISTEV-CGMMV-CP的菌液上样的泳道中出现一条分子量为19.5 kD的蛋白带,而用含空载体pEHISTEV的菌液上样的泳道中没有出现(图3),说明制备的抗血清与原核表达载体pEHISTEV-CGMMV-CP表达的CGMMV CP有特异性免疫反应。抗血清与CGMMV侵染的本氏烟叶片提取液有特異性免疫反应(图4),而与健康本氏烟叶片提取液及同属的TMV均无反应,说明制备的抗血清有非常好的特异性。
2.4抗血清效价及灵敏度
琼脂免疫双扩散结果表明,抗血清的效价为1∶16;ACP-ELISA结果表明,抗血清效价为1∶1024。Western Blotting结果表明,在病汁液稀释2~16倍时,NC膜上出现明显的黑色条带;在病汁液稀释到128倍时,依然可以看到较为明显的条带,说明该血清具有较高的灵敏度(图5)。
M: 蛋白分子量标准;1~8:感病本氏烟叶片病汁液梯度稀释(1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256);9∶健康本氏烟汁液。
3结论
利用提纯病毒制备的抗血清中常含有寄主蛋白的抗体,容易导致假阳性反应[13]。另外,有些病毒在病组织中的含量低,不易获得大量高纯度病毒。利用原核细胞表达病毒基因的产物作为抗原可以得到特异性强的抗血清,较好地解决以上问题。TMV与CGMMV同属烟草花叶病毒属,彼此的血清间容易出现交叉反应[14]。本研究以在大肠杆菌中表达的CP为抗原制备了CGMMV的抗血清,该血清效价高、特异性强,可用于琼脂免疫双扩散、ELISA和Western Blotting分析,为CGMMV的快速检测及病毒的致病机理研究提供了条件。
参考文献:
[1]Francki R I, Hu J, Palukaitis P. Taxonomy of cucurbit-infecting tobamoviruses as determined by serological and molecular hybridization analyses[J]. Intervirology, 1986, 26(3):156-163.
[2]Ainsworth G. Mosaic diseases of the cucumber[J]. Annals of Applied Biology, 1935, 22 (1): 55-67.
[3]Vareri C, Vassilakos N, Bem F. Characterization and detection of Cucumber green mottle mosaic virus in Greece[J]. Phytoparasitica, 2002, 30(5): 493-501.
[4]Choi G S. Occurrence of two tobamovirus diseases in cucurbits and control measures in Korea[J]. Plant Pathology Journal, 2001, 17(5): 243-248.
[5]Zitikaite I. Viruses of cucumber plants and identification of their agents[J]. Biologija, 2002, 2: 42-46.
[6]陈红运, 赵文军, 程毅, 等. 辽中地区西瓜花叶病病原的分子鉴定[J]. 植物病理学报, 2006, 36(4):306-309.
[7]吴元华, 李立梅, 赵秀香, 等. 黄瓜绿斑驳花叶病毒在我国定殖和扩散的风险性分析[J]. 植物保护, 2010, 36 (1): 33-36.
[8]Wang H, Stubbs G. Structure determination of Cucumber green mottle mosaic virus by X-ray fiber diffraction: significance for the evolution of tobamoviruses[J]. Journal of Molecular Biology, 1994, 239(3): 371-384.
[9]Hollings M, Komuro Y, Tochihara H. Cucumber green mottle mosaic virus[J]. CMI/AAB Descriptions of Plant Viruses, 1975,154: 1-4.
[10]許帅, 刘群, 耿超, 等. 基于全基因组序列的黄瓜绿斑驳花叶病毒重组和系统发育分析[J]. 植物病理学报, 2016, 46(3): 320-327.
[11]Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some application [J]. Proceedings of the National Academy of Sciences of the USA, 1979, 76: 4350-4354.
[12]Tian B, Pei M Y. Plant virus research methods (Part 1) [M]. Beijing: Science Press, 1987: 247-249.
[13]邓丛良, 韩丽娟, 燕照玲, 等. 白草花叶病毒CP基因在大肠杆菌中的表达及抗血清的制备[J]. 植物病理学报, 2005, 35(5): 442-445.
[14]Hull R. Matthews plant virology (Forth Edition) [M]. Academic Press, 2001.

