142例恶性胸水细胞蜡块的免疫组化检测及分子病理检测
隋燕霞,柳 雨,蒋 娜,蒋伊娜,张冠军
142例恶性胸水细胞蜡块的免疫组化检测及分子病理检测
隋燕霞,柳 雨,蒋 娜,蒋伊娜,张冠军
目的 探讨细胞蜡块结合免疫组化在恶性胸水的诊断及鉴别诊断中的作用,并分析胸水细胞蜡块在肺腺癌分子病理检测中的作用。方法 回顾性分析142例恶性胸水的液基细胞学、细胞蜡块HE染色以及免疫组化EnVision两步法染色,并结合细胞形态抗体的表达情况对恶性胸水进行肿瘤分类。采用ARMS-PCR法对其中40例经免疫组化EnVision染色确诊为肺腺癌的胸水细胞蜡块,进行表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变检测。结果 142例胸水细胞蜡块经免疫组化染色证实肺腺癌99例,肺小细胞癌4例,肺鳞状细胞癌3例,乳腺癌13例,卵巢癌9例,胃癌 2例,甲状腺癌1例,子宫内膜癌1例,间皮瘤5例,淋巴瘤3例,恶性黑色素瘤1例,滑膜肉瘤1例。40例肺腺癌中EGFR 基因突变20例,其中19del突变9例,L858R突变11例。结论 恶性胸水细胞蜡块行免疫组化检测不仅有助于肿瘤的明确诊断,更有助于对肿瘤进行分类并判断肿瘤原发部位及帮助判断预后。利用胸水细胞蜡块可以对肺腺癌进行EGFR基因突变的检测,为肺腺癌的基因检测提供新型的标本来源。
胸水;细胞蜡块;免疫组织化学;基因突变
胸水是许多疾病的常见临床表现,其性质的判断对临床诊断及治疗具有重要意义。胸水细胞学检查具有损伤小、方法简易等特点,目前传统的细胞学检查既无法对胸水样本长期保存,也未能对临床提供更多的有效信息[1]。本文现采用细胞蜡块技术,探讨细胞蜡块结合免疫组化EnVision两步法染色在胸水诊断中的应用。同时对经免疫组化EnVision两步法确诊为肺腺癌的部分病例进行表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变检测,从而为临床靶向药物的筛选提供新型的标本来源。
1 材料与方法
1.1 材料 收集西安交通大学第一附属医院病理科2015年1月~2016年6月确诊为恶性胸水142例,其中男性58例,女性84例,男女比为1 ∶1.45,年龄27~99岁,平均(60.98±12.12)岁。
1.2 方法
1.2.1 液基细胞学 使用广州安必平液基细胞沉降式制片染色机,按试剂盒操作步骤进行制片,巴氏染色,阅片。
1.2.2 细胞蜡块的制作 取液基制片后剩余胸水放入50 mL离心管中,离心机2 000 r/min,离心5 min,弃上清,如果沉淀物不够可反复离心收集(血性标本先加入3%醋酸乙醇10 mL,振荡均匀,2 000 r/min,离心5 min,去除血细胞干扰);向沉淀物中加入10%中性福尔马林5 mL,振荡,2 000 r/min,离心5 min,弃上清;向沉淀物中加入95%乙醇10 mL,振荡,2 000 r/min,离心10 min,弃上清液;底部沉淀镊取至擦镜纸上,包好,与常规组织一起行脱水处理,制成细胞蜡块。
1.2.3 免疫组化 用细胞蜡块制作3 μm厚切片,免疫组化采用EnVision两步法,具体步骤按试剂盒说明书进行染色。一抗选用CK、vimentin、CEA、CK7、Napsin A、TTF-1、p40、CK5/6、p63、Calretinin、WT-1、MC、D2-40、CD56、CgA、Syn、CA125、Pax-8、p16、CK20、Villin、CDX2、GCDFP-15、Mammaglobin、ER、PR、HER-2、CD45、CD20、CD79a、CD3、CD43、HMB-45、Melan-A、S-100、CK19、Galectin-3、TG、EMA、desmin、p53、Ki-67等进行检测;抗体及工作液均购自福州迈新公司。
1.2.4 ARMS-PCR法 细胞蜡块标本切片10 μm厚,数量≥10 张,将切片用镊子转移至洁净的1.5 mL离心管中。应用厦门艾德公司的石蜡包埋组织样品DNA提取试剂盒,按试剂盒说明书进行DNA提取,DNA样本经Nano Drop 2000分光光度计(美国Thermo Scientific 公司)定量,并调节终浓度为2 ng/μL。应用ARMS法对提取的DNA进行EGFR基因突变检测,具体步骤按试剂盒说明书进行。
2 结果
2.1 恶性胸水的肿瘤细胞来源及肺腺癌的基因突变 142例胸水细胞蜡块经免疫组化EnVision两步法染色证实肺腺癌99例,肺小细胞癌4例,肺鳞状细胞癌3例,乳腺癌13例,卵巢癌9例,胃癌 2例,甲状腺癌1例,子宫内膜癌1例,间皮瘤5例,淋巴瘤3例,恶性黑色素瘤1例,滑膜肉瘤1例(表1)。40例肺腺癌中EGFR 基因突变20例,其中19del突变9例,L858R突变11例。
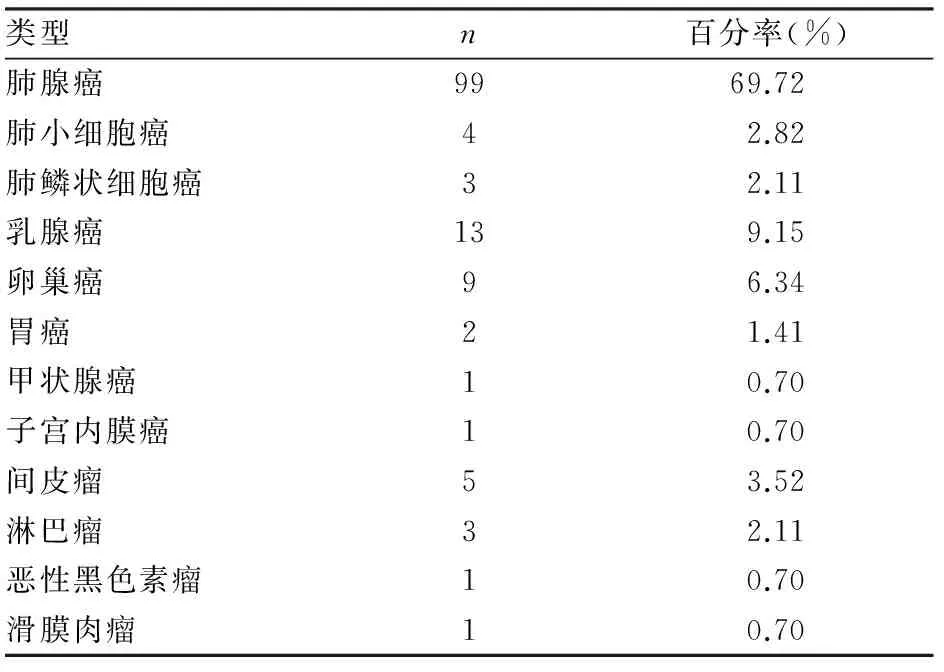
表1 胸水细胞蜡块免疫组化的分型诊断结果(n=142)
2.2 液基制片观察 液基细胞巴氏染色结果以腺癌多见,其中最常见的是肺腺癌,癌细胞常聚集成团,分化差时可散在分布,核质比增大,核异形,核仁明显,胞质内可见黏液空泡(图1A);另外较常见的腺癌有乳腺癌和卵巢癌,乳腺癌细胞黏附性强,常形成大小不同的圆形、卵圆形三维细胞团,团内细胞可相互重叠,大小较一致(图1B);卵巢癌常形成大量的细胞团,三维立体感强,可有黏液空泡。少见肿瘤有肺小细胞癌、肺鳞状细胞癌、胃癌、甲状腺癌、子宫内膜癌、间皮瘤、淋巴瘤以及其他软组织肿瘤。小细胞癌细胞体积小,可成堆或成团排列,镶嵌特征明显,并常见单个细胞呈列兵式排列,胞质稀少或缺如,核形不规则深染,核分裂象易见;鳞状细胞癌细胞异形性明显,散在分布,胞质丰富,核异形明显,可见巨核细胞,核染色质粗糙、深染;胃癌、甲状腺癌、子宫内膜癌液基细胞学均为不同分化程度的腺癌特点,即常聚集成团,核质比增大,核异形,核仁明显,胞质内可见黏液空泡;间皮瘤细胞由一系列的间皮细胞构成,细胞可呈团排列,细胞团边缘呈桑葚状或结节状,细胞较腺癌异形性小,核居中,胞质核周浓染,边缘较淡;淋巴瘤细胞小而一致,呈圆形或卵圆形,胞质稀少,核染色质颗粒状;恶性黑色素瘤细胞呈圆形、卵圆形及不规则形,细胞异形性明显,核不规则,可见八字形细胞核,核仁明显,细胞质内可见黑色素颗粒;滑膜肉瘤细胞大小形态多样,可见梭形细胞,异形明显,核染色质粗糙,核分裂象多见。
2.3 细胞蜡块切片观察 细胞蜡块切片HE染色镜下观察,切片背景干净,染色对比清晰,细胞数明显增多。腺癌的细胞蜡块切片不仅具有癌细胞的形态学特点,还可以观察类似组织学的排列方式及结构,如腺状、乳头状、梁索状、巢团状结构等(图2)。肺小细胞癌、鳞状细胞癌、间皮瘤、淋巴瘤及其他软组织肿瘤形态上与相应的组织学相似。
2.4 细胞蜡块结合免疫组化进行分型诊断 142例胸水细胞蜡块经免疫组化染色证实肺腺癌99例,免疫组化通常CK7、Napsin A(图3A)和TTF-1均呈阳性;乳腺癌13例,免疫组化标记CK7、GCDFP-15、Mammaglobin均呈阳性,不同程度表达ER (图3B)、PR、HER-2;卵巢癌9例,免疫组化标记CK7、CA125、Pax-8、WT-1均呈阳性,不同程度表达ER、PR、p16;肺小细胞癌4例,免疫组化标记TTF-1、CD56、Syn、CgA均呈阳性;肺鳞状细胞癌3例,免疫组化标记CK、p40、CK5/6、p63均呈阳性;胃癌2例,免疫组化标记CK20、Villin、CDX2均呈阳性;甲状腺癌1例,免疫组化标记CK19、Galectin-3、TG、TTF-1均呈阳性;子宫内膜癌1例,免疫组化标记CK7、ER、PR均呈阳性;间皮瘤5例,免疫组化标记CK5/6、WT-1、D2-40、CR、MC、EMA、p53均呈阳性;B细胞淋巴瘤3例,免疫组化标记vimentin、CD45、CD20、CD79a均呈阳性;恶性黑色素瘤1例,免疫组化标记vimentin、HMB-45、Melan-A、S-100均呈阳性;滑膜肉瘤1例,免疫组化标记CK、EMA、vimentin、Calretinin不同程度阳性表达。
2.5 应用细胞蜡块进行肺腺癌EGFR基因突变检测 40例肺腺癌胸水细胞蜡块中EGFR基因突变20例(图4),其中19del突变9例,L858R突变11例,其余20例未见EGFR基因突变。
3 讨论
胸水是许多疾病,尤其是恶性肿瘤的常见临床表现。虽然胸水细胞学检查具有快速、简单、标本易于采集等优点,但传统的细胞学涂片及胸水液基细胞学涂片检查标本难以长期保存,对恶性胸水无法行进一步检测等缺点,使传统胸水细胞学诊断具有一定的局限性,诊断水平停留在“找见肿瘤细胞”或“未找见肿瘤细胞”。细胞蜡块包埋技术在国外许多国家已成为细胞学常规诊断技术[2],而在国内应用有限,仅在一些大型医院的病理科开展。本文回顾性分析我院确诊为恶性胸水细胞蜡块142例,对液基细胞学巴氏染色与细胞蜡块HE染色进行对比,发现细胞蜡块的肿瘤细胞数量多,细胞结构清晰,并能保持一定的组织学结构和排列方式,HE染色也更接近组织学特点,有利于细胞学的诊断,从而提高细胞学诊断的灵敏度和准确性[3]。

①A①B②A②B③A③B
图1 A.肺腺癌细胞聚集成团或散在分布,核质比增大,核异形,核仁明显,胞质内可见黏液空泡,巴氏染色;B.乳腺癌癌细胞形成大小不等的圆形、卵圆形三维细胞团,细胞大小较一致,巴氏染色 图2 A.肺腺癌细胞蜡块切片可见腺样及乳头状结构;B.乳腺癌细胞蜡块切片癌细胞呈巢团状结构,其内可见小的腺腔形成 图3 A.肺腺癌Napsin A癌细胞胞质阳性,EnVision两步法;B.乳腺癌ER癌细胞胞核阳性,EnVision两步法
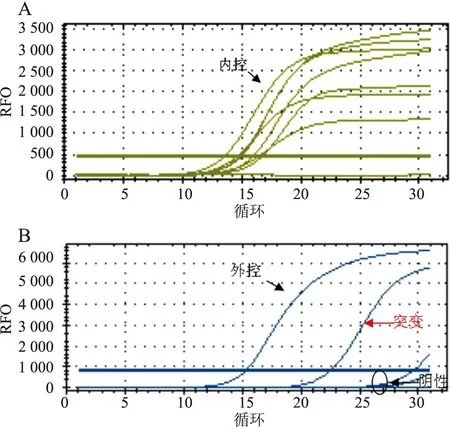
图4 内控(A)、外控(B)信号均升起,表明检测体系正常;可见EGFR基因突变信号
细胞蜡块的最大优点是可以连续切片,并可以行免疫组化染色以满足诊断需要,提高诊断的准确性,帮助判断肿瘤细胞的原发部位[4-5]。随着细胞学技术的迅速发展,免疫组化染色已逐步应用于细胞学的诊断中,但免疫组化标志物种类繁多,其敏感性和特异性各异,因此要求细胞学诊断医师能够熟练掌握各种肿瘤细胞与间皮细胞免疫标志物的表达特点,对胸水细胞学作出精确的诊断,确定肿瘤类型为临床提供治疗依据[6]。大量数据表明转移性腺癌是胸水中最常见的恶性肿瘤,包括肺腺癌、乳腺癌、卵巢癌等,其中以肺腺癌最常见[7]。转移性腺癌细胞和胸水中的反应性增生间皮细胞、间皮瘤细胞的形态也有不少相似之处,因此器官特异性抗体的应用为确定诊断以及判断肿瘤的来源提供较大的帮助。Napsin A、TTF-1在肺腺癌细胞中表达,联合两者是肺腺癌较为可靠的标志物[8];联合应用p40、p63是鳞状细胞癌较为可靠的标志物;联合应用CD56、CgA、Syn是小细胞癌较为可靠的标志物;联合应用Mammaglobin、ER、PR是乳腺癌较为可靠的标志物;CA125是卵巢癌较为可靠的标志物;联合应用Calretinin、WT-1、MC、D2-40是间皮细胞较为可靠的标志物。然而具有异型性的间皮细胞是反应性增生还是恶性间皮瘤,需使用EMA、desmin、p53和Ki-67加以鉴别,恶性间皮瘤细胞EMA呈强阳性,而在反应性间皮细胞中为灶状弱阳性,反应性增生的间皮细胞中desmin呈阳性,而在恶性间皮瘤细胞中呈阴性,p53阳性率大于50%,Ki-67大于20%提示恶性间皮瘤细胞[9]。少见肿瘤的免疫组化根据细胞学特点与特异性免疫组化标志物的表达情况进行确定。本组142例恶性胸水细胞蜡块的免疫组化结果:肺腺癌99例,肺小细胞癌4例,肺鳞状细胞癌3例,乳腺癌13例,卵巢癌9例,胃癌 2例,甲状腺癌1例,子宫内膜癌1例,间皮瘤5例,淋巴瘤3例,恶性黑色素瘤1例,滑膜肉瘤1例;其结果与文献报道一致。
EGFR是跨细胞膜糖蛋白,属于受体型酪氨酸激酶,其信号通路在细胞的生长、增殖和分化等过程中发挥重要的调节作用。EGFR基因在多种肿瘤中存在过表达或突变,从而调节肿瘤的生长、侵袭、转移和血管生成[10]。EGFR被认为是最有效的肺腺癌治疗靶点之一。目前,虽然肺腺癌的靶向治疗已经进入规范化阶段,新的靶向药物不断出现,但EGFR依然是靶向治疗前的必检基因[11-12]。临床上用于EGFR检测的标本大多来自于手术切除标本或活检标本,但对于已经失去手术机会的晚期肺癌患者或者活检标本不易获取的肺癌患者,胸腔积液就成为进行EGFR检测重要的标本来源。胸水细胞蜡块中肿瘤细胞富集,是EGFR检测的一种新型标本[13]。EGFR突变通常发生于18~21号外显子,其中19del缺失及 L858R突变最常见。文献报道在西方国家,非小细胞肺癌患者EGFR基因突变发生率为10%~15%,而亚洲国家发生率高达30%~40%。EGFR突变在年轻女性和不吸烟者患者中更为常见[14-15]。本组40例肺腺癌胸水细胞蜡块中EGFR基因突变20例,其中19del突变9例,L858R突变11例,与文献报道基本一致。
[1] Nathan N A, Narayan E, Smith M M,etal. Cell block cytology. Improved preparation and its efficacy in diagnostic cytology[J]. Am J Clin Pathol, 2000,114(4):599-606.
[2] Shivakumarswamy U, Arakeri S U, Karigowdar M H,etal. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology[J]. J Cytol, 2012,29(1):11-15.
[3] Thapar M, Mishra R K, Sharma A,etal. Critical analysis of cell block versus smear examination in effusions[J]. J Cytol, 2009,26(2):60-64.
[4] Ensani F, Nematizadeh F, Irvanlou G. Accuracy of immunohistochemistry in evaluation of malignant pleural and peritoneal effusions[J]. Pol J Pathol, 2011,62(2):95-100.
[5] Skoog L, Tani E. Immunocytochemistry: an indispensable technique in routin ecytology[J]. Cytopathology, 2011,22(4):215-229.
[6] Kimbrell H Z, Gustafson K S, Huang M,etal. Subclassification of non-small cell lung cancer by cytologic sampling: a logical approach with selective use of immunocytochemistry[J]. Acta Cytol, 2012,56(4):419-424.
[7] Gomez-Fernandez C, Jorda M, Delgado P I,etal. Thyroid transcription factor 1: a marker for lung adenoarinoma in body cavity fluids[J]. Cancer, 2002,96(5):289-293.
[8] Myong N H. Thyroid transcription factor-1 (TTF-1) expression in human lung carcinomas: its prognostic implication and relationship with expression of p53 and Ki-67 proteins[J]. J Korean Med Sci, 2003,18 (4):494-500.
[9] Su X Y, Li G D, Liu W P,etal. Cytological differential diagnosis among adenocarcinoma, epithelial mesothelioma, and reactive mesothelial cells in serous effusions by immunocytochemistry[J]. Diagn Cytopathol, 2011,39(12):900-908.
[10] Jorissen R N, Walker F, Pouliot N,etal. Epidermal growth factor receptor: mechanisms of activation and signaling[J]. Exp Cell Res, 2003,284(1):31-53.
[11] Paez J G, Janne P A, Lee J C,etal. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy[J]. Science, 2004,304(5676):1497-1500.
[12] Pao W, Chmielecki J. Rational, biologically based treatment of EGFR-mutant non-small-cell lung cancer[J]. Nat Rev Cancer, 2010,10(11):760-774.
[13] Liu X, Lu Y, Zhu G,etal. The diagnostic accuracy of pleural effusion and plasma samples versus tumour tissue for detection of EGFR mutation in patients with advanced non-small cell lung cancer: comparison of methodologies [J]. J Clin Pathol, 2013,66(12):1065-1069.
[14] Kumar A, Petri E T, Halmos B,etal. Structure and clinical relevance of the epidermal growth factor in human cancer[J]. J Clin Oncol, 2008,26(10):1742-1751.
[15] Shigematsu H, Lin L, Takahashi T,etal. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers[J]. J Natl Cancer Inst, 2005,97(5):339-346.
Immunohistochemical detection and molecular pathological examination of 142 cases of malignant pleural effusion
SUI Yan-xia, LIU Yu, JIANG Na, JIANG Yi-na, ZHANG Guan-jun
(DepartmentsofPathology,theFirstAffiliatedHospitalofxi’anJiaotongUniversity,xi’an710061,China)
Purpose To explore the role of cell blocks combined with immunohistochemical examination in the diagnosis and differential diagnosis of malignant pleural effusion, and to explore the role of pleural effusion cell blocks in lung adenocarcinoma molecular pathology examination. Methods 142 cases of malignant pleural effusion based cytology, cell blocks of HE staining and immunohistochemical staining by EnVision two-step were retrospectively analysed, the tumor classification was made through analyzing the characteristics of the cells combined with antibody expression. The detection of epidermal growth factor receptor (EGFR) gene mutation of 40 cases of lung adenocarcinoma diagnosed after immunohistochemical staining were used by ARMS-PCR method. Results Among 142 cases of malignant pleural effusion, there were 99 cases caused by lung adenocarcinoma, 4 cases of lung small cell carcinoma, 3 cases of lung squamous cell carcinoma, 13 cases of breast carcinoma, 9 cases of ovarian carcinoma, 2 cases of gastric carcinoma, 1 case of thyroid carcinoma, 1 case of endometrial carcinoma, 5 cases of mesothelioma, 3 cases of lymphoma, 1 case of malignant melanoma, 1 case of synovial sarcoma. In 40 cases of lung adenocarcinoma pleural effusion cell block, there were 20 cases with EGFR mutations, 9 cases of 19del mutations and 11 cases L858R mutations. Conclusion The pleural effusion cell blocks combined immunohistochemistry are useful to improve the accuracy of diagnosis of patients with pleural effusion, and helpful for the determination of classification and the primary site of tumor, assessment of prognosis. Pleural dffusion cell block may used to detect EGFR mutations of lung adenocarcinoma, which provide new source of specimen for the gene detection of lung adenocarcinoma.
pleural effusion;cell blocks;immunohistochemistry; mutation
时间:2017-3-16 14:23
http://kns.cnki.net/kcms/detail/34.1073.R.20170316.1423.013.html
陕西省社会发展科技攻关(2016SF-174)
西安交通大学第一附属医院病理科,西安 710061
隋燕霞,女,硕士,主治医师。E-mail: suiyanxi029@163.com
R 734.2
A
1001-7399(2017)03-0292-05
10.13315/j.cnki.cjcep.2017.03.013
接受日期:2017-01-14

