miR-31通过结合Dock180抑制乳腺癌细胞侵袭
郑书贤,孙雪梅,王瑞鸽,史立宏,张宝刚
miR-31通过结合Dock180抑制乳腺癌细胞侵袭
郑书贤1,孙雪梅1,王瑞鸽1,史立宏2,张宝刚1
目的 探讨miR-31表达与Dock180表达的相关性,以及miR-31通过结合Dock180对乳腺癌细胞侵袭能力的影响。方法 通过脂质体转染技术,将miR-31转染乳腺癌细胞系过表达miR-31;采用荧光酶报告基因检测miR-31与Dock180的结合方式;应用Western blot法检测miR-31表达不同的乳腺癌细胞中Dock180和其他相关蛋白的表达;RT-PCR检测miR-31与Dock180 mRNA的关系;基质胶侵袭实验检测miR-31过表达时,乳腺癌细胞的侵袭能力。结果 在乳腺癌细胞中,miR-31靶向结合Dock180,且Dock180蛋白表达与miR-31表达呈负相关,Dock180下调和miR-31上调削弱了乳腺癌的侵袭能力。结论 miR-31可通过结合Dock180抑制乳腺癌细胞的侵袭。
乳腺肿瘤;miR-31;Dock180;侵袭
乳腺癌是女性最常见的恶性肿瘤,其发病率与病死率逐年上升,侵袭和转移是乳腺癌患者死亡的主要原因[1]。Dock180是作为信号衔接蛋白(Crk)下游因子为人们熟知,相对分子质量约1.80×105。Dock180作为小GTP酶Rho家族的鸟嘌呤核苷交换因子(guanine-nucleotide exchange factor, GEF),是调节肌动蛋白细胞骨架及细胞形态的重要分子[2]。Li等[3]的研究表明,Dock180参与乳腺癌的侵袭。作者推测有microRNA(miRNA)参与调节Dock180的表达,通过Target Scan靶点预测工具(http://www.targetscan.org/)搜索,发现Dock180基因为miR-31潜在的靶基因。近来,大量研究表明[4-8],miR-31可以抑制乳腺癌的侵袭[5]和转移[6],促进凋亡[7]。因此,miR-31在乳腺癌中异常低表达,有望成为乳腺癌筛查、诊断乃至治疗中的新靶点。因此,为进一步明确miR-31和Dock180的关系,需对两者进行深入分析。本文旨在探讨miR-31是否参与调节Dock180的表达,且miR-31和Dock180结合对乳腺癌侵袭的影响。
1 材料与方法
1.1 材料 人类乳腺癌细胞系MDA-MB-231、MDA-MB-435、MCF-7购自American Type Culture Collection(ATCC)公司;培养基及相关试剂购自Hyclone公司;细胞裂解液、胰酶等购自北京碧云天公司;兔抗人Dock180单抗购自北京中杉金桥公司;侵袭实验所用的Transwell小室购自Corning公司;Matrigel购自BD公司。
1.2 方法
1.2.1 细胞培养和转染 MDA-MB-231、MDA-MB-435、MCF-7细胞置于37 ℃ 5%CO2的湿润环境中常规培养。MDA-MB-231(2×105个)细胞种植于4个35 mm培养皿内,24 h后根据试剂盒说明书将miR-31阴性对照、miR-31、miR-31抑制剂、miR-31抑制剂阴性对照的Lipofectamine 2000(Invitrogen, Carlsbad, CA, USA))转染MDA-MB-231。转染后分别命名为MDA-MB-231/NC、MDA-MB-231/miR-31、miR-31 inhibitor、inhibitor NC,于37 ℃、5%CO2环境下培养,以供后续实验使用。
1.2.2 体外癌细胞侵袭实验 按照文献[5]方法进Transwell小室侵袭实验。将转染成功的MDA-MB-231/miR-31、MDA-MB-231/NC分别用胰蛋白酶消化,1×105个细胞种于Transwell小室的上室,预涂层为20 μg Matrigel(基质胶),下室为10%胎牛血清作为化学引诱物。37℃、5%CO2温箱孵育24 h后取出培养板,弃去Transwell小室内培养基,用棉签擦掉上室的基质胶和非侵袭细胞,下室用甲醇固定10 min后,常规HE染色,400倍光镜下观察5个高倍镜视野,计数Transwell小室下室的细胞数即为穿透人工基膜的细胞数,每个实验重复3次,取平均数作为实验结果。
1.2.3 Western blot法 使用Western blot法检测转染后细胞的Dock180蛋白表达量,β-actin作为内参。转染后的MDA-MB-231/NC、MDA-MB-231/mR-31、miR-31 inhibitor、inhibitor NC细胞常规培养72 h提取总蛋白,蛋白变性后经SDS-PAGE凝胶电泳、转膜、封闭、一抗孵育过夜、二抗孵育后显影得到Dock180的蛋白表达情况。实验重复3次,结果用Image J软件处理,以第一个数值作为基数,其他数值与第一个数值的比值为相对密度。
1.2.4 RT-PCR法 用Trizol抽提细胞总RNA,5 ng总RNA为模板,在引物的指引下以dNTP为原料经过变性、复性、延伸35个循环合成cDNA,Dock180的表达水平应用Quantity One 4.62定量分析。
1.2.5 荧光素酶报告实验 MDA-MB-231/miR-31、MDA-MB-231/NC细胞各3.5×104个接种于48孔板。设计引物用PCR法从基因组DNA中克隆所需的靶启动子片段Dock180-3′UTR,将此片段插入到荧光素酶报告基因腺病毒中构成pGL-Dock180-3′UTR。培养24 h后,Lipofectamine 2000转染。转染48 h后用荧光素酶报告实验工具箱依据公司给与的说明检测pGL-Dock180-3′UTR的相对荧光酶素活性。
1.3 统计学方法 所有数据采用SPSS 17.0软件进行统计学处理,统计方法采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-31与Dock180的3′UTR互补结合 通过Target Scan靶点预测工具搜索,结果显示miR-31与Dock180的3′UTR互补结合(图1)。
2.2 miR-31在3种乳腺癌细胞系中的表达 本实验选择3种乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-435(侵袭力依次增强),RT-PCR检测显示,miR-31在3种乳腺癌中表达不同,侵袭力较弱的MCF-7高表达miR-31,侵袭力强的MDA-MB-435低表达miR-31,MDA-MB-231表达居中。提示miR-31的表达量与乳腺癌细胞系的侵袭能力呈反比(图2)。

图1 miR-31与Dock180的3′UTR互补结合
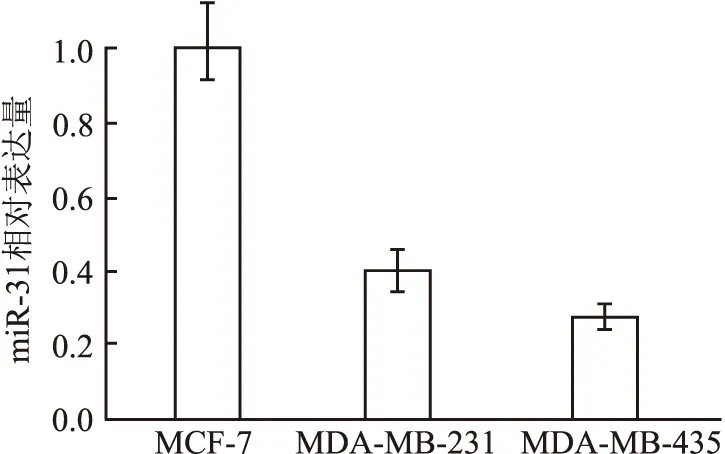
图2 miR-31在3种乳腺癌细胞系中的表达
2.3 Dock180的表达与miR-31呈负相关 miR-31可以结合Dock180,但miR-31对Dock180表达量的影响未知。采用Western blot法检测转染后细胞中Dock180的表达, MDA-MB-231/miR-31中Dock180低表达,miR-31 inhibitor中Dock180高表达;Dock180的表达与miR-31呈负相关(图3)。
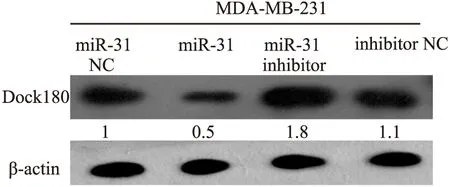
图3 Dock180的表达与miR-31呈负相关
2.4 miR-31与Dock180的3′UTR结合抑制其翻译 miRNA通过两种方式对靶基因的表达进行反向调节,一种是与mRNA结合,使其降解;另一种是结合在mRNA的3′UTR,抑制翻译。为了证明miR-31与Dock180作用方式,本实验通过RT-PCR分别检测MDA-MB-231/miR-31、MDA-MB-231/NC中Dock180 mRNA的表达。MDA-MB-231/miR-31、MDA-MB-231/NC中,Dock180 mRNA表达量的差异无统计学意义(P>0.05)。提示miR-31不是结合在Dock180 mRNA上使其降解,而是结合在Dock180的3′UTR上抑制翻译(图4)。
2.5 miR-31通过与Dock180的3′UTR靶向结合降低Dock180的翻译 本组采用荧光素酶报告基因实验检测MDA-MB-231/miR-31、MDA-MB-231/NC的pGL-Dock180-3′UTR的相关荧光素酶活性,MDA-MB-231/NC的活性明显高于MDA-MB-231/miR-31,差异有统计学意义(P<0.05),提示miR-31结合Dock180的3′UTR(图5)。

图4 RT-PCR检测MDA-MB-231/miR-31、MDA-MB-231/NC中 Dock180 mRNA表达差异
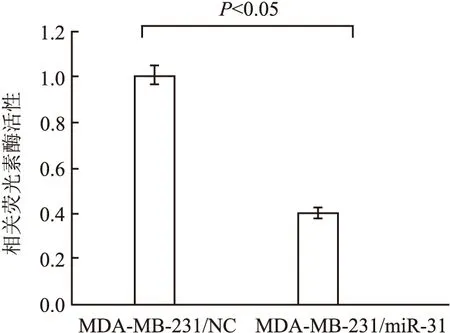
图5 MDA-MB-231/NC、MDA-MB-231/miR-31的 pGL-Dock180-3′UTR的相关荧光素酶活性
2.6 miR-31对乳腺癌MDA-MB-231细胞侵袭性的影响 采用基质胶侵袭实验检测MDA-MB-231/miR-31、MDA-MB-231/NC的侵袭能力。与MDA-MB-231/NC相比,MDA-MB-231/miR-31穿过人工基膜的细胞减少,差异有统计学意义(P<0.05,图6)。
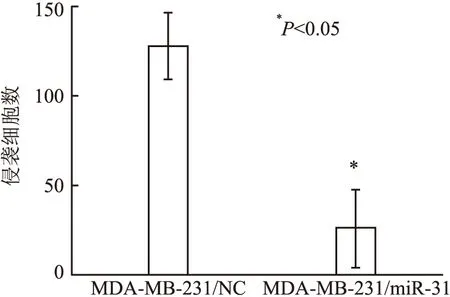
图6 MDA-MB-231/miR-31、MDA-MB-231/NC的侵袭能力比较
3 讨论
乳腺癌在演进过程中以侵袭力强、转移早、化疗多重耐药为特点[9]。其中,乳腺癌细胞的扩散是患者病情急剧恶化的重要原因,其中对细胞外基质和基膜的侵袭是乳腺癌侵袭转移过程中的关键环节[10]。进一步探讨乳腺癌演进的机制,抑制乳腺癌侵袭和转移是提高患者生存质量,延缓患者病情甚至治愈乳腺癌的关键。
miRNA是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,Iorio等[11]表明miRNA参与乳腺癌的发生,且miRNA的表达与ER状态相关,参与肿瘤的侵袭转移。miRNA在不同部位肿瘤组织中的表达出现上调和下调两个方向变化。一方面,miR-31在乳腺癌[4-8]、胃癌[12]及卵巢癌[13]中的表达水平均明显降低,可抑制DNA复制及细胞周期或侵袭。本组实验发现与MDA-MB-231/NC相比,MDA-MB-231/miR-31中miR-31过表达削弱乳腺癌细胞系的侵袭能力,提示本实验结果与上述报道相符。然而,在有些癌症中miR-31的过表达反而会增强肿瘤细胞的侵袭能力,在Cottonham等[14]报道中,miR-31过表达可增强直肠癌细胞系的迁移和侵袭能力。Xu等[15]发现,结肠癌中miR-31可能通过靶基因RhoBTB1促进结肠癌的发生。
本实验发现miR-31可以与Dock180的3′UTR特异性的靶向结合,每个miRNA可以结合多个靶基因[6,8],而几个miRNA也可以调节同一个基因[14]。这种复杂的调节网络既可以由一个miRNA来调控多个基因的表达,也可以通过几个miRNA的组合来共同调控某个基因的表达。miRNA通过两种方式对靶基因的表达进行反向调节,一种方式为依赖miRNA诱导的基因沉默,miRNA与编码蛋白质的mRNA近乎完全互补,其沉默复合体被相关酶切断致使靶基因降解;另一种方式通过与靶基因mRNA的部分碱基互补(通常发生在 3′非翻译端),降低蛋白质翻译水平。为了证明miR-31通过哪种方式结合Dock180,本实验采用荧光酶报告基因分析证明miR-31特异性作用于Dock180的3′UTR。通过Western blot法检测MDA-MB-231/miR-31组的Dock180蛋白表达与MDA-MB-231/NC相比下降,miR-31 inhibitor的Dock180的表达上调,进一步证实Dock180是miR-31的靶基因。Li等[3]的实验证明,在乳腺癌中趋化因子CXCL12与其受体CXCR4结合促进Dock180与ELMO稳定结合形成复合体,进而激活Rac促进肌动蛋白的聚合反应;为miR-31通过结合Dock180抑制乳腺癌的侵袭提供了理论依据。
综上所述,miR-31可通过结合Dock180抑制乳腺癌侵袭,有望成为通过Dock180逆转乳腺癌侵袭的新靶点,提高患者的生存质量。但是,miR-31通过结合Dock180抑制乳腺癌的具体机制尚不清楚,有待进一步探讨。
(本文获得国家留学生基金管理委员会资助,特此鸣谢!)
[1] 杨 硕,李洪利,李文通,等. 乳腺癌中PKCζ、MMP-2、MMP-9的表达及相关性[J]. 临床与实验病理学杂志, 2014,30(9):958-962.
[2] Akakura S, Kar B, Singh S,etal. C-terminal SH3 domain of CrkII regulates the assembly and function of the DOCK180/ELMO Rac-GEF[J]. J Cell Physiol, 2005,204(1):344-351.
[3] Li H, Yang L, Fu H,etal. Association between Galphai2 and ELMO1/Dock180 connects chemokine signalling with Rac activation and metastasis[J]. Nat Commun, 2013,4:1706.
[4] Valastyan S, Reinhardt F, Benaich N,etal. A pleiotropically acting micro RNA, miR-31 inhibits breast cancer metastasis[J]. Cell, 2009,137(6):1032-1046.
[5] Rasheed S A, Teo C R, Beillard E J,etal. MicroRNA-31 controls G protein alpha-13 (GNA13) expression and cell invasion in breast cancer cells[J]. Mol Cancer, 2015,14:67.
[6] Valastyan S, Chang A, Benaich N,etal. Concurrent suppression of integrin alpha5, radixin, and RhoA phenocopies the effects of miR-31 on metastasis[J]. Cancer Res, 2010,70(12):5147-5154.
[7] Körner C, Keklikoglou I, Bender C,etal. MicroRNA-31 sensitizes human breast cells to apoptosis by direct targeting of protein kinase C epsilon (PKCepsilon)[J]. J Biol Chem, 2013,288(12):8750-8761.
[8] Viré E, Curtis C, Davalos V,etal. The breast cancer oncogene EMSY represses transcription of antimetastatic microRNA miR-31[J]. Mol Cell, 2014,53(5):806-818.
[9] Wang C Z, Yuan P, Li Y,etal. mi R-126 regulated breast cancer cell invasion by targeting ADAM9[J]. Int J Clin Exp Pathol, 2015,8(6):6547-6553.
[10] 李小龙,齐岳亮,陈为一,等. 下调Raptor表达对乳腺癌细胞侵袭能力影响及其机制探讨[J]. 中华肿瘤防治杂志, 2014,21(22):1764-1768.
[11] Iorio M V, Ferracin M, Liu C G,etal. Micro RNA gene expression deregulation in human breast miRNA[J]. Cancer Res, 2005,65(16):7065-7070.
[12] Zhang Y, Guo J, Li D,etal. Down-regulation of miR-31 expression in gastric cancer tissues and its clinical significance[J]. Med Oncol, 2010,27(3):685-689.
[13] Creighton C J, Fountain M D, Yu Z,etal. Molecular profiling uncovers a p53-associated role for micro RNA-31 in inhibiting the proliferation of serous ovarian carcinomas and other cancers[J]. Cancer Res, 2010,70(5):1906-1915.
[14] Cottonham C L, Kaneko S, Xu L,etal. miR-21 and miR-31 converge on TIAM1 to regulate migration and invasion of colon carcinoma cells[J]. J Biol Chem, 2010,285(46):35293-35302.
[15] Xu R S, Wu X D, Zhang S Q,etal. The tumor suppressor gene RhoBTB1 is a novel target of miR-31 in human colon cancer[J]. Int J Oncol, 2013,42(2):676-682.
MiR-31 inhibit the invasion of breast cancer by Dock180
ZHENG Shu-xian1, SUN Xue-mei1, WANG Rui-ge1, SHI Li-hong2, ZHANG Bao-gang1
(1DepartmentofPathology,2DepartmentofPharmacology,WeifangMedicalUniversity,Weifang261053,China)
Purpose To investigate the correlation of Dock180 and miR-31 expression in breast cancer cells, and to observe the effect of miR-31 on the invasion of breast cancer cells by Dock180. Methods MiR-31 was transfected into breast cancer cells by liposome transfection technique. The actual binding site of miR-31 to the 3′-untranslated region of Dock180 was confirmed through luciferase assay. Western blot was performed to detect the expression of Dock180 and other related proteins. Real-time PCR was used to measure the expression of Dock180. Matrigel invasion were performed to detect the invasion of breast cancer cell lines with miR-31 increased. Results The protein levels of Dock180 in breast cancer cell lines negatively correlated with miR-31 expression, and Dock180 was directly targeted by miR-31. Dock180 downregulation and miR-31 overexpression reduced breast cancer cells invasion. Conclusion Dock180 modulated by miR-31 plays an important function in breast cancer cell lines invasion.
breast neoplasm; miR-31; Dock180; invasion
时间:2017-3-16 14:23
http://kns.cnki.net/kcms/detail/34.1073.R.20170316.1423.002.html
国家自然科学基金(81072068、81672631)、山东省自然科学基金中青年科学家奖励基金(2010BSB14051)、山东省教育厅课题(J14LK13)
潍坊医学院1病理学教研室、2药理学教研室,潍坊 261053
郑书贤,女,硕士研究生。Tel:(0536)8462034,E-mail: shuxianzheng@126.com 张宝刚,男,教授,通讯作者。E-mail: zbg0903@hotmail.com
R 737.9
A
1001-7399(2017)03-0241-04
10.13315/j.cnki.cjcep.2017.03.002
接受日期:2017-01-23

