乳腺导管原位癌微浸润的危险因素
严俊 李孟圈
(郑州大学第一附属医院 乳腺外科 河南 郑州 450052)
乳腺导管原位癌微浸润的危险因素
严俊 李孟圈
(郑州大学第一附属医院 乳腺外科 河南 郑州 450052)
目的 分析乳腺导管原位癌微浸润(ductal carcinoma in situ with microinvasion,DCIS-Mi)的危险因素及其临床病理特点与局部复发或远处转移的相关性。方法 收集郑州大学第一附属医院2008年4月至2012年8月期间接受手术且经病理确诊的所有乳腺导管原位癌及乳腺微浸润癌病例,对其临床病理资料进行统计分析,并对乳腺微小浸润癌患者进行随访,分析其临床病理特点与局部复发或转移的相关性。结果 DCIS患者中多发病灶的存在与肿瘤间质微浸润的发生有关(P=0.005<0.05),肿瘤最大直径<3.5 cm的DCIS-Mi患者生存率高于直径≥3.5 cm患者(χ2=11.88,P=0.003<0.05)。结论 具有多发可疑病灶的DCIS伴或不伴可疑浸润的患者存在微浸润的可能性大。肿瘤最大直径<3.5 cm的患者可能有更高的生存率,但未发现其与DCIS-Mi局部复发或转移有关。
乳腺癌;导管原位癌;微浸润
随着乳腺钼靶摄片普查的推广及应用,乳腺导管原位癌(ductal carcinoma in situ,DCIS)的检出率逐年上升,在欧美占新诊断乳腺癌的20%~30%[1]。乳腺导管原位癌微浸润(ductal carcinoma in situ with microinvasion,DCIS-Mi)这一概念最初由Lagios提出,其发病率占新诊断乳腺癌的0.24%~0.3%[2]。美国癌症联合会(American Joint Committee on Cancer,AJCC)肿瘤组织学分类将微小浸润定义为乳腺间质中存在1个或多个清晰且独立的肿瘤细胞浸润灶,每灶最大直径≤1 mm[3]。目前对于术后病理诊断为DCIS及DCIS伴可疑浸润的患者,预估其有无微浸润及如何处理腋窝淋巴结成为了亟待解决的问题。近年来,虽有研究者对以上问题进行了分析,但结论仍存在争议。本研究对63例DCIS患者及75例DCIS-Mi患者进行回顾性研究,通过收集其术前病历资料对DCIS间质浸润的危险因素进行分析,并对DCIS-Mi患者局部复发、远处转移的影响因素进行探讨。
1 资料和方法
1.1 研究对象 收集郑州大学第一附属医院2008年4月至2012年8月所有接受手术且经病理确诊为DCIS、DCIS-Mi共138例患者的临床资料,根据是否伴有微浸润分为DCIS组(63例)、DCIS-Mi组(75例)。排除标准:双侧乳腺癌患者、既往曾接受乳腺癌或其他恶性肿瘤放化疗者、于外院已进行原发肿块手术切除及既往接受过乳腺恶性肿瘤切除术的患者。每位患者的年龄、月经情况、肿瘤大小、是否多发、是否伴有恶性钙化、是否伴有Paget’s病、病理组织学分类、免疫组化、辅助治疗方式、腋窝淋巴结状态及是否复发或转移等信息均纳入分析。
1.2 方法
1.2.1 病理及免疫组化 根据美国临床肿瘤协会(ASCO)和美国病理学家学会(CAP)于2010年发布的指南,雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)阳性定义为≥1%的肿瘤细胞核着色,ER、PR阴性定义为在有阳性内对照的情况下<1%的肿瘤细胞核着色。本研究根据此标准对ER、PR、人表皮因子生长受体2(human epidermal growth factor receptor-2,Her-2)进行分组分析。
1.2.2 治疗方式 手术治疗方式包括乳腺癌改良根治术、全乳房切除术加前哨淋巴结活检术、保乳加前哨淋巴结活检术。根据术后常规病理结果及患者意愿进行化疗、内分泌治疗和/或靶向治疗;对于接受保乳或病例证实有淋巴结转移者建议行放疗。
1.2.3 分析指标 分析指标包括患者年龄、手术时是否绝经、原发肿块大小、是否多发、病理学分类、免疫组化指标、淋巴结转移情况等。本研究通过对以上因素进行分析,从而探讨DCIS微转移的危险因素。对于DCIS-Mi组患者给予亚组分析以探讨复发或转移的危险因素。
1.3 统计学分析 采用SPSS 19.0软件对数据进行统计分析。定性资料采用χ2检验、秩和检验,单因素及多因素分析采用Logistic回归分析。采用Kaplan-Merier法比较生存率差异,Log-rank检验检测生存曲线的差异。P<0.05为差异有统计学意义。
2 结果
2.1 DCIS-Mi危险因素 本研究138例患者均为女性,年龄为28~88岁,DCIS组及DCIS-Mi组中位年龄分别为45岁和47岁,差异无统计学意义(P=0.449>0.05)。DCIS患者中多发病灶的存在与肿瘤间质微浸润的发生有关(P=0.005<0.05)。见表1。DCIS-Mi组中PR(P=0.004<0.05)及Ki-67(P=0.012<0.05)呈高表达。DCIS与DCIS-Mi组中是否有淋巴结转移、ER及HER-2表达状态差异均无统计学意义。见表2。两组淋巴结转移率分别为9%(5/54)、19%(13/55),差异无统计学意义。
2.2 影响DCIS-Mi患者出现局部复发或远处转移的危险因素 DCIS-Mi组中位随访时间为62个月(3~90个月)。本次分析以是否发生局部复发或远处转移为随访终点,未随访到死亡病例。共有13例患者术后出现腋窝淋巴结转移,直到随访终点,有3例患者出现远处转移(均出现骨转移),其中1例患者出现多发肝转移,该3例患者均为DCIS-Mi患者。根据肿瘤直径大小将DCIS-Mi患者分为两组,肿瘤直径≥3.5 cm组和直径<3.5 cm组。对各组临床因素进行Kaplan-Meier分析并绘制生存曲线,两条生存曲线差异有统计学意义(χ2=11.88,P=0.003<0.05),发现肿瘤最大直径<3.5 cm患者生存率高于肿瘤最大直径≥3.5 cm患者。
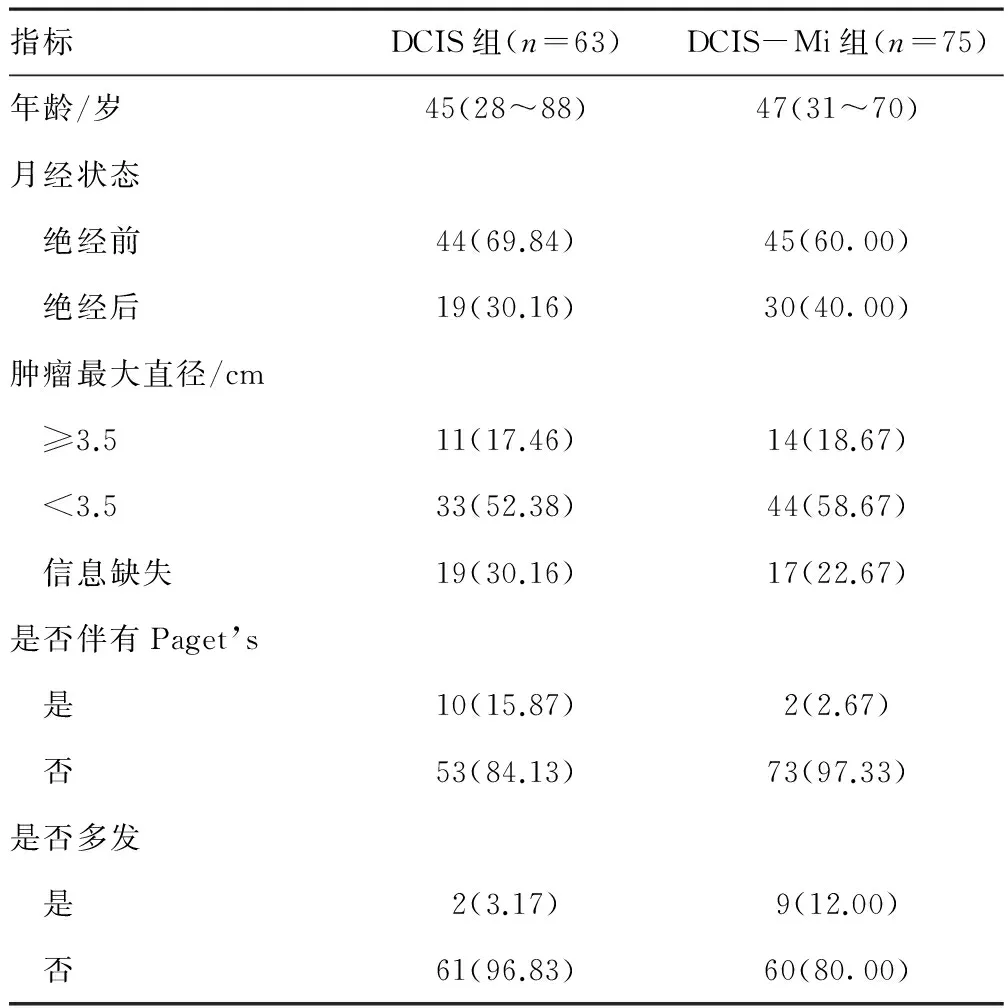
表1 DCIS组与DCIS-Mi组患者术前临床基本特征比较[n(%)]

表2 DCIS组与DCIS-Mi组术后病理特征比较[n(%)]
3 讨论
几乎所有的乳腺微小浸润癌均与DCIS伴发[4],本研究也证实了这点。从临床表现上看,DCIS-Mi组中41%(31/75)病例伴有恶性钙化(簇状、细小点样、线状、分支状钙化),3%(2/75)的病例伴有乳头Paget’s病。但本研究发现原发肿块是否为多发与MIBC的发生有着密切联系(OR=8.198,P=0.005<0.05),而与肿瘤最大直径、月经状态、是否伴有恶性钙化或Paget’s病无明显相关性。这提示有着多发病灶的患者可能存在潜在转移倾向。
值得注意的是,52%的DCIS-Mi病例出现了HER-2的过表达,在一般的浸润癌中,这一比例约为25%。国外研究显示,DCIS-Mi中HER-2阳性比例也在50%左右[5]。HER-2过表达在分化好的DCIS中很罕见,但在分化差的病变中却呈现高表达,可以推测,HER-2高表达可能与细胞黏附性降低及浸润癌的形成有关,而在微浸润灶逐渐增大过程中,HER-2高表达可能并不起作用,因此会出现HER-2阳性表达降低的情况[6]。在本研究中,DCIM-Mi组PR及Ki-67均呈高表达状态(P=0.004,P=0.012<0.05),这与来自上海的一项研究结果[7]相一致。该研究认为,DCIS-Mi更倾向于发生在肿瘤直径更大及高级别肿瘤组织学分级者(P=0.011<0.05)。但在本研究中并未得到这样的结果,这可能与信息缺失及随访时间较短有关。
DCIS-Mi曾被认为是DCIS与浸润性乳腺癌之间的过渡状态,但越来越多的学者认为DCIS-Mi有着较独立的生物学及细胞分子学特点。这意味着DCIS-Mi与单纯DCIS有着本质的不同。本研究75例DCIS-Mi患者中,13例术后发现腋窝淋巴结转移,1例发现脉管内癌栓,未发现非前哨淋巴结阳性转移者。这也说明了对DCIS-Mi患者进行腋窝淋巴结状态评定的重要性。根据2015年St.Gallen专家共识,保乳术后阴性切缘距离>1 mm是安全的(术后给予放疗),即使术后病理证实有1或2个前哨淋巴结转移,也无需进行腋窝淋巴结清扫术(ALND)[8]。虽然SLNB较传统清扫术对腋窝淋巴引流影响较小,但术后淋巴水肿发生率仍达11.9%。对MIBC患者行ALND是否为过度医疗一直存在争议。目前多项研究证实,前哨淋巴结活检术替代ALND安全性高,腋窝淋巴结复发率极低(0.25%~3.0%)[9]。腋窝淋巴结是否存在转移对乳腺癌患者的治疗及预后有着至关重要的作用,而ALND是对腋窝淋巴结状态评估最直观的办法。本研究中3例出现远处转移的患者均有原发肿瘤直径大(均值4.1 cm)的特点,可见对于肿瘤直径较大、多发病灶、保乳术中冰冻未能明确浸润灶等无法保证阴性切缘的情况下,应酌情考虑行ALND。本研究中DCIS和DCIS-Mi两组患者均存在腋窝淋巴结转移,这可能与病灶中潜在的浸润灶未被发现有关。肌上皮细胞标记免疫组化染色可以帮助MIBC与DCIS和浸润性乳腺癌的鉴别,同时也应注意与术前曾行穿刺活检导致的上皮细胞移位相鉴别。
有研究证实,术后辅助化疗对乳腺癌的治疗至关重要,特别是三阴性乳腺癌[10]。但也应注意化疗所带来的额外的不良反应。对于DCIS-MI患者进行辅助化疗应充分权衡利弊。本研究中所有三阴性MIBC患者均进行了化疗,但并未发现辅助化疗对患者的局部复发或远处转移有明显影响。有研究显示,化疗可能使三阴性DCIS-MI患者短期获益[11]。对于存在高危因素的患者,有必要进行辅助化疗。 本研究还发现,肿瘤最大直径<3.5 cm的患者可能有更高的生存率,但未发现其与DCIS-Mi局部复发或转移有关。其5年无病生存率(disease-free survival,DFS)为80.0%,与已报道的数据(90%~100%)相差较大[12]。这可能与本研究病例较少、随访时间较短有关。在一项针对425例MIBC患者的研究数据中,Ki-67的高水平表达与不良预后明显相关[13]。但在本研究中,并未发现Ki-67与局部生存或复发有明显联系(P=0.206)。
本研究是一项回顾性研究,由于保乳病例数较少及信息缺失病例较多,并未发现与DCIS-Mi局部复发或转移明显相关的危险因素。随着钼靶的普及和大众健康意识的提升,相信大样本量的前瞻性研究和分子生物学上的进展能更好地揭示该病的本质,促进个体化治疗。
[1] Baxter N N,Virnig B A,Durham S B,et al.Trends in the treatment of ductal carcinoma in situ of the breast[J].J Natl Cancer Inst,2004,96(6):443-448.
[2] Lagios M D,Westdahl P R,Margolin F R,et al.Duct carcinoma in situ. Relationship of extent of noninvasive disease to the frequency of occult invasion, multicentricity, lymph node metastases, and short-term treatment failures[J].Cancer,1982,50(7):1309-1314.
[3] Ko B S,Lim W S,Kim H J,et al.Risk factor for axillary lymph node metastases in microinvasive breast cancer[J].Ann Surg Oncol,2012,19(1):212-216.
[4] Ross D S,Hoda S A.Microinvasive (T1mic) lobular carcinoma of the breast: clinicopathologic profile of 16 cases[J].Am J Surg Pathol,2011,35(5):750-756.
[5]Margalit D N,Sreedhara M,Chen Y H,et al.Microinvasive breast cancer: ER, PR, and HER-2/neu status and clinical outcomes after breast-conserving therapy or mastectomy[J].Ann Surg Oncol,2013,20(3):811-818.
[6] Mori M,Tsugawa K,Yamauchi H,et al.Pathological assessment of microinvasive carcinoma of the breast[J].Breast Cancer,2013,20(4):331-335.
[7] Yu K D,Wu L M,Liu G Y,et al.Different distribution of breast cancer subtypes in breast ductal carcinoma in situ (DCIS), DCIS with microinvasion, and DCIS with invasion component[J].Ann Surg Oncol,2011,18(5):1342-1348.
[8] Coates A S,Winer E P,Goldhirsch A,et al.Editor’s choice: Tailoring therapies—improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary, Therapy of Early Breast Cancer 2015[J].Ann Oncol,2015,26(8):1533-1546.
[9] Galimberti V,Cole B F,Zurrida S,et al.Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial[J].Lancet Oncol,2013,14(4):297-305.
[10]Esposito A,Criscitiello C,Salè E O,et al.Optimal adjuvant chemotherapy in breast cancer: selection of agents[J].Expert Rev Clin Pharmacol,2014,7(5):1-7.
[11]Rosner D,Lane W W.Node-negative minimal invasive breast cancer patients are not candidates for routine systemic adjuvant therapy[J].Cancer,1990,66(2):199-205.
[12]Silver S A,Tavassoli F A.Mammary ductal carcinoma in situ with microinvasion[J].Cancer,1998,82(12):2382-2390.
[13]Colleoni M,Rotmensz N,Peruzzotti G,et al.Minimal and small size invasive breast cancer with no axillary lymph node involvement: the need for tailored adjuvant therapies[J].Ann Oncol,2004,15(11):1633-1639.
Risk factors of breast ductal carcinoma in situ with microinvasion
Yan Jun,Li Mengquan
(DepartmentofBreastSurgery,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
Objective To investigate the risk factors of ductal carcinoma in situ with microinvasion(DCIS-Mi). Methods All cases of DCIS or DCIS-Mi were retrieved from April of 2008 to August of 2012. Clinicopathologic parameters were analyzed for entire cohort. Multivariate analysis was used to identify risk factors of DCIS-Mi and the correlation between clinicopathologic characteristics and distant metastasis. Results 138 cases were evaluated in this period. The DCIS-Mi was almost always encountered in the setting of DCIS. The presence of multiple lesions was proven as a risk factor of DCIS-Mi (P=0.005<0.05).There was significant difference between two survival curves, and the survival rate of the group with tumor size less than 3.5 cm was higher than that of the group with tumor size greater than or equal to 3.5 cm (χ2=11.88,P=0.003<0.05). Conclusion Patients with multiple lump demonstrated high possibility of DCIS-Mi. The group with tumor size less than 3.5 cm has higher survival rate.
breast cancer; ductal carcinoma in situ; microinvasion
R 737.9
10.3969/j.issn.1004-437X.2017.06.006
2016-12-02)

