痘病毒锚蛋白重复序列蛋白对NF-кB信号通路的影响①
陈轶霞 龙 玲 骆学农
(西北民族大学生命科学与工程学院,兰州730124)
·专题综述·
痘病毒锚蛋白重复序列蛋白对NF-кB信号通路的影响①
陈轶霞 龙 玲 骆学农②
(西北民族大学生命科学与工程学院,兰州730124)
痘病毒科(Poxviridae)病毒是在细胞质中复制的双链DNA病毒,拥有130 kb~> 350 kb的基因组。分为两个亚科:脊椎动物痘病毒亚科(Chordopoxvirinae)和昆虫痘病毒亚科(Entomopo-xvirinae)。脊椎动物痘病毒亚科包含10个属。痘病毒间的基因组结构有很高的相似性,病毒DNA复制和转录所必需的基因以及涉及病毒粒子形态和结构的基因位于基因组高度保守的中间区域。基因组的末端区域在不同的属间呈现很大的多样性,包括一些属或种特异性基因以及感染和毒力相关基因[1]。
锚蛋白(Ankyrin,ANK)重复基序是33个残基的重复基序,最初发现于酵母细胞周期调控蛋白Sw16、Cdc10,以及果蝇的Notch蛋白。随后,在人细胞骨架锚蛋白中发现了24个重复基序,因此人们将其命名为锚蛋白重复基序。大多数ANK重复蛋白存在于真核生物,细菌中不常见;病毒的ANK重复蛋白主要见于痘病毒,大多数脊椎动物痘病毒末端区域的基因编码的富含多种ANK重复序列蛋白[2]。
真核生物的ANK重复基序涉及蛋白质-蛋白质的相互作用,在细胞的许多连接调控和结构功能方面发挥重要作用。ANK重复基序也与一些细胞内信号通路的蛋白有关联,比如IκB蛋白,其ANK重复基序封闭核转录因子-κB(Necrosis factor-κB,NF-κB)以调节基因转录;Notch受体的胞内ANK重复基序结构域是细胞周期调控信号通路必不可少的;癌锚蛋白完全由7个ANK基序组成,它具有多个与细胞周期调控有关的结合伴侣[3]。本文主要对痘病毒编码ANK重复蛋白的特征以及与NF-кB信号通路相互作用的研究概况做一综述,以促进对痘病毒该蛋白家族的深入研究。
1 痘病毒ANK重复蛋白的概况
大多数脊椎动物痘病毒编码富含ANK重复序列的多种蛋白,禽痘病毒属(Avipoxvirus)成员编码的ANK重复蛋白最多,其中鸽痘病毒(FeP2株)编码26个ANK重复蛋白,鸡痘病毒(Iowa株)编码31个,金丝雀痘病毒(ATCC VR111株)编码51个[4]。相比之下,正痘病毒属(Orthopoxvirus)成员的ANK重复蛋白较少,从天花病毒(Bangladesh 1975株)的10个到痘苗病毒(Brighton Red 株)的15个不等。羊痘病毒属(Capripoxvirus)、兔痘病毒属(Leporipoxvirus)、猪痘病毒属(Suipoxvirus)、牙塔痘病毒属(Yatapoxvirus)、副痘病毒属(Parapoxvirus)以及鹿痘病毒属(Cervidpoxvirus)成员编码的ANK重复蛋白更少[5]。软疣病毒属(Molluscipoxvirus)、鳄鱼痘病毒属(Crocodylidpoxvirus)、红松鼠痘病毒[6,7],以及昆虫痘病毒属的成员都不编码ANK重复蛋白[8]。
痘病毒ANK重复蛋白的大小不等,一般为400-800个残基的长度,具有典型的结构域排列,ANK基序并联重复的数目为4~10个不等,起始于蛋白的N-端。有的锚蛋白重复序列紧跟着非锚蛋白连接器序列,这一序列终止于C-端的一个细胞F-box同源序列基序,这种排列在Pfam数据库中被注释为C-端锚蛋白重复痘蛋白(Pox protein repeats of ANkyrin-C terminal,PRANC)结构域(Pfam family PF09372)。这些ANK/F-box蛋白的研究主要集中在它们是怎样与细胞的泛素化通路相互作用的。
对正痘病毒属成员ANK重复蛋白的比较研究表明,这些蛋白基因存在频繁的丢失和截断现象,导致每个成员的ANK重复基因数目存在很大差异。脊椎动物痘病毒亚科的系统发育分析表明,大部分ANK重复蛋白在每个痘病毒种内是可以彼此区分的;ANK重复蛋白形成的同源组在一个属内的多个种间有交叉。痘病毒基因组中ANK重复蛋白的数目与该基因组的大小存在一定的相关性,比如,天花病毒的基因组最小,它也因此只拥有4个完整的ANK/F-box重复蛋白[6,7];这种基因组的大小和完整的ANK/F-box蛋白的数目与病毒的宿主范围也存在相关性,如牛痘病毒广泛的宿主范围与天花病毒狭窄的宿主范围[9,10]。
在高度致弱和宿主范围有限的痘苗病毒Ankara(MVA)株中发现了ANK重复蛋白与其他免疫调节蛋白的丢失,仅保留了高度保守的68 k ANK/F-box蛋白。对绵羊痘病毒疫苗株(NK株,AY077834)和流行株(SA株,AY077833)编码的2个ANK蛋白(ORF138和ORF141)的比较分析发现,疫苗株的ORF138和ORF141分别由单核苷酸颠换和插入突变,导致ORF移位发生片断化,使得ORF138和ORF141均形成两个新的ORF(ORF138a、ORF138b和ORF141a、ORF141b),编码两种不同的蛋白质。这种ANK重复蛋白缺失、突变导致毒力减弱的机理还不清楚。总之,一些ANK重复蛋白与宿主范围的相关性,以及在黏液瘤病毒、绵羊痘病毒、鸡痘病毒和羊口疮病毒等病毒的减毒株基因组中的丢失或突变,说明这些基因在痘病毒的宿主范围与毒力方面发挥重要的作用。
ANK重复基序由通过β-转角和短环连接的α-螺旋组成,形成一连串重复,其中β-转角/环排成一行,与α-螺旋呈90°垂直,从空间上看形成了一个很有特色的弯曲结构,就像一只弯曲的手:β片层形成手指,而螺旋平面形成手掌部分,手指与手掌相互垂直,从而形成手心内部的一个疏水性深沟。我们对绵羊痘病毒的ANK重复蛋白ORF141的三维建模图呈现出典型的构造(图1)。有关痘病毒的ANK重复蛋白的结构、生物物理学特性的研究很少,仅有的关于痘苗病毒K1L蛋白(PDB ID∶3KEA)的晶体结构的研究表明,该蛋白完全是由9个ANK重复组成的,其特征性延伸的螺旋是这些多重基序的堆积所致[11](图2)。这一结构揭示了蛋白的宿主范围等功能,其影响宿主范围功能的关键残基暴露在 “手背”凸面,而不在通常与ANK介导的蛋白相互作用有关联的“手掌”凹面。这可能表明这一蛋白很大程度上与宿主蛋白是一种瞬时的相互作用。K1L蛋白在正痘病毒属的分布也变化多端,其中天花病毒、骆驼痘病毒、鼠痘病毒包含突变的K1L基因。
2 痘病毒ANK蛋白对NF-кB信号通路的影响
NF-кB转录通路是病毒的免疫反应抑制的主要靶标。病毒感染机体后,机体借助SCF连接酶启动NF-кB抑制剂IκBα的降解,释放静息的NF-кB二聚体,导致抗病毒基因的表达。包括ANK重复蛋白在内的许多痘病毒蛋白能够靶向NF-κB信号通路的多个位点,包括产生胞外病毒受体以阻断IL-18、IL-1β以及TNF-α、IFN等白细胞介素和细胞因子的信号传导,抑制细胞内的信号转导;阻断细胞内PKR的激活;阻止静默的NF-κB二聚体的加工、释放和他们在细胞核内的转运和活性等[12]。痘病毒的抗NF-κB蛋白在痘病毒的属和种间有明显的不同,可能是主要的致病因子[13-17],比如,接触传染性软疣病毒(Molluscum contagiosum virus,MCV)的MC132蛋白能够将NF-κB亚单位p65招募到宿主的Cullin-5/Elongin B/Elongin C复合物上,使p65泛素化并降解,而MC132就是MCV特有的,在其他痘病毒中没有发现其同源物[18]。不像其他病毒,至今还没有发现痘病毒的NF-κB激活剂(图3)。
2.1 ANK蛋白拮抗PKR通路 依赖RNA的蛋白激酶(Protein kinase RNA-dependent,PKR)通过抑制蛋白质的合成和激活NF-кB发挥抗病毒效应,因此,许多病毒编码抑制PKR的蛋白。研究发现,痘苗病毒 (Vaccinia virus ,VACV)K1L锚蛋白在病毒感染的早期就能够减少dsRNA水平,从而直接抑制PKR,阻止IκB激酶(IKK)复合物的活化,抑制IκB的降解,从而阻断来自病毒感染的Toll样受体TLR2、TLR4和TLR9的NF-κB信号转导,增强病毒的存活[19]。另外,K1L还通过抑制病毒诱导的eIFα2的磷酸化,间接抑制PKR,并阻止eIFα2介导的蛋白合成的关闭[20,21]。可见,K1L先于VACV的E3或K3蛋白,在病毒感染的早期拮抗PKR通路,因为E3或K3蛋白通过与中晚期dsRNA或PKR相结合抑制PKR。K1L的这一作用是病毒进行有效感染所必需的。
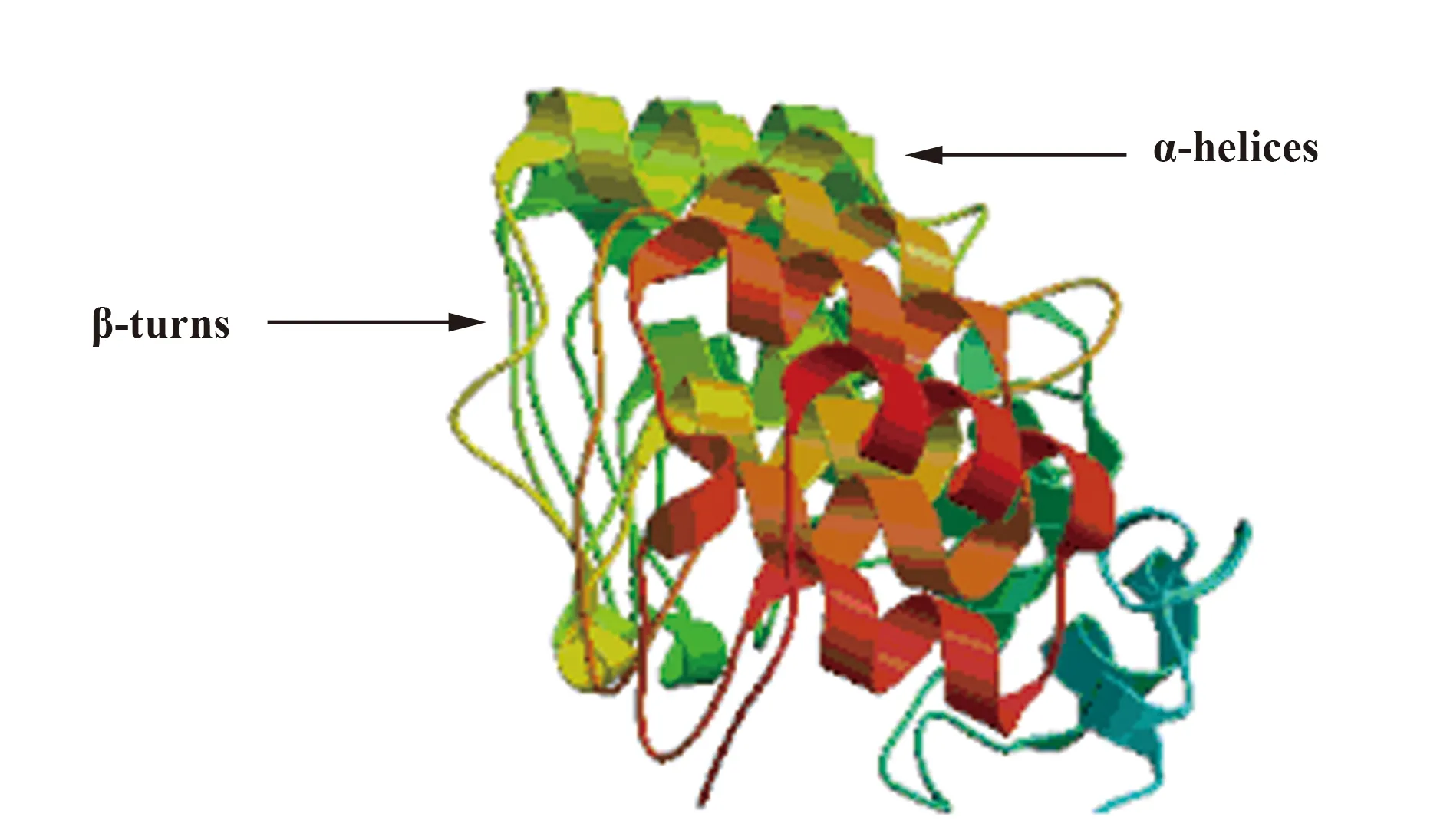
图1 绵羊痘病毒ORF141 ANK重复蛋白的结构Fig.1 Sheeppox virus ORF141 ankyrin proteinNote: β-turns link the helix pairs and project outwards in a conserved manner at an angle of approximately 90° from the α-helices.This arrangement has been likened to a "cupped hand" where the convex surface forms the "back"; the concave surface the "palm" and the loops form the "fingers".

图2 痘苗病毒锚蛋白K1L的结构(PDB ID: 3KEA)[11]Fig.2 Vaccinia virus K1L ankyrin protein structure(PDB ID: 3KEA)[11]Note: K1L protein made up of nine ANK repeats;the residues C47 and N51 on the second repeat are required for host-range function;the residues F82 and S83 on the third repeat are required for in vitro viral replication.
2.2 ANK蛋白直接影响NF-κB的活性 与不包含F-box域的K1L相比,痘病毒的ANK/F-box蛋白还能直接影响NF-κB的活性。通过酵母双杂交筛选方法证明天花病毒G1R、牛痘病毒CPXV-006以及猴痘病毒MPXV-003 ANK/F-box蛋白能够与NF-κB/p105亚单位的p105前体相结合阻止活性NF-κB的形成。奇怪的是,与SCF1和p105底物的结合并没有使p105降解,而使其更加稳定[22]。说明这些相互作用可能发挥的不是蛋白酶体降解的作用,而是其他的作用。进一步的研究表明,敲除CPXV-006不但使牛痘病毒的毒力减弱,也使IKK复合物磷酸化,导致IκBα和NF-κB/p105降解,使NF-κB释放和核移位,并启动抗病毒细胞因子的转录,如IL-6、IL-1β和TNFα。在病毒复制的组织部位诱发了严重的炎性反应[23]。牛痘病毒编码的另一个ANK/F-box蛋白CP77是一个宿主范围蛋白,能够与NF-κB p65相互作用,抑制炎性细胞因子的转录,但这一功能并不依赖F-box[24]。
2.3 ANK蛋白抑制IκBα的降解和核移位 鼠痘病毒编码的4个ANK/F-box蛋白(EVM002、EVM005、EVM154、EVM165)都能与细胞的SCF泛素连接酶复合物相互作用,抑制IκBα的降解以及NF-κB的核移位,并且这种效应需要F-box域的参与。有趣的是,尽管EVM005的F-box域对NF-κB信号通路的体外抑制作用是必需的,但对毒力没有影响,说明即使没有EVM005连接的SCF1泛素连接酶的参与,EVM005 ANK重复结构域也可以有效隔离其底物,并且与毒力相关[25]。此外,研究还发现,单独敲除鼠痘病毒任何一个ANK/F-box基因,都没有针对IκBα降解的任何显著的抑制作用和随后的p65易位。双敲除EVM002和EVM005仍有IκBα降解的抑制作用[26]。说明就鼠痘病毒而言,其ANK/F-box蛋白是与其他的具有调节NF-κB通路功能的蛋白联合发挥作用的。虽然F-box结构域具有将底物募集到细胞SCF(Skp1、Cullin1、Roc1、F-box)复合物上的E3泛素连接酶功能。然而,ANK重复基序和F-box域针对NF-κB功能上的相互关系并不清楚,因为没有痘病毒ANK/F-box蛋白被证明直接参与NF-κB组件或其调控蛋白的泛素化。而且,从现有的研究结果来看,有的痘病毒ANK/F-box蛋白在影响NF-κB时需要F-box域,而有的不依赖F-box域,F-box结构域在这一过程中究竟扮演了怎样的角色,仍然是未解之谜。

图3 痘病毒ANK/F-box蛋白对NF-кB信号通路的影响(改自Herbert MH,et al,2015[32])Fig.3 Poxviral ANK/F-box proteins roles in NF-кB Signaling(modified from Herbert MH,et al,2015[32])Note: Interactions of ANK/F-box proteins are known from several poxviral species of the Avipoxvirus (AVPV), Orthopoxvirus (OPXV) genera, and also the Leporipoxvirus super-group (LSG) genera.
2.4 ANK蛋白在细胞核中抑制NF-κB的功能 黏液瘤病毒编码的4个ANK/F-box蛋白(M-T5、M148、M149、M150)都是毒力因子。都能抑制p65在核内的积累,从而抑制NF-κB信号通路,维持病毒感染。敲除全部4个ANK/F-box基因的重组黏液瘤病毒感染细胞的NF-κB的活性极大的增强,且病毒的毒力极大的减弱[27-29]。在痘苗病毒、牛痘病毒、天花病毒等病毒中都发现了M150的同源基因,说明这类蛋白很可能是这些病毒的免疫和致病机制的一部分。 M148、M149和M150的结合伴侣和潜在的目标底物尚不清楚。M-T5与丝氨酸/苏氨酸激酶、蛋白激酶等另外的结合伴侣的相互作用,说明这些ANK/F-box蛋白在病毒感染过程中也可能还存在其他独立的特异的作用。
2.5 ANK蛋白阻断IFN的信号传导 虽然禽痘病毒属成员编码的ANK重复蛋白最多,但对其功能的研究很少,仅在研究禽类IFN对鸡痘病毒感染的影响的过程中发现其中的2个ANK重复蛋白(FPV012、FPV014)有助于鸡痘病毒对禽类Ⅰ型干扰素的高抵抗力。FPV012阻碍细胞对鸡IFN-β的感应,FPV014增强对外源性IFN-α的抵抗。金丝雀痘病毒CNPV030蛋白是FPV012的同源蛋白,也能抑制对IFN-β的感应[30,31]。说明禽痘病毒ANK重复蛋白可能通过阻断IFN的信号传导影响NF-κB信号通路,并且这些功能具有一定的保守性。
3 总结与展望
现有的研究结果表明痘病毒ANK重复蛋白抑制NF-κB通路的能力是一个值得关注的领域,这些蛋白大多与病毒的毒力和宿主范围功能相关。但也不难看出,这些功能在痘病毒的属和种间有明显的不同,并且也绝不是唯一的功能。上述的研究结果只是痘病毒家族编码的庞大、复杂且精细的ANK重复蛋白的冰山一角,很多痘病毒ANK重复蛋白的功能研究仍然是空白,比如与羊痘病毒、副痘病毒等属的ANK相互作用的蛋白及影响的通路还未见相关报道。有关对痘病毒ANK蛋白的调控机制也知之甚少。就NF-κB信号通路调节来说,许多细节仍然不甚清楚。ANK蛋白发生缺失、突变导致的毒力减弱的机理值得进一步探讨。可否将这种突变作为痘病毒毒力减弱或返祖的分子标志之一?未来,随着大部分细节的研究进展,ANK蛋白和他们的潜在靶标的相互作用会逐渐被揭示清楚,将有助于更加准确、可靠、快捷的防控痘病毒病。
[1] Haller SL,Peng C,Mcfadden G,etal.Poxviruses and the evolution of host range and virulence[J].Infect Genet Evol,2014,21:15-40.
[2] Jernigan KK,Bordenstein SR.Ankyrin domains across the Tree of Life[J].Peer J,2014,264:1-14.
[3] Li J,Guo Y.Gankyrin oncoprotein:Structure,function,and involvement in cancer[J].Curr Chem Biol,2010,4(1):13-19.
[4] Offerman K,Carulei O,van der Walt AP,etal.The complete genome sequences of poxviruses isolated from a penguin and a pigeon in South Africa and comparison to other sequenced avipoxviruses[J].BMC Genomics,2014,15(1):e463.
[5] Hautaniemi M,Ueda N,Tuimala J,etal.The genome of pseudocowpoxvirus:Comparison of a reindeer isolate and a reference strain[J].J Gen Virol,2010,91(6):1560-1576.
[6] Sonnberg S,Fle ming SB,Mercer AA.Phylogenetic analysis of the large family of poxvirus ankyrin-repeat proteins reveals orthologue groups within and across chordopoxvirus genera[J].J Gen Virol,2011,92(11):2596-2607.
[7] Bratke KA,Mclysaght A,Rothenburg S.A survey of host range genes in poxvirus genomes[J].Infect Genet Evol,2013,14:406-425.
[8] Theze J,Takatsuka J,Li Z,etal.New insights into the evolution of Entomopoxvirinae from the complete genome sequences of four entomopoxviruses infecting Adoxophyes honmai,Choristoneura biennis,Choristoneura rosaceana,and Mythimna separata[J].J Virol,2013,87(14):7992-8003.
[9] Hendrickson RC,Wang C,Hatcher EL,etal.Orthopoxvirus genome evolution:The role of gene loss[J].Viruses,2010,2(9):1933-1967.
[10] Hughes AL,Irausquin S,Friedman R.The evolutionary biology of poxviruses[J].Infect Genet Evol,2010,10(1):50-59.
[11] Li Y,Meng X,Xiang Y,etal.Structure function studies of vaccinia virus host range protein K1 reveal a novel functional surface for ankyrin repeat proteins[J].J Virol,2010,84(7):3331-3338.
[12] Brady G,Bowie AG.Innate immune activation of NF-κB and its antagonism by poxviruses[J].Cytokine Growth Factor Rev,2014,25(5):611-620.
[13] Di Pilato M,Mejías-Pérez E,Zonca M,etal.NFκB activation by modified vaccinia virus as a novel strategy to enhance neutrophil migration and HIV-specific T-cell responses[J].Proc Natl Acad Sci U S A,2015,112(11):E1333-1342.
[14] Diel DG,Delhon G,Luo S,etal.A novel inhibitor of the NF-κB signalling pathway encoded by the parapoxvirus orf virus[J].J Virol,2010,84(8):3962-2973.
[15] Diel DG,Luo S,Delhon G,etal.A nuclear inhibitor of NF-κB encoded by a poxvirus[J].J Virol,2011,85(1):264-275.
[16] Diel DG,Luo S,Delhon G,etal.Orf virus ORFV121 encodes a novel inhibitor of NF-κB that contributes to virus virulence[J].J Virol,2011,85(5):2037-2049.
[17] Arndt WD,Cotsmire S,Trainor K,etal.Evasion of the innate immune type I interferon system by monkeypox virus[J].J Virol,2015,89(20):10489-10499.
[18] Brady G,Haas DA,Farrell PJ,etal.Poxvirus protein mc132 from molluscum contagiosum virus inhibits NF-B activation by targeting p65 for degradation[J].J Virol,2015,89(16):8406-8415.
[19] Shisler JL,Jin XL.The vaccinia virus K1L gene product inhibits host NF-κB activation by preventing IκBα degradation[J].J Virol,2004,78(7)3553-3560.
[20] Willis KL,Patel S,Xiang Y,etal.The effect of the vaccinia K1 protein on the PKR-eIF2α pathway in RK13 and HeLa cells[J].Virology,2009,394(1):73-81.
[21] Willis KL,Langland JO,Shisler JL.Viral double-stranded RNAs from vaccinia virus early or intermediate gene transcripts possess PKR activating function,resulting in NF-κB activation,when the K1 protein is absent or mutated[J].J Biol Chem,2011,286(10):7765-7778.
[22] Mohamed MR,Rahmana MM,Lanchbury JS,etal.Proteomic screening of variola virus reveals a unique NF-κB inhibitor that is highly conserved among pathogenic orthopoxviruses[J].Proc Natl Acad Sci U S A,2009,106(22):9045-9050.
[23] Mohamed MR,Rahmana MM,Rice A,etal.Cowpox virus expresses a novel ankyrin repeat NF-κB inhibitor that controls inflammatory cell influx into virus-infected tissues and is critical for virus pathogenesis[J].J Virol,2009,83(18):9223-9236.
[24] Chang SJ,Hsiao JC, Sonnber G,etal.Poxvirus host range protein CP77 contains an F-box-like domain that is necessary to suppress NF-kappaB activation by tumor necrosis factor alpha but is independent of its host range function[J].J Virol,2009,83(9):4140-4152.
[25] Burles K,Van Buuren N,Barry M.Ectromelia virus encodes a family of ANK/F-box proteins that regulate NFκB[J].Virology,2014,468-470:351-362.
[26] Van Buuren N,Burles K,Schriewer J,etal.EVM005:An ectromelia-encoded protein with dual roles in NF-κB inhibition and virulence[J].PLoS Pathog,2014,10(8):e1004326.
[27] Blanie S,Gelfi J,Bertagnoli S,etal.MNF,an ankyrin repeat protein of myxoma virus,is part of a native cellular SCF complex during viral infection[J].Virol J,2010,7:56.
[28] Blanie S,Mortier J,Delverdier M,etal.M148R and M149R are two virulence factors for myxoma virus pathogenesis in the European rabbit[J].Vet Res,2009,40(1):e11.
[29] Lamb SA,Rahman MM,Mcfadden G.Recombinant myxoma virus lacking all poxvirus ankyrin-repeat proteins stimulates multiple cellular anti-viral pathways and exhibits a severe decrease in virulence[J].Virology,2014,464-465:134-145.
[30] Buttigieg K,Laidlaw SM,Ross C,etal.Genetic screen of a library of chimeric poxviruses identifies an ankyrin repeat protein involved in resistance to the avian type I interferon response[J].J Virol,2013,87(9):5028-5040.
[31] Laidlaw SM,Robey R,Davies M,etal.Genetic screen of a mutant poxvirus library identifies an ankyrin repeat protein involved in blocking induction of avian type I interferon[J].J Virol,2013,87(9):5041-5052.
[32] Herbert MH,Squire CJ,Mercer AA.Poxviral ankyrin proteins[J].Viruses,2015,7(2):709-738.
[收稿2016-08-09]
(编辑 许四平)
10.3969/j.issn.1000-484X.2017.05.028
①本文为国家自然科学基金地区项目(31560697、31260609、31360533)。
陈轶霞(1969年-),女,博士,教授,硕士生导师,主要从事动物重大疫病病原分子生物学研究, E-mail: chenyx69@126.com。
及指导教师:骆学农(1968-),男,博士,研究员,主要从事动物重大疫病病原分子生物学研究,E-mail: xuenongluo@aliyun.com。
S855.3
A
1000-484X(2017)05-0765-05
②中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室,兰州730046。

