替莫唑胺联合丙戊酸钠对人脑胶质瘤细胞生物学行为的影响
蔺 勇,马志骏,乔寒栋,徐效义,张 扬*
(1.长春市中心医院 神经科,吉林 长春130051;2.吉林大学药学院 生物药学系,吉林 长春130022;3.吉林大学第一医院 转化医学研究院,吉林 长春130021)
替莫唑胺联合丙戊酸钠对人脑胶质瘤细胞生物学行为的影响
蔺 勇1,马志骏2,乔寒栋2,徐效义3,张 扬2*
(1.长春市中心医院 神经科,吉林 长春130051;2.吉林大学药学院 生物药学系,吉林 长春130022;3.吉林大学第一医院 转化医学研究院,吉林 长春130021)
目的 观察替莫唑胺(TMZ)与丙戊酸钠(VPA)联用对人脑胶质瘤细胞SHG-44和U251生物学行为的影响。方法 将细胞分为对照组、VPA单用组、TMZ单用组和VPA-TMZ联用组。分别采用MTT法检测细胞增殖;流式细胞术AnnexinV-FLUOS染色法检测细胞凋亡;DAPI染色法观察凋亡细胞形态学变化;Transwell小室检测细胞侵袭能力。结果 VPA-TMZ联用较TMZ/VPA单独用药,能有效抑制人胶质瘤细胞SHG-44和U251的增殖,促进其凋亡且减弱其侵袭能力。结论 VPA可提高人脑胶质瘤细胞对TMZ的敏感性,为临床合理用药提供参考。
替莫唑胺;丙戊酸钠;人脑胶质瘤
(ChinJLabDiagn,2017,21:0885)
脑胶质瘤是最常见的中枢神经系统肿瘤之一,具有高侵袭性、高复发率、治疗效果差、预后较差和存活率低等特点[1]。目前对于恶性胶质瘤的治疗方案多为手术结合术后放化疗,但由于血-脑脊液屏障的存在,常规化疗药物对颅内恶性肿瘤术后辅助治疗的效果比较有限。替莫唑胺(Temozolomide,TMZ)因其脂溶性高,易于通过血脑屏障,且不良反应轻,目前广泛应用于临床[2,3]。但其单独用药易导致脑胶质瘤产生耐药,治疗后患者中位生存期仍然少于15个月[4]。因此,寻找有效的TMZ药物联用策略,对于增强脑胶质瘤化疗效果,改善患者生存质量,减少脑胶质瘤复发尤为重要。
丙戊酸钠(Valproic acid,VPA)是临床常用的抗癫痫药物,其在胶质瘤术后预防癫痫的同时能够增强化疗药物杀伤肿瘤的效果,并且对恶性肿瘤具有诱导分化作用[5]。本研究拟采用TMZ与VPA联合用药,观察其对人脑胶质瘤细胞SHG-44和U251生物学行为的影响,为进一步指导临床VPA治疗脑胶质瘤提供实验依据,亦为TMZ与药物联用后提高其药效提供参考。
1 材料与方法
1.1 主要药物、试剂及仪器 TMZ及VPA购自美国Selleck公司;人脑胶质瘤细胞株SHG-44和U251均由吉林大学第一医院转化医学研究院肿瘤中心实验室提供;DMEM培养液购自美国Gibco公司;胎牛血清购自北京元亨金马生物技术有限公司;胰蛋白酶购自长春宝泰克生物技术公司;EDTA、DMSO、ECM购自美国Sigma公司;MTT购自美国Amresco公司;AnnexinV-FLUOS凋亡试剂盒购自上海碧云天生物技术有限公司;Transwell小室购自美国Corning公司;倒置显微镜和荧光显微镜,Olympus日本;流式细胞仪,BD美国。
1.2 方法
1.2.1 细胞培养与药物处理 SHG-44和U251用含10%胎牛血清的DMEM培养液于5%CO2、37℃恒温培养箱中传代培养。取对数增长期细胞进行药物处理。分为4组:(1)DMSO(对照组,浓度为0.05%);(2)VPA(0.5、1、2、4、8、16、32 mM);(3)TMZ(0.05、0.1、0.5、1、5 mM);(4)VPA+TMZ。
1.2.2 MTT法检测细胞存活 取对数增长期的两种细胞,分别以1.0×104/ml和3.0×104/ml密度、每孔100 μl细胞悬液接种于96孔板,每组各设3个复孔。收集各时间点的细胞(0、24、48、72 h),每孔加入MTT(5 mg/ml)20 μl,继续培养4 h,弃上清液,再加入DMSO溶剂150 μl,置于振荡器避光直至甲瓒结晶溶解,酶标仪检测波长490 nm处吸光度(A值),计算各组细胞存活率。
1.2.3 AnnexinV-FLUOS染色法检测细胞凋亡 取对数增长期的两种细胞,分别以1.0×104/ml和3.0×104/ml密度接种于6孔板内过夜,弃上清,按分组处理细胞,每组各设3个复孔。培养48 h后,将培养板上各组培养基分别移至15 ml试管中并置于冰上备用;PBS洗涤细胞,用不含EDTA的胰蛋白酶消化后将细胞重悬于上一步所得培养基中;将细胞悬液移至一离心管,加入200 μl AnnexinV-FLUOS结合液轻混;室温避光反应10 min,1000 rpm离心5 min,弃上清;再加入190 μl AnnexinV-FLUOS结合液重悬后加入10 μl碘化丙啶(PI),立即行流式细胞仪检测细胞凋亡。
1.2.4 DAPI染色法观察凋亡细胞形态学变化 取对数增长期SHG-44细胞,以1.0×104/ml密度接种于6孔板内,每孔2 ml。按分组处理细胞,培养48 h;弃孔板内培养基,PBS洗涤2次,每孔加入500 μl甲醇固定10 min;PBS洗涤2次,每孔加入200 μl DAPI染液,室温避光反应15 min;甲醇洗涤1次后于荧光显微镜下观察。
1.2.5 Transwell小室检测细胞侵袭能力 将ECM胶(8-12 mg/ml)置于4℃融化过夜,用预冷的无血清DMEM按1∶9稀释(稀释至1 mg/ml);Transwell板上室每孔加入40 μl冰预冷的ECM胶,37℃放置20 min,平铺胶化。收集对数增长期SHG-44细胞,无血清培养基调整细胞密度为1.0×105/ml,在Transwell板滤膜上方加入200 μl细胞悬液,孔板下室加入含30%胎牛血清的DMEM培养基600 μl,置于37℃、5%CO2条件下培养24 h;取上室,弃室内培养液,用棉签拭去滤膜上的细胞,冰甲醛固定15 min,0.1%结晶紫染色15-20 min,光镜下观察细胞。随机取5个视野,高倍镜(×200)下计数每个视野内穿过微孔的细胞数,以迁移细胞的相对数目来表示肿瘤细胞的侵袭能力。
1.2.6 统计学分析 采用SPSS10.0统计学软件对实验数据进行整理和分析,实验结果以均数±标准差表示,两样本显著性比较用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 VPA、TMZ单独及联用对细胞增殖的影响
MTT检测两种细胞存活率变化。在SHG44细胞中,除0.5 mM低浓度外,VPA单独作用48 h该细胞活性随着其浓度增加而减弱(P<0.01);在U251细胞中,VPA单独作用48 h且浓度≥4 mM时,对该细胞存活有显著的抑制作用(P<0.05),且抑制作用随药物浓度的增加而增强。VPA对两种细胞的IC50约为16mM(图1a)。除0.05、0.1 mM低浓度外,TMZ其余浓度组作用48 h均能显著抑制两种细胞的存活(P<0.01)。结果亦发现,TMZ抑制作用随药物浓度的增加而增强,且对两种细胞的IC50约为1 mM(图1b)。在后续实验中,鉴于VPA具有提高TMZ对胶质瘤细胞的杀伤能力,故选取低浓度1、2 mM作为后续VPA-TMZ联用的实验浓度。

图1 VPA、TMZ单独作用48 h对两种胶质瘤细胞增殖的影响
如表1所示,与单独用药组相比,VPA-TMZ联用两种细胞的存活率都有所减少(P<0.01)。提示经VPA作用后,在一定程度上增强了TMZ对脑胶质瘤细胞增殖的抑制作用。
2.2 VPA-TMZ联用对细胞凋亡的影响
流式细胞术Annexin V-FLUOS染色法检测细胞凋亡结果显示,低浓度VPA(1、2 mM)作用于两种胶质瘤细胞后,其细胞凋亡率较对照组无明显差别(P<0.05);单用TMZ组两种胶质瘤细胞凋亡率略有增多但不显著;与单用VPA/TMZ相比,VPA-TMZ联用均使两种胶质瘤细胞凋亡及坏死率明显增多(P<0.01),以2 mM VPA +1 mM TMZ促细胞凋亡效果最为显著(图2)。
2.3 VPA-TMZ联用SHG-44细胞凋亡形态学的变化
经DAPI染色免疫荧光观察VPA-TMZ联用对胶质瘤SHG-44细胞凋亡的形态学变化(图3)。对照组细胞核形完整,染色质均匀;VPA单用组的细胞形态及荧光显色上与对照组无明显差别;单用TMZ后细胞体积有所增大,凋亡数量增多,且荧光染色减弱;而VPA-TMZ联用组细胞凋亡明显增多,染色质固缩,周边化聚集,甚至细胞核破裂形成碎片,核解体。

表1 VPA-TMZ联用对胶质瘤细胞存活率的影响
注:与空白对照组比较,**P<0.01,*P<0.05。
2.4 Transwell检测VPA-TMZ联用对SHG-44细胞侵袭能力的影响
细胞侵袭实验显示,在铺有ECM凝胶的Transwell小室中,与空白对照组(255±13)及单用VPA组(247±11)或TMZ组(156±23)相比,VPA-TMZ联用组穿膜细胞数(86±9)明显减少,差异具有统计学意义(P<0.05)(图4),表明二者联用能有效减弱SHG-44细胞侵袭能力。
3 讨论
目前美国国立综合癌症网络(NCCN)、欧洲肿瘤联盟(ESMO)和我国均推荐将TMZ列为初治及复发恶性胶质瘤最重要的一线化疗药物,但其总体预后不乐观。因此寻找增强TMZ药物敏感性,提高TMZ疗效的辅助化疗药物十分必要。
研究者们发现VPA作为组蛋白去乙酞化酶抑制剂(histone deacetylase inhibitor,HDACI),通过诱导细胞周期停滞、细胞凋亡和分化,可抑制人乳腺癌细胞MCF-7、腺病毒5DNA转化HEK细胞、人神经胶质瘤细胞、淋巴单核细胞、鼠原代星形胶质细胞和肺癌细胞株等生长增殖,或是阻碍血管生成、抑制转移,从而达到治疗肿瘤的目的[6-11]。此外,VPA因半衰期长、生物利用性较好及有效药物浓度较低等特点,在临床辅助治疗方面有一定的优势。例如脑胶质瘤患者围手术期应用VPA可显著降低癫痫发生率,不良反应小,且安全性较好[12]。


图2 VPA-TMZ联用对SHG-44(a)和U251(b)细胞凋亡的影响

图3 VPA-TMZ联用SHG-44细胞凋亡形态学的变化
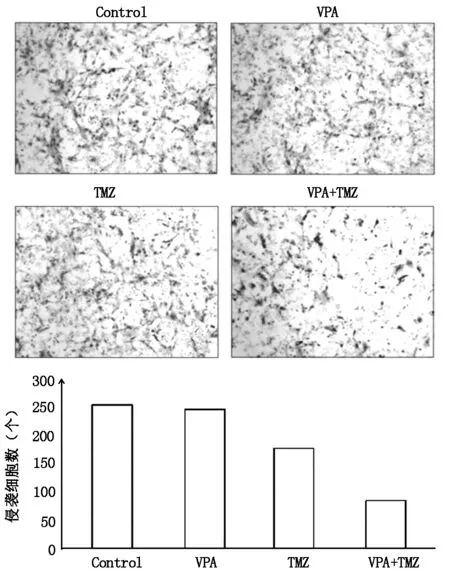
图4 VPA-TMZ联用对SHG-44细胞侵袭能力的影响
VPA不仅可以单独应用,还可以与传统化疗药物TMZ联合应用治疗恶性肿瘤,尤其是恶性程度极高的脑胶质瘤。有报道[13],VPA-TMZ联用对TMZ敏感型脑胶质瘤细胞株(T98、U138)的增殖和迁移抑制,以及凋亡和自噬诱导有良好的协同效应;体内实验亦观察到联合用药可降低胶质瘤移植模型肿瘤的生长。此外,Ⅱ期临床试验结果显示,VPA协同放疗及TMZ对药物敏感性胶质瘤患者有较好的耐受性[14],且延长其生存时间,提高其生活质量[15]。
本实验通过利用MTT法、流式细胞术、免疫荧光染色法和Transwell肿瘤细胞侵袭实验等技术,观察到VPA-TMZ联用较TMZ/VPA单独用药,能有效抑制人胶质瘤细胞SHG-44和U251的增殖,促进其凋亡且减弱其侵袭能力。邵翠杰等亦证实体外VPA在1 mM浓度时,能够增强TMZ对大部分胶质瘤细胞的杀伤作用[16]。因此,VPA联合TMZ可能成为胶质瘤临床化疗过程中候选治疗措施,为提高胶质瘤化疗效果提供参考。
[1]Stupp R,Hegi ME,Mason WP,et al.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J].Lancet Oncol,2009,10(5):459.
[2]Omuro A,Chan TA,Abrey LE,et al.Phase Ⅱtrial of continuous low-dose temozolomide for patients with recurrent malignant glioma[J].Neuro Oncol,2012,15(2):242.
[3]Filippi-Chiela EC,Thome MP,Buenoe Silva MM,et al.Resveratrol abrogates the Temozolomide-induced G2 arrest leading to mitotic catasthophe and reinforces the Temozolomide senescence in glioma cells[J].BMC Cancer,2013,13(1):147.
[4]张 勇,马继伟,李海莹,等.替莫唑胺联合粉防己碱对人脑胶质瘤U87细胞的抑制作用[J].中国药理学与毒理学杂志,2014,28(3):367.
[5]Blaheta RA,Cinatl J Jr.Anti-tumor mechanisms of valproate:a novel role for an old drug[J].Med Res Rev,2002,22(5):492.
[6]Detich N,Bovenzi V,Szyf M.Valproate induces replication-independent active DNA demethylation[J].J Biol Chem,2003,278(30):27586.
[7]Marchion DC,Bicaku E,Daud AI,et al.Valproic acid alters chromatin structure by regulation of chromatin modulation proteins[J].Cancer Res,2005,65(9):3815.
[8]Milutinovic S,D’Alessio AC,Detich N,et al.Valproate induces widespread epigenetic reprogramming which involves demethylation of specific genes[J].Carcinogenesis,2007,28(3):560.
[9]Perisic T,Zimmermann N,Kirmeier T,et al.Valproate and amitriptyline exert common and divergent influences on global and gene promoter-specific chromatin modifications in rat primary astrocytes[J].Neuropsychopharmacol,2010,35(3):792.
[10]Gu S,Tian Y,Chlenski A,et al.Valproic acid shows potent antitumor effect with alteration of DNA methylation in neuroblastoma[J].Anticancer Drugs,2012,23(10):1054.
[11]Brodie SA,Li G,El-Kommos A,et al.Class I HDACs are mediators of smoke carcinogen-induced stabilization of DNMT1 and serve as promising targets for chemoprevention of lung cancer[J].Cancer Prev Res,2014,7(3):351.
[12]张 静,江 燕.脑肿瘤患者预防性使用抗癫痫药物的有效性及安全性[J].中国实用神经疾病杂志,2016,19(4):24.
[13]Ryu CH,Yoon WS,Park KY,et al.Valproic acid downregulates the expression of MGMT and sensitizes temozolomide-resistant glioma cells[J].J Biomed Biotechnol,2012,(4):987495.
[14]Krauze AV,Myrehaug SD,Chang MG,et al.A phase Ⅱ study of concurrent radiation therapy,temozolomide,and the histone deacetylase inhibitor valproic acid for patients with glioblastoma[J].Int J Radiat Oncol Biol Phys,2015,92(5):986.
[15]Weller M,Gorlia T,Cairncross JG,et al.Prolonged survival with valpronic acid use in the EORTC/NCIC temozolomide trial for glioblastoma[J].Neurology,2011,77(12):1156.
[16]邵翠杰,许洪升,陈忠平.丙戊酸对胶质瘤细胞化疗敏感性的影响[J].山东医药,2010,50(31):1.
Study on effects of biological activity by temozolomide combined with valproic acid on human glioma cells
LINYong1,MAZhi-jun2,QIAOHan-dong2,etal.
(1.DepartmentofNeurobiology,ChangchunCentralHospital,Changchun130051,China;2.DepartmentofBiologicalPharmacy,SchoolofPharmaceuticalSciences,JilinUniversity;3.InstituteofTranslationMedicine,theFirstHospitalofJilinUniversity)
Objective The main aim of the present study was to observe the effects of biological activity by TMZ combined with VPA on human glioma cells.Methods Cultured cells were divided into 4 groups:Control,VPA,TMZ and VPA-TMZ.MTT assay were used to detect the cell proliferation,and the cell proliferation rate were calculated;cell apoptosis was assayed using flow cytometry with Annexin V-FLUOS staining;morphological changes of apoptotic cells was observed by DAPI staining;invasionability of cells was detected with Transwell chamber.Results VPA combined with TMZ caused a more significant inhibition of SHG-44 and U251cells.The combination of these two drugs enhanced the apoptotic cell death,as well as suppressed the invasive abilities in glioma cells compared with the monotherapy groups.Conclusion VPA could enhance the sensitivity of human glioma cells to TMZ.The clinical efficacy of TMZ in malignant glioma may be improved by combination with VPA.
Temozolomide;Valproic acid;human glioma cell
吉林省卫生厅重点实验室项目(2012Z114)和吉林省科技厅自然科学基金项目(20130101173JC)
*通讯作者
1007-4287(2017)05-0885-05
R739
A
蔺勇,医学博士,副主任医师,主要从事脑血管病临床和基础研究。
2016-08-20)

