硬膜外麻醉与镇痛对非小细胞肺癌患者术后并发症的影响
许珍真,李怀瑾,李 雪,孔 昊,刘雅菲,周 寅,刘庆浩,王东信*
(北京大学第一医院:1麻醉科,2胸外科,北京100034)
手术是肺癌患者的重要治疗手段。但此类患者是术后并发症的高危患者,这与其疾病特点(肺部病变)、手术特点(切除部分肺组织、手术部位靠近心脏)及术后疼痛密切相关[1-3]。而术后并发症的发生伴随患者预后的恶化,包括住院时间延长、死亡率升高、医疗费用升高[4]。硬膜外阻滞常复合用于大手术患者麻醉,其优势是减轻术中应激反应、减少麻醉药物的使用,并为术后患者提供良好的镇痛效果[5,6]。在以往的研究中,与全身麻醉相比,神经轴索阻滞可降低术后并发症(特别是肺部并发症)发生率和死亡率;但神经轴索阻滞与全身麻醉复合应用是否具有同样优势尚不明确[7,8]。对于心脏手术患者,硬膜外复合全身麻醉可减少术后心律失常和肺部并发症的发生[9];对于胸科手术患者,硬膜外阻滞是术后镇痛的金标准[6]。然而,对于微创胸外科手术,目前尚无公认的麻醉/镇痛标准[10]。对于接受胸腔镜辅助小切口肺癌根治性手术患者,硬膜外复合全身麻醉和术后硬膜外镇痛同样可能有助于减少术后并发症的发生。本研究旨在观察硬膜外阻滞用于微创肺癌手术患者麻醉和镇痛对术后并发症发生率的影响。
1 对象与方法
1.1 研究设计
这是一项标签开放的单中心随机对照研究。研究方案经北京大学第一医院伦理委员会批准(批准号为 2013[653]),并分别在 clinicaltrial.gov(NCT 02801409)及中国临床研究注册平台(ChiCTR-TRC-14004136)注册。本研究于2014年1月至2015年11月在北京大学第一医院实施。所有入组患者均由其本人或委托人签署知情同意书。
1.2 研究对象
研究者在术前1 d访视、筛选患者。纳入标准:(1)年龄≥18岁且<80岁;(2)临床初步诊断为原发性非小细胞肺癌(non-small cell lung cancer,NSCLC)(ⅠA~ⅢA期),拟行外科根治性手术治疗;(3)同意接受术后自控镇痛。
排除标准包括:(1)已发生肿瘤转移或术前曾行放化疗;(2)既往曾经接受肺癌手术;(3)合并其他部位肿瘤;(4)合并自身免疫疾病,长期服用激素或免疫抑制剂者;(5)既往神经、精神疾病或终末期疾病等情况无法完成术前评估;(6)术前美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级≥Ⅳ级者,严重肾脏疾病(血清肌酐>442 μmol/L,伴或不伴血钾 >6.5 mmol/L,或临床医师认为需行肾脏替代治疗者)或严重肝脏疾病(Child-Pugh分级C级);(7)有硬膜外麻醉禁忌,包括拟麻醉穿刺节段脊柱严重畸形或脊柱手术史、凝血功能异常[国际标准化比值(international normalized ratio,INR)>1.4或部分活化凝血酶原时间(activated partial thromboplastin time,aPTT)>正常上限]、血小板计数<80×109/L、穿刺部位感染及外伤、严重腰背部疼痛在麻醉后可能加重者。
1.3 随机分组
本研究由SAS软件产生随机数字表,采用区组随机(区组大小为4),按1∶1比例将患者分为两组。研究期间符合纳入、排除标准且已签署知情同意书的患者,由专人在麻醉前根据随机数字将患者分至两组,分别接受“单纯全身麻醉加术后静脉镇痛(GA组)”或“硬膜外全身复合麻醉加术后硬膜外镇痛(EGA 组)”。
1.4 麻醉和手术方法
GA组患者麻醉诱导使用咪唑安定、舒芬太尼、异丙酚、罗库溴铵,麻醉维持使用吸入麻醉(七氟醚)、静脉麻醉(持续输注异丙酚)或静脉/吸入复合麻醉,间断/泵注给予舒芬太尼和罗库溴铵维持镇痛和肌肉松弛。术后3 d内采用静脉自控镇痛:配方为0.5 mg/ml吗啡,总量100 ml;镇痛泵设置为背景剂量1 ml/h,单次追加剂量2 ml,时间间隔6~10 min。低体质量、一般状况差的患者可以酌情减小药量。
EGA组患者全麻诱导前进行硬膜外穿刺置管,穿刺点应选择可以覆盖切口范围的椎间隙,穿刺后经硬膜外管给予2%利多卡因3~4 ml,测量阻滞平面,以确定阻滞效果满意。维持期间经硬膜外导管间断推注0.375% ~0.500%罗哌卡因维持镇痛直至手术结束。全身麻醉诱导和其他维持药物和方法基本同于GA对照组。术后3 d内采用硬膜外自控镇痛:配方为0.12%罗哌卡因和 0.5 μg/ml舒芬太尼,总量250 ml;镇痛泵设置为背景量4 ml/h,单次追加剂量2 ml,时间间隔20 min。低体质量、一般状况差的患者可以酌情减小药量。
EGA组硬膜外穿刺失败或置管失败的受试者,按照GA组同样方法实施麻醉和术后镇痛。如果术后自控镇痛效果不满意,GA组患者可调整镇痛泵设置(增加背景用量或/和单次追加量,缩短给药间隔)或加用其他镇痛药物(如口服/静注/肌注NSAIDs类/阿片类等镇痛药);EGA组患者可调整镇痛泵设置、加用其他镇痛药物或改用静脉自控镇痛(如果对硬膜外导管位置有疑问)。以上各种情况均需在病例报告表中特别注明。
两组患者均接受胸腔镜辅助下小切口肺叶切除术加淋巴结清扫术,通过肌肉间隙或沿肌纤维方向分离开肌肉,套上一次性切口牵开固定器(装置)(商品名:欣皮护 VIPA型,标准:YZB/苏 0825-2011)后,不切除肋骨而经过肋间入胸,通过此路径放置胸腔镜(Stryker,美国)及相应手术器械并借助高分辨显示器完成手术操作。术毕于腋中线或腋后线第6或7或8肋间放置20或24Fr胸管。
1.5 资料收集
术前1 d受试者签署知情同意书后(特殊情况下允许在获得患者或/及其委托人口头同意后)收集基线资料,包括采集人口学资料。
手术当天记录麻醉方法(包括硬膜外穿刺点选择、穿刺置管经过及硬膜外阻滞效果等),麻醉用药物及持续时间,术中出血量、输血量及液体出入量,手术方式、术中所见及持续时间,以及不良事件发生情况。
术后第1~3天每天固定在16∶00~18∶00时间段里评估患者静息及咳嗽时数字评定量表(numeric rating scale,NRS)疼痛评分(0=完全无痛,10=最严重疼痛),并记录术后镇痛泵使用情况及镇痛相关不良事件(如恶心呕吐、硬膜外导管脱出、硬膜外感染、镇痛无效等)的发生情况。术后第4天起每周随访直至出院,记录术后拔出胸管时间、引流量、术后并发症发生情况及术后住院时间。
主要研究终点为术后住院期间并发症发生情况。术后并发症定义为术后新发的、对患者预后有不良影响且需要医学干预的情况。次要终点包括术后1~3 d镇痛效果(NRS疼痛评分)、术后住院时间及术后住院期间死亡率。
1.6 统计学处理
采用意向性治疗分析。连续变量及等级资料的分析采用两独立样本t检验或Mann-Whitney U检验;分类无序变量的分析采用卡方检验或Fisher精确概率法,有序变量采用CMH秩和检验;时间相关事件变量采用Kaplan-Meier生存分析,组间差异使用Log-Rank法进行检验。P<0.05为差异有统计学意义。采用SPSS22.0软件包对数据进行统计学处理。
2 结果
2.1 患者一般情况
本研究共纳入396例在胸腔镜辅助下行小切口肺癌根治术的NSCLC患者,其中GA组198例,EGA组198例,全部患者进入意向治疗分析。术前基线资料两组之间差异无统计学意义(表1)。术中舒芬太尼及瑞芬太尼用量EGA组明显少于GA组(均P<0.0001),其他围术期管理情况两组间差异均无统计学意义(表2)。
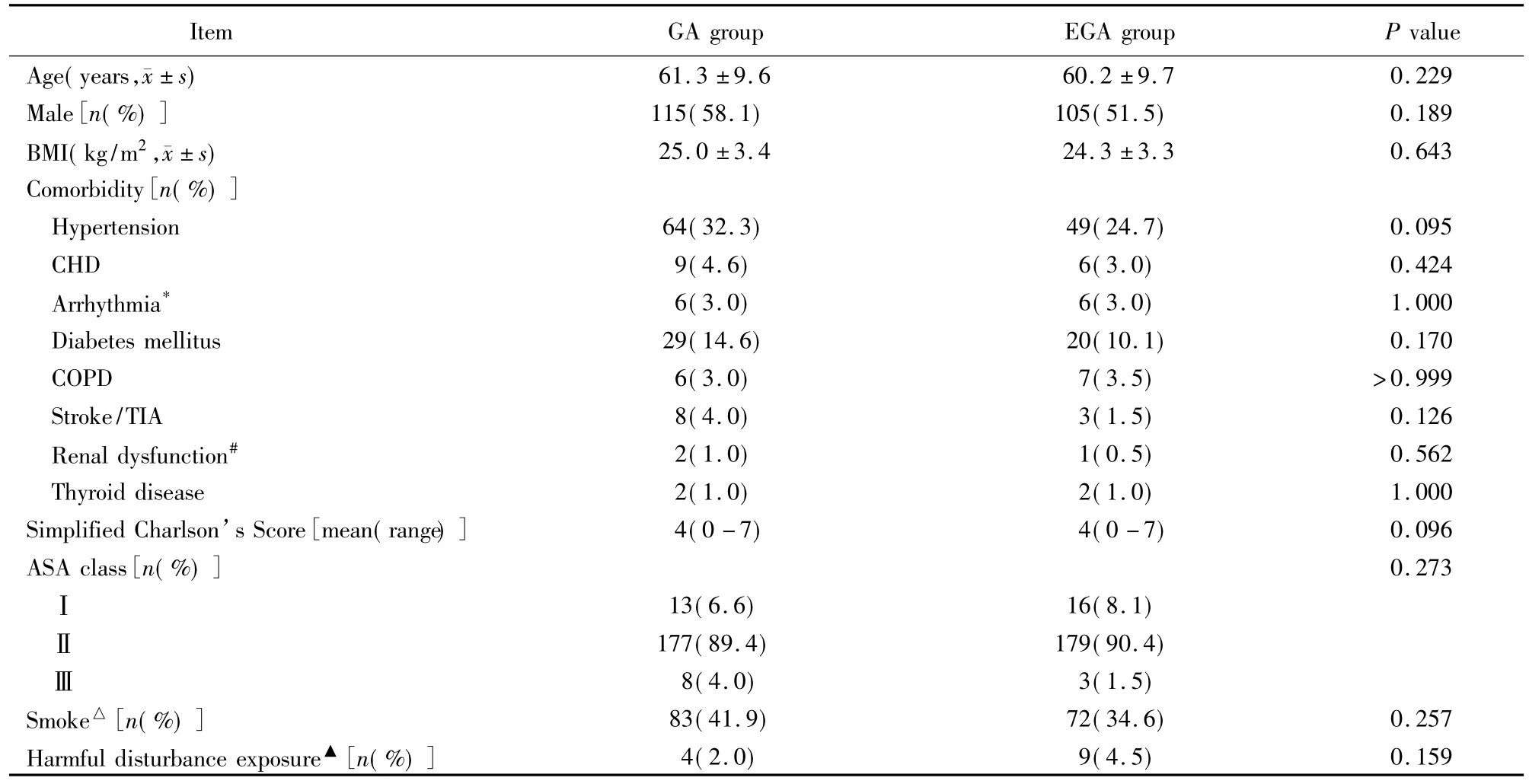
表1 两组人口学及基线资料Table 1 Baseline characteristics of all subjects (n=198)
2.2 有效性指标
术后入ICU患者比例EGA组[1.0%(2/198)]低于 GA 组[4.5%(9/198),P=0.032]。术后前 3 d静息及咳嗽时NRS疼痛评分EGA组均明显低于GA组(均为P<0.0001)。肺不张发生率EGA组[1.0%(2/198)]低于 GA 组[4.5%(9/198),P=0.032];EGA 组房颤发生率[2.0%(4/198)]及心血管并发症发生率[2.5%(5/198)]均低于GA组[分别 5.1%(14/198),P=0.016;8.1%(16/198),P=0.014]。术后总的并发症发生率两组间差异无统计学意义[EGA组 18.2%(36/198),GA组17.7%(35/198),P=0.892]。术后住院天数两组间无明显差异;两组均无院内死亡发生(表3)。
2.3 安全性指标
本研究中1例穿破硬脊膜、2例硬膜外穿刺失败,术中99.0%(196/198)完成了硬膜外麻醉;9例术后硬膜外管脱出,术后94.4%(187/198)完成硬膜外镇痛。围术期需要干预的心动过缓患者比例EGA组低于GA组(P=0.002),需要干预的低血压患者比例EGA组高于GA组(P=0.021),需要干预的高血压患者比例EGA组低于GA组(P<0.0001)。其他不良事件发生率两组间差异无统计学意义(表4)。
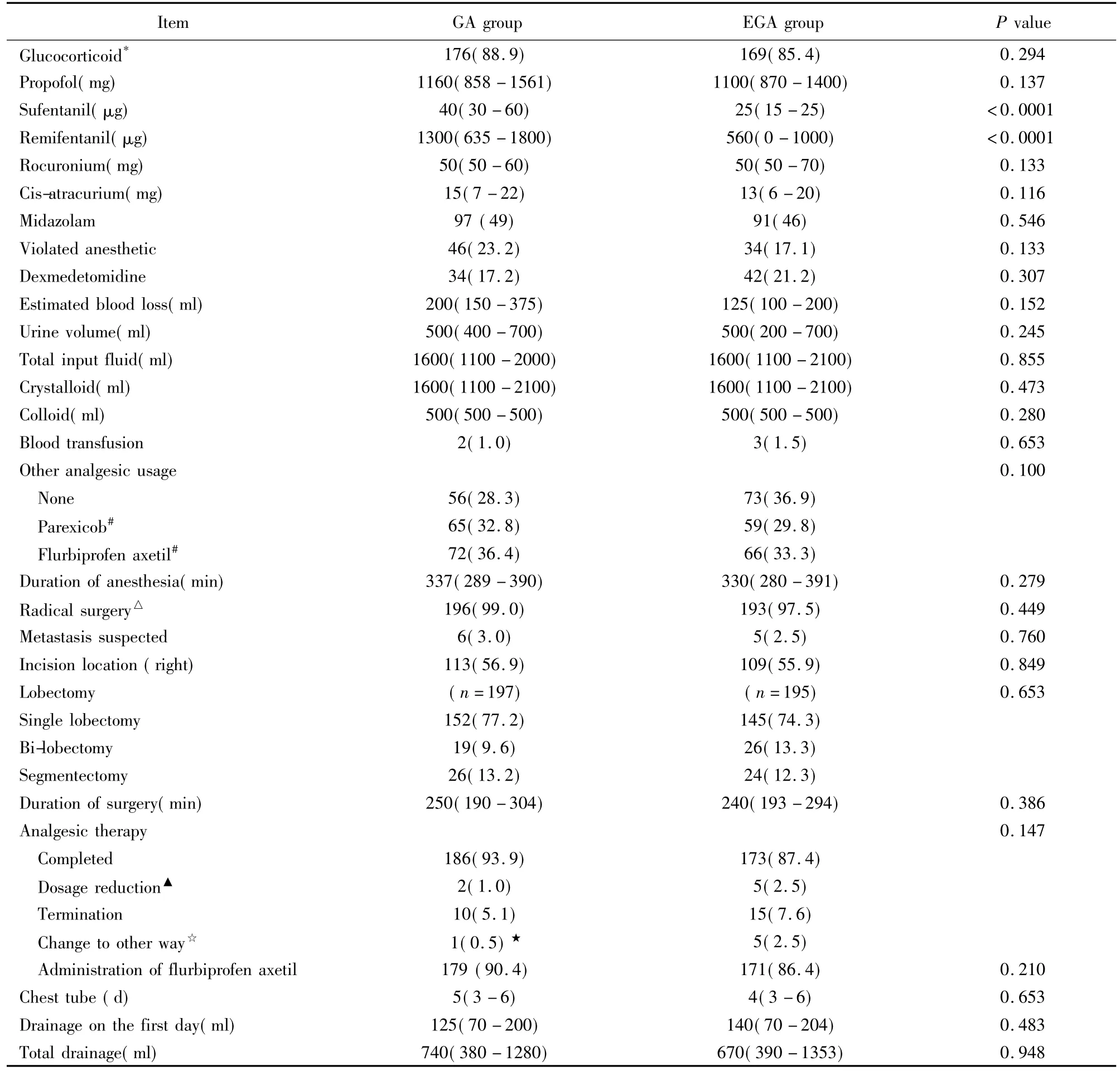
表2 围术期管理Table 2 Perioperative managements (n=198)
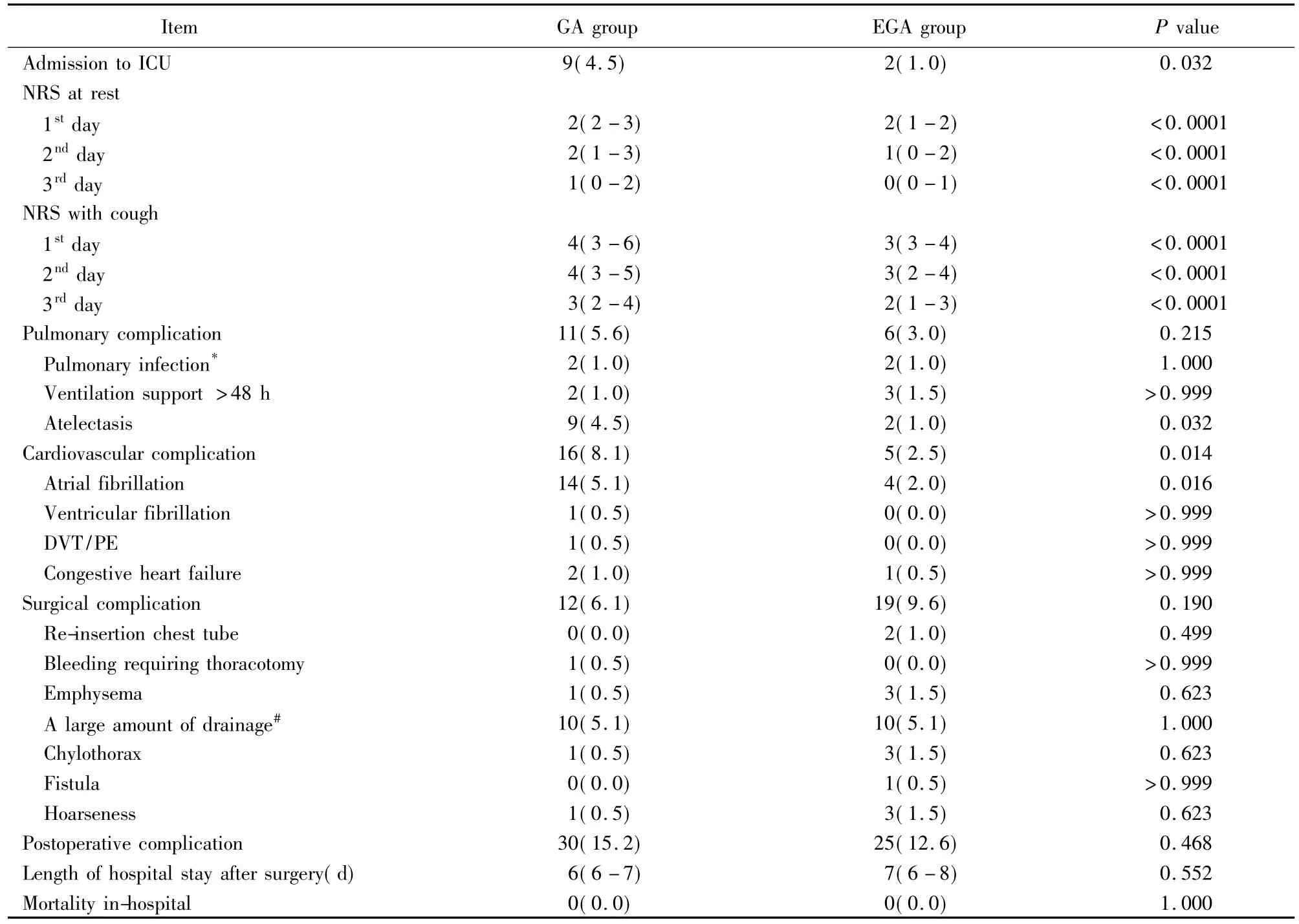
表3 术后并发症发生及近期结局Table 3 Postoperative complications and short-term outcome (n=198)

表4 不良事件发生情况Table 4 Adverse events (n=198)
3 讨论
本研究结果显示,对于接受胸腔镜辅助小切口肺癌切除术的患者,术中复合硬膜外麻醉和术后硬膜外镇痛减少了术中阿片类药物的使用和术后入ICU的患者比例,改善了术后镇痛效果,减少了术后肺不张、房颤及心血管并发症的发生率,但对术后总的并发症发生率及术后住院时间无明显影响。
与常规开胸术相比,胸腔镜辅助下小切口肺叶切除术具有创伤小、术后疼痛程度低、术后并发症少等优势,近年来逐渐得到广泛开展[11,12]。在以往的研究中,硬膜外麻醉与镇痛对常规开胸手术患者具有明显优势[6]:可有效减轻术后疼痛程度[13]、减少肺部并发症的发生[14]、加速康复离院并降低术后死亡率[15]。但对于术后疼痛程度轻、并发症风险少的胸腔镜辅助下小切口肺叶切除手术,硬膜外阻滞的优势如何尚不清楚。近年来对于微创胸科手术的麻醉镇痛研究多集中在椎旁阻滞、肋间神经阻滞、胸长神经阻滞等方面,这些区域神经阻滞方法的缺陷是术后镇痛时间不足[16,17],其对术后并发症的影响也不明确。
术中硬膜外阻滞的优势是减少全身麻醉药物的使用[5,6],本文也发现术中阿片类药物用量硬膜外组更少。本文中术后入ICU患者比例在硬膜外组更低可能与此有关,因更少的药物用量使患者术后恢复更好。本研究中硬膜外阻滞持续至术后第3天,并与传统的术后吗啡静脉镇痛进行比较,结果术后1~3 d咳嗽时及静息时的NRS疼痛评分硬膜外组均明显更低。术后切口的疼痛会严重影响患者胸壁的运动、使肺的功能残气量减少,排痰不利会造成肺不张甚至肺炎。开胸手术患者疼痛的主要来源是术中肋间扩张时器械对肋间神经的压迫以及术后留置胸管对胸膜的刺激。以往针对胸腔镜辅助下开胸手术患者的镇痛研究主要侧重于镇痛效果,对患者结局关注较少[10,18,19]。本研究采用严格的随机分组设计,在手术方式、手术部位、手术淋巴结清扫范围、胸管留置情况等指标间两组均无显著差异。本文结果说明,即使对于微创肺癌手术患者,硬膜外镇痛仍然具有明显优势,这与接受开放式手术的患者是一致的。镇痛效果的改善可明显增加患者咳嗽的主动性,这可能是本文结果中硬膜外组术后肺不张比例更低的主要原因。
房颤是胸科手术后最常见的心律失常,也是最常见的心脏并发症[20]。开胸手术房颤的发生机制仍然不是十分明确,可能与手术刺激和肺静脉结扎有关。本研究同样发现术后房颤是最常见的心血管并发症,全身麻醉组的发生率为7.1%,与文献中报告的结果一致[21,22]。在心脏手术患者中,研究显示硬膜外麻醉可减少术后房颤发生,可能与胸段硬膜外阻滞直接抑制交感神经活性有关[9,23]。但硬膜外阻滞对胸科手术患者术后房颤的发生有无保护意义并不明确[20]。有研究报告硬膜外阻滞并无预防术后房颤的作用[24,25]。本研究结果显示,胸段硬膜外麻醉与镇痛减少了肺癌手术患者术后房颤的发生。
本文中尽管硬膜外组术后镇痛效果更好,术后肺不张和房颤发生率更低,但术后总的并发症发生率和住院时间并无差异。前者可能与其他并发症特别是外科并发症的干扰有关,本研究中术后外科并发症发生率为7.9%;后者可能与患者的术后住院时间较长有关。在Mckenna等[21]的研究中,接受胸腔镜下肺切除手术患者的中位总住院时间为3 d(平均住院时间为4.8 d);在 Paul等[22]对杜克大学患者的研究中,中位术后住院时间为4 d。本研究中患者的术后平均住院时间为6~7 d,较长的住院时间可能掩盖了硬膜外阻滞的优势。
硬膜外穿刺本身有一定风险。本文中有1例患者穿刺期间发生硬脊膜穿破,但无神经损伤发生;另有2例硬膜外穿刺失败。硬膜外阻滞增加围术期需要干预的低血压发生率,与文献报告的结果相似[6];本研究中EGA组心动过缓减少可能与干预低血压过程中使用了较多的拟交感类药物有关。但另一方面,硬膜外阻滞也减少了需要干预的高血压的发生。这与胸段硬膜外阻滞阻断伤害性刺激的传入和降低交感神经活性有关。此外,EGA组患者有一定的术后硬膜外导管脱出发生率。总体而言,硬膜外阻滞可安全用于胸腔镜下小切口肺癌术后的麻醉与术后镇痛。
严格规范的随机对照设计是本研究的优势,但仍有一些局限性。首先,作为一项单中心研究,本研究中患者所处的临床医疗背景相对单一。今后应开展多中心研究以提供更强有力的临床证据。其次,由于硬膜外穿刺的有创性,本研究无法实现双盲设计。但术后随访者不参与对患者的围术期管理,且随访结局与随访者无利益冲突,所以将偏倚风险降至最低。
综上,对于接受胸腔镜辅助下小切口肺癌手术的患者,硬膜外麻醉与镇痛可减少术中阿片类药物使用、改善术后镇痛效果,并减少术后肺不张和房颤的发生。该方法是安全的。硬膜外阻滞对肺癌手术患者术后远期结局的影响还需进一步研究。
[1] Canet J,Gallart L,Gomar C,et al.Prediction of postoperative pulmonary complications in a population-based surgical cohort[J].Anesthesiology,2010,113(6):1338 - 1350.DOI:10.1097/ALN.0b013e3181fc6e0a.
[2] Keshava HB,Boffa DJ.Cardiovascular complications following thoracic surgery[J]. ThoracSurgClin,2015,25(4):371 -392.DOI:10.1016/j.thorsurg.2015.07.001.
[3] Loan WB,Morrison JD.The incidence and severity of postoperative pain[J].Br J Anaesth,1967,39(9):695 -698.
[4] Rotman JA,Plodkowski AJ,Hayes SA,et al.Postoperative complications after thoracic surgery for lung cancer[J].Clin Imaging,2015,39(5):735 - 749.DOI:10.1016/j.clinimag.2015.05.013.
[5] Ezhevskaya AA,Mlyavykh SG,Anderson DG.Effects of continuous epidural anesthesia and postoperative epidural analgesia on pain management and stress response in patients undergoing major spinal surgery[J].Spine(Phila Pa 1976),2013,38(15):1324 -1330.DOI:10.1097/BRS.0b013e318290ff26.
[6] Guay J,Kopp S.Epidural pain relief versus systemic opioid-based pain relief for abdominal aortic surgery[J].Cochrane Database Syst Rev,2016,(1):Cd005059.DOI:10.1002/14651858.CD005059.pub4.
[7] Guay J,Choi P,Suresh S,et al.Neuraxial blockade for the prevention of postoperative mortality and major morbidity:an overview of Cochrane systematic reviews[J].Cochrane Database Syst Rev,2014, (1):Cd010108. DOI:10.1002/14651858.CD010108.pub2.
[8] Hausman MS Jr,Jewell ES,Engoren M.Regional versus general anesthesia in surgical patients with chronic obstructive pulmonary disease:does avoiding general anesthesia reduce the risk of postoperative complications[J]?Anesth Analg,2015,120(6):1405 -1412.DOI:10.1213/ane.0000000000000574.
[9] Svircevic V,Passier MM,Nierich AP,et al.Epidural analgesia for cardiac surgery[J].Cochrane Database Syst Rev,2013,6):Cd006715.DOI:10.1002/14651858.CD006715.pub2.
[10] Steinthorsdottir KJ,Wildgaard L,Hansen HJ,et al.Regional analgesia for video-assisted thoracic surgery: a systematic review[J].Eur J Cardiothorac Surg,2014,45(6):959 - 966.DOI:10.1093/ejcts/ezt525.
[11] Scott WJ,Allen MS,Darling G,et al.Video-assisted thoracic surgery versus open lobectomy for lung cancer:a secondary analysis of data from the American College of Surgeons Oncology Group Z0030 randomized clinical trial[J].J Thorac Cardiovasc Surg,2010,139(4):976 -981;discussion 981 -973.DOI:10.1016/j.jtcvs.2009.11.059.
[12] Yan TD,Black D,Bannon PG,et al.Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of video-assisted thoracic surgery lobectomy for early-stage non-small-cell lung cancer[J].J Clin Oncol,2009,27(15):2553 -2562.DOI:10.1200/jco.2008.18.2733.
[13] Block BM,Liu SS,Rowlingson AJ,et al.Efficacy of postoperative epidural analgesia:a meta-analysis[J].JAMA,2003,290(18):2455 -2463.DOI:10.1001/jama.290.18.2455.
[14] Bauer C,Hentz JG,Ducrocq X,et al.Lung function after lobectomy:a randomized,double-blinded trial comparing thoracic epiduralropivacaine/sufentaniland intravenousmorphinefor patient-controlled analgesia[J].Anesth Analg,2007,105(1):238 -244.DOI:10.1213/01.ane.0000266441.58308.42.
[15] Yeager MP,Glass DD,Neff RK,et al.Epidural anesthesia and analgesia in high-risk surgical patients[J].Anesthesiology,1987,66(6):729-736.
[16] Kaya FN,Turker G,Mogol EB,et al.Thoracic paravertebral block for video-assisted thoracoscopic surgery:single injection versus multiple injections[J].J Cardiothorac Vasc Anesth,2012,26(1):90 -94.DOI:10.1053/j.jvca.2011.09.008.
[17] Hill SE,Keller RA,Stafford-Smith M,et al.Efficacy of singledose,multilevel paravertebral nerve blockade for analgesia after thoracoscopic procedures[J].Anesthesiology,2006,104(5):1047-1053.
[18] Yoshioka M,Mori T,Kobayashi H,et al.The efficacy of epidural analgesia after video-assisted thoracoscopic surgery:a randomized control study[J].Ann Thorac Cardiovasc Surg,2006,12(5):313-318.
[19] Yie JC,Yang JT,Wu CY,et al.Patient-controlled analgesia(PCA)following video-assisted thoracoscopic lobectomy:comparison of epidural PCA and intravenous PCA[J].Acta Anaesthesiol Taiwan,2012,50(3):92 -95.DOI:10.1016/j.aat.2012.08.004.
[20] Frendl G,Sodickson AC,Chung MK,et al.2014 AATS guidelines for the prevention and management of perioperative atrial fibrillation and flutter for thoracic surgical procedures[J].J Thorac Cardiovasc Surg,2014,148(3):e153-e193.DOI:10.1016/j.jtcvs.2014.06.036.
[21] Mckenna RJ Jr,Houck W,Fuller CB.Video-assisted thoracic surgery lobectomy:experience with 1100 cases[J].Ann Thorac Surg,2006,81(2):421-425;discussion 425-426.DOI:10.1016/j.athoracsur.2005.07.078.
[22] Paul S,Altorki NK,Sheng S,et al.Thoracoscopic lobectomy is associated with lower morbidity than open lobectomy:a propensitymatched analysis from the STS database[J].J Thorac Cardiovasc Surg,2010,139(2):366 -378.DOI:10.1016/j.jtcvs.2009.08.026.
[23] Bakhtiary F,Therapidis P,Dzemali O,et al.Impact of high thoracic epidural anesthesia on incidence of perioperative atrial fibrillation in off-pump coronary bypass grafting:a prospective randomized study[J].J Thorac Cardiovasc Surg,2007,134(2):460 -464.DOI:10.1016/j.jtcvs.2007.03.043.
[24] Lee SH,Ahn HJ,Yeon SM,et al.Potentially modifiable risk factors for atrial fibrillation following lung resection surgery:a retrospective cohort study[J].Anaesthesia,2016,71(12):1424 -1430.DOI:10.1111/anae.13644.
[25] Komatsu R,Makarova N,Dalton JE,et al.Association of thoracic epidural analgesia with risk of atrial arrhythmias after pulmonary resection:a retrospective cohort study[J].J Anesth,2015,29(1):47 -55.DOI:10.1007/s00540-014-1865-z.
[26]职爱丽.老年股骨颈骨折患者手术硬膜外麻醉与蛛网膜下腔麻醉对血压影响的比较[J].中华老年多器官疾病杂志,2011,10(3):273 - 274.DOI:10.3969/j.issn.1671-5403.2011.03.024.Zhi AL.The comparison of the effect on blood pressure between epidural anesthesia and spinal anesthesia in the elderly patients with femoral neck fracture after surgery[J].Chin J Mult Organ Dis Elderly,2011,10(3):273 - 274.DOI:10.3969/j.issn.1671-5403.2011.03.024.

