创伤后应激障碍生物学基础及治疗研究进展
李硕硕,刘谦东,袁增强
(1.中国科学院大学生物物理研究所脑与认知国家重点实验室,北京 100101;2.山东省日照市人民医院急诊科,山东日照 276800;3.军事医学研究院军事认知与脑科学研究所,北京 100850)
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指在经历重大创伤事件如战争、重大灾害(地震、交通事故等)或性侵害之后所表现出的慢性精神疾病。PTSD的症状包括噩梦、失眠、闪回,以及对创伤事件相关人物、场所和情景的逃避,过度警觉及负向认知情绪变化。2014年,世界精神卫生调查显示,12个月内全球PTSD患病率平均为1.1%,但实际终身患病率远高于此。PTSD可发生于任何年龄段,症状出现一般在经历事件后3个月内,但也有延迟数年出现〔精神疾病诊断与统计手册第5版(Diagnostic and Statistical Manual of Mental Disorders Fifth Edition,DSM5)中将延迟发生(delay onset)改为延迟出现(delay expression)〕,症状典型符合诊断标准。PTSD的主要症状可能会随时间发生变化,生活压力或新的外伤刺激都会对PTSD症状的重现及强度产生影响。老年个体健康水平、认知功能的下降和社会孤立会加重PTSD症状[1]。
在诸多PTSD风险因素中,性别、环境和基因因素对PTSD的发生发展影响较大。根据2004年世界卫生组织调查报告,PTSD女性终身患病率(9.7%)明显高于男性(3.6%),这可能与女性受到性侵害和暴力的概率显著高于男性相关。2016年,美国一项对于患有PTSD士兵的研究表明,PTSD症状表现具有性别差异[2]。环境因素中,战争和自然灾害是导致PTSD患病率显著升高的2种诱因。1988年,对美国越战退伍军人的调查表明,在1200例退伍老兵中,预计PTSD终身患病率为30.9%,正在经受PTSD折磨的有15.2%。2006年,美国的另一项研究对此数据重新分析指出,PTSD终身患病率为18.7%,在战后11~12年中有9.1%老兵患有PTSD[3]。2008年汶川地震的发生导致该地区PTSD高发,震后1年,青少年PTSD发病率为19.2%,18个月依然高达7.5%[4],远高于正常人群。基因突变会使PTSD患病风险增加,目前已报道C反应蛋白(C-reactive protein,CRP)和编码FK506结合蛋白5(FK506 binding protein 5,FKBP5)的单核苷酸多态性与PTSD症状显著相关[5-6]。另外,研究表明药物滥用和酗酒常与PTSD共发[7]。从生理层面到精神层面,从分子到大脑,多种因素与PTSD的发病密切相关,多种发病因素为进一步认识PTSD提供了更多线索,也为PTSD的治疗带来巨大挑战。本文对PTSD患者中的内分泌紊乱、免疫失调和神经环路基础改变进行详细阐述,同时对临床治疗及在研新药作简要概述,为进一步揭示PTSD的病理机制及治疗提供理论依据。
1 创伤后应激障碍的病理基础
1.1 下丘脑-垂体-肾上腺(hypothalamic-pituitaryadrenal,HPA)轴紊乱
HPA轴是人体主要的内分泌调节系统,在压力应激、能量代谢、免疫反应中都发挥重要作用。在正常应激反应中,下丘脑感受到外界刺激活动增强,分泌促肾上腺皮质激素释放因子(corticotrophin releasing factor,CRF)刺激腺垂体分泌更多的促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)调控肾上腺等靶器官,从而使肾上腺分泌的皮质醇和肾上腺激素等压力激素水平增加。压力激素可负反馈调控HPA轴活动。ACTH和皮质醇都能通过负反馈调节抑制下丘脑和腺垂体活动,避免产生过多的压力激素。PTSD患者HPA轴紊乱,表现为过多的CRF和低水平的皮质醇(图1)。皮质醇是调节应激反应的重要物质,在应激条件下对多个组织或器官发挥调节作用,从而增强机体对外界刺激的抵抗力和适应能力。临床研究发现,PTSD患者体内CRF水平增高,但皮质醇水平下降,表明PTSD患者HPA轴调控的神经内分泌网络紊乱。皮质醇水平的降低会引起中枢神经系统的应激失调,导致CRF及肾上腺素通路持续激活,从而产生PTSD关键症状,如易激惹、过度的恐惧反应、对恐怖事件相关情景事物过度敏感和闪回等。低水平皮质醇能使交感神经活动增加,促进学习,使得PTSD患者对创伤事件的记忆增强[8]。
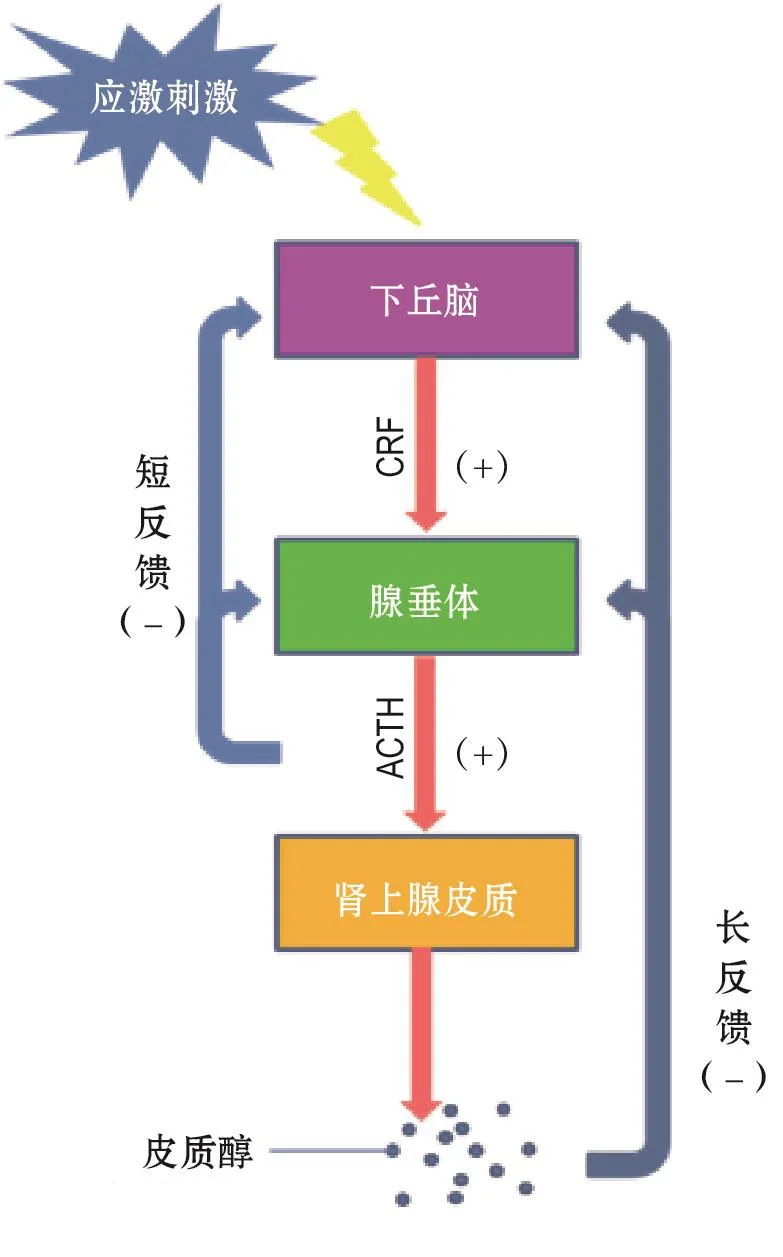
图1 应激条件下皮质醇的调节示意图.CRF:促肾上腺皮质激素释放因子;ACTH:促肾上腺皮质激素.
皮质醇可透过细胞膜,通过与糖皮质激素受体(glucocorticoid receptor,GR)结合发挥作用。GR在脑中分布广泛,其中海马表达量较高,而海马是受HPA轴负反馈调控的主要脑区。地塞米松实验认为,皮质醇激素的下调是由于HPA轴负反馈增强导致[9]。有文献报道,PTSD患者不仅在杏仁核、海马和前额叶GR表达异常,GR对皮质醇的亲和力也有增强[10]。PTSD患者脑中GR表达的变化引起HPA轴功能调节紊乱,可能是PTSD发病的因素之一[11-12]。FKBP5基因多样性与PTSD及其他压力应激障碍发病风险增加相关。FKBP5是一个重要的GR复合体功能调控蛋白,同时还是细胞内超短负反馈环的一部分,能够调控GR的活性。通过对1585名美国退伍军人的研究发现,常见的4种FKBP5单核苷酸(rs9296158,rs3800373,rs1360780和rs947008)突变与FKBP5蛋白水平升高相关,从而导致了GR对皮质醇的耐受和HPA轴负反馈通路异常。同时作者还指出FKBP5的单核苷酸多态性(single nucleotide polymorphism,SNP)可能与压力引起的皮质醇水平升高且不能快速恢复有关,持续高水平的皮质醇将潜在增加PTSD的发病风险[13]。FKBP5的单核苷酸多态性与童年遭受虐待的成年PTSD患者症状的严重程度密切相关[14]。
1.2 神经炎症与免疫系统失调
PTSD患者往往主述自身健康水平下降,如罹患心血管、呼吸和消化系统疾病,以及炎症和自身免疫病等[15-16]。研究表明,PTSD患者免疫系统功能发生明显改变,炎症反应增强。Bam等[17]从PTSD患者外周血中提取总RNA进行转录组测序,并对变化基因进行功能分析显示,PTSD患者炎症相关基因表达异常,免疫网络失调。2015年,美国一项针对666 269名伊拉克战争参战士兵的研究发现,与健康对照者相比,PTSD患者免疫性疾病发病风险大幅度增加,且不存在性别差异[18]。
众多研究认为,应激条件下神经解剖和神经内分泌的改变会使免疫系统失调,增加了对自身免疫或炎症疾病的易感性,并加速其病程发展,从而加重患者的疾病负担。在正常压力条件下,HPA轴可和免疫系统相互调控维持稳态,肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白介细胞素-6(interleukin-6,IL-6)刺激HPA轴产生更多的皮质醇,皮质醇可负反馈地调节HPA轴避免过多的炎症反应。在长期或过强的压力条件下及PTSD患者中,皮质醇对HPA轴负反馈调控途径不足以抑制炎症,使其保持在正常水平。免疫细胞不仅可通过释放炎症因子调控神经可塑性变化,从而加强记忆形成和巩固;还可通过炎症因子调控神经内分泌系统,从而影响神经疾病的发生发展进程。小胶质细胞是脑内维持稳态的一类重要细胞,对于中枢神经系统出现的微小病理改变非常敏感,能有效地清除斑块、损伤,甚至不必要的神经元和突触。有报道提出,小胶质细胞在个体接受外界压力刺激或危险信号时被激活且数量增多,而后在长期压力过程中,小胶质细胞数量下降至低于正常水平[19]。对于多个研究的元分析发现,在PTSD患者血清中,炎症因子TNF-α,IL-1β,IL-6和干扰素γ(interferon γ,IFN-γ)均高于健康对照组。作者认为慢性低水平炎症可能是PTSD治疗的一个分子标志[20]。另有文章认为,血浆中CRP的浓度可能与PTSD的发展相关[21],在再次创伤引起更多的细胞因子产生,这与再次创伤时PTSD症状加剧相关。这些现象说明炎症反应的发生不仅使得个体更易于发展成PTSD,也可能是个体对压力敏感的生物学基础[22]。长期暴露于慢性炎症条件下,小鼠会呈现出抑郁样表现[23]。在慢性压力条件下,小胶质细胞的激活增加了对突触的修剪和重塑,神经元树突棘数量下降,导致小鼠焦虑、抑郁样表现[24]。在对于PTSD患者免疫细胞及免疫因子的研究中发现,Th1细胞与血浆中IFNγ水平均上调,且具有相关性[25],Treg的表型发生改变[26]。总之,免疫系统稳态失衡可能参与PTSD的发病进程,对于PTSD患者免疫系统的研究可为临床诊治提供新的策略。
1.3 神经结构和环路改变
神经影像学研究发现,PTSD患者脑结构发生改变,海马、前额叶皮质(prefrontal cortex,PFC)和前扣带回体积缩小,大脑白质发生非特异性损害。功能性磁共振研究表明,在接受负向刺激时,PTSD患者杏仁核和前扣带回皮质过度活跃[27]。杏仁核一直以来被认为在恐惧记忆的习得和表现中发挥至关重要的作用[28-29],且杏仁核区的活动受到皮质的调控。在条件恐惧的情况下,杏仁核中的中央杏仁核(central amygdala,CeA)区发生神经可塑性的改变,使得恐怖记忆得以储存[30]。在PTSD患者中,杏仁核反应过度,造成加重的恐惧反应和持续的创伤记忆。在恐惧反应中,前额叶皮质和海马与杏仁核有着紧密联系。海马是参与学习记忆的主要脑区,在恐惧的消除和调控压力状态下神经内分泌的过程中发挥重要作用,海马功能失调导致患者记忆缺失和信息处理受损。PFC是情绪调控的主要脑区,光遗传学结合神经成像手段表明,PFC中的缘前皮质(prelimbic cortex,PL)区能整合来自基底外侧杏仁核(basolateral amygdala,BLA)区和腹侧海马(ventral hippocampus,vHPC)区的信息,调控恐惧反应[31]。PFC参与PTSD患者的情绪调控,且在PTSD患者中呈现活度下降,灰质密度降低。在危险信号或压力刺激下,杏仁核脑区过度兴奋,视觉皮质兴奋,同时PFC活度下降,语言中枢布洛卡区出现空白。前额叶对杏仁核的抑制作用下调。腹侧PFC和前扣带回受到抑制,不仅使恐惧记忆增强,同时也损坏情绪调控环路,临床表现为恐惧记忆再现、愤怒和愧疚等应激反应。情绪环路调控障碍除上述失调的表现以外,在一些人群中表现为过强的调节。在接收到外界信号刺激时,腹侧PFC活动增强,从而能增加对杏仁核的抑制,使杏仁核活度下降,产生情绪调节过强,如麻木、痛觉缺失和现实感丧失等行为表现(图2)。近来,科学家发现外侧缰核(lateral habenula,LHb)区和腹侧被盖区(ventral tegmental area,VTA)也参与压力应激反应调控。PTSD模型小鼠LHb脑区神经元LTP增强,同时记忆相关的分子水平增加[32]。PTSD患者杏仁核神经活度增强,而VTA区活度下降[33]。PTSD模型大鼠VTA区神经元发生长期的生理性变化,从而加重了PTSD的症状[34]。不同的症状表现及环路投射更能说明PTSD的病症是动态变化的系统紊乱疾病,其调控机制尚不清楚,这也是进一步揭示其病理机制和治疗的主要障碍。
2 PTSD的治疗方式及效果
对PTSD患者的治疗有多种方法,目前临床多采用心理治疗与药物治疗相结合,以药物治疗为主,同时辅以心理治疗[36]。近年来物理治疗在PTSD患者上也有获益,但还处于试验阶段,到临床应用还需要进一步的探索。
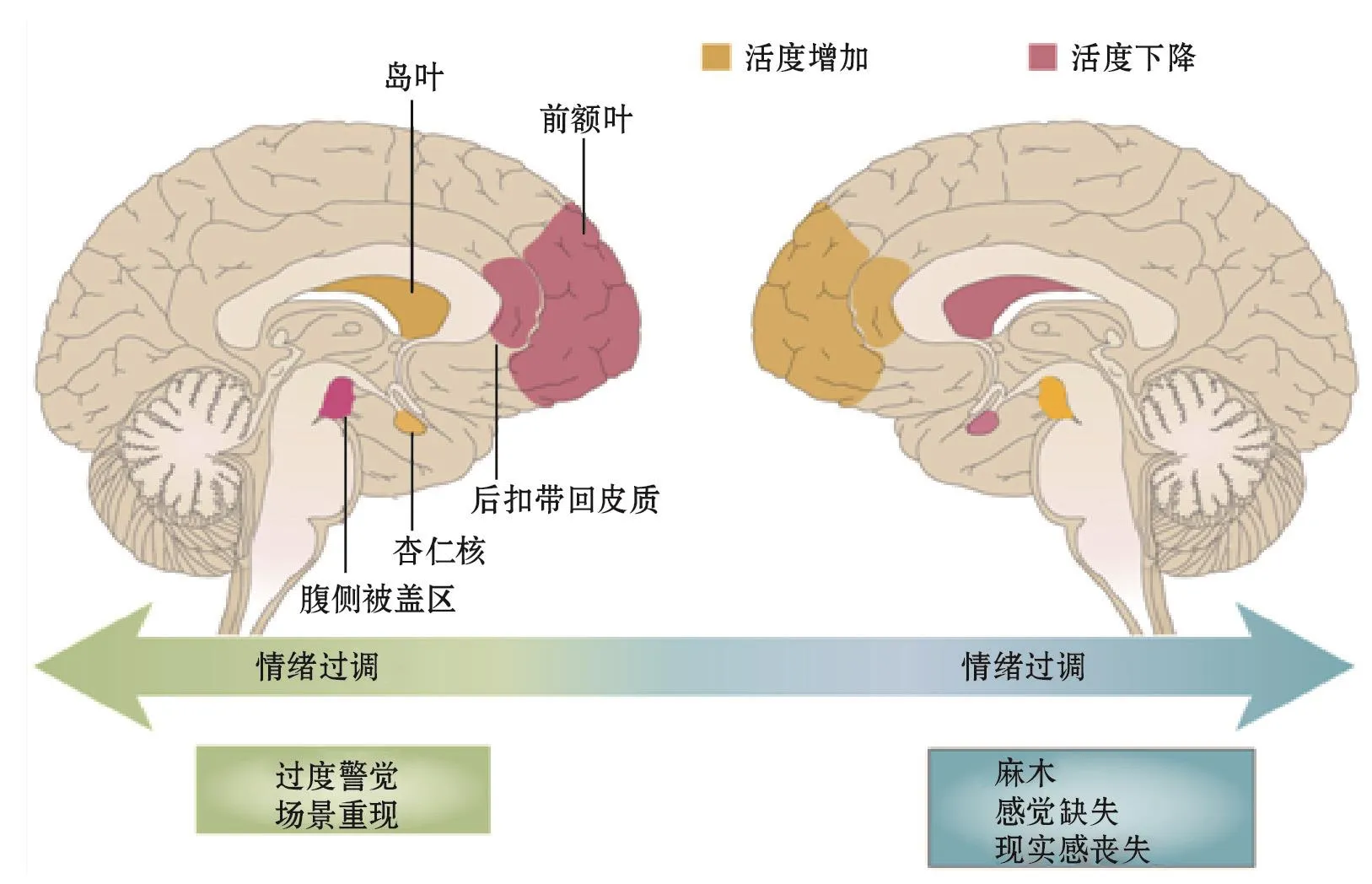
图2 PTSD患者脑中情绪调控障碍示意图[35].
2.1 药物治疗
2.1.1 抗抑郁药
目前获美国FDA批准用于临床PTSD患者治疗的药物只有舍曲林(sertraline)和帕罗西汀(paroxetine),它们都是选择性5-羟色胺重摄取抑制剂(selective serotonin reuptake inhibitor,SSRI),可显著改善患者的焦虑、抑郁样行为,是治疗PTSD的首选药物。在2014年进行的一项随机双盲测试中,从70名伊朗退伍军人PTSD患者中随机选取35名接受舍曲林治疗10周,剂量为每日50~200 mg,另35名给予安慰剂,通过临床总体印象严重度量表(Clinical Global Impression Scale-severity,CGI-S)和事件影响修正量表(Impact of Event Scale-Revised,IES-R)分析表明,服用舍曲林可显著改善PTSD患者的症状,作者认为舍曲林是一种安全有效的治疗药物[37]。此外多个研究报道,帕罗西汀无论是对PTSD患者还是模型动物都有较好的治疗效果[38-39]。基于PTSD患者伴随焦虑、抑郁样行为表现,很多抗焦虑、抑郁的三环类药物也被尝试在临床应用,但由于其副作用较大,患者更易于中途停止治疗[40]。
2.1.2 抗惊厥药
文献报道,使用拉莫三嗪(lamotrigine)可减轻治疗抵抗性PTSD患者的攻击性或攻击性相关行为[41]。在2014年的另一项研究中,将拉莫三嗪和加巴喷丁(gabapentin)联用治疗PTSD,发现抗惊厥药物可明显改善PTSD患者的闪回和噩梦症状[42]。但这些研究患者例数较少,还需要进一步临床试验。
2.1.3 其他药物
基于HPA轴紊乱,研究者设计的药物〔如米非司酮(mifepristone)和氢化可的松〕也取得了明显的改善效果,但它们还需要大量的临床试验[43]。给予PTSD患者去甲肾上腺素受体拮抗剂进行治疗,能减轻杏仁核过度活动引起的创伤记忆增强,但并不能增强PFC对杏仁核的抑制效应[44]。谷氨酸是中枢神经系统重要的兴奋性神经递质,研究表明,PTSD患者脑内谷氨酸水平的升高对于创伤记忆的巩固与增强具有重要作用[45]。以谷氨酸受体为靶点的在研药物在治疗PTSD中显示有效,但还需要更多的研究证明[46]。目前临床也在尝试将≥2种药物联合用于PTSD治疗。
目前技术手段尚不能充分揭示人脑的结构和功能,PTSD的药物治疗也仅限于针对其发生的生物学变化,而不能有效地根治病因,治疗PTSD的药物发展面临很多挑战。
2.2 物理疗法
2.2.1 经颅磁刺激(transcranial magnetic stimulation,TMS)
TMS作为一种非侵入性的大脑刺激过程,通过给予特定顺序和频率的脉冲可改变神经元的电活动。因其非侵入性和对目标脑区的精确刺激而被认为是一种可替代的治疗方法[47]。根据对多个试验预后效果评价和比较,TMS被认为是一种新的科学的治疗方法[48]。但目前该方法还存在很多问题,如设备的参数在众多研究中不尽一致、治疗机制尚不清楚等。现认为有效的目标脑区主要集中在PFC,但也有研究人员认为,该法的有益效果是由于影响了其他情绪调控脑区产生的。这种治疗方法还不够成熟完善,还需进一步探索和临床验证[49-50]。
2.2.2 深部脑刺激(deep brain stimulation,DBS)
文献报道,靶向PTSD模型大鼠杏仁核区的DBS能减轻焦虑样行为和电击引起的过度警觉,且效果比帕罗西汀的疗效更为显著[51],目前认为DBS的作用机制是减轻条件恐惧引起的神经可塑性改变[52],从而减轻恐惧记忆形成。DBS有较好发展前景,未来可使PTSD患者受益[53-54]。
2.3 心理疗法
心理疗法在PTSD的治疗中早于药物治疗,目前很多形式的心理疗法在PTSD的治疗中被认为是有效的。心理治疗主要有针对行为疗法(聚焦创伤疗法,trauma-focused treatments)和非针对行为疗法(非聚焦创伤疗法,non-trauma-focused treatments),且根据多个研究结果的分析认为,针对行为疗法比非针对行为疗法更为有效[55]。
2.3.1 针对行为疗法
针对行为疗法主要有认知行为治疗(cognitive behavioral therapies,CBT)和眼动脱敏再加工(eye movement desensitization and reprocessing,EMDR)。CBT是通过行为矫正技术来改变患者不合理的认知观念,包括延长暴露治疗和焦虑管理训练。延长暴露治疗通过长时间将患者暴露在引起恐惧的线索或记忆中以达到脱敏,从而减少恐惧等负面情绪。CBT主要包括资料收集、呼吸训练、心理教育、在体暴露(in vivo exposure)和想象暴露[56]5个步骤,其对难民和寻求庇护者有较好的效果[57]。焦虑管理训练主要是通过教给患者处理不良情绪的技巧来改善患者对焦虑的应时能力,增加患者自信心和积极的生活态度。在EMDR治疗中,治疗师用双边刺激形式鼓励患者在回想起创伤事件时有相反的意念[58]。它主要是通过促进信息加工的过程,改变患者对创伤事件的认知和处理,帮助患者迅速降低焦虑,诱导积极情感,使患者能改善行为和人际关系。EMDR有暴露和认知的成分,比CBT疗效更佳[59]。
2.3.2 非针对行为疗法
非针对行为疗法包括支持治疗、人际关系治疗及非直接咨询,因其更易于坚持,对患者也有很大的帮助[60]。对PTSD患者的治疗,来自社会(尤其是家庭)的积极支持和配合也起到很关键的作用。
3 结语
对于PTSD的研究虽已取得了巨大进步,但其发生发展的病理生理学机制尚不清楚。目前研究认为,PTSD是一种由多系统紊乱而影响到中枢和外周对压力应激响应的疾病进程,临床治疗多为药物和心理疗法相结合,预后效果个体差异较大。脑解剖结构和神经环路的变化、免疫系统的改变、神经内分泌系统紊乱以及基因多态性都是PTSD发病的重要因素,但对于这些影响因素之间的内在联系还缺少深入的研究,如细菌脂多糖诱发的神经炎症存在明显的脑区特异性[61],在PTSD中神经炎症的发生是否具有脑区特异性?是否与恐惧反应的环路相关联?神经内分泌受神经环路的调控,同时也负反馈地影响神经可塑性,这些跨系统的信息交流也为药物发展提供了可能的靶点。全面具体的认识PTSD的生物学病理基础是研究的重要前提,个体化的治疗法案是其治疗的关键,其研究方向从单因素的分析向多系统之间交互调控的发展是必然趋势。
[1]Lohr JB,Palmer BW,Eidt CA,Aailaboyina S,Mausbach BT,Wolkowitz OM,et al.Is post-traumatic stress disorder associated with premature senescence? a review of the literature[J].Am J Geriatr Psychiatry,2015,23(7):709-725.
[2]Koo KH,Hebenstreit CL,Madden E,Maguen S.PTSD detection and symptom presentation:racial/ethnic Differences by gender among veterans with PTSD returning from Iraq and Afghanistan[J].J Affect Disord,2016,189:10-16.
[3]Dohrenwend BP,Turner JB,Turse NA,Adams BG,Koenen KC,Marshall R.The psychological risks of Vietnam for U.S.veterans:a revisit with new data and methods[J].Science,2006,313(5789):979-982.
[4]Geng FL,Fan F,Zhang L.Poor sleep quality associated with PTSD,anxiety,and depression among adolescents exposed to 2008 Wenchuan earthquake,China[J].Chin J Clin Psychol(中国临床心理学杂志),2012,20(2):172-175.
[5]Michopoulos V,Rothbaum AO,Jovanovic T,Almli LM,Bradley B,Rothbaum BO,et al.Association of CRP genetic variation and CRP level with elevated PTSD symptoms and physiological responses in a civilian population with high levels of trauma[J].Am J Psychiatry,2015,172(4):353-362.
[6]Watkins LE,Han S,Harpaz-Rotem I,Mota NP,Southwick SM,Krystal JH,et al.FKBP5 polymorphisms,childhood abuse,and PTSD symptoms:results from the national health and resilience in veteransstudy[J].Psychoneuroendocrinology,2016,69:98-105.
[7]Miller MW, Reardon AF,Wolf EJ,Prince LB,Hein CL.Alcohol and drug abuse among U.S.veterans:comparing associations with intimate partner substance abuse and veteran psychopathology[J].J Trauma Stress,2013,26(1):71-76.
[8]Yehuda R.Clinical relevance of biologic findings in PTSD[J].Psychiatr Q,2002,73(2):123-133.
[9]Bremner D,Vermetten E,Kelley ME.Cortisol,dehydroepiandrosterone,and estradiol measured over 24 hours in women with childhood sexual abuse-related posttraumatic stress disorder[J].J Nerv Ment Dis,2007,195(11):919-927.
[10]Liberzon I,López JF,Flagel SB,Vázquez DM,Young EA.Differential regulation of hippocampal glucocorticoid receptors mRNA and fast feedback:relevance to post-traumatic stress disorder[J].J Neuroendocrinol,1999,11(1):11-17.
[11]Zhang JH,Li M ,Shi YX,Han F.Expression of glucocorticoid receptors in medial prefrontal cortex is increased in posttraumatic stress disorder rats[J].Acta Anat Sin(解剖学报),2011,42(2):151-154.
[12]Liu NY,Han F,Du Z,Shi YX.Expression changes of glucocorticoid receptors in the central amygdaloid nucleus of PTSD-like rats[J].J China Med Univ(中国医科大学学报),2008,37(2):148-151.
[13]Binder EB.The role of FKBP5,a co-chaperone of the glucocorticoid receptor in the pathogenesis and therapy of affective and anxiety disorders[J].Psychoneuroendocrinology,2009,34(Suppl 1):S186-S195.
[14]Binder EB,Bradley RG,Liu W,Epstein MP,Deveau TC,Mercer KB,et al.Association of FKBP5 polymorphisms and childhood abuse with risk of posttraumatic stress disorder symptoms in adults[J].JAMA,2008,299(11):1291-1305.
[15]Boscarino JA.Posttraumatic stress disorder and physical illness:results from clinical and epidemiologic studies[J].Ann N Y Acad Sci,2004,1032:141-153.
[16]KubzanskyLD, KoenenKC.Isposttraumatic stress disorder related to development of heart disease?An update[J].Cleve Clin J Med,2009,76 (Suppl 2):S60-S65.
[17]Bam M,Yang X,Zumbrun EE,Zhong Y,Zhou J,Ginsberg JP,et al.Dysregulated immune system networks in war veterans with PTSD is an outcome of altered miRNA expression and DNA methylation[J].Sci Rep,2016,6:31209.
[18]O′Donovan A,Cohen BE,Seal KH,Bertenthal D,Margaretten M,Nishimi K,et al.Elevated risk for autoimmune disorders in Iraq and Afghanistan veterans with posttraumatic stress disorder[J].Biol Psychiatry,2015,77(4):365-374.
[19]Kreisel T,Frank MG,Licht T,Reshef R,Ben-Menachem-Zidon O, Baratta MV, et al.Dynamic microglial alterations underlie stress-induced depressive-like behavior and suppressed neurogenesis[J].Mol Psychiatry,2014,19(6):699-709.
[20]Passos IC,Vasconcelos-Moreno MP,Costa LG,Kunz M,Brietzke E,Quevedo J,et al.Inflammatory markers in post-traumatic stress disorder:a systematic review,meta-analysis,and meta-regression[J].Lancet Psychiatry,2015,2(11):1002-1012.
[21]Eraly SA,Nievergelt CM,Maihofer AX,Barkauskas DA,Biswas N,Agorastos A,et al.Assessment of plasma C-reactive protein as a biomarker of posttraumatic stress disorder risk[J].JAMA Psychiatry,2014,71(4):423-431.
[22]Neigh GN,Ali FF.Co-morbidity of PTSD and immune system dysfunction:opportunities for treatment[J].Curr Opin Pharmacol,2016,29:104-110.
[23]Mello BS,Monte AS,McIntyre RS,Soczynska JK,Custódio CS,Cordeiro RC,et al.Effects of doxycycline on depressive-like behavior in mice after lipopolysaccharide(LPS)administration[J].J Psychiatr Res,2013,47(10):1521-1529.
[24]Wohleb ES,Terwilliger R,Duman CH,Duman RS.Stress-induced neuronal colony stimulating factor 1 provokes microglia-mediated neuronal remodeling and depressive-like behavior[J].Biol Psychiatry,2018,83(1):38-49.
[25]Zhou J,Nagarkatti P,Zhong Y,Ginsberg JP,Singh NP,Zhang J,et al.Dysregulation in microRNA expression is associated with alterations in immune functions in combat veterans with post-traumatic stress disorder[J].PLoS One,2014,9(4):e94075.
[26]Jergovic′M,Bendelja K,Vidovi c′A,Savi c′A,Vojvoda V,Aberle N,et al.Patients with posttraumatic stress disorder exhibit an altered phenotype of regulatory T cells[J].Allergy Asthma Clin Immunol,2014,10(1):43.
[27]Hayes JP,Vanelzakker MB,Shin LM.Emotion and cognition interactions in PTSD:a review of neurocognitive and neuroimaging studies[J].Front Integr Neurosci,2012,6:89.
[28]LeDoux JE.Emotion circuits in the brain[J].Annu Rev Neurosci,2000,23:155-184.
[29]Ehrlich I,Humeau Y,Grenier F,Ciocchi S,Herry C,Lüthi A.Amygdala inhibitory circuits and the control of fear memory[J].Neuron,2009,62(6):757-771.
[30]Li H,Penzo MA,Taniguchi H,Kopec CD,Huang ZJ,Li B.Experience-dependent modification of a central amygdala fear circuit[J].Nat Neurosci,2013,16(3):332-339.
[31]Sotres-Bayon F,Sierra-Mercado D,Pardilla-Delgado E,Quirk GJ.Gating of fear in prelimbic cortex by hippocampal and amygdala inputs[J].Neuron,2012,76(4):804-812.
[32]Park H,Rhee J,Park K,Han JS,Malinow R,Chung C.Exposure to stressors facilitates longterm synaptic potentiation in the lateral habenula[J].J Neurosci,2017,37(25):6021-6030.
[33]Hughes KC,Shin LM.Functional neuroimaging studies of post-traumatic stress disorder[J].Expert Rev Neurother,2011,11(2):275-285.
[34]Corral-Frias NS,Lahood RP,Edelman-Vogelsang KE,French ED,Fellous JM.Involvement of the ventral tegmental area in a rodent model of post-traumatic stressdisorder[J].Neuropsychopharmacology,2013,38(2):350-363.
[35]Yehuda R,Hoge CW,McFarlane AC,Vermetten E,Lanius RA,Nievergelt CM,et al.Post-traumatic stress disorder[J].Nat Rev Dis Primers,2015,1:15057.
[36]Zhang DW,Gan JL.Progressing in PTSD pharmcological tharepy[J].J Clin Psychiatry(临床精神医学杂志),2010,20(1):66-67.
[37]Panahi Y,Moghaddam BR,Sahebkar A,Nazari MA,Beiraghdar F,Karami G,et al.A randomized,double-blind,placebo-controlled trial on the efficacy and tolerability of sertraline in Iranian veterans with post-traumatic stress disorder[J].Psychol Med,2011,41(10):2159-2166.
[38]Kucukalic′A,Bravo-Mehmedbasic′A,Dzubur-Kulenovic′A.Paroxetine in the treatment of post traumatic stress disorder:our experiences[J].Bosn J Basic Med Sci,2008,8(1):76-79.
[39]Bentefour Y,Bennis M,Garcia R,M'hamed SB.Effects of paroxetine on PTSD-like symptoms in mice[J].Psychopharmacology(Berl),2015,232(13):2303-2312.
[40]Albucher RC,Liberzon I.Psychopharmacological treatment in PTSD:a critical review[J].J Psychiatr Res,2002,36(6):355-367.
[41]Kozaric′-Kovacˇic′D,Eterovic′M.Lamotrigine abolished aggression in a patient with treatment-resistant posttraumatic stress disorder[J].Clin Neuropharmacol,2013,36(3):94-95.
[42]Kishimoto A,Goto Y,Hashimoto K.Post-traumatic stress disorder symptoms in a female patient following repeated teasing:treatment with gabapentin and lamotrigine and the possible role of sensitization[J].Clin Psychopharmacol Neurosci,2014,12(3):240-242.
[43]Golier JA,Caramanica K,Demaria R,Yehuda R.A pilot sudy of mifepristone in combat-related PTSD[J].Depress Res Treat,2012,2012:393251.
[44]McGhee LL,Maani CV,Garza TH,Desocio PA,Gaylord KM,Black IH.The effect of propranolol on posttraumatic stress disorder in burned service members[J].J Burn Care Res,2009,30(1):92-97.
[45]Reul JM,Nutt DJ.Glutamate and cortisol-a critical confluence in PTSD?[J].J Psychopharmacol,2008,22(5):469-472.
[46]Burgdorf J,Kroes RA,Zhang XL,Gross AL,Schmidt M,Weiss C,et al.Rapastinel(GLYX-13)has therapeuticpotentialforthe treatmentof post-traumatic stress disorder:characterization of a NMDA receptor-mediated metaplasticity process in the medial prefrontal cortex of rats[J].Behav Brain Res,2015,294:177-185.
[47]Wahbeh H,Senders A,Neuendorf R,Cayton J.Complementary and alternative medicine for posttraumatic stress disorder symptoms:a systematic review[J].J Evid Based Complementary Altern Med,2014,19(3):161-175.
[48]Clark C,Cole J,Winter C,Williams K,Grammer G.A review of transcranial magnetic stimulation as a treatment for post-traumatic stress disorder[J].Curr Psychiatry Rep,2015,17(10):83.
[49]Horvath JC, Perez JM,Forrow L,Fregni F,Pascual-Leone A.Transcranial magnetic stimulation:a historical evaluation and future prognosis of therapeutically relevant ethical concerns[J].J Med Ethics,2011,37(3):137-143.
[50]Karsen EF,Watts BV,Holtzheimer PE.Review of the effectiveness of transcranial magnetic stimulation for post-traumatic stress disorder[J].Brain Stimul,2014,7(2):151-157.
[51]Stidd DA,Vogelsang K,Krahl SE,Langevin JP,Fellous JM.Amygdala deep brain stimulation is superior to paroxetine treatment in a rat model of posttraumatic stress disorder[J].Brain Stimul,2013,6(6):837-844.
[52]Sui L,Huang S,Peng B,Ren J,Tian F,Wang Y.Deep brain stimulation of the amygdala alleviates fear conditioning-induced alterations in synaptic plasticity in the cortical-amygdala pathway and fear memory[J].J Neural Transm(Vienna),2014,121(7):773-782.
[53]Langevin JP,Koek RJ,Schwartz HN,Chen JWY,Sultzer DL,Mandelkern MA,et al.Deep brain stimulation of the basolateral amygdala for treatment-refractory posttraumatic stress disorder[J].Biol Psychiatry,2016,79(10):e82-e84.
[54]Koek RJ,Langevin JP,Krahl SE,Kosoyan HJ,Schwartz HN,Chen JW,et al.Deep brain stimulation of the basolateral amygdala for treatment-refractory combat post-traumatic stress disorder(PTSD):study protocol for a pilot randomized controlled trial with blinded,staggered onset of stimulation[J].Trials,2014,15:356.
[55]Bisson JI,Roberts NP,Andrew M,Cooper R,Lewis C.Psychological therapies for chronic posttraumatic stress disorder(PTSD) in adults[J].Cochrane Database Syst Rev,2013,(12):CD003388.
[56]Chen SL,Li LJ.Psychotherapy strategies of PTSD[J].J Clin Psychol Med(临床精神医学杂志),2005,15(3):180-181.
[57]Mørkved N,Hartmann K,Aarsheim LM,Holen D,Milde AM,Bomyea J,et al.A comparison of narrative exposure therapy and prolonged exposure therapy for PTSD[J].Clin Psychol Rev,2014,34(6):453-467.
[58]Leer A,Engelhard IM,Altink A,van den Hout MA.Eye movements during recall of aversive memory decreases conditioned fear[J].Behav Res Ther,2013,51(10):633-640.
[59]Seidler GH,Wagner FE.Comparing the efficacy of EMDR and trauma-focused cognitive-behavioral therapy in the treatment of PTSD:a meta-analytic study[J].Psychol Med,2006,36(11):1515-1522.
[60]Schottenbauer MA,Glass CR,Arnkoff DB,Gray SH.Contributions of psychodynamic approaches to treatment of PTSD and trauma:a review of the empirical treatment and psychopathology literature[J].Psychiatry,2008,71(1):13-34.
[61]Noh H,Jeon J,Seo H.Systemic injection of LPS induces region-specific neuroinflammation and mitochondrial dysfunction in normal mouse brain[J].Neurochem Int,2014,69:35-40.

