突触异常发育在孤独症谱系障碍发生机制中的研究进展
陈丽萍,吴海涛
(军事医学研究院军事认知与脑科学研究所,北京 100850)
孤独症谱系障碍(autism spectrum disorders,ASD)是一种绝大部分由遗传因子决定的神经发育性精神疾病。大多数ASD患者均在2~3岁前后被诊断出来,而2~3岁正是人大脑发育过程中突触形成和活性重塑的重要时期。通过对ASD患者进行磁共振成像(MRI)扫描研究发现,ASD患者存在大脑结构异常,在2~4岁时大脑的容量大小会出现一个高峰,随年龄的增长到青少年时期降低[1-2],并且在2~4岁前后ASD患儿大脑皮质会出现增厚症状[3]。突触是大脑的基本组成单元,是神经细胞之间进行通讯的基本单位,许多突触蛋白在此过程中发挥至关重要的生理功能。对突触进行不同类型的刺激可导致突触更易被激活或抑制,谓之突触可塑性(synaptic plasticity),这种可塑性也是大脑进行学习记忆和情感交流等认知功能的重要神经生物学基础。与ASD相关的致病基因虽目前尚未完全揭示,但在已鉴定出的关联基因中有一大类重要成员编码突触相关蛋白,从而在分子层面进一步揭示了突触发育和功能异常与ASD发生之间的密切关系。
已有研究结果表明,同ASD谱系障碍密切相关的常见单基因突变有脆性X复合体(fragile X syndrome,FXS)FMR1基因,结节性硬化综合征(tuberous sclerosis complex,TSC)TSC1和TSC2基因,多发性神经纤维瘤病NF1基因,天使综合征(angelman syndrome,AS)UBE3A基因,Rett综合征MECP2基因和染色体22q13.3缺失综合征SHANK3基因等。分别编码突触黏附蛋白神经配蛋白(neuroligins)和神经连接蛋白类(neurexins)的NLGN和NRXN基因突变也会导致ASD的发生。诱发形成ASD谱系障碍的相关基因虽目前尚不能被完全揭示,但在ASD患者中具有高频突变的基因大多数为突触功能相关关键调控分子,这为理解ASD谱系障碍及相关疾病发生的神经机制和药物研发提供了重要参考依据。
1 孤独症相关突触分子
1.1 神经连接蛋白与神经配蛋白
神经连接蛋白和神经配蛋白是富集于突触的细胞黏附分子,在哺乳动物体内存在3种编码神经连接蛋白的基因亚型,依次是Nrex1/2/3,每个基因可编码α与β 2种亚型的同源异构体[4]。神经配蛋白是神经连接蛋白的内源性配体,在人体内编码NLGN1/2/3/4共4个基因。通过单个位点可变剪接产生NLGN2/3/4,2个位点可变剪接产生NLGN1。
神经连接蛋白是存在于突触前膜的单次跨膜蛋白,可与突触后膜的单次跨膜黏附分子神经配蛋白相互作用。在突触前膜,神经连接蛋白可与钙/钙调蛋白依赖性丝氨酸蛋白激酶(calcium/calmodulindependent serine protein kinase,CASK)在胞内相互结合,而神经配蛋白则与突触后密度蛋白95(postsynaptic density protein 95,PSD95)在突触后膜的致密区相互结合[5]。不管是兴奋性突触还是抑制性突触,突触前后膜之间的相互作用在突触分化与成熟中都起着至关重要的作用[5-6]。NLGN基因突变可降低其在突触后膜致密区的聚集并降低其与神经连接蛋白结合的亲和力。在小鼠中,对神经连接蛋白与神经配蛋白2者中任一基因进行敲除均会导致突触传递功能缺陷。此外,许多实验均证实,神经配蛋白与神经连接蛋白之间相互作用在突触发育与递质释放中均发挥关键调控作用。
存在于X染色体上的NLGN3和NLGN4基因是第一批被鉴定出来的能引起ASD的突变基因。在一对同胞兄弟中,其中一个男孩NLGN3基因的一段高保守区域错义突变引起编码蛋白产物R451C突变,从而出现了ASD、严重智力缺陷和癫痫等症状;而其兄弟则患上了阿斯伯格综合征(Asperger syndrome)。而他们的母亲则是NLGN3突变携带者,却无任何临床症状,提示这是一种典型的X染色体相关的遗传模式[7]。NLGN4突变是在一个男孩ASD患儿身上发现的,NLGN4基因突变引起移码突变和编码蛋白的提前终止,其兄弟患上了阿斯伯格综合征,而母亲是一名健康的突变携带者[7]。其他有关NLGN4的移码突变是在一个存在与X染色体相关智力障碍患者的大家族成员和一对同胞兄弟中发现的。在这2兄弟中,一个表现出ASD和智力障碍等症状,另一个则出现多动症、认知障碍和Tourette综合征等症状[8-9]。由此可见,NLGN3和NLGN4基因突变可引起一系列社交和认知障碍,从而导致包括ASD及其他严重认知缺陷在内精神疾病的发生。
首次在ASD患者中鉴定出NRXN基因突变的现象是在2名自闭症患者中发现NRXN1基因及其所在染色体异常[10]。随后,人们在一名患有生理和认知缺陷以及ASD倾向的男孩身上发现NRXN1基因片段的缺失,这段基因片段能编码α启动子和外显子1~5区域,该片段的缺失导致了下游β启动子无法正常发挥功能[11]。2009年,一名具有ASD倾向,同时伴有严重智力障碍、呼吸过频和部分发育畸形的患者体内也检测出NRXN1基因出现缺失突变和翻译提前终止突变的混合型杂合突变[12]。此外,在精神分裂症患者中也存在一些NRXN1基因的缺失及重复突变。关于NRXN2基因,人们也在一名ASD患者及其患有语言迟缓症的父亲体内发现了NRXN2基因的一个移码突变[13]。这些珍贵的临床资料表明,NRXN基因与ASD、智力障碍以及精神分裂症等相关疾病均具有非常密切的联系。
1.2 Shank蛋白
Shank蛋白是位于突触后膜致密区的一大类突触后框架蛋白,其中包括与鸟苷酸激酶相关蛋白(PSD95结合蛋白或SAPAP)相互作用的Shank1/2/3、Homer、皮动蛋白结合蛋白以及生长抑素受体。Shank蛋白还可与突触后膜上的神经配蛋白产生直接或间接相互作用,与PSD95、SAPAP、谷氨酸受体以及细胞骨架形成一个巨大蛋白复合体。所有Shank蛋白都能在大脑中表达,尤其是在皮质和海马神经元中。但不同的SHANK基因在大脑不同区域的表达模式和表达量存在差别[14]。Shank蛋白可与突触后密度蛋白相互作用并稳定PDS-95/SAPAP/Shank/Homer复合体。另外,Shank蛋白可将肌醇三磷酸受体和纤丝状肌动蛋白募集到突触后膜,从而扩大和稳定树突棘末端,因此,Shank蛋白是参与调控突触棘形态的重要分子。
在小鼠海马神经元中过表达Shank1蛋白能引起树突棘增大和成熟度增加[15],而敲除Shank1则会出现树突棘变小、PSD变薄和突触传递降低。并且,Shank1缺失小鼠会呈现焦虑样行为,异常语境恐怖记忆以及在空间任务中长期停留行为的减少[16]。Shank3+/-杂合突变小鼠也可导致海马CA1区神经元基础水平突触传递和长时程增强(longterm potentiation,LTP)的降低。除了突触功能异常外,Shank3+/-杂合雄性小鼠识别雌性小鼠的社交能力也有所降低[17]。并且,在Shank3B-/-小鼠纹状体中,突触后膜上的改变还包括兴奋性突触传递的降低。Shank3+/-和Shank3B-/-2种模型小鼠的研究结果均表明,在Shank3突变小鼠中谷氨酸能信号和α-氨基-3-羟基-5-甲基-4-异噁唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid,AMPA)受体介导的突触传递出现了紊乱,增强AMPA传递可能会有助于Shank3单倍剂量不足而引发的相关疾病的治疗。最新研究表明,Shank3突变ASD模型小鼠中,纹状体D2型多棘神经元形态和功能改变对小鼠重复刻板行为有重要影响[18]。
Phelan-McDermid综合征(PMS)是一种由22号染色体q13位出现一个微小的基因缺失引起的新生儿重症肌无力,体态异常以及全身发育迟缓的疾病。因此,人们希望从22号染色体上鉴定出PMS致病基因。后来发现,具有SH3和锚蛋白结构域的SHANK3基因位于此位置上,且具有许多神经系统的表现。2001年,Bonaglia[19]首次在一名儿童患者鉴定出SHANK3基因发生易位突变。随后,研究者通过从60多名患者提取DNA进行分析鉴定发现,SHANK3基因的杂合性丢失是导致神经系统表型的罪魁祸首。研究者在PMS疾病研究中发现,促使SHANK3基因在其他神经精神疾病致病中起重要作用,其中就包括ASD。2007年,在患有ASD和智力障碍的患者体内均发现了SHANK3基因缺失引起的蛋白截断突变[20-21]。此外,在ASD患者中还发现了SHANK2基因的缺失和终止突变[22],从而进一步证实了SHANK家族基因突变在ASD发生过程中的重要意义和价值。
1.3 UBE3A
包括泛素化在内的蛋白质翻译后修饰是一类参与调控突触许多生理过程的重要机制。其中,UBE3A基因编码一种E3泛素连接酶,能将泛素链连接到靶蛋白并标记上,使得靶蛋白能够顺利地被蛋白酶体系统识别降解。研究发现,敲除UBE3A基因可引起小鼠大脑海马神经元出现严重LTP紊乱和学习记忆能力的降低[23]。此外,UBE3A还能够调控皮质可塑性,其中包括参与调控抑制性中间神经元突触前膜囊泡循环以及兴奋性谷氨酸能神经递质的释放等[24-26]。
由于UBE3A可直接通过调控蛋白泛素化修饰调节突触中靶蛋白的含量,因此UBE3A水平降低引起的突触功能和可塑性异常可能与其靶蛋白在突触中的异常堆积有关。在UBE3A众多靶蛋白中,活性调控细胞骨架相关蛋白(cytoskeletonassociated protein,Arc)是其中一个关键靶分子[27]。Arc可通过调控AMPA受体内吞从而对突触可塑性发挥重要调节作用。通过学习记忆等行为经历的获得可提高神经活性和UBE3A表达水平,并可通过UBE3A泛素化降解Arc的方式发挥负反馈调节作用。UBE3A缺失可导致Arc表达上升,从而诱发AMPA受体内吞和兴奋性突触传递异常[28]。在母系UBE3A缺失的小鼠中,Arc表达量会随着突触活性的提高而增加;在结构水平上,UBE3A缺失可导致树突棘发育紊乱,包括树突棘的形态、数量以及长度[29]。通过对锥体神经元高度极化的树突形态进行深入研究证实,UBE3A能够调控树突的生长和极性。此外,在UBE3A突变小鼠中,人们还发现钙调素依赖蛋白激酶Ⅱ(Ca/calmodulin-dependent protein kinaseⅡ,αCaMKⅡ)中一个抑制性磷酸化位点突变能够挽救UBE3A突变引起的LTP和学习记忆缺陷[30]。
最近一项关于UBE3A杂合突变小鼠诱发AS的小鼠模型研究显示,UBE3A杂合突变小鼠海马区中代谢型谷氨酸受体5(metabotropic glutamate receptor,mGluR5)介导的长时程抑制(long-term depression,LTD)会出现选择性扩增[31]。但这种改变并不是由于下游信号通路改变或者Arc表达水平升高引起的,而是与突触后膜蛋白Homer1a亚型表达量降低和mGluR5受体与Homer1b/c亚型结合增加密切相关。mGluR5介导的LTD过度增强可以被mGluR5拮抗剂所纠正。此外,在UBE3A突变的AS模型小鼠中,海马锥体神经元中钠/钾-三磷酸腺苷酶 α1亚 基(α1-sodium-potassium ATPase,α1-Na+/K+-ATPase)和轴突起始段蛋白表达量增加[32]。这些改变可能会影响神经元兴奋性,并改变大脑海马区依赖的学习记忆能力,通过对神经元的α1-Na+/K+-ATPase进行遗传敲减能够预防AS小鼠中神经元轴突起始段异常,改善突触LTP和海马相关的学习记忆缺陷。
1.4 脆性X智力低下蛋白
脆性X智力低下蛋白(fragile X mental retardation protein,FMRP)是一类在神经元中高表达,并且能够在神经元胞体和树突中与mRNAs相互结合的蛋白。目前,FMRP功能研究有一个比较引人注目的发现,就是FMRP在突触后膜能够选择性地与mRNA结合,从而负调控一系列树突mRNA的转录[33]。FMRP的靶蛋白包含了突触传递中的大量蛋白,且其中许多蛋白是ASD研究中的候选靶基因产物。FMRP蛋白缺失可引起树突蛋白的过量合成。另外,FMRP还能通过调控突触前膜神经递质释放来控制海马锥体神经元动作电位的持续时间[34]。因此,FMRP缺失能够导致动作电位持续时间的延长,增强突触前膜钙离子内流和重复激活状态下神经递质的释放。与突触后膜不同,这种突触前的作用机制并不依赖于蛋白翻译,而是由大电导钙离子激活钾离子通道所介导的[34]。
FMRP在突触中的具体作用机制目前认为主要与mGluR介导的信号有关。FMRP在突触接受刺激后通过抑制突触后膜mRNA蛋白翻译从而对mGluR依赖的LTD发挥调控[35-36]。mGluR介导的LTD失调是引发FXS患者中许多神经系统病症的原因之一,在FMR1敲除小鼠中抑制mGluR5能够部分恢复突触中蛋白合成水平[37-38]。在一种ASD表型的BTBR模型小鼠中,部分抑制mGluR5亦能显著改善其异常行为症状[39]。FMRP的缺失除了会影响mGluR相关的突触可塑性以外,还会影响多巴能和γ-氨基丁酸(gamma-aminobutyric acid,GABA)能信号。在FMR1基因敲除小鼠和FXS模型果蝇中均出现了GABA-A受体表达量的显著降低[40]。此外,在FMR1基因缺陷小鼠中,多巴胺依赖的LTP减弱,给予多巴胺拮抗剂可以显著提高FXS患者的活力和运动症状[41-42]。
在FMR1缺失小鼠及来源于FXS患者的成纤维细胞中,哺乳动物雷帕霉素靶蛋白(mammalian target of Rapamycin,mTOR)信号通路显著激活,mTOR激酶活性及其下游靶蛋白S6激酶和4E-BP磷酸化水平均显著提高,提示FMRP可负调控mTOR信号通路活化[43]。在FMR1缺失小鼠中,胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号增加还会直接影响蛋白的翻译速率。并且,羟甲基戊二酰辅酶A还原酶(hydroxy methylglutaryl coenzyme A reductase inhibitor,HMG-CoA)抑制剂和ERK1/2信号通路的阻断剂洛伐他汀(lovastatin)能减轻该模型小鼠的许多缺陷表型[44]。糖原合酶激酶 3β(glycogen synthase kinase 3β,GSK3β)是FMRP另一个靶蛋白,其活性在FXS果蝇和小鼠中显著增加,采用GSK3β抑制剂锂处理FXS果蝇和小鼠可显著改善其分子和行为学表型。在另一项开放式研究中,也证实了锂可适度提高和改善FXS患者的异常行为问题[45]。上述研究结果表明,能够作用于mTOR或ERK信号通路及其下游靶蛋白(如磷脂酰肌醇-3-羟激酶)的抑制剂可作为纠正FXS患者蛋白合成和突触相关缺陷的潜在候选目标。
1.5 TSC1和TSC2
蛋白harmarin(TSC1)和tuberin(TSC2)分别由TSC1和TSC2基因编码,TSC1与TSC2蛋白可与TBC1结构域家族成员7(TBC1 domain family member 7,TBC1D7)蛋白三者相互结合形成蛋白复合物。这种蛋白复合物作为小G蛋白RheB(在脑中富集的Ras同源物)的GTP酶激活蛋白,能响应细胞内多种信号。TSC1/2蛋白复合物对神经元树突棘生成和轴突生长非常重要,TSC1或TSC2缺失可导致树突棘结构和密度紊乱[46]以及轴突导向受损[47]。TSC2+/-杂合突变小鼠可出现mTOR信号通路过度激活和自噬障碍。此外,研究者从散发性ASD患者死后的大脑颞叶组织中发现树突棘密度增大和成熟缺陷,这可能与TSC-mTOR信号通路相关[48]。
TSC是由TSC1和TSC2基因突变引发的遗传性多系统神经皮肤综合征。在30%家族性遗传患者和15%散发性患者体内均发现TSC1基因的突变,而更高比例的家族性遗传患者和50%散发性患者体内则出现TSC2基因的突变。TSC患者中许多中枢神经系统症状的病理生理学机制正在逐渐被揭示,包括细胞增殖和迁移失调、轴突生长改变、突触生成和髓鞘化受损等,以及由此引发的中枢神经系统解剖结构的破坏和神经连接的改变等[49]。TSC转基因小鼠模型能很好地模拟ASD患者的核心症状,非常适合用来研究ASD大脑神经连接异常的机制。在小鼠小脑的浦肯野细胞中特异性地敲除TSC1或TSC2基因能引发小鼠出现社交障碍、刻板行为和异常发声等ASD样表型[50-51]。组成型的TSC1或TSC2杂合型基因敲除小鼠也会出现不同程度的认知和社交障碍[51-52]。
利用免疫抑制剂西罗莫司(雷帕霉素,sirolimus,Rapamycin)对TSC突变小鼠进行药物处理可减轻小鼠的一些行为学缺陷表型。西罗莫司是mTOR信号通路抑制剂。此外,对成年小鼠进行西罗莫司处理可纠正TSC突变小鼠中晚期LTP表型并改善其学习记忆缺陷[52]。这表明TSC患者中的一些突触和行为表型与FXS和Rett综合征相似,即都可能是由于持续性病理生理过程所引发,而不是发育过程中一个不可逆的突发事件导致的,这些病理生理学变化可望通过药物加以纠正。
1.6 甲基CpG结合蛋白2
甲基CpG结合蛋白2(methyl CpG binding protein 2,MECP2)是一种存在于细胞核内的甲基化胞嘧啶结合蛋白,属于甲基化CpG结合蛋白家族成员。MECP2基因位于X染色体q28上。研究表明,MECP2可通过与组蛋白去乙酰化酶(histone deacetylase,HDAC)复合物相互作用发挥转录抑制功能[53-54]。意外的是,某些基因转录在MECP2缺失条件下会被抑制,而在其激活条件下出现过表达,表明MECP2不是一种典型的转录抑制子。MECP2可结合到这些靶基因的启动子区域,这些被MECP2正调控的基因中就包括关键的脑源性神经营养因子(brain derived neurotrophic factor,BDNF)等。除了与靶基因进行特异性结合外,染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)结果显示,MECP2在全基因组能广泛地与DNA 结合[55-56]。
MECP2在神经元表达水平很高,并且在动物出生后随神经元成熟蛋白水平会进一步增加。最近的研究结果显示,在神经胶质细胞中也有MECP2的表达。虽其在胶质细胞中的表达较神经元低,但MECP2在胶质细胞中的缺失可导致MECP2野生型或敲除型神经元树突形态发育异常,提示MECP2可通过胶质细胞对神经元发育间接发挥调控作用[57]。MECP2缺失的胶质细胞虽可能会引起或加重某些神经系统症状,但还有一些研究表明,在神经元中特异性地敲除MECP2足以引起突变小鼠神经系统的功能障碍。
位于X染色体上的MECP2基因突变是引发Rett综合征的主要病因[58]。绝大部分(99%)Rett综合征散发病例都有其相应的遗传基础,其中97%的典型病例都与MECP2基因的突变有关[59]。MECP2突变引发Rett综合征的发现揭示这个基因的突变可能导致神经系统功能障碍并出现精神疾病症状。除了突变外,MECP2基因的2倍或3倍扩增均能引起进行性神经综合征,这表明神经系统对MECP2蛋白表达水平的精准度非常敏感[60]。MECP2基因在Xq28片段上出现的2倍或3倍扩增可将多个不同基因共轭在一起,提示MECP2可能是调控ASD发生的关键致病分子[61]。MECP2基因异常扩增的男性患者通常出现张力减退和发育迟缓,早期出现ASD症状进一步发展为严重的运动和认知障碍、癫痫、震颤、Rett综合征样症状和过早死亡[62-63]。根据X染色体失活模式的不同,女性患者的临床症状主要包括焦虑、抑郁、广谱ASD表型以及Rett综合征等[63-64]。因此,MECP2的缺失突变或异常扩增2种不同变化所导致的神经精神系统障碍和异常表型为进一步探索MECP2的调控机制提供了巨大机遇和挑战。我国学者在构建MECP2基因非人灵长类动物模型方面取得一系列重要标志性成果,其中包括首次在世界上成功建立了MECP2转基因“ASD”食蟹猴[65],以及利用转录激活因子样效应物核酸酶(transcription activatorlike effector nucleases,TALEN)技术构建的食蟹猴Rett综合征动物模型[66]。这些成果为深入揭示MECP2基因致病机制以及干预治疗等提供了宝贵的研究对象。
1.7 其他突触相关蛋白
除上述提到的ASD相关突触分子外,高表达在突触位置的L型压力门控钙离子通道和钙黏蛋白(cadherin)功能异常也与ASD发生密切相关。患有心肌病的Timothy综合征患者存在L型钙离子通道蛋白G406R突变,此类患者会表现出部分典型的ASD症状[67]。L型钙离子通道也存在于神经元的树突棘和树突干上,能调控突触后膜的LTP和突触可塑性[68]。在突触间隙中,钙黏蛋白可通过同源结合将突触前后膜连接起来,只能促进突触分化和成熟,并调控突触可塑性[69]。在部分ASD患者体内发现了编码钙黏蛋白的CDH9,CDH10和CDH15基因突变或染色体异常,这些突变会降低突触连接的稳定性,破坏突触发生和分化,从而导致ASD的产生。随着二代高通量测序技术的不断发展和研究的逐步深入,越来越多的ASD致病基因正在逐渐被发现和报道,通过采用大数据手段对这些数据进行深度挖掘和分析,必将会进一步加深对ASD致病机制的理解。
2 孤独症相关重要信号通路
每一个被鉴定出来的ASD易感基因都会为研究ASD发生神经机制提供新的曙光。许多ASD相关基因能归纳到一些主要的信号通路中,即基因转录调控与染色质重塑、蛋白合成与细胞代谢以及突触发育与功能三大方面。有许多细胞过程在神经元和非神经细胞中虽然共性存在,但这些过程在大脑中似乎起着一些与ASD特异性相关的作用(图1)。
2.1 基因转录调控与染色质重塑
De Rubeis等[70]通过采用大规模外显子组测序方法对上千类ASD患者及其亲代进行了深入研究。结果表明,有>5%的ASD患者可检出新发功能丧失突变,相关基因基因多集中在突触、转录和染色质重塑中发挥功能。如前所述,引起Rett综合征的MECP2基因就是一个典型的参与多任务、可通过影响染色质重塑、靶基因转录和剪辑来调控基因转录的关键分子。MECP2通过与基因启动子区甲基化CpG位点结合,或与染色质沉默复合物相互作用来抑制基因表达。也有研究表明,MECP2能与染色质和转录激活子相互作用激活蛋白的表达[71]。另外,与FMRP类似的是,MECP2蛋白也可通过转录后调控方式参与微小RNA介导的基因表达[72]。
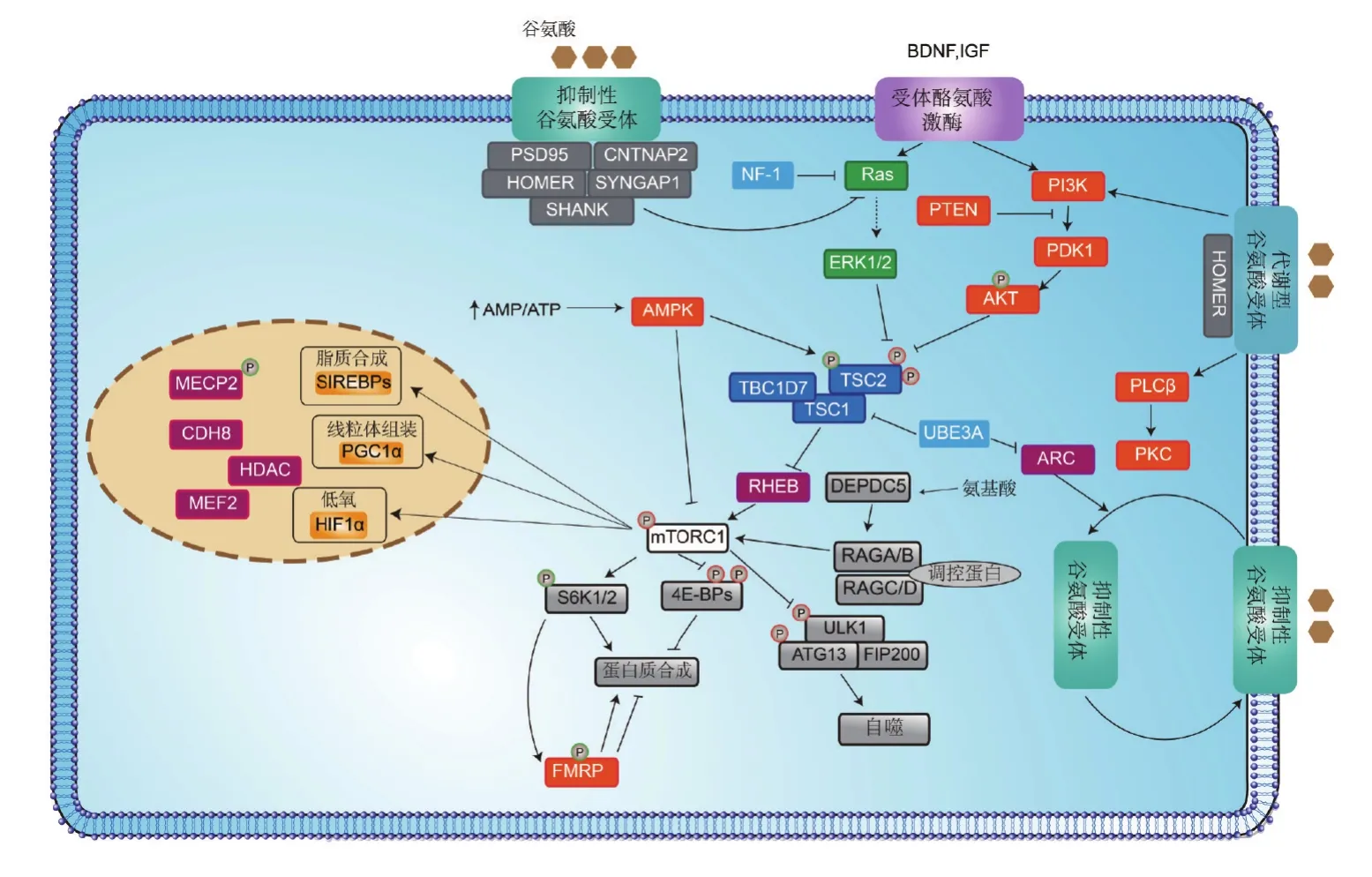
图1 孤独症及相关疾病中突变蛋白所参与的主要信号通路.BDNF:脑源性神经营养因子;IGF:胰岛素样类增长因子;MECP2:甲基CpG结合蛋白2;CDH8:钙黏蛋白8;HDAC:组蛋白去乙酰化酶;MEF2:肌细胞增强因子2;mTORC1:哺乳动物西罗莫司(雷帕霉素)靶蛋白1;AMPK:腺苷酸活化蛋白激酶;FMRP:脆性X智力低下蛋白;AMP/ATP:磷酸腺苷/三磷酸腺苷;Ras:大鼠肉瘤;RHEB:Ras蛋白脑组织同源类似物;ARC:细胞骨架活性调节蛋白;PTEN:磷酸酶和张力蛋白同源物一种抑癌基因;PI3K:磷脂酰肌醇3激酶;AKT:蛋白激酶B;PDK1:3-磷酸肌醇依赖性蛋白激酶1;PLCβ:磷脂酶Cβ;PKC:蛋白激酶C;ERK1/2:细胞外信号调节激酶1和2;NF-1:神经纤维瘤病1型;UBE3A:15号染色体上UBE3A基因控制合成的蛋白;S6K1/2:核糖体蛋白S6激酶1和2.
此外,最新研究显示,表观遗传修饰也会影响ASD疾病及大脑早期发育调控进程。研究发现一个新的ASD致病基因Auts2基因可通过募集多梳群蛋白(polycomb group proteins,PcG)家族成员胞质分裂调节蛋白1(protein regulator of cytokinesis 1,PRC1)等形成复合体,进而将PRC原有的基因抑制功能逆转成促转录激活因子,从而对大脑发育相关关键基因和ASD等疾病相关基因的表达发挥重要调控作用,这也为开发此类疾病新疗法提供了新依据[73]。
染色体结构域解旋酶DNA结合蛋白8(chromodomain helicase DNA binding protein 8,CHD8)是一个调控染色质重塑的重要分子,其编码基因CHD8变异与ASD发生亦密切相关。研究表明,CHD8突变的杂合小鼠胚胎的神经发育出现延迟,成年后可出现类似于ASD患者样的行为表型,其大脑基因表达在一定范围内出现了全局性变化。基因集合富集分析显示,CHD8突变小鼠和人类ASD患者脑内RE-1沉默转录因子(RE1-silencing transcription factor,REST)目标基因的表达均有所降低,提示CHD8突变或单倍剂量不足所导致的ASD病理生理学改变可能与REST蛋白的非正常活动及基因异常表达有关[74]。除此以外,包括人第10号染色体缺失的磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN),β-连环蛋白(βcatenin)等在内的很多分子都可通过调控关键靶基因转录的方式发挥作用。
2.2 蛋白合成与细胞代谢信号通路
在神经元中,磷脂酰肌醇-3-羟激酶(phosphoinositide 3-kinase,PI3K)/mTOR和GTP结合蛋白Ras(rat sarcoma,Ras)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)2条蛋白合成和细胞代谢信号通路对突触功能起到至关重要调节作用,这些信号通路的异常与神经发育和突触功能障碍密切相关。TSC和PTEN错构瘤综合征(PTEN hamartoma tumor syndrome,PHTS)是2种典型的mTOR信号通路介导的疾病,TSC1/TSC2缺失或PTEN功能异常会引起mTOR激酶的激活进而导致智力障碍、癫痫发作以及ASD的发病率增加[42]。在mTOR信号通路中能引起ASD的其他基因有1型神经纤维瘤蛋白(neurofibromin 1,NF1)基因。NF1基因编码一种可以抑制原癌基因Ras活性并改变mTOR信号通路的三磷酸酯鸟苷激活蛋白,该基因突变会导致Ⅰ型神经纤维瘤疾病。
蛋白合成失调是部分神经发育障碍性疾病的典型特征之一,如脆性X综合征。FMRP是一类mRNA结合蛋白,参与mRNA翻译调控并在脆性X综合征患者中表达沉默,FMRP沉默会导致突触可塑性相关重要功能分子的蛋白合成出现紊乱。与此类似的是,MECP2也可影响几百个基因的表达。在MECP2基因突变小鼠中,BDNF和IGF1的表达水平均显著降低,两者表达水平的下降可与其他分子协同作用从而导致PI3K/mTOR和ERK/MAPK信号通路活化减少,而给予重组人源IGF1处理能显著上调这两条信号通路活化水平[71]。由于PI3K/mTOR和ERK/MAPK信号通路参与调控大量的细胞生物学过程,包括转录、自噬、代谢以及细胞器生成和维持等,可见,要深入理解这些信号通路及其所参与的细胞生物学过程在ASD发生机制和治疗方案中的意义和价值,仍有待进一步深入探索。
3 孤独症相关脑区与神经环路
众所周知,大脑神经元内分子信号通路的变化往往通过影响神经元和突触功能,进而影响神经元之间的连接与功能环路,最终导致大脑整体功能的改变。引发ASD的致病机制中有关大脑区域与神经环路的精确信息迄今尚不明了。由于ASD患者伴有多种认知与行为学改变,因此很难将引发ASD的神经机制归结在某一特定细胞类型或神经环路上。此外,目前已知有上百种基因参与ASD及相关疾病的发生,这些分布在不同节点上的不同基因所参与的细胞类型和神经环路的多样性也使得对ASD神经环路机制的揭示难度进一步增加。
基于遗传性ASD模型小鼠的研究表明,在大脑内某些特定区域及一些特定细胞类型存在功能异常。研究还发现,人脑中一些ASD致病基因相互之间存在共表达范式[75-76]。其中一项研究表明,ASD模型鼠大脑中正在形成皮质第5/6质的皮质投射神经元出现富集;还有研究发现,ASD模型鼠大脑中出现浅表皮质和谷氨酸能投射神经元的富集。尽管这2项研究发现的ASD相关大脑皮质的部位并不完全相同,但2项研究均证实,皮质投射神经元异常可能与ASD的发生密切相关且至关重要。
除皮质投射神经元外,研究还发现,其他亚型神经细胞在ASD病理发生中都能起到一定作用。在大量ASD模型小鼠的新皮质内都出现了小清蛋白(parvalbumin,PV)阳性抑制性中间神经元密度的降低[77]。PV特异性地敲除小鼠会出现与ASD患者类似的核心症状及行为学表型。与此不同的是,其他研究发现,ASD患者大脑内海马CA1和CA3区域出现了PV阳性和钙视网膜蛋白阳性中间神经元的选择性增加[78]。总之,在某一特定类型细胞和脑区内进行ASD基因的特异性敲除,对解析ASD病理环路及其不同症候群之间的对应关系至关重要。如前所述,NLGN1敲除小鼠表现出ASD样重复行为和皮质纹状体突触异常。NLGN3突变体具有类似的异常表型,但这些缺陷更像是伏隔核/腹侧纹状体特异性突触异常引起的[79]。Shank3能在基底神经节中表达,而且Shank3敲除小鼠表现出重复的修饰整理行为、社交异常和纹状体突触的改变[18,80]。上述结果表明,基底神经节与皮质的连接异常可能从某些方面部分解释ASD发生的致病机制。
通过对ASD患者进行组织病理学、影像学及相关损伤的流行病学研究还发现,小脑在ASD病理发生过程中也可能发挥调控作用。神经病理学研究表明,与小脑发育正常的对照组个体相比,小脑浦肯野细胞缺失的个体更易患ASD。此外,对ASD患者进行影像学分析发现,直到儿童期早期患者小脑中还会出现灰质和白质的异常。通过对患有TSC的ASD患者进行正电子成像分析发现,患者的小脑核代谢水平显著提高,提示小脑皮质的能量输出增加,而不伴有ASD的TSC患者却检测不到此现象[81]。通过对近1000名ASD和正常人的大脑进行全脑关联分析后,找到了20个与ASD最为相关的脑区,它们包含了多个神经环路,其中一个重要神经环路“颞叶视觉皮质-腹内侧前额叶皮质”的功能连接显著减弱,为深入揭示ASD发生的相关脑区和神经环路提供了重要依据和线索[82]。
4 孤独症治疗的临床药理学研究进展
目前为止,能够缓解ASD相关症状的治疗方案仍较为有限。虽然相关研究为ASD治疗新方案的研发提供了希望,但从近期一项系统性调查结果看,许多进行药物治疗的ASD患儿并未获得预期的治疗效果[83]。ASD有效治疗方案的获得依然充满挑战。如前所述,ASD表型在遗传、环境、认知和社交等方面的异质性给研究者带来了诸多困难,这些背景各异的患者使得一种药物能产生广泛有效的可能大为降低[84]。另一些阻碍获得有效治疗方案的难度因素还包括样本量不足、缺乏严重受损患者参与、以及缺乏统一评价标准等。此外,不同文化之间的差异性也为ASD人群治疗方案的获得增加了不确定性。
当前认为,治疗ASD相关行为异常的黄金治疗方案是在患病早期进行一种密集传递模式的行为介入。且早期的精细行为学干扰实施起来非常昂贵,需要综合其他资源方能达到一定疗效,这对很多ASD儿童以及家庭来说都是难以承受的。尽管围绕ASD在基础神经科学和人类遗传学研究方面迄今为止已取得诸多进展,但被美国食品药品监督管理局(FDA)批准用于临床ASD治疗的药物仅限于利培酮(利哌立酮,risperidone)一种多巴胺拮抗剂)和阿立哌唑(aripiprazole,一种多巴胺受体激动剂)。利培酮是2006年被批准用于成年人的精神抑制药,可用于治疗ASD儿童和青少年出现的易怒和兴奋性过强,包括侵略行为、蓄意自伤和发脾气等症状。利培酮是大脑多巴胺和5-羟色胺受体拮抗剂,其短期疗效安全有效,可改善ASD患者刻板重复行为和过度兴奋等症状[85]。不过,副作用严重,包括食欲增强引起的肥胖、嗜睡和脑垂体分泌催乳素水平增加等[86]。2009年,在对阿立哌唑的短期疗效和安全性进行评价后,FDA批准此药用于治疗儿童和青少年ASD患者的易怒症状。阿立哌唑是第三代非典型性精神抑制药,是一种多巴胺系统稳定剂,不会引起血清中催乳素水平增加及引发锥体外系症状。其主要副作用包括疲劳、呕吐、食欲增加、嗜睡、震颤和因为攻击和体质量增加引起的不连续服药等[87]。
由于ASD具有数目庞大的致病候选基因,其遗传异质性对治疗效果的评估具有重要意义。首先,用提高有效干预措施的方式来进行最大同质化治疗分组的选择,可望优化治疗的实验设计。其次,进一步提高对ASD遗传异质性生物基础的正确理解,将有利于精准识别和划分特征各异的患者亚群。此外,对ASD相关临床合并症和心理疾病的调查,包括ASD患者免疫系统异常、线粒体功能障碍、消化系统异常、睡眠障碍、癫痫、抑郁和焦虑等,也是一种获得ASD异质性特点的有效方式。与此同时,ASD遗传异质性也为其有效治疗方案的开发带来了巨大的障碍和挑战。一种治疗方案或药物能治愈所有ASD患者固然是一种非常理想的状态,但在现实情况下其可能性微乎其微,因为ASD是一种典型的多基因遗传性疾病,某些ASD相关基因在突触水平甚至具有截然相反的表型[88]。而针对每一种ASD患者的遗传因素开发特异性治疗方案的策略同样也充满了不确定性。
现阶段最理想的治疗方案就是希望能找出一些用有限药物就可干扰的一些分子和神经环路的集合。目前,相关研究大多集中在ASD外显率较高的遗传性状上,尤其是单基因突变引发的遗传性状(表1)。

表1 遗传性神经发育障碍临床试验.
5 展望
ASD作为一种异常复杂的多基因关联遗传性精神疾病,在过去十余年间对其认识取得了飞速发展。随着高通量测序和遗传连锁分析技术的运用,一系列ASD致病基因被陆续发现和报道,其中相当大一部分基因直接或间接地参与了突触发育与功能调控进程。基于脑成像与功能连接组学等技术的运用,也揭示了多个同ASD密切相关的神经环路功能变化,提示ASD发生的机制可能是以网络状和多维度调控的方式进行。
目前,用于改善ASD患者主要症状的治疗方案和药物仍极为匮乏,ASD的遗传异质性是导致其疗效欠佳的一个根本原因。在缺乏行为学治疗的条件下,单独药物治疗恐难以达到最佳效果。未来,需要遗传学家、神经科学家、药理学家和临床医师携手攻关,一方面,尽可能全面深入地揭示ASD相关的致病基因,研发出新型高效药物;另一方面,需考虑将药物治疗同新型神经调控、行为学精准干预等技术结合,通过多中心、大队列联合研究等方式开展协同攻关,并建立标准化、定量化和统一化的病例资源数据库。从而为解决ASD这一重大难题和挑战提供基础理论支撑和潜在治疗前景。
[1]Courchesne E,Carper R,Akshoomoff N.Evidence of brain overgrowth in the first year of life in autism[J].JAMA,2003,290(3):337-344.
[2]Courchesne E,Karns CM,Davis HR,Ziccardi R,Carper RA,Tigue ZD,et al.Unusual brain growth patterns in early life in patients with autistic disorder:an MRI study[J].Neurology,2001,57(2):245-254.
[3]Hardan AY,Muddasani S,Vemulapalli M,Keshavan MS,Minshew NJ.An MRI study of increased cortical thickness in autism[J].Am J Psychiatry,2006,163(7):1290-1292.
[4]Tabuchi K,Südhof TC.Structure and evolution of neurexin genes:insight into the mechanism of alternative splicing[J].Genomics,2002,79(6):849-859.
[5]Dean C,Dresbach T.Neuroligins and neurexins:linking cell adhesion,synapse formation and cognitive function[J].Trends Neurosci,2006,29(1):21-29.
[6]Graf ER,Zhang X,Jin SX,Linhoff MW,Craig AM.Neurexins induce differentiation of GABA and glutamate postsynaptic specializations via neuroligins[J].Cell,2004,119(7):1013-1026.
[7]Jamain S,Quach H,Betancur C,Råstam M,Colineaux C,Gillberg IC,et al.Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism[J].Nat Genet,2003,34(1):27-29.
[8]Laumonnier F,Bonnet-Brilhault F,Gomot M,Blanc R,David A,Moizard MP,Raynaud M,et al.X-linked mental retardation and autism are associated with a mutation in the NLGN4 gene,a member of the neuroligin family[J].Am J Hum Genet,2004,74(3):552-557.
[9]Lawson-Yuen A,Saldivar JS,Sommer S,Picker J.Familial deletion within NLGN4 associated with autism and Tourette syndrome[J].Eur J Hum Genet,2008,16(5):614-618.
[10]Kim HG,Kishikawa S,Higgins AW,Seong IS,Donovan DJ,Shen Y,et al.Disruption of neurexin 1 associated with autism spectrum disorder[J].Am J Hum Genet,2008,82(1):199-207.
[11]Zahir FR,Baross A,Delaney AD,Eydoux P,Fernandes ND,Pugh T,et al.A patient with vertebral,cognitive and behavioural abnormalities and a de novo deletion of NRXN1alpha[J].J Med Genet,2008,45(4):239-243.
[12]Zweier C,de Jong EK,Zweier M,Orrico A,Ousager LB,Collins AL,et al.CNTNAP2 and NRXN1 are mutated in autosomal-recessive Pitt-Hopkins-like mental retardation and determine the level of a common synaptic protein in Drosophila[J].Am J Hum Genet,2009,85(5):655-666.
[13]Gauthier J,Siddiqui TJ,Huashan P,Yokomaku D,Hamdan FF,Champagne N,et al.Truncating mutations in NRXN2 and NRXN1 in autism spectrum disordersandschizophrenia [J].Hum Genet,2011,130(4):563-573.
[14]Lim S,Naisbitt S,Yoon J,Hwang JI,Suh PG,Sheng M,et al.Characterization of the Shank family of synaptic proteins.multiple genes,alternative splicing,and differential expression in brain and development[J].J Biol Chem,1999,274(41):29510-29518.
[15]Sala C,Piëch V,Wilson NR,Passafaro M,Liu G,Sheng M.Regulation of dendritic spine morphology and synaptic function by Shank and Homer[J].Neuron,2001,31(1):115-130.
[16]Hung AY,Futai K,Sala C,Valtschanoff JG,Ryu J,Woodworth MA,Kidd FL,et al.Smaller dendritic spines,weaker synaptic transmission,but enhanced spatial learning in mice lacking Shank1[J].J Neurosci,2008,28(7):1697-1708.
[17]Bozdagi O,Sakurai T,Papapetrou D,Wang X,Dickstein DL,Takahashi N,et al.Haploin sufficiency of the autism-associated Shank3 gene leads to deficits in synaptic function,social interaction,and social communication[J].Mol Autism,2010,1(1):15.
[18]Wang W,Li C,Chen Q,van der Goes MS,Hawrot J,Yao AY, et al.Striatopallidal dysfunction underlies repetitive behavior in Shank3-deficient model of autism[J].J Clin Invest,2017,127(5):1978-1990.
[19]Bonaglia MC,Giorda R,Borgatti R,Felisari G,Gagliardi C,Selicorni A,Zuffardi O.Disruption of the Pro-SAP2 gene in at(12;22)(q24.1;q13.3)is associated with the 22q13.3 deletion syndrome[J].Am J Hum Genet,2001,69(2):261-268.
[20]Durand CM,Betancur C,Boeckers TM,Bockmann J,Chaste P,Fanchereau F,et al.Mutations in the gene encoding the synaptic scaffolding protein SHANK3 are associated with autism spectrum disorders[J].Nat Genet,2007,39(1):25-27.
[21]Moessner R,Marshall CR,Sutcliffe JS,Skaug J,Pinto D,Vincent J,et al.Contribution of SHANK3 mutations to autism spectrum disorder[J].Am J Hum Genet,2007,81(6):1289-1297.
[22]Berkel S,Marshall CR,Weiss B,Howe J,Roeth R,Moog U,et al.Mutations in the SHANK2 synaptic scaffolding gene in autism spectrum disorder and mental retardation[J].Nat Genet,2010,42(6):489-491.
[23]Jiang YH,Armstrong D,Albrecht U,Atkins CM,Noebels JL,Eichele G,et al.Mutation of the Angelman ubiquitin ligase in mice causes increased cytoplasmic p53 and deficits of contextual learning and long-term potentiation[J].Neuron,1998,21(4):799-811.
[24]Yashiro K,Riday TT,Condon KH,Roberts AC,Bernardo DR,Prakash R,et al.Ube3a is required for experience-dependent maturation of the neocortex[J].Nat Neurosci,2009,12(6):777-783.
[25]Wallace ML,Burette AC,Weinberg RJ,Philpot BD.Maternal loss of Ube3a produces an excitatory/inhibitory imbalance through neuron type-specific synaptic defects[J].Neuron,2012,74(5):793-800.
[26]Hayrapetyan V,Castro S,Sukharnikova T,Yu C,Cao X,Jiang YH,et al.Region-specific impairments in striatal synaptic transmission and impaired instrumental learning in a mouse model of Angelman syndrome[J].Eur J Neurosci,2014,39(6):1018-1025.
[27]Kishino T,Lalande M,Wagstaff J.UBE3A/E6-AP mutations cause Angelman syndrome[J].Nat Genet,1997,15(1):70-73.
[28]Greer PL,Hanayama R,Bloodgood BL,Mardinly AR,Lipton DM,Flavell SW,et al.The Angelman syndrome protein Ube3A regulates synapse development by ubiquitinating arc[J].Cell,2010,140(5):704-716.
[29]Dindot SV,Antalffy BA,Bhattacharjee MB,Beaudet AL.The Angelman syndrome ubiquitin ligase localizes to the synapse and nucleus,and maternal deficiency results in abnormal dendritic spine morphology[J].Hum Mol Genet,2008,17(1):111-118.
[30]van Woerden GM,Harris KD,Hojjati MR,Gustin RM,Qiu S,de Avila Freire R,et al.Rescue of neurological deficits in a mouse model for Angelman syndrome by reduction of alphaCaMKⅡinhibitory phosphorylation[J].Nat Neurosci,2007,10(3):280-282.
[31]Pignatelli M,Piccinin S,Molinaro G,Di Menna L,Riozzi B,Cannella M,et al.Changes in mGlu5 receptor-dependent synaptic plasticity and coupling to homer proteins in the hippocampus of Ube3A hemizygous mice modeling Angelman syndrome[J].J Neurosci,2014,34(13):4558-4566.
[32]Kaphzan H,Buffington SA,Jung JI,Rasband MN,Klann E.Alterations in intrinsic membrane properties and the axon initial segment in a mouse model of Angelman syndrome[J].J Neurosci,2011,31(48):17637-17648.
[33]O′Donnell WT,Warren ST.A decade of molecular studies of fragile X syndrome[J].Annu Rev Neurosci,2002,25:315-338.
[34]Deng PY,Rotman Z,Blundon JA,Cho Y,Cui J,Cavalli V,et al.FMRP regulates neurotransmitter release and synaptic information transmission by modulating action potential duration via BK channels[J].Neuron,2013,77(4):696-711.
[35]Wang T,Bray SM,Warren ST.New perspectives on the biology of fragile X syndrome[J].Curr Opin Genet Dev,2012,22(3):256-263.
[36]Santoro MR,Bray SM,Warren ST.Molecular mechanisms of fragile X syndrome:a twenty-year perspective[J].Annu Rev Pathol,2012,7:219-245.
[37]AschrafiA, Cunningham BA, EdelmanGM,Vanderklish PW.The fragile X mental retardation protein and groupⅠmetabotropic glutamate receptors regulate levels of mRNA granules in brain[J].Proc Natl Acad Sci USA,2005,102(6):2180-2185.
[38]Osterweil EK,Krueger DD,Reinhold K,Bear MF.Hypersensitivity to mGluR5 and ERK1/2 leads to excessive protein synthesis in the hippocampus of a mouse model of fragile X syndrome[J].J Neurosci,2010,30(46):15616-15627.
[39]Silverman JL,Smith DG,Rizzo SJ,Karras MN,Turner SM,Tolu SS,et al.Negative allosteric modulation of the mGluR5 receptor reduces repetitive behaviors and rescues social deficits in mouse models of autism[J].Sci Transl Med, 2012,4(131):131ra 51.
[40]Adusei DC,Pacey LK,Chen D,Hampson DR.Early developmental alterations in GABAergic protein expression in fragile X knockout mice[J].Neuropharmacology,2010,59(3):167-171.
[41]Wang H,Wu LJ,Kim SS,Lee FJ,Gong B,Toyoda H.FMRP acts as a key messenger for dopamine modulation in the forebrain[J].Neuron,2008,59(4):634-647.
[42]Erickson CA,Stigler KA,Wink LK,Mullett JE,Kohn A,Posey DJ,et al.A prospective open-label study of aripiprazole in fragile X syndrome[J].Psychopharmacology(Berl),2011,216(1):85-90.
[43]Lipton JO,Sahin M.The neurology of mTOR[J].Neuron,2014,84(2):275-291.
[44]Osterweil EK,Chuang SC,Chubykin AA,Sidorov M,Bianchi R,Wong RK,et al.Lovastatin corrects excess protein synthesis and prevents epileptogenesis in a mouse model of fragile X syndrome[J].Neuron,2013,77(2):243-250.
[45]Berry-Kravis E,Sumis A,Hervey C,Nelson M,Porges SW,Weng N,et al.Open-label treatment trial of lithium to target the underlying defect in fragile X syndrome[J].J Dev Behav Pediatr,2008,29(4):293-302.
[46]Tavazoie SF,Alvarez VA,Ridenour DA,Kwiatkowski DJ,Sabatini BL.Regulation of neuronal morphology and function by the tumor suppressors Tsc1 and Tsc2[J].Nat Neurosci,2005,8(12):1727-1734.
[47]Nie D,Di Nardo A,Han JM,Baharanyi H,Kramvis I,Huynh T,et al.Tsc2-Rheb signaling regulates EphA-mediated axon guidance[J].Nat Neurosci,2010,13(2):163-172.
[48]Tang G,Gudsnuk K,Kuo SH,Cotrina ML,Rosoklija G,Sosunov A,et al.Loss ofmTOR-dependent macroautophagy causes autistic-like synaptic pruning deficits[J].Neuron,2014,83(5):1131-1143.
[49]Crino PB.Evolving neurobiology of tuberous sclerosis complex[J].Acta Neuropathol,2013,125(3):317-332.
[50]Reith RM,McKenna J,Wu H,Hashmi SS,Cho SH,Dash PK,et al.Loss of Tsc2 in Purkinje cells is associated with autistic-like behavior in a mouse model of tuberous sclerosis complex[J].Neurobiol Dis,2013,51:93-103.
[51]Tsai PT,Hull C,Chu Y,Greene-Colozzi E,Sadowski AR,Leech JM,et al.Autistic-like behaviour and cerebellar dysfunction in Purkinje cell Tsc1 mutant mice[J].Nature,2012,488(7413):647-651.
[52]Ehninger D,Han S,Shilyansky C,Zhou Y,Li W,Kwiatkowski DJ,et al.Reversal of learning deficits in a Tsc2+/-mouse model of tuberous sclerosis[J].Nat Med,2008,14(8):843-848.
[53]Jones PL,Veenstra GJ,Wade PA,Vermaak D,Kass SU,Landsberger N,et al.Methylated DNA and MeCP2 recruit histone deacetylase to repress transcription[J].Nat Genet,1998,19(2):187-191.
[54]Nan X,Ng HH,Johnson CA,Laherty CD,Turner BM,Eisenman RN,et al.Transcriptional repression by the methyl-CpG-binding protein MeCP2 involves a histone deacetylase complex[J].Nature,1998,393(6683):386-389.
[55]Yasui DH,Peddada S,Bieda MC,Vallero RO,HogartA, Nagarajan RP, etal.Integrated epigenomic analyses of neuronal MeCP2 reveal a role for long-range interaction with active genes[J].Proc Natl Acad Sci USA,2007,104(49):19416-19421.
[56]Skene PJ,Illingworth RS,Webb S,Kerr AR,James KD,Turner DJ,et al.Neuronal MeCP2 is expressed at near histone-octamer levels and globally alters the chromatin state[J].Mol Cell,2010,37(4):457-468.
[57]Maezawa I,Jin LW.Rett syndrome microglia damage dendrites and synapses by the elevated release of glutamate[J].J Neurosci,2010,30(15):5346-5356.
[58]Amir RE,Van den Veyver IB,Wan M,Tran CQ,Francke U,Zoghbi HY.Rett syndrome is caused by mutations in X-linked MECP2,encoding methyl-CpG-binding protein 2[J].Nat Genet,1999,23(2):185-188.
[59]Neul JL,Fang P,Barrish J,Lane J,Caeg EB,Smith EO,et al.Specific mutations in methyl-CpG-binding protein 2 confer different severity in Rett syndrome[J].Neurology,2008,70(16):1313-1321.
[60]Meins M,Lehmann J,Gerresheim F,Herchenbach J,Hagedorn M,Hameister K,et al.Submicroscopic duplication in Xq28 causes increased expression of the MECP2 gene in a boy with severe mental retardation and features of Rett syndrome[J].J Med Genet,2005,42(2):e12(2005-02).
[61]del Gaudio D,Fang P,Scaglia F,Ward PA,Craigen WJ,Glaze DG,et al.Increased MECP2 gene copy number as the result of genomic duplication in neurodevelopmentally delayed males[J].Genet Med,2006,8(12):784-792.
[62]Van Esch H,Bauters M,Ignatius J,Jansen M,Raynaud M,Hollanders K,et al.Duplication of the MECP2 region is a frequent cause of severe mental retardation and progressive neurological symptoms in males[J].Am J Hum Genet,2005,77(3):442-453.
[63]Ramocki MB,Peters SU,Tavyev YJ,Zhang F,Carvalho CM,Schaaf CP,et al.Autism and other neuropsychiatric symptoms are prevalent in individuals with MeCP2 duplication syndrome[J].Ann Neurol,2009,66(6):771-782.
[64]Ramocki MB,Tavyev YJ,Peters SU.The MECP2 duplication syndrome[J].Am J Med Genet A,2010,152A(5):1079-1088.
[65]Liu Z,Li X,Zhang JT,Cai YJ,Cheng TL,Cheng C,et al.Autism-like behaviours and germline transmissionintransgenicmonkeysoverexpressing MeCP2[J].Nature,2016,530(7588):98-102.
[66]Chen Y,Yu J,Niu Y,Qin D,Liu H,Li G,et al.Modeling Rett syndrome using TALEN-edited MECP2 mutant cynomolgus monkeys[J].Cell,2017,169(5):945-955.e10.
[67]Splawski I,Timothy KW,Sharpe LM,Decher N,Kumar P,Bloise R,et al.Ca(Ⅴ)1.2 calcium channel dysfunction causes a multisystem disorder including arrhythmia and autism[J].Cell,2004,119(1):19-31.
[68]Kochlamazashvili G,Henneberger C,Bukalo O,Dvoretskova E,Senkov O,Lievens PM,et al.The extracellular matrix molecule hyaluronic acid regulates hippocampal synaptic plasticity by modulating postsynaptic L-type Ca2+channels[J].Neuron,2010,67(1):116-128.
[69]Brigidi GS,Bamji SX.Cadherin-catenin adhesion complexes at the synapse[J].Curr Opin Neurobiol,2011,21(2):208-214.
[70]De Rubeis S,He X,Goldberg AP,Poultney CS,Samocha K,Cicek AE,et al.Synaptic,transcriptional and chromatin genes disrupted in autism[J].Nature,2014,515(7526):209-215.
[71]Chahrour M,Jung SY,Shaw C,Zhou X,Wong ST,Qin J,et al.MeCP2,a key contributor to neurological disease,activates and represses transcription[J].Science,2008,320(5880):1224-1229.
[72]Wu H,Tao J,Chen PJ,Shahab A,Ge W,Hart RP,et al.Genome-wide analysis reveals methyl-CpG-binding protein 2-dependent regulation of microRNAs in a mouse model of Rett syndrome[J].Proc Natl Acad Sci USA,2010,107(42):18161-18166.
[73]Gao Z,Lee P,Stafford JM,von Schimmelmann M,Schaefer A,Reinberg D.An AUTS2-polycomb complex activates gene expression in the CNS[J].Nature,2014,516(7531):349-354.
[74]Katayama Y,Nishiyama M,Shoji H,Ohkawa Y,Kawamura A,Sato T,et al.CHD8 haploinsufficiency results in autistic-like phenotypes in mice[J].Nature,2016,537(7622):675-679.
[75]Willsey AJ,Sanders SJ,Li M,Dong S,Tebbenkamp AT,Muhle RA,et al.Coexpression networks implicate human midfetal deep cortical projection neurons in the pathogenesis of autism[J].Cell,2013,155(5):997-1007.
[76]Parikshak NN,Luo R,Zhang A,Won H,Lowe JK,Chandran V,et al.Integrative functional genomic analyses implicate specific molecular pathways and circuits in autism[J].Cell,2013,155(5):1008-1021.
[77]Gogolla N,Leblanc JJ,Quast KB,Südhof TC,Fagiolini M,Hensch TK.Common circuit defect of excitatory-inhibitory balance in mouse models of autism[J].J Neurodev Disord,2009,1(2):172-181.
[78]Lawrence YA,Kemper TL,Bauman ML,Blatt GJ.Parvalbumin-,calbindin-,and calretinin-immunoreactive hippocampal interneuron density in autism[J].Acta Neurol Scand,2010,121(2):99-108.
[79]Rothwell PE,Fuccillo MV,Maxeiner S,Hayton SJ,Gokce O,Lim BK,et al.Autism-associated neuroligin-3 mutations commonly impair striatal circuits to boost repetitive behaviors[J].Cell,2014,158(1):198-212.
[80]Peça J,Feliciano C,Ting JT,Wang W,Wells MF,Venkatraman TN,et al.Shank3 mutant mice display autistic-like behaviours and striatal dysfunction[J].Nature,2011,472(7344):437-442.
[81]Asano E,Chugani DC,Muzik O,Behen M,Janisse J,Rothermel R,et al.Autism in tuberous sclerosis complex is related to both cortical and subcortical dysfunction[J].Neurology,2001,57(7):1269-1277.
[82]Cheng W,Rolls ET,Gu H,Zhang J,Feng J.Autism:reduced connectivity between cortical areas involved in face expression,theory of mind,and the sense of self[J].Brain,2015,138(Pt 5):1382-1393.
[83]McPheeters ML,Warren Z,Sathe N,Bruzek JL,Krishnaswami S,Jerome RN,et al.A systematic review of medical treatments for children with autism spectrum disorders[J].Pediatrics,2011,127(5):e1312-e1321.
[84]Siegel M,Beaulieu AA.Psychotropic medications in children with autism spectrum disorders:a systematic review and synthesis for evidence-based practice[J].J Autism Dev Disord,2012,42(8):1592-1605.
[85]McCracken JT,McGough J,Shah B,Cronin P,Hong D,Aman MG,et al.Risperidone in children with autism and serious behavioral problems[J].N Engl J Med,2002,347(5):314-321.
[86]Anderson GM,Scahill L,McCracken JT,McDougle CJ,Aman MG,Tierney E,et al.Effects of shortand long-term risperidone treatment on prolactin levels in children with autism[J].Biol Psychiatry,2007,61(4):545-550.
[87]Marcus RN,Owen R,Kamen L,Manos G,McQuade RD,Carson WH,et al.A placebocontrolled,fixed-dose study of aripiprazole in children and adolescents with irritability associated with autistic disorder[J].J Am Acad Child Adolesc Psychiatry,2009,48(11):1110-1119.
[88]Auerbach BD,Osterweil EK,Bear MF.Mutations causing syndromic autism define an axis of synaptic pathophysiology[J].Nature,2011,480(7375):63-68.

