小胶质细胞对缺血性脑卒中的双重作用
范丽桢,陶文渊,张 曦,韩沁煜,徐 运
(南京大学医学院附属鼓楼医院神经内科,江苏南京 210008)
脑卒中是全球致残和致死的最常见疾病,分为缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中占70%~80%。缺血性脑卒中可引发缺血级联反应,最终导致神经元功能障碍和死亡[1]。缺血级联反应通过破坏血脑屏障(blood brain barrier,BBB),促进脑免疫炎症反应等引起卒中后脑损伤,并在亚急性期加重脑水肿和神经功能损害[2],而这些早期的分子事件与慢性期的病情恢复和预后相关。缺血性脑卒中发生时,脑部损伤区域主要分成两种,一种为核心梗死区域,细胞即刻凋亡并坏死,此为不可逆过程;另一种为缺血半暗带,该区域细胞将要发生凋亡但尚可逆[3],故有望通过逆转缺血半暗带细胞凋亡过程来治疗缺血性脑卒中。
小胶质细胞是神经系统中参与免疫反应的重要细胞,在大脑中分布广泛,占脑内胶质细胞总数的5%~20%[4],分为M1型和M2型,M1型为经典激活型,主要表达CD80、CD86和主要组织相容性复合体Ⅱ(major histocompatibility complexⅡ,MHCⅡ)等表面抗原,并可分泌白细胞介素-1(interleukin-1,IL-1)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和干扰素-γ(interferon-γ,IFN-γ)等促炎因子,促进诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)合成,对神经元产生细胞毒性作用[5]。而M2型为替代激活型,主要表达Ym-1和CD206等表面抗原,并可分泌IL-10、转化生长因子-β(transforming growth factor-β,TGF-β)、IL-4、IL-3和胰岛素样生长因子-1(insulin like growth factor-1,IGF-1)等抗炎因子[6],抑制炎症反应,M2型小胶质细胞同时还能分泌各种神经营养因子,在大脑缺血低氧时起神经保护作用。M2型又分为M2a,M2b和M2c,M2a型主要参与细胞再生,而其他两型主要参与吞噬和清除坏死组织[7]。将小胶质细胞分为M1型和M2型虽过于简单,但这种分类方法有利于理解小胶质细胞在各种脑部疾病中的功能[8-9]。
1 缺血性脑卒中后小胶质细胞的活化
1.1 小胶质细胞的活化机制
当大脑受到缺血损伤的刺激时,小胶质细胞转化为阿米巴状,胞体变大,突起及分支增多,具有吞噬功能,并可吞噬血管内皮细胞[10]。这种形态改变被认为是一种高度激活状态,代表着小胶质细胞对卒中免疫应答事件的启动。引发小胶质细胞活化的因素十分广泛,如脂多糖、ATP以及iNOS等,这些配体与细胞表面受体结合,激活小胶质细胞,并产生吞噬作用及一系列细胞因子,从而介导炎症反应[11]。另外,某些配体还能改变小胶质细胞的分化方向。神经元可溶性Fas配体(Fas ligand,FasL)在缺血性脑损伤后促进小胶质细胞向M1型分化。动物实验和细胞实验同时证明可溶性FasL能诱导小胶质细胞向M1型分化[12]。当发生缺血性脑损伤后,FasL基因突变能减少动物模型募集外周炎性细胞,抑制小胶质细胞等固有胶质细胞的活化,抑制Jun氨基端K激酶(Jun N-terminal K-kinase,JNK)信号通路。阻断FasL有望抑制小胶质细胞活化,并改善卒中患者的长期预后[13]。
目前研究较多的小胶质细胞活化受体是Toll样受体(Toll-like receptor,TLR)家族。有研究显示,缺血性脑卒中患者血浆TLR2和TLR4表达水平显著增高,而TLR水平升高往往与不良预后密切相关[14]。应用TLR4抑制剂TAK-242可显著减轻脑缺血动物模型神经功能缺损[15]。除此之外,其他TLR同样参与了卒中后的炎症反应。动物实验表明,脑缺血再灌注后神经元和小胶质细胞TLR9表达水平显著上调[16]。小胶质细胞也表达其他细胞因子受体,如TNF受体,而TNF受体激活会触发NF-κB信号通路,促进小胶质细胞分泌TNF-α,并进一步活化小胶质细胞[17]。
当发生缺血性脑卒中时,损伤区域的小胶质细胞迁移至损伤处,并分化为M1型和M2型二大类型,M1型,分泌IL-1,IL-6,TNF-α和IFN-γ等促炎因子,促进炎症反应对神经组织的损伤[5];M2型分泌IL-10,TGF-β,IL-4,IL-3,TGF-β和IGF-1等抗炎因子,以及脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和神经生长因子(nerve growth factor,NGF)等营养因子[6],抑制炎症反应的同时,促进神经组织修复过程(图1)。小胶质细胞的活化调控机制还有待进一步研究。
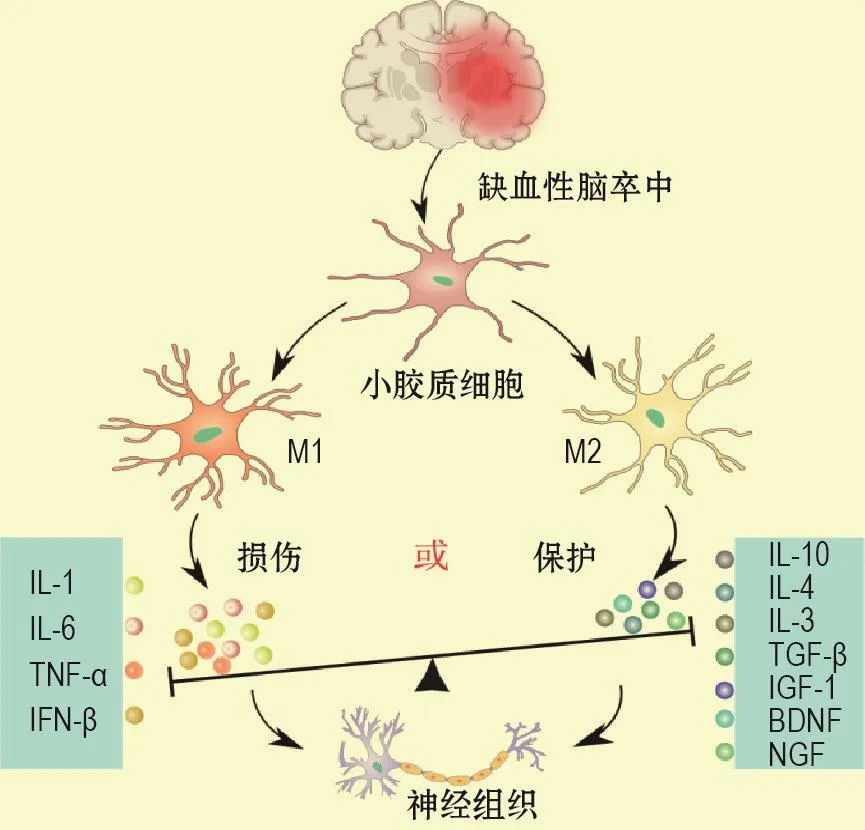
图1 缺血性脑损伤中小胶质细胞的活化过程.IL:白细胞介素;TNF-α:肿瘤坏死因子α;IFNγ:干扰素-γ;TGF-β:转化生长因子β;BDNF:脑源性神经营养因子;NGF:神经生长因子.
1.2 小胶质细胞活化的时序性
小胶质细胞的活化在缺血性脑卒中的炎症反应中是一个动态过程,并有一定的时序性。小胶质细胞的活化是炎症反应的第一步,几分钟内即可发生,缺血后2~3 d内小胶质细胞的活化和增殖状态将达到顶峰,随后的几周内持续下去[18]。相关研究显示,发生缺血性脑卒中后,损伤区域内活化的小胶质细胞和巨噬细胞在早期主要表达M2信号基因,而在损伤后期它们主要表达M1信号基因。因此,小胶质细胞在卒中后不同时间内表现出不同的分化趋势。在缺血性脑卒中急性期,小胶质细胞主要向M2型转化,但在亚急性和慢性期,则主要向M1型转化[19],但具体的分化机制有待进一步研究。小胶质细胞在急性期参与炎症反应对神经细胞的存活是有利的[20],而在慢性期,由于小胶质细胞长期过度激活,引起慢性炎症反应,会造成神经组织损伤,导致神经退行性疾病的发生以及认知障碍[21]。
1.3 小胶质细胞活化的异位性
缺血性脑卒中发生后,不同病变部位的小胶质细胞活化不尽相同。在核心梗死区域,24 h内若损伤区域获得再灌注,小胶质细胞发生活化和表型改变,若24 h内未进行再灌注治疗,活化的小胶质细胞很少,并表现出很强的吞噬作用[22]。而24 h后,M2型的表面抗原Ym-1和CD206表达增加,小胶质细胞参与损伤组织的修复过程[23]。当缺血性脑卒中情况恶化时,于72 h后小胶质细胞数量减少并开始发生破碎,动物实验已验证这一过程。利用化学诱导法建立持续性局灶脑缺血小鼠模型,7 d后小鼠的脑内核心梗死区域小胶质细胞发生崩解破碎,而此时缺血半暗带的小胶质细胞数量增加[24]。在卒中发生后3~7 d内,缺血半暗带的小胶质细胞数量逐渐增加,以CD68和MHCⅡ表面抗原阳性的小胶质细胞为主[25]。可见小胶质细胞干预疗法治疗缺血性脑卒中应考虑不同的脑损伤区域。
2 小胶质细胞对缺血性脑卒中的神经保护作用
2.1 小胶质细胞减轻炎症反应和继发性脑损伤
已有研究表明,小胶质细胞是脑内炎症反应的重要调节器。选择性消除大脑中动脉闭塞(middlecerebral artery occlusion,MCAO)小鼠的增殖状态小胶质细胞,小鼠的脑梗死面积增加,且IGF-1等抗炎因子的水平降低[18]。Szalay等[26]通过快速体内双光子活体钙成像实验发现,选择性清除小胶质细胞会显著增加梗死面积。另一项研究结果显示,将培养的小胶质细胞移植入缺血损伤脑组织内可减轻缺血性脑损伤和增强神经修复的功能[27]。这些结果说明,小胶质细胞能减轻梗死区域的炎症反应和组织损伤。
小胶质细胞对于缺血性脑卒中的神经保护作用主要依靠M2型小胶质细胞。M2型小胶质细胞可分泌神经营养因子,如BDNF,TGF-β和NGF[28]。研究表明,发生缺血性脑卒中后,小胶质细胞可通过分泌BDNF来发挥神经保护作用。BDNF主要通过丝裂原活化蛋白激酶通路及磷酯酰肌醇3激酶通路发挥作用[29]。BDNF通过增加神经元内的Ca2+结合蛋白的表达来抑制Ca2+内流,减少细胞内Ca2+浓度,抑制Ca2+超载和神经元凋亡,进而减轻脑水肿和缩小脑梗死体积。TGF-β是一种多功能细胞因子,有3种亚型,其中TGF-β1分布广泛且可调控机体多种细胞的生长、分化、迁移、凋亡和细胞外基质生成。在生理状态下,中枢神经系统(central nervous system,CNS)中TGF-β1含量较少,发生缺血性脑卒中后,TGF-β1显著增加,既可促进微血管再生和神经组织重塑,也可通过抑制炎症因子的释放从而减轻CNS的炎症反应,减轻脑水肿[30]。
2.2 小胶质细胞促进神经组织修复
研究表明,小胶质细胞对缺血性脑卒中后的神经保护作用不仅仅在于抑制炎症反应和减轻脑组织损伤,同时也能刺激神经组织修复和缺血后神经元的再生。迄今为止,临床治疗只能通过减轻缺血性脑卒中后的脑损伤来改善预后,脑损伤的核心梗死区域凋亡的神经元虽无法修复,但缺血半暗带的神经元尚可进行修复,还可挽救其神经元功能。
多项研究发现,大脑在广泛的神经元死亡后能自行修复,而在脑卒中后也会出现代偿性神经元修复[31-32]。一般认为,神经元多发生于海马体的颗粒下层和侧脑室周围的室管膜下层[33]。当神经元大量损伤时,来源于颗粒下层和室管膜下层的神经母细胞需要迁移到损伤区域并不断分化为有功能的神经元[34]。相关研究发现,脑卒中后,激活的小胶质细胞会伴随神经母细胞共同迁移至损伤区域[35],在脑卒中患者的缺血半暗带区域发现新生的神经元和小胶质细胞[36],动物实验也得出类似的结果[37-38]。因此,小胶质细胞与神经元的神经交互作用可能在神经修复的过程中发挥了重要作用。体外模型同样能观察到小胶质细胞对神经元的保护作用,并确定了TGF-β2是参与神经保护的重要因子[20]。由此可见,小胶质细胞的迁移以及神经母细胞的交互作用是小胶质细胞发挥神经元保护作用的基础,但具体机制尚未有明确定论。
此外,小胶质细胞还能维持受损区域的微环境稳态。M2型小胶质细胞表达特定的细胞表面因子,如精氨酸酶-1,CD206和Ym1,可阻止细胞质基质的降解[39],在缺血性脑卒中小鼠模型中CD206和Ym1与脑组织修复有关[23]。研究发现,M2型小胶质细胞也可通过与Th2细胞的交互作用促进神经组织的修复。M2型小胶质细胞产生抗炎因子并可促进Th2细胞分泌IL-10和IL-13,为神经组织修复提供了微环境。与M1型小胶质细胞相比,M2型小胶质细胞具有更高的吞噬活性[39],因此它可有效地消除细胞碎片,恢复受损组织内稳态,减轻炎症反应,促进组织再生和修复以及细胞外基质的重建。Wake等[40]发现,在缺血期间,小胶质细胞突起与突触的接触时间更长,随后其中一些突触被清除,表明小胶质细胞能监测突触的功能状态,并可能有助于清除丧失功能的突触。
3 小胶质细胞对缺血性脑卒中的神经损害作用
3.1 小胶质细胞促进炎症反应和增强细胞毒性作用
经典激活的M1型小胶质细胞可分泌多种促炎因子,如IL-1,IL-6,TNF-α和IFN-γ等。其中,TNF-α在炎症过程中发挥重要作用。在局部脑损伤区域,TNF-α主要由小胶质细胞分泌,是介导缺血低氧损伤的重要因子,能刺激中性粒细胞等炎症细胞促进炎症反应[41]。TNF-α主要通过以下3种途径促进炎症反应并增强细胞毒性作用:①激活JNK通路,使c-Jun的Ser63和Ser73末端磷酸化,促进c-myc和p53的活性,介导细胞凋亡。②促进内皮细胞和白细胞表面的黏附分子表达增高,加强内皮细胞和白细胞之间的黏附作用,导致血管通透性增强,加重脑水肿,同时细胞毒性因子更易进入,进一步加重损伤。③与p55和p75这2种TNF细胞表面受体(通常称为TNFR1和TNFR2)发挥作用,TNFR1和TNFR2在神经元和小胶质细胞上均可表达,尤其是缺血性卒中发生后数小时内,两者的表达增加。另外,药物、中和抗体或可溶性受体可抑制TNF-α信号传导,并可减少模型动物脑损伤体积[42]。
脑缺血时,小胶质细胞表面的嘌呤受体P2X7与积聚在细胞外的ATP结合,使小胶质细胞活化,并通过胱天蛋白酶1通路促进小胶质细胞分泌大量促炎因子IL-1β,导致更多神经细胞死亡[43]。死亡的神经细胞可释放ATP,与P2Y12受体相互作用以诱导小胶质细胞活化,小胶质细胞可通过ATP的自分泌信号传导进一步放大活化过程。这种正反馈环将增加IL-1β和TNF-α的表达[44],并加剧炎症反应。
3.2 小胶质细胞引起血脑屏障通透性改变
小胶质细胞也能释放基质金属蛋白酶(matrix metalloproteinases,MMP),主要包括MMP-3和MMP-9两种。MMP能降解多种细胞外蛋白并参与细胞外基质重塑,主要以非活性形式存在于细胞液中,并参与胶原蛋白的降解。当缺血性脑损伤发生时,MMP分泌增加,可引起CNS细胞外基质的降解,使BBB通透性增加,导致缺血性脑卒中后损伤加重[45]。相关研究发现,敲除小鼠MMP-3和MMP-9基因,并在急性期给予MMP抑制剂后,小鼠脑梗死面积减小,脑水肿程度减轻,神经功能损伤减轻[46]。最新研究表明,在缺血性脑卒中期间,小胶质细胞能活化组织型纤溶酶原激活物(tissue-type plasminogen activator,tPA)介导的血小板源性生长因子-CC,并提高BBB的通透性,增加脑损伤[47]。
3.3 小胶质细胞的迁移作用加剧神经元损伤
当发生缺血性脑损伤时,小胶质细胞受到缺血刺激活化并能迁移到脑损伤区域[48]。大脑和部分外周器官均能表达单核细胞趋化蛋白-1(MCP-1)等趋化因子,并促进小胶质细胞和白细胞迁移到缺血区,从而诱发炎症反应。凋亡神经元释放的趋化因子CX3CL1和ATP,与小胶质细胞的表面受体结合诱导小胶质细胞迁移。此外,在大脑中动脉闭塞模型中,缺血部位的MCP-1表达水平升高,在2~3 d达到峰值。与此同时,缺血部位的小胶质细胞的表达水平也开始出现峰值,说明MCP-1在一定程度上可诱导小胶质细胞迁移[49]。MCP-1基因敲除小鼠的缺血性损伤较轻,说明缺乏MCP-1能减少小胶质细胞迁移至缺血部位,相应地减轻炎性损伤。
4 小胶质细胞干预治疗缺血性脑卒中
使用tPA进行溶栓治疗是迄今缺血性卒中唯一成功的治疗方法,但存在治疗时间窗(4.5 h)窄和安全性不稳定等问题[50],仅有不到5%患者能接受溶栓治疗[51]。目前尚无针对卒中后免疫应答的特定治疗方法,小胶质细胞的双重作用使其成为潜在的治疗靶点。
4.1 作用于小胶质细胞的抗炎治疗
目前,所有小胶质细胞激活的靶向药物仅用于实验研究或临床前试验。尽管其中一些已被用于治疗自身免疫性疾病(例如TNF-α拮抗剂),但对于调节卒中后小胶质细胞活化的有效药物的探索性研究仍处于起步阶段。
实验研究发现,腺苷酸活化蛋白激酶激活剂二甲双胍可通过诱导小胶质细胞向M2分化来促进卒中小鼠功能恢复和组织修复[52]。二甲双胍通过抑制NF-κB介导的炎症信号传导,使小胶质细胞/巨噬细胞向M2表型转化。他汀类药物是一类降胆固醇药物,在缺血性卒中中具有抗炎和保护作用。辛伐他汀能以胆固醇依赖方式改变小胶质细胞因子(IL-1β和TNF-α)和BDNF的分泌。吲哚美辛是一种非甾体类抗炎药物,可明显减少小胶质细胞的活化数量,在卒中后7 d可促进神经母细胞增殖[53]。头蛋白(noggin)是一种骨形态发生蛋白的内源性拮抗剂,可以预防缺血性脑损伤,这种作用可能与调节小胶质细胞M1/M2活化有关。它可降低M1标志物(IL-1β,TNF-α,IL-12,CCL2和CD86)的表达,导致小胶质细胞向M2分化[54],使M2标志物(IL-1Ra,IL-10,Arg-1,CD206和Ym1)升高。IL-13基因免疫治疗是在神经炎症过程中调节小胶质细胞活化的潜在治疗方法。在多发性硬化的小鼠模型中,慢病毒载体介导的IL-13调节小胶质细胞向M2表型分化[55]。
中药在缺血性脑损伤中发挥有效的抗炎作用,并能在炎症级联期激活神经保护转录因子。穿心莲内酯是来自穿心莲的主要活性化合物,可防止脑梗死,可以改善24 h动物中动脉缺血模型的神经功能缺损。穿心莲内酯通过抑制局部缺血区的小胶质细胞激活和小胶质细胞介导的IL-1β和TNF-α的表达而发挥神经保护作用[56]。葛根中分离的总异维生素可以显着降低缺血2 h和再灌注48 h的脑梗死体积,小胶质细胞在刺激下转化为M2型,并分泌各种细胞因子以修复缺血性损伤,其作用涉及小胶质细胞活化和抑制小胶质细胞介导的IL-1β在缺血皮质中的表达[57]。在中国草本植物坡垒中提取了一种天然抗氧化剂,称为Malibatol A,能减少MCAO动物模型的脑梗塞面积并减轻脑缺血损害。并且,Malibatol A能降低M1型小胶质细胞标志物(CD86等)的表达,升高M2型标志物(CD206,Ym-1)的表达,还能促进PPAPγ核受体的激活,以此来抑制炎症反应[58]。
4.2 细胞疗法
目前尚缺乏有效的药物来提高卒中后亚急性期和慢性期患者的生存率或改善生活质量,大量研究聚焦到细胞疗法。使用M2型小胶质细胞疗法可能是针对卒中的保护性治疗策略,原因有三:首先,M2型小胶质细胞分泌保护性重构因子,从而通过组织(包括神经元)和血管重塑促进神经元网络恢复;其次M2型小胶质细胞可通过BBB或脉络丛迁移到局部损伤区域;第三,在适当的时机进行干预,M2型小胶质细胞可减轻炎症诱导的继发性脑损伤。
研究表明,慢性卒中患者接受髓鞘内注射自体骨髓单个核细治疗后可明显改善步态和手部功能,加速康复进程[59]。脑卒中患者接受鞘内注射21.9×106个自体M2小胶质细胞治疗后,NIHSS评分在治疗6个月后从11降至6,此外,患者体内IL-8,IL-10和IL-4水平升高,IL-1b,TNF-α,IFN-γ和IL-6水平降低。由此可见,脑卒中患者鞘内给予自体M2小胶质细胞治疗是有一定疗效的,但效果因人而异,往往与患者的自身免疫反应水平有关,内源性免疫抑制机制较差、促炎反应活跃的患者疗效相对较好[60]。
5 结语
综上所述,小胶质细胞的异常活化与缺血性脑卒中存在着紧密联系,对缺血性脑卒中的发生发展具有双重作用。主要表现在M1型通过增加促炎因子的释放,产生细胞毒性作用,并可改变BBB,从而加重缺血脑组织神经损伤;而M2型则通过分泌抗炎及神经营养因子,从而起到了促进神经元修复和再生的作用。因此,调节小胶质细胞的功能性分化至关重要,这包括抑制小胶质细胞向M1型分化,诱导其向M2型分化,促进M1型向M2型逆转等,不仅能减少M1型小胶质细胞对脑组织的免疫损伤,而且能增强M2型小胶质细胞的抗炎能力,促进神经元修复和再生,这可能成为临床治疗缺血性脑卒中的新策略和补充。然而缺血性脑卒中后小胶质细胞的活化和调控机制异常复杂,还需要更多的研究进一步明确两者关系。
[1]Mehta SL,Manhas N,Raghubir R.Molecular targets in cerebral ischemia for developing novel therapeutics[J].Brain Res Rev,2007,54(1):34-66.
[2]Jin R,Yang G,Li G.Inflammatory mechanisms in ischemic stroke:role of inflammatory cells[J].J Leukoc Biol,2010,87(5):779-789.
[3]Lo EH.A new penumbra:transitioning from injury into repair after stroke[J].Nat Med,2008,14(5):497-500.
[4]Sieweke MH,Allen JE.Beyond stem cells:self-renewal of differentiated macrophages[J].Science,2013,342(6161):1242974.
[5]Lan X,Han X,Li Q,Yang QW,Wang J.Modulators of microglial activation and polarization after intracerebral haemorrhage[J].Nat Rev Neurol,2017,13(7):420-433.
[6]Xiong XY,Liu L,Yang QW.Functions and mechanisms of microglia/macrophages in neuroinflammation and neurogenesis after stroke[J].Prog Neurobiol,2016,142:23-44.
[7]Chhor V,Le Charpentier T,Lebon S,Oré MV,Celador IL,Josserand J,et al.Characterization of phenotype markers and neuronotoxic potential of polarised primary microglia in vitro[J].Brain Behav Immun,2013,32:70-85.
[8]Han L,Cai W,Mao L,Liu J,Li P,Leak RK,et al.Rosiglitazone promotes white matter integrity and long-term functional recovery after focal cerebral ischemia[J].Stroke,2015,46(9):2628-2636.
[9]Hu X,Leak RK,Shi Y,Suenaga J,Gao Y,Zheng P,et al.Microglial and macrophage polarization-new prospects for brain repair[J].Nat Rev Neurol,2015,11(1):56-64.
[10]Jolivel V,Bicker F,Binamé F,Ploen R,Keller S,Gollan R,et al.Perivascular microglia promote blood vessel disintegration in the ischemic penumbra[J].Acta Neuropathol,2015,129(2):279-295.
[11]Iadecola C,Anrather J.The immunology of stroke:from mechanisms to translation[J].Nat Med,2011,17(7):796-808.
[12]Meng HL,Li XX,Chen YT,Yu LJ,Zhang H,Lao JM,et al.Neuronal soluble fas ligand drives M1-microglia polarization after cerebral ischemia[J].CNS Neurosci Ther,2016,22(9):771-781.
[13]Niu FN,Zhang X,Hu XM,Chen J,Chang LL,Li JW,et al.Targeted mutation of Fas ligand gene attenuates brain inflammation in experimental stroke[J].Brain Behav Immun,2012,26(1):61-71.
[14]Brea D,Sobrino T,Rodríguez-Yáñez M,Ramos-Cabrer P,Agulla J,Rodríguez-González R,et al.Toll-like receptors 7 and 8 expression is associated with poor outcome and greater inflammatory response in acute ischemic stroke[J].Clin Immunol,2011,139(2):193-198.
[15]Zhang Y,Peng W,Ao X,Dai H,Yuan L,Huang X,et al.TAK-242,a Toll-like receptor 4 antagonist,protects against aldosterone-induced cardiac and renal injury[J].PLoS One, 2015, 10(11):e0142456.
[16]Ji Y,Zhou Y,Pan J,Li X,Wang H,Wang Y.Temporal pattern of Toll-like receptor 9 upregulation in neurons and glial cells following cerebral ischemia reperfusion in mice[J].Int J Neurosci,2016,126(3):269-277.
[17]Sriram K,Miller DB,O'Callaghan JP.Minocycline attenuates microglial activation but fails to mitigate striatal dopaminergic neurotoxicity:role of tumor necrosis factor-alpha[J].J Neurochem,2006,96(3):706-718.
[18]Lalancette-Hébert M,Gowing G,Simard A,Weng YC,Kriz J.Selective ablation of proliferating microglial cells exacerbates ischemic injury in the brain[J].J Neurosci,2007,27(10):2596-2605.
[19]Hu X,Li P,Guo Y,Wang H,Leak RK,Chen S,et al.Microglia/macrophage polarization dynamics reveal novel mechanism of injury expansion after focal cerebral ischemia[J].Stroke,2012,43(11):3063-3070.
[20]Polazzi E,Altamira LE,Eleuteri S,Barbaro R,Casadio C,Contestabile A,et al.Neuroprotection of microglial conditioned medium on 6-hydroxydopamine-induced neuronal death:role of transforming growth factor beta-2[J].J Neurochem,2009,110(2):545-556.
[21]Frank-Cannon TC,Alto LT,McAlpine FE,Tansey MG.Does neuroinflammation fan the flame in neurodegenerative diseases?[J].MolNeurodegener,2009,4:47.
[22]Lee Y,Lee SR,Choi SS,Yeo HG,Chang KT,Lee HJ.Therapeutically targeting neuroinflammation and microglia after acute ischemic stroke[J].Biomed Res Int,2014,2014:297241.
[23]Perego C,Fumagalli S,De Simoni MG.Temporal pattern of expression and colocalization of microglia/macrophage phenotype markers following brain ischemic injury in mice[J].J Neuroinflammation,2011,8:174.
[24]Fukumoto D,Hosoya T,Nishiyama S,Harada N,Iwata H,Yamamoto S,et al.Multiparametric assessment of acute and subacute ischemic neuronal damage:a small animal positron emission tomography study with rat photochemically induced thrombosis model[J].Synapse,2011,65(3):207-214.
[25]Walberer M,Rueger MA,Simard ML,Emig B,Jander S,Fink GR,et al.Dynamics of neuroinflammation in the macrosphere model of arterio-arterial embolic focal ischemia:an approximation to human stroke patterns[J].Exp Transl Stroke Med,2010,2(1):22.
[26]Szalay G,Martinecz B,Lénárt N,Környei Z,OrsolitsB, JudákL, etal.Microglia protect against brain injury and their selective elimination dysregulates neuronal network activity after stroke[J].Nat Commun,2016,7:11499.
[27]Kitamura Y,Takata K,Inden M,Tsuchiya D,Yanagisawa D,Nakata J,et al.Intracerebroventricular injection of microglia protects against focal brain ischemia[J].J Pharmacol Sci,2004,94(2):203-206.
[28]Lee EJ,Moon PG,Baek MC,Kim HS.Comparison of the effects of matrix metalloproteinase inhibitors on TNF-α release from activated microglia and TNF-α converting enzyme activity[J].Biomol Ther(Seoul),2014,22(5):414-419.
[29]Kim GS,Cho S,Nelson JW,Zipfel GJ,Han BH.TrkB agonist antibody pretreatment enhances neuronal survival and long-term sensory motor function following hypoxic ischemic injury in neonatal rats[J].PLoS One,2014,9(2):e88962.
[30]Dobolyi A,Vincze C,Pál G,Lovas G.The neuroprotective functions of transforming growth factor beta proteins[J].Int J Mol Sci,2012,13(7):8219-8258.
[31]Tobin MK,Bonds JA,Minshall RD,Pelligrino DA,Testai FD,Lazarov O.Neurogenesis and inflammation after ischemic stroke:what is known and where we go from here[J].J Cereb Blood Flow Metab,2014,34(10):1573-1584.
[32]Lin R,Cai J,Nathan C,Wei X,Schleidt S,Rosenwasser R,et al.Neurogenesis is enhanced by stroke in multiple new stem cell niches along the ventricular system at sites of high BBB permeability[J].Neurobiol Dis,2015,74:229-239.
[33]Zhao C,Deng W,Gage FH.Mechanisms and functional implications of adult neurogenesis[J].Cell,2008,132(4):645-660.
[34]Kerschensteiner M,Meinl E,Hohlfeld R.Neuroimmune crosstalk in CNS diseases[J].Results Probl Cell Differ,2010,51:197-216.
[35]Thored P,Heldmann U,Gomes-Leal W,Gisler R,Darsalia V,Taneera J,et al.Long-term accumulation of microglia with proneurogenic phenotype concomitant with persistent neurogenesis in adult subventricular zone after stroke[J].Glia,2009,57(8):835-849.
[36]Jin K,Wang X,Xie L,Mao XO,Zhu W,Wang Y,et al.Evidence for stroke-induced neurogenesis in the human brain[J].Proc Natl Acad Sci USA,2006,103(35):13198-13202.
[37]Tang Y,Wang J,Lin X,Wang L,Shao B,Jin K,et al.Neural stem cell protects aged rat brain from ischemia-reperfusion injury through neurogenesis and angiogenesis[J].J Cereb Blood Flow Metab,2014,34(7):1138-1147.
[38]Nada SE,Tulsulkar J,Shah ZA.Heme oxygenase 1-mediated neurogenesis is enhanced by Ginkgo biloba (EGb 761®) afterpermanentischemic stroke in mice[J].Mol Neurobiol,2014,49(2):945-956.
[39]Tang Y,Le W.Differential roles of M1 and M2 microglia in neurodegenerative diseases[J].Mol Neurobiol,2016,53(2):1181-1194.
[40]Wake H,Moorhouse AJ,Jinno S,Kohsaka S,Nabekura J.Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals[J].J Neurosci,2009,29(13):3974-3980.
[41]Wang J,Yang Z,Liu C,Zhao Y,Chen Y.Activated microglia provide a neuroprotective role by balancing glial cell-line derived neurotrophic factor and tumor necrosis factor-α secretion after subacute cerebral ischemia[J].Int J Mol Med,2013,31(1):172-178.
[42]Chen Y,Won SJ,Xu Y,Swanson RA.Targeting microglial activation in stroke therapy:pharmacological tools and gender effects[J].Curr Med Chem,2014,21(19):2146-2155.
[43]Katayama T,Kobayashi H,Okamura T,Yamasaki-Katayama Y,Kibayashi T,Kimura H,et al.Accumulating microglia phagocytose injured neurons in hippocampal slice cultures:involvement of p38 MAP kinase[J].PLoS One,2012,7(7):e40813.
[44]Giraldi-Guimarães A,de Freitas HT,Coelho Bde P,Macedo-Ramos H,Mendez-Otero R,Cavalcante LA,et al.Bone marrow mononuclear cells and mannose receptor expression in focal cortical ischemia[J].Brain Res,2012,1452:173-184.
[45]Miao XY,Liu XB,Yue Q,Qiu N,Huang WD,Wang JJ,et al.Deferoxamine suppresses microglia activation and protects against secondary neural injury after intracerebral hemorrhage in rats[J].J South Med Univ(南方医科大学学报),2012,32(7):970-975.
[46]Chen Z,Jalabi W,Shpargel KB,Farabaugh KT,Dutta R,Yin X,et al.Lipopolysaccharide-induced microglial activation and neuroprotection against experimental brain injury is independent of hematogenous TLR4[J].J Neurosci,2012,32(34):11706-11715.
[47]SuEJ, CaoC, FredrikssonL, NilssonI,Stefanitsch C,Stevenson TK,et al.Microglialmediated PDGF-CC activation increases cerebrovascular permeability during ischemic stroke[J].Acta Neuropathol,2017,134(4):585-604.
[48]Boscia F,Esposito CL,Casamassa A,de Franciscis V,Annunziato L,Cerchia L.The isolectin IB4 binds RET receptor tyrosine kinase in microglia[J].J Neurochem,2013,126(4):428-436.
[49]Wolf SA,Gimsa U,Bechmann I,Nitsch R.Differential expression of costimulatory molecules B7-1 and B7-2 on microglial cells induced by Th1 and Th2 cells in organotypic brain tissue[J].Glia,2001,36(3):414-420.
[50]Hacke W,Kaste M,Bluhmki E,Brozman M,Dávalos A,Guidetti D,et al.Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke[J].N Engl J Med,2008,359(13):1317-1329.
[51]Fonarow GC,Smith EE,Saver JL,Reeves MJ,Bhatt DL,Grau-Sepulveda MV,et al.Timeliness of tissue-type plasminogen activator therapy in acute ischemic stroke:patient characteristics,hospital factors,and outcomes associated with door-toneedle times within 60 minutes[J].Circulation,2011,123(7):750-758.
[52]Jin Q,Cheng J,Liu Y,Wu J,Wang X,Wei S,et al.Improvement of functional recovery by chronic metformin treatment is associated with enhanced alternative activation ofmicroglia/macrophages and increased angiogenesis and neurogenesis following experimentalstroke [J].BrainBehavImmun,2014,40:131-142.
[53]LopesRS, CardosoMM, SampaioAO,Barbosa MS Jr,Souza CC,DA Silva MC,et al.Indomethacin treatment reduces microglia activation and increases numbers of neuroblasts in the subventricular zone and ischaemic striatum after focal ischaemia[J].J Biosci,2016,41(3):381-394.
[54]Shin JA,Lim SM,Jeong SI,Kang JL,Park EM.Noggin improves ischemic brain tissue repair and promotes alternative activation of microglia in mice[J].Brain Behav Immun,2014,40:143-154.
[55]GuglielmettiC, Le Blon D, SantermansE,Salas-Perdomo A,Daans J,De Vocht N,et al.Interleukin-13 immune gene therapy prevents CNS inflammation and demyelination via alternative activation of microglia and macrophages[J].Glia,2016,64(12):2181-2200.
[56]Sun K,Fan J,Han J.Ameliorating effects of traditional Chinese medicine preparation,Chinese materia medica and active compounds on ischemia/reperfusion-induced cerebral microcirculatory disturbances and neuron damage[J].Acta Pharm Sin B,2015,5(1):8-24.
[57]Miyamoto A,Wake H,Ishikawa AW,Eto K,Shibata K,Murakoshi H,et al.Microglia contact induces synapse formation in developing somatosensory cortex[J].Nat Commun,2016,7:12540.
[58]Pan J,Jin JL,Ge HM,Yin KL,Chen X,Han LJ,et al.Malibatol A regulates microglia M1/M2 polarization in experimental stroke in a PPARγ-dependent manner[J].J Neuroinflammation,2015,12:51.
[59]Sharma A,Sane H,Gokulchandran N,Khopkar D,Paranjape A,Sundaram J,et al.Autologous bone marrow mononuclear cells intrathecal transplantation in chronic stroke[J].Stroke Res Treat,2014,2014:234095.
[60]Chernykh ER, Shevela EY, Starostina NM,Morozov SA,Davydova MN,Menyaeva EV,et al.Safety and therapeutic potential of M2 macrophages in stroke treatment[J].Cell Transplant,2016,25(8):1461-1471.

