脊髓损伤与修复研究进展及展望
黄振晖,刘耀波
(苏州大学神经科学研究所,江苏省重大神经精神疾病研究重点实验室,江苏苏州 215123)
脊髓损伤通常是指由于外伤等多种原因所造成的脊髓直接损伤,导致损伤平面以下的运动和感觉功能不同程度的缺失,甚至运动和感觉功能完全丧失出现截瘫。世界卫生组织(World Health Organization,WHO)及欧美国家的流行病学研究显示,全世界脊髓损伤的发生率平均每百万人10~40人。中国和美国均为脊髓损伤高发生率国家(每年每百万人>40人),美国脊髓损伤的发病率可达每年每百万人40~50人,国内尤其在经济发达地区,如北京和上海等地,脊髓损伤的发病率可达每年每百万人50~60人,造成脊髓损伤的原因主要是车祸、跌落和暴力等因素引起的外伤[1-3]。脊髓损伤后,如何恢复神经功能使截瘫患者站起来,仍然是难以攻克的医学难题,国内外目前也尚无有效治疗脊髓损伤后截瘫的药物或技术。脊髓损伤患者均需要长期的保守治疗和康复训练来维持或改善残存的神经功能。因此,围绕脊髓损伤的机制、治疗和康复的研究已成为当今生物医学界的重大课题之一,脊髓损伤修复也成为了全世界医学界高度关注并投入巨资研究的重大医学难题。
1 脊髓损伤病理过程
脊髓损伤的具体病理过程主要包括脊髓损伤发生时的原发性机械损伤,以及随后由于微循环障碍、过度炎症反应等导致的继发性损伤。
1.1 原发性损伤
机械外力对脊髓的直接创伤使脊髓损伤区域被压迫、震荡、出血甚至断裂,引发脊髓中上下行神经纤维(运动和感觉神经通路)脱髓鞘、断裂甚至脊髓神经元的直接死亡。具体而言,脊髓中的神经轴突会在损伤末端发生轴突和髓鞘退行性变性,其中的微管、神经丝、线粒体等结构在脊髓损伤后数小时内逐步降解成散布于轴浆内并持续堆积的碎片化颗粒,并且在短时间内自断裂处末端封闭形成回缩膨大结构,阻止轴浆中的线粒体等细胞器的持续分解和流出。另外,损伤后数天内损伤末端的轴突都极易断裂而使其连续的结构消失;相对于周围神经系统,中枢神经系统的轴突在损伤后清除损伤轴突及其外面的髓鞘碎片的效率较低,这与周围神经系统中施旺细胞和巨噬细胞的高活性有关[4-5]。
1.2 继发性损伤
脊髓损伤后,脊髓血管会因为机械外力等物理因素、以及血液中释放的血管收缩因子等化学因素发生血栓、收缩闭塞等病理变化,导致渐进性缺血或血肿。尤其是在脊髓灰质区,由于血管更为丰富,出血点也常由此扩散,往往逐渐联合蔓延形成炎性血肿区域,进一步引发细胞凋亡[6];与此同时,血液中的单核细胞、淋巴细胞、中性粒细胞,联合神经系统中的小胶质细胞,均大量释放炎性因子,互相促进细胞凋亡的发生,并导致脱髓鞘的发生和局部胶质瘢痕的过度增生[7-8]。需要具体指出的是,上述血细胞和脊髓损伤后中枢神经系统内固有的小胶质细胞等激活而释放特定分子,刺激损伤处附近的星形胶质细胞在基因表达、形态学和功能上都发生了迅速的变化,反应性星形胶质细胞通过连续、分级和特定的反应进入应激态,所合成并分泌到细胞外基质中的硫酸软骨素等会对受损的轴突再生产生明显的阻抑作用[7-8]。另外,髓鞘相关分子、神经导向信号分子,以及神经黏附分子等也会在损伤后对神经轴突有不同程度的影响。
谷氨酸和天冬氨酸等作为脊髓中主要的兴奋性神经递质,在脊髓损伤后会出现病理性浓度增高,即使在膜完整性不受损的前提下也会刺激谷氨酸受体引起相应离子通道的过度开放,引发的钠、钾和钙等离子电解质的失衡,共同引起细胞外钠/钙离子大量内流且细胞器内钙离子释放入细胞质,引发多种钙依赖性蛋白激酶及特定磷脂酶等的活化,经过各种级联放大反应,最终导致细胞凋亡[9-10]。同样,微循环障碍产生的过量自由基对细胞膜脂质的过氧化作用,不但使膜上离子通道的正常结构被破坏,还严重破坏膜的完整性引发胞内电解质紊乱。另外,对于线粒体等细胞器发生脂质过氧化不仅会引起其中细胞色素c释放,还能释放出大量活性氧,进一步作用于细胞内部其他区域,大大加速细胞凋亡,最终引起细胞凋亡或坏死[11-14]。
2 脊髓损伤的神经生物学机制
脊髓损伤所致的损伤神经不能再生,以及环路破坏、神经元死亡所造成的神经环路相关结构和功能不可逆的丢失,是脊髓损伤领域目前公认的难以完全攻克的难题之一。脊髓中控制运动感觉神经环路主要由4部分组成,包括来自高级中枢的下行输入支配、来自外周的感觉信息的传入、脊髓内中央模式发生器(central pattern generators,CPG)为核心的局部神经环路以及最终的外周效应单元如肌肉等[15-16]。
来自脑区的下行输入支配,包含来自体感运动皮质、中脑和脑干等区域的谷氨酸能的兴奋性输入如皮质脊髓束、红核脊髓束等的支配,以及分别来自中脑和脑干区域的去甲肾上腺素能和5-羟色胺能的兴奋性输入如网状脊髓束、缝核脊髓束等,通过前馈机制等方式对运动协调功能进行规划和调整。而来自外周的感觉信息的传入,通过前馈、负反馈等机制对运动协调功能进行实时调节,从而将信息进一步整合到局部神经环路[17-18(]图1)。
脊髓中具有CPG功能的中间神经元构成的局部神经环路,是控制下游肌肉节律运动的“起搏器”单元,因为其具有自主兴奋的特点,相对独立于运动感觉上下行输入的支配。一般来说,CPG构成的局部神经环路由谷氨酸能等兴奋性的中间神经元,和γ-氨基丁酸能、甘氨酸能等抑制性的中间神经元共同偶联而成,控制模式相对多样化。例如,兴奋性中间神经元(V2a中间神经元)激活同侧相关的运动神经元,同时通过激活抑制性中间神经元等多种方式,抑制对侧相关的运动神经元,实现同侧肢体和对侧肢体的协调运动[15-18](图1)。进而,由脊髓损伤引起的对外周组织的支配如神经肌肉接头的影响是多方面的,如脊髓损伤导致从中枢神经系统对肌肉分泌的一系列神经营养因子减少;神经肌肉接头处乙酰胆碱能的分支支配存在神经和肌源性分子的双向作用机制,当突触前膜或突触后膜一侧受损时,另外一侧也会出现功能缺陷。另外,脊髓损伤也会引起对神经肌肉接头有重要保护作用的外周神经膜细胞的凋亡,从而加速神经信号传递效率的降低和神经营养因子分泌的减少[19-20]。因此,脊髓损伤会导致神经肌肉接头和肌肉本身的一系列退行性病变,最终导致萎缩甚至坏死。

图1 脊髓神经环路层面的控制机制.
因此,脊髓损伤的神经生物学机制是:由于脊髓损伤不同程度地破环了来自高级中枢的下行输入支配和来自外周的感觉信息的传入,阻碍了高级中枢和感受器通过前馈、反馈等机制对运动协调功能进行的规划和调整,同时也在一定程度上影响到具有相对自主性和可塑性的局部神经环路的正常功能的进行。
3 脊髓损伤研究的动物模型
脊髓损伤基础研究领域常用的实验动物有小鼠和大鼠。它们作为哺乳动物的模式动物,与人类基因具有较高的同源性,小鼠可使用多种基因调控技术(如基因敲除、敲入等),繁殖相对高效且使用成本较低,是本领域最常用的实验动物。大型动物如猫、犬、猪和猴等也常用于脊髓损伤研究,尤其是作为非人灵长类的动物如狨猴和猕猴等,使用成本虽相对高,但非常接近人类脊髓的形态、生理参数,以及运动和感觉行为功能,研究数据价值较高[21]。
动物脊髓损伤模型主要分为切断损伤模型、砸击损伤模型、压迫损伤模型、缺血损伤模型和化学损伤模型等。切断损伤模型又分为特定脊髓节段的全横断、半横断、背侧部分切断等损伤模型,主要应用于脊髓损伤后的再生修复研究,包括评估各类型轴突的再生能力和突触重建,探讨输送各类药物和(或)移植细胞对脊髓的功能恢复的作用等[22]。该法建模相对稳定,个体差异能被有效控制,便于研究比较损伤后脊髓恢复的程度,以及对疗效的定量分析。脊髓全横断模型的缺点是临床上相对少见,临床借鉴意义较小,且易引起动物排尿排便完全失控、产生过重的炎症和死亡等情况,术后日常护理要求较高。砸击损伤模型是手术暴露特定节段的脊髓后,通过控制一定质量物体从特定高度自由落体砸击脊髓,或利用能实时感应对脊髓的压力的电磁砸击器来实现。其中,机械砸击时对脊髓和脊柱的移位会有个体差异,且砸击脊髓时易造成二次损伤;而电磁砸击器可实现可控的高速运动物体撞击脊髓造成的损伤模型,到达预设压力会自动收回从而避免了反弹造成的二次损伤[23]。压迫损伤模型又可简单分为急性和慢性2类。急性压迫损伤模型的手术在暴露特定节段的脊髓后,通过手术钳夹住特定节段脊髓,可模拟现实条件下小规模物体钝性机械撞击所导致的骨错位等情况,造成脊髓小范围急性变形损伤模型[24]。慢性压迫损伤模型可通过植入气囊等方式对脊髓造成持续压迫,临床上椎间盘突出等原因往往会造成类似的长期局部压迫损伤。一般来说压迫损伤模型对脊髓完整性影响较小,且夹击力度和时间可控性相对较好[23]。缺血损伤模型又分为血管机械封闭法和血管电凝封闭法等。在暴露特定节段的脊髓后,脊髓缺血损伤模型可通过栓塞、夹闭、电凝等手段模拟脊髓缺血再灌注造成的损伤,并进一步研究损伤的病理机制和特定介入手段的疗效[25]。一般来说,脊髓缺血损伤后,损伤位点周边脊髓组织影响相对较小。化学损伤模型是手术暴露特定节段的脊髓后,局部注射特定的化学物质,通常用于模拟脊髓损伤后,各种内源性因子互相影响所造成的继发性级联反应,如缺血和脱髓鞘等[23,26]。
实际的临床脊髓损伤大都是多中心、闭合创伤、损伤状态很不稳定,这是脊髓损伤动物模型难以模拟的。上述脊髓损伤模型各有优缺点,反映并模拟临床状况的某个或某些方面。在今后研究中,依据各自的要求和具体情况,实现脊髓损伤制备装置标准化,实验动物使用和手术操作流程规范化,尽量提高实验流程的可控性和实验结果的可重复性。
4 脊髓损伤修复的基础研究方向
4.1 神经再生的分子机制和基因调控
脊髓损伤后中枢神经不能再生是脊髓损伤当前难以完全攻克的难题之一。围绕其开展的分子机制研究在近十几年取得较大进展,主要包括损伤外环境分子的调控机制,以及神经元再生能力的分子调控机制。
损伤外环境分子的调控机制包括胶质瘢痕所构成的损伤环境中的细胞外基质分子,如硫酸软骨素蛋白聚糖[27-28]和细胞黏合素C(tenascin-C)[28-29];髓鞘相关分子,如轴突生长抑制因子(Nogo)[28,30]、髓鞘相关糖蛋白[28,31]和少突胶质细胞髓鞘糖蛋白[28,32]等;发育中影响神经轴突投射并且损伤后被再次诱导表达的分子,如排斥性轴突导向分子如无翅型整合位点家族成员5a(Wnt5a)及其受体受体酪氨酸激酶(Ryk)[33-35]、信号素家族成员3A(Sema3A)及其受体神经纤毛蛋白1(neuropilin-1)和神经丛蛋白(plexin)[36]、肝配蛋白B3(ephrinB3)及受体促红细胞生成素产生肝细胞基因家族成员A4(EphA4)[37]等;神经黏附分子,如L1神经细胞黏附分子的紧密同源分子[38]和接触蛋白家族成员6(contactin 6,CNTN6/NB-3)等[39-40]。需要补充说明的是,虽然传统概念里脊髓损伤瘢痕区域的星形胶质细胞和成纤维细胞等分泌多种抑制性分子并形成胶质瘢痕的物理屏障,但近几年研究提示,损伤区域反应性星形胶质细胞也能降低炎症反应,同时形成“桥接联系”也是轴突再生所必须的因素之一[28,41-43]。
神经元再生能力的分子调控机制主要是调控神经元再生能力的基因,包括抑癌基因类如第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)[44]、转录因子类的哺乳动物性别决定因子相关的同源基因家族成员11(SOX11)[45]和控制细胞内能量代谢和轴浆运输的分子网络如Krüppel样转录因子等[46],控制细胞内细胞骨架的变化,尤其是微观稳定性的分子网络如双肾上腺皮质激素样激酶等[47],控制损伤相关的基因如低氧诱导因子家族成员1α等[48]。另外,表观遗传学的调控手段如组蛋白去乙酰化酶[49]、DNA甲基化相关基因如甲基胞嘧啶双加氧酶等[50],还有微小RNA诸如Micro-375对神经再生的调控作用也逐渐引起关注[51]。这些分子机制的发现,为促进脊髓损伤后神经轴突的再生提供了重要的分子靶点(图2)。
4.2 细胞修复机制及应用
迄今为止,应用于脊髓损伤治疗的细胞主要有2类:具有特定分化潜力的干细胞大类,包括胚胎干细胞、神经干细胞、少突胶质前体细胞和间充质干细胞,以及近年来兴起的人工干预已分化成熟的细胞去分化,并再次向特定方向分化得到的干细胞类型,即诱导性多能干细胞等[52];另外就是有特定功能的成熟细胞,如嗅鞘细胞、施旺细胞和巨噬细胞等。
脊髓损伤后细胞移植所起到的修复作用主要有有3类:直接代替损伤和(或)坏死的神经元,重新构建功能性神经环路;分泌神经营养因子等,改善脊髓损伤区域的微环境,并抑制炎性反应及瘢痕组织形成,提供神经元保护作用;协助损伤神经轴突再次髓鞘化,恢复脊髓中神经放电的传导,促进相关功能重建。
胚胎干细胞/神经干细胞/少突胶质前体细胞:将神经干细胞或少突胶质前体细胞等移植到脊髓损伤区域,试图修复神经元胞体及其轴突(包括重建髓鞘)。移植了神经前体细胞或少突胶质前体细胞后,通过免疫组织化学和电生理检测等手段发现,移植的干细胞能定向迁移、增殖、分化并成熟,分泌血管内皮生长因子和脑源性神经营养因子等,受损处会有新的血管及髓鞘重建,运动功能也有明显改善[53-54]。人胚胎干细胞具有广泛的临床应用潜能,但在使用上一直存在伦理问题。
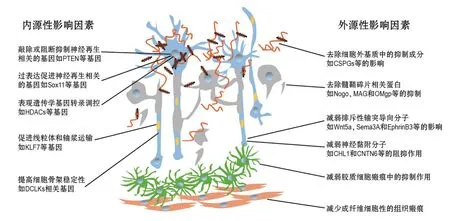
图2 神经再生的分子调控网络示例.
间充质干细胞:成体中依然存在于骨髓和脐带中因而相对易得,具有较强的增殖和分化能力,细胞移植后无免疫排斥反应,且冻存复苏后性质依然相对稳定。混合于生物兼容性材料的间充质干细胞通过分泌神经营养因子能为神经元提供保护作用,并促进功能恢复[55]。
诱导性多能干细胞:终末分化细胞可被诱导为多功能干细胞的技术,不仅规避了伦理学的争议,同时可避免伦理、道德及法律带来的制约,更重要的是其具有类似于胚胎干细胞的潜在特性。多个实验室报道显示,诱导性多能干细胞可分化表达成神经细胞、骨髓间充质细胞、施旺细胞、嗅鞘细胞等,并能在脊髓损伤后不同程度上重建神经环路,从而改善相应功能[52-53,56-59]。
嗅鞘细胞和神经膜细胞:它们分别存在于中枢和周围神经系统,但两者分离、纯化、增殖后都可用于脊髓损伤后损伤区域的移植,使受损的神经纤维重建髓鞘,并分泌脑源性神经营养因子、神经生长因子、胶质细胞源性神经营养因子等多种因子促进神经保护,还会分泌如纤连蛋白和层粘连蛋白等基质促进轴突生长,但研究显示,通常该类细胞移植需要配合其他干细胞类型或材料共同移植,来实现更好的功能恢复[58-59]。临床研究的报道也表明,嗅鞘细胞/施旺细胞移植是一种相对安全的方法,但是目前仍然需要在疗效方面做进一步深入的研究[59-60]。
被激活的巨噬细胞:脊髓损伤后激活的巨噬细胞通过趋化性侵入损伤区域附近,并分泌细胞黏附分子和神经生长因子等。移植激活的巨噬细胞到损伤的脊髓中一定程度上能促进脊髓功能的修复[58-59]。
4.3 生物材料的修复机制及应用
脊髓损伤后生物材料的修复及应用,主要是作为所移植的细胞和所包裹的神经营养因子等药物的载体,从而能为神经环路的重建提供良好的微环境,并进一步促进脊髓组织的修复。目前生物兼容材料应用得比较广泛的主要是以下几大类:水凝胶为主要成分的移植材料、体外预搭建的框架型材料为主要成分的移植材料以及两者的混合型。
水凝胶含水量接近人体组织,天然组分的水凝胶虽无法如合成的聚合物一样精确调控组分,但依然能保证其多空隙结构,从而使得所移植的细胞与外界环境的物质能量交换能来去畅通,同时,这种结构蕴含了巨大的表面空间,能为移植细胞增殖、迁移、分化等生理过程,以及所包被的神经营养因子等药物的释放提供条件。天然水凝胶能促进所移植的干细胞迁移和神经轴突再生进凝胶基质,尤其是经过酶消化处理后去除细胞的、以细胞外基质为主体的水凝胶,是一种保留了包括层黏连蛋白、纤连蛋白、胶原和神经营养因子等主要细胞外组分的水凝胶材料。脊髓损伤后,通过在脊髓组织中移植混合了神经干细胞的该水凝胶,能在其中观察到神经再生,同时受损轴突的脱髓鞘程度明显减少,并促进了运动功能的恢复[61-62]。人工合成的水凝胶其生物相容性和天然材料特性基本一致(部分人工合成类的水凝胶会经过一定化学修饰),具有减少损伤空洞、提供桥接空间、抑制胶质瘢痕形成、促进损伤轴突的再次髓鞘化和进一步生长等修复功能[63-64]。
体外预搭建的框架型材料,无论是天然材料还是可精确调控生产工艺的人工合成聚合物,均具有的优点是:体外预搭建框架力学结构相对稳定,至少比水凝胶降解要慢,可实现更长时间的结构支撑和药物缓释等功能,其加工过程中对内部孔隙比例和化学成分修饰可进行精确调控,为细胞移植、轴突再生及神经突触的重建提供机械支撑的框架结构以及模拟的化学导向信息[64-65]。混合了移植细胞和营养因子的体外预搭建的框架性材料植入损伤区域以后,能在脊髓损伤模型上观察到一定程度上减少硫酸软骨素表达、支持神经轴突生长、促进神经元髓鞘化和增进功能恢复的现象,在其降解后,再生的神经轴突基本连接了损伤区域的间隙并展现出有序的纵向结构,另外还能有效促进运动功能的恢复[66-71]。
近年来研究发现,结合3D打印等新型材料构建技术[72],制作以上2种材料的混合型,能充分发挥它们各自的优势,不仅能实现神经营养因子等药物的可控释放,改善损伤脊髓微环境,还能显著促进损伤区的移植神经细胞的存活、增殖、分化,并能引导神经纤维的定向再生、轴突髓鞘化和突触再形成。需要指出的是,结合生物兼容材料的细胞移植由于损伤模型等参数的不同,很难进行不同实验室研究之间横向定量的修复效果的比较,同时其修复效果的机制依然有待进一步研究阐明。
4.4 神经保护机制及应用
脊髓损伤后神经保护的机制及应用主要包括针对原发性脊髓损伤的神经保护和针对继发性脊髓损伤的神经保护。
针对原发性脊髓损伤的神经保护是针对急性反应时期神经营养因子缺失的药物,比如维生素B12的活性代谢产物如甲钴胺(弥可保,mecobalamin),主要作用为促进核酸蛋白质的合成代谢,尤其是合成卵磷脂的代谢,促进髓鞘的重建[73];另外,在小鼠脊髓损伤模型中,赛生灵(cethrin,非专利名称BA-210,丝氨酸/苏氨酸激酶的一种抑制剂)在早期能降低细胞凋亡发生率,有促进轴突生长并重建功能的作用[74];而阿托伐他汀(atorvastatin)治疗能减轻髓鞘缺失,并通过减少释放白细胞介素1β和肿瘤坏死因子α防止细胞凋亡和胶质细胞过度增生[75]。针对继发性脊髓损伤的神经保护,又主要分为:①作用范围相对较广的激素及其衍生物等配体类:皮质类固醇类如人工合成的甲泼尼龙(甲强龙,methylprednisolone),因其抗炎反应的良好效果,临床上长期用于减轻脊髓急性损伤后的水肿,其可能机制为防止过量钙离子涌入细胞,降低炎症细胞因子引起过度的炎症和免疫反应,并抑制脂质过氧化和自由基的合成,增强中枢神经系统血流量等,但同时也会增加呼吸系统并发症所导致的肺栓塞、重症肺炎和败血症的继发死亡风险,所以在脊髓损伤时使用这种治疗方法是否合适依然有待进一步深入研究[76];促甲状腺激素释放激素及其类似物,能有效抑制由兴奋性氨基酸、内源性阿片多肽类以及血小板激活因子等引起的继发性损伤,同时也能降低脂类降解引发的过氧化作用,并增加血流[77];红细胞生成素及其衍生物,作为内源性神经营养因子的一种,能有效降低脊髓损伤后脂质过氧化作用,降低中性粒细胞引发的炎症反应,并抑制细胞凋亡等[78];另外发现雌激素以及黄体酮,同样能提供相应的神经营养因子,降低过氧化作用导致的过量自由基数量,抑制炎症细胞因子的产生,降低继发性神经损伤的兴奋性毒性并减少细胞凋亡[79-80]。②神经递质受体和(或)离子通道抑制剂:谷氨酸的N-甲基-D-天冬氨酸受体拮抗剂如加环利定(gacyclidine),能促进脊髓损伤小鼠模型中的组织和电生理状态的修复,有效缓解脊髓损伤后继发性神经损伤,但对主要兴奋性神经递质的抑制所引起的副作用也应引起高度关注[81];阿片样多肽类的受体拮抗剂如纳洛酮(naloxone),研究发现能缓解脊髓损伤后内源性阿片多肽类的大量涌出导致的钠离子通道等打开引发的兴奋毒性,从而可以反转脊髓损伤后引发的电流震荡,同时它还能增加血流供应量[82];钙通道阻滞剂如尼莫地平(nimodipine)同样可增加损伤后脊髓血流量,改善微环境,但同时其血流调节作用所导致的大范围低血压的潜在风险也需要引起重视[83];另外,神经节苷脂如单唾液酸神经节苷脂,一方面能降低脊髓损伤后兴奋性氨基酸的毒性,另一方面可缓解自由基带来的过氧化作用,从而能促进轴突生长及提高脊髓损伤区域神经元和轴突的存活比例[84-85];而在神经保护作用方面被广泛认可的镁离子,除能刺激血管内皮细胞分泌前列环素扩张脊髓的血管,以及降低神经组织中自由基的产生实现神经保护以外,还可通过拮抗谷氨酸过量带来的毒性作用最终降低脂质过氧化作用[86]。③主要用于抗氧化实现神经保护的相关药物:脊髓损伤后自由基增加,除了抗坏血酸和在脊髓损伤临床应用上基本摒弃的低温疗法,多种自由基清除剂已在临床上得以应用,如褪黑素(melatonin)[87]以及环氧合酶抑制剂如布洛芬(ibuprofen)[88-89]和吲哚美辛(indometacin)[89-90]等,也先后在脊髓损伤临床研究中得以应用。
5 神经信号刺激作用机制及功能康复训练
目前,在脊髓损伤修复的临床治疗中,电磁刺激并配合康复训练已成为广泛使用的治疗模式之一。脊髓损伤后,下行的电传导和神经递质的调制作用会很大程度地紊乱甚至丧失,通常人工干预的办法是利用植入或非植入的设备通过外加电场或磁场,在脊髓背侧施加恰当的硬膜外刺激(或刺激大脑运动皮质),同时适时适量加入外源的谷氨酸和5-羟色胺等神经递质,从而在局部神经环路的基础上,尝试重构下行输入对外周肌肉运动控制的功能性神经环路。当前多数研究在外加刺激时,主要刺激位置在脊髓背侧中线附近,在一定程度上也能通过控制刺激频率和幅度实现对相应伸肌和缩肌的控制[91-92]。而近十年来,随着光敏感离子通道工具的迅速发展,光刺激引起离子通道介导的电流变化对神经元功能活动调控的作用[93-94],也逐渐受到脊髓损伤修复领域广泛的关注和研究。
另外,通过康复训练修复或促进形成新的功能性神经环路,在基础和临床领域也都有了长足的进展,特别是针对不同脊髓节段不同程度损伤,分别引起的运动能力受损、呼吸功能不全和排尿功能障碍等症状的功能改善研究。针对运动能力受损症状的基础研究,一般来说是在脊髓损伤后,通过微电流脉冲等各种刺激,经由脑到脊髓再到肌肉各个节点的兴奋传导,引起肌肉收缩和肢体的某些规律运动,从而促进抓取、站立、行走等生理功能的恢复,主要包括:中枢神经中运动相关的上下行传导束的再生和突触再形成;以脊髓特定节段中运动相关的、有自激兴奋特性的、CPG细胞为中心的局部神经环路的重建;还有就是外周神经肌肉连接的修复。局部电刺激可在一定程度上促进轴突的延伸,配合干细胞移植手段形成新的突触联系,并观察到电传导现象,一定程度上实现了功能重建[91-92,95];通过电刺激结合辅助康复训练设备强化其弛缓性麻痹而暂时失去反射的四肢肌肉,促进新血管形成而改善毛细血管和血流,改善神经肌肉萎缩,缓解肌肉质量下降和骨骼密度损失的状况,恢复、强化或再建其肢体功能[96-100];利用瞬时大电流产生的脉冲磁场和皮肤、脂肪、骨骼的高阻抗,产生微小感应电流而实现的无痛磁刺激,同样也能刺激脊髓损伤后受到抑制的体感运动皮质的神经元,改善损伤节段以下、部分或全部中断的下行传导所累及的神经元输入障碍,以及缓解递质、神经营养因子分泌缺失等状况,在某一特定皮质区给予的重复和规律的刺激能在功能修复方面产生长时程效应和累积效应[101-102];利用光敏感离子通道蛋白的特性,在特定光刺激的前提下,分别利用干细胞移植手段或基因治疗手段,在脊髓损伤区域引入神经干细胞等或SOX11等基因的过表达,观察发现均能在一定程度上实现轴突再生、功能性突触再建等现象[103-104]。
针对脊髓损伤后呼吸功能不全的基础研究:脊髓颈段神经元和外周膈神经等共同控制着包裹胸腔的膈肌等肌肉的正常收缩,因而脊髓颈段损伤会引起自主呼吸功能不全症状。除了节律性刺激膈神经的膈肌起搏技术,对脊髓颈段的功能性电刺激同样对呼吸相关的生理功能有明显的改善作用[105]。
针对脊髓损伤后排尿功能障碍的基础研究:脊髓腰骶段神经元和相应的外周神经共同控制着膀胱和尿道等肌肉的正常收缩,因此脊髓腰骶段的损伤会引起排尿功能障碍的症状。作为脊髓损伤后的常见并发症即泌尿系统并发症也是后期死亡的主因之一。通过特定的电刺激手段对脊髓腰骶段进行刺激,结合专业、系统的护理和自身的康复训练,促进自主排尿节律的逐步恢复,并可缓解泌尿系统并发症[106]。
6 大数据时代背景下人工智能和脑机接口的应用
近年来在大数据时代背景下,学者们充分利用拓扑数据分析等人工智能算法工具,尝试对大量的脊髓损伤基础和临床研究数据开展分析应用[107]。利用神经编码信号相关的大数据,来自瑞士联邦理工学院(洛桑)(École Polytechnique Fédérale de Lausanne,EPFL)的研究工作揭示,通过在非人灵长类恒河猴上构建对应下肢区域的运动皮质区的脑机接口系统,实现无线控制的硬膜外刺激,能在一定程度上缓解脊髓损伤后的运动能力的缺失[108]。同样来自EPFL的研究工作发现,脊髓损伤患者通过脑-机接口设备相联后能准确记录到其运动意向的神经信息,同时调制输出信息可以指导机器人外骨骼辅助运动设备,协助患者进行意向性运动的康复训练,最终研究人员能检测到受试患者的外周感觉功能(触感和痛感)有较明显恢复,且肌肉收缩能力也有部分恢复[109]。人工智能技术的快速进步,为高通量记录神经信号、获得这些大数据进行计算分析,以及通过调制、拷贝使用这些神经信号提供了强有力的武器;同时,在高速网络时代,云存储和可穿戴设备等技术的成熟,为针对治疗脊髓损伤的神经信号刺激和康复一体化设备的研发提供了重要的基础。但是,为了实现更特异性、更高效和更精确的神经环路刺激效果,柔性多电极阵列、可植入的无线刺激器等新型工具的研发、闭环神经刺激调制和电极位置计算建模的改进提高是目前急需深入研究的重要课题[91-92,108-109]。
7 结语和展望
由上可见,脊髓损伤基础研究领域随着技术突破进展日新月异,近年来在基因调控、细胞移植、生物材料应用、神经保护和神经康复训练等各个方向上都取得了相当程度的进展,未来可在更大范围开展多学科更深程度的交叉合作研究。基础研究方面,内源性神经轴突再生能力的提高、外源性损伤环境的解析和改善、破解干细胞移植中神经细胞分化和连接、神经环路重建的分子细胞机制,以及其他有前景的新的研究方向和技术推广等;临床研究方面,开展脊髓损伤治疗药物、细胞和生物材料的临床试验等,在脊髓损伤诊治中临床影像学技术的应用,临床脊髓损伤分型的标准制定、临床试验大样本收集分析的规范化、其他有效的临床康复新技术的推广,以及脊髓损伤患者的心理干预等等。相信在不远的将来,我国在常规的脊髓损伤研究和临床应用中,也能记录和分析脊髓损伤个体大脑意愿的神经信号,同时以分子调控、细胞移植、神经保护药物等手段辅助高级(脑)和低级(延髓、脊髓)中枢间的神经环路的保护、维系甚至重新桥接,并以电、磁、光等各种输送形式向脊髓具有一定自主性、控制感觉运动相关的局部神经环路给予刺激,达到对相关神经环路的精细调节,再通过各种康复手段训练并强化相应神经环路的功能实现,促成脊髓损伤个体能尽快恢复自主运动,从而最终促进脊髓损伤研究和治疗在诸多领域取得更大的突破。
需要指出的是,脊髓损伤基础研究整体产出质量偏低,各地发展不均衡,科研经费重复、碎片化和利用效率不高等配置问题需进一步解决:①需要通过良好的科研文化氛围激发一线研究人员的团队凝聚力和积极性的同时,更需要落实高质量原创科技成果的转化应用等多方面的评价激励体制,除了专注于脊髓损伤研究等本领域的学科建设以外,更要注重培养跨学科、复合型的基础医学的中坚力量。②对于脊髓损伤相关研究的数据获取、表达和分享方面需要提供相关参考标准,提供脊髓损伤领域内标准化术语界定严格的、统一整合的数据资源库,以及相对更开放的脊髓损伤研究前沿领域进展的数据资源空间,以促进该领域数据的严谨、透明和可重复性,并尽量避免研究资源的重复和浪费[110-112]。③需要政府以更积极的心态整合研究资助方、科研机构、第三方独立监管机构、制药企业、外包研发部门,以及国家医疗保障服务相关机构等等,制定严格的执行规范和行业标准,提高审批效率,引导更多社会力量的进入,最大限度整合各方面的资源,促进脊髓损伤的基础研究实现更高水平的跨学科合作研究,产出更高质量的临床转化成果,从而推动脊髓损伤治疗这个医学难题取得重要的进展。
[1]National Spinal Cord Injury Statistical Center.Spinal cord injury(SCI):facts and figures at a glance[R/OL].2017,1-2.https://www.nscisc.uab.edu/reports.aspx
[2]National Spinal Cord Injury Statistical Center.NSCISC 2015 annual report(public version)[R/OL].2016,1-93.https://www.nscisc.uab.edu/reports.aspx
[3]Lee BB,Cripps RA,Fitzharris M,Wing PC.The global map for traumatic spinal cord injury epidemiology:update 2011,global incidence rate[J].Spinal Cord,2014,52(2):110-116.
[4]Phillips AA, Krassioukov AV.Cardiovascular dysfunction following spinal cord injury,neurological aspects of sptinal cord injury[M].Vancouver:Springer International,2017:325-361.
[5]Vargas ME,Barres BA.Why is Wallerian degeneration in the CNS so slow?[J].Annu Rev Neurosci,2007,30:153-179.
[6]Coleman MP,Freeman MR.Wallerian degeneration,wld(s),and nmnat[J].Annu Rev Neurosci,2010,33:245-267.
[7]Anwar MA,Al Shehabi TS,Eid AH.Inflammogenesis of secondary spinal cord injury[J].Front Cell Neurosci,2016,10:98.
[8]Lee JY,Kang SR,Yune TY.Fluoxetine prevents oligodendrocyte cell death by inhibiting microglia activation after spinal cord injury[J].J Neurotrauma,2015,32(9):633-644.
[9]Morris R.Neurotoxicity and neuroprotection in spinal cord injury,handbook of neurotoxicity[M].New York:Springer,2014:1457-1482.
[10]Umebayashi D,Natsume A,Takeuchi H,Hara M,Nishimura Y,Fukuyama R,et al.Blockade of gap junction hemichannel protects secondary spinal cord injury from activated microglia-mediated glutamate exitoneurotoxicity [J].J Neurotrauma,2014,31(24):1967-1974.
[11]Dawson TM,Dawson VL.Mitochondrial mechanisms of neuronal cell death:potential therapeutics[J].Annu Rev Pharmacol Toxicol,2017,57:437-454.
[12]Kirkinezos IG, Bacman SR, Hernandez D,Oca-Cossio J,Arias LJ,Perez-Pinzon MA,et al.Cytochrome c association with the inner mitochondrial membrane is impaired in the CNS of G93A-SOD1 mice[J].J Neurosci,2005,25(1):164-172.
[13]Serhan CN,Yacoubian S,Yang R.Anti-inflammatory and proresolving lipid mediators[J].Annu Rev Pathol,2008,3:279-312.
[14]Dietrich WD,Keane RW.Neuroinflammation:brain and spinal cord injury[M].Berlin,Heidelberg:Springer,2009:2727-2731.
[15]Arber S.Motor circuits in action:specification,connectivity,and function[J].Neuron,2012,74(6):975-989.
[16]Kiehn O.Decoding the organization of spinal circuits that control locomotion[J].Nat Rev Neurosci,2016,17(4):224-238.
[17]Ruder L,Takeoka A,Arber S.Long-distance descending spinal neurons ensure quadrupedal locomotor stability[J].Neuron,2016,92(5):1063-1078.
[18]Arber S.Organization and function of neuronal circuits controlling movement[J].EMBO Mol Med,2017,9(3):281-284.
[19]Juan CL.Synaptogenesis:the chicken,the egg and the NMJ[J].Nature Rev Neurosci,2001,2:381-382.
[20]Whalley K.Synaptic remodeling:sculpting the NMJ[J].Nature Rev Neurosci,2009,10:698.
[21]Becker CG,Becker T.Model organisms in spinal cord regeneration[M].Edinburgh:Wiley,2007,127-144.
[22]Tuszynski MH,Steward O.Concepts and methods for the study of axonal regeneration in the CNS[J].Neuron,2012,74(5):777-791.
[23]Young W.Spinal cord contusion models[J].Prog Brain Res,2002,137:231-255.
[24]Ropper AE,Zeng X,Anderson JE,Yu D,Han I,Haragopal H,et al.An efficient device to experimentally model compression injury of mammalian spinal cord[J].Exp Neurol,2015,271:515-523.
[25]Simon FH,Erhart P,Vcelar B,Scheuerle A,Schelzig H,Oberhuber A.Erythropoietin preconditioning improves clinical and histologic outcome in an acute spinal cord ischemia and reperfusion rabbit model[J].J Vasc Surg,2016,64(6):1797-1804.
[26]Cheriyan T,Ryan DJ,Weinreb JH,Cheriyan J,Paul JC,Lafage V,et al.Spinal cord injury models:a review[J].Spinal Cord,2014,52(8):588-595.
[27]Lang BT,Cregg JM,DePaul MA,Tran AP,Xu K,Dyck SM,et al.Modulation of the proteoglycan receptor PTPσ promotes recovery after spinal cord injury[J].Nature,2015,518(7539):404-408.
[28]Tedeschi A,Bradke F.Spatial and temporal arrangement of neuronal intrinsic and extrinsic mechanisms controlling axon regeneration[J].Curr Opin Neurobiol,2017,42:118-127.
[29]Andrews MR,Czvitkovich S,Dassie E,Vogelaar CF,Faissner A,Blits B,et al.Alpha9 integrin promotes neurite outgrowth on tenascin-C and enhances sensory axon regeneration [J].J Neurosci,2009,29(17):5546-5557.
[30]Kim JE,Li S,GrandPré T,Qiu D,Strittmatter SM.Axon regeneration in young adult mice lacking Nogo-A/B[J].Neuron,2003,38(2):187-199.
[31]Wong ST,Henley JR,Kanning KC,Huang KH,Bothwell M,Poo MM.A p75(NTR)and Nogo receptor complex mediates repulsive signaling by myelin-associated glycoprotein[J].Nat Neurosci,2002,5(12):1302-1308.
[32]Cafferty WB,Duffy P,Huebner E,Strittmatter SM.MAG and OMgp synergize with Nogo-A to restrict axonal growth and neurological recovery after spinal cord trauma[J].J Neurosci,2010,30(20):6825-6837.
[33]Liu YB,Wang XF,Lu CC,Sherman R,Steward O,Xu XM,et al.Repulsive Wnt signaling inhibits axon regeneration following central nervous system injury[J].J Neurosci,2008,28(33):8376-8382.
[34]Hollis ER Ⅱ,Ishiko N,Yu T,Lu CC,Haimovich A,Tolentino K,et al.Ryk controls remapping of motor cortex during functional recovery after spinal cord injury[J].Nat Neurosci,2016,19(5):697-705.
[35]González P,Fernández-Martos CM,Arenas E,Rodríguez FJ.The Ryk receptor is expressed in glial and fibronectin-expressing cells after spinal cord injury[J].J Neurotrauma,2013,30(10):806-817.
[36]Kaneko S,Iwanami A,Nakamura M,Kishino A,Kikuchi K,Shibata S,et al.A selective Sema3A inhibitor enhances regenerative responses and functional recovery of the injured spinal cord[J].Nat Med,2006,12(12):1380-1389.
[37]Hollis ER Ⅱ.Axon guidance molecules and neural circuit remodeling after spinal cord injury[J].Neurotherapeutics,2016 ,13(2):360-369.
[38]Jakovcevski I,Wu J,Karl N,Leshchyns′ka I,Sytnyk V,Chen J,et al.Glial scar expression of CHL1,the close homolog of the adhesion molecule L1,limits recovery after spinal cord injury[J].J Neurosci,2007,27(27):7222-7233.
[39]Huang Z,Yu Y,Shimoda Y,Watanabe K,Liu Y.Loss of neural recognition molecule NB-3 delays the normal projection and terminal branching of developing corticospinal tract axons in the mouse[J].J Comp Neurol,2012,520(6):1227-1245.
[40]Huang Z, Gao Y,Sun Y,Zhang C,Yin Y,Shimoda Y,et al.NB-3 signaling mediates the cross-talk between post-traumatic spinal axons and scar-forming cells[J].EMBO J,2016,35(16):1745-1765.
[41]Herrmann JE,Imura T,Song B,Qi J,Ao Y,Nguyen TK,et al.STAT3 is a critical regulator of astrogliosis and scar formation after spinal cord injury[J].J Neurosci,2008,28(28):7231-7243.
[42]Anderson MA, Burda JE, Ren Y, Ao Y,O′Shea TM,Kawaguchi R,et al.Astrocyte scar formation aids central nervous system axon regeneration[J].Nature,2016,532(7598):195-200.
[43]Göritz C,Dias DO,Tomilin N,Barbacid M,Shupliakov O,Frisén J.A pericyte origin of spinal cord scar tissue[J].Science,2011,333(6039):238-242.
[44]Liu K,Lu Y,Lee JK,Samara R,Willenberg R,Sears-Kraxberger I,et al.PTEN deletion enhances the regenerative ability ofadultcorticospinal neurons[J].Nat Neurosci,2010,13(9):1075-1081.
[45]Norsworthy MW,Bei F,Kawaguchi R,Wang Q,Tran NM,Li Y,et al.Sox11 expression promotes regeneration of some retinal ganglion cell types but kills others[J].Neuron,2017,94(6):1112-1120.e4.
[46]Blackmore MG,Wang Z,Lerch JK,Motti D,Zhang YP,Shields CB,et al.Krüppel-like Factor 7 engineered for transcriptional activation promotes axon regeneration in the adult corticospinal tract[J].Proc Natl Acad Sci USA,2012,109(19):7517-7522.
[47]Nawabi H,Belin S,Cartoni R,Williams PR,Wang C,Latremolière A,et al.Doublecortin-like kinases promote neuronal survival and induce growth cone reformation via distinct mechanisms[J].Neuron,2015,88(4):704-719.
[48]Cho Y,Shin JE,Ewan EE,Oh YM,Pita-Thomas W,Cavalli V.Activating injury-responsive genes with hypoxiaenhancesaxonregenerationthrough neuronal HIF-1α[J].Neuron,2015,88(4):720-734.
[49]Cho Y,Sloutsky R,Naegle KM,Cavalli V.Injuryinduced HDAC5 nuclear export is essential for axon regeneration[J].Cell,2013,155(4):894-908.
[50]Weng YL,An R,Cassin J,Joseph J,Mi R,Wang C,et al.An intrinsic epigenetic barrier for functional axon regeneration[J].Neuron,2017,94(2):337-346.e6.
[51]Bhinge A,Namboori SC,Bithell A,Soldati C,Buckley NJ,Stanton LW.MiR-375 is essential for human spinal motor neuron development and may be involved in motor neuron degeneration[J].Stem Cells,2016,34(1):124-134.
[52]Heiman M,Schaefer A,Gong S,Peterson JD,Day M,Ramsey KE,et al.A translational profiling approach for the molecular characterization of CNS cell types[J].Cell,2008,135(4):738-748.
[53]Lu P,Wang Y,Graham L,McHale K,Gao M,Wu D,et al.Long-distance growth and connectivity of neural stem cells after severe spinal cord injury[J].Cell,2012,150(6):1264-1273.
[54]Hesp ZC,Goldstein EZ,Miranda CJ,Kaspar BK,McTigue DM.Chronic oligodendrogenesis and remyelination after spinal cord injury in mice and rats[J].J Neurosci,2015,35(3):1274-1290.
[55]Ding L,Li X,Sun H,Su J,Lin N,Péault B,et al.Transplantation of bone marrow mesenchymal stem cells on collagen scaffolds for the functional regeneration of injured rat uterus[J].Biomaterials,2014,35(18):4888-4900.
[56]Lu P,Woodruff G,Wang Y,Graham L,Hunt M,Wu D,et al.Long-distance axonal growth from human induced pluripotent stem cells after spinal cord injury[J].Neuron,2014,83(4):789-796.
[57]Araki R,Uda M,Hoki Y,Sunayama M,Nakamura M,Ando S,et al.Negligible immunogenicity of terminally differentiated cells derived from induced pluripotent or embryonic stem cells[J].Nature,2013,494(7435):100-104.
[58]Silva NA,Sousa N,Reis RL,Salgado AJ.From basics to clinical:a comprehensive review on spinal cord injury[J].Prog Neurobiol,2014,114:25-57.
[59]Vismara I, Papa S, Rossi F, Forloni G,Veglianese P.Current options for cell therapy in spinal cord injury[J].Trends Mol Med,2017,23(9):831-849.
[60]Kanno H,Pressman Y,Moody A,Berg R,Muir EM,Rogers JH,et al.Combination of engineered Schwann cell grafts to secrete neurotrophin and chondroitinase promotes axonal regeneration and locomotion after spinal cord injury[J].J Neurosci,2014,34(5):1838-1855.
[61]Salgado AJ,Silva NA,Neves NM,et al.Hydrogel based systems for spinal cord injury regeneration,natural-based polymers for biomedical applications[M].Braga/Guimarães:Woodhead Publishing,2008:570-588.
[62]Koch E,Schackert G,Steiner G,et al.Ramanbased imaging uncovers the effects of alginate hydrogel implants in spinal cord injury[M].Dresden:OSA Publishing,2015,9536:95360Y-8.
[63]Hong LTA,Kim YM,Park HH,Hwang DH,Cui Y,Lee EM,et al.An injectable hydrogel enhances tissue repair after spinal cord injury by promoting extracellular matrix remodeling[J].Nat Commun,2017,8(1):533.
[64]Jandial R,Chen MY,Chen BT,et al.Regenerative biology of the spine and spinal cord[M].New York:Springer,2012:25-73.
[65]Karp JM,Sarraf F,Shoichet MS,Davies JE.Fibrin-filled scaffolds for bone-tissue engineering:An in vivo study[J].J Biomed Mater Res A,2004,71(1):162-171.
[66]Goktas M, Cinar G, Orujalipoor I, Ide S,Tekinay AB,Guler MO.Self-assembled peptide amphiphile nanofibers and peg composite hydrogels as tunable ECM mimetic microenvironment[J].Biomacromolecules,2015,16(4):1247-1258.
[67]Chen BK,Knight AM,de Ruiter GC,Spinner RJ,Yaszemski MJ,Currier BL,et al.Axon regeneration through scaffold into distal spinal cord after transection[J].J Neurotrauma,2009,26(10):1759-1771.
[68]Silva NA,Sousa RA,Pires AO,Sousa N,Salgado AJ,Reis RL.Interactions between Schwann and olfactory ensheathing cells with a starch/polycaprolactone scaffold aimed at spinal cord injury repair[J].J Biomed Mater Res A,2012,100(2):470-476.
[69]Hurtado A,Cregg JM,Wang HB,et al.Robust CNS regeneration after complete spinal cord transection using aligned poly-L-lactic acid microfibers[J].Biomaterials,2011,32(26):6068-6079.
[70]Thomas AM,Kubilius MB,Holland SJ,Seidlits SK,Boehler RM,Anderson AJ,et al.Channel density and porosity of degradable bridging scaffolds on axon growth after spinal injury[J].Biomaterials,2013,34(9):2213-2220.
[71]Duan H,Ge W,Zhang A,Xi Y,Chen Z,Luo D,et al.Transcriptome analyses reveal molecular mechanisms underlying functional recovery after spinal cord injury[J].Proc Natl Acad Sci USA,2015,112(43):13360-13365.
[72]Shafiee A,Atala A.Printing technologies for medical applications[J].Trends Mol Med,2016,22(3):254-265.
[73]Okada K1,Tanaka H,Temporin K,Okamoto M,Kuroda Y,Moritomo H,et al.Methylcobalamin increases Erk1/2 and Akt activities through the methylation cycle and promotes nerve regeneration in a rat sciatic nerve injury model[J].Exp Neurol,2010,222(2):191-203.
[74]Mckerracher L,Ferraro GB,Fournier AE.Chapter six,rho signaling and axon regeneration[M].//International Review of Neurobiology.Montreal/Florida:Elsevier Science&Technology,2012:117-140.
[75]Mestre H,Balanza R,Ibarra A.Pharmacological neuroprotection for acute spinal cord injury[M].Mexico City:Elsevier Inc,2015:303-331.
[76]Brooks NP,Potts E,O′Toole J.Letter:The impact of guidelines on clinical practice:survey of the use of methylprednisolone for acute spinal cord injury[J].Neurosurgery,2016,79(3):E516-E520.
[77]Karsy M,Hawryluk G.Pharmacologic management of acute spinal cord injury[J].Neurosurg Clin N Am,2017,28(1):49-62.
[78]Costa DD,Beghi E,Carignano P,Pagliacci C,Faccioli F,Pupillo E,et al.Tolerability and efficacy of erythropoietin(EPO)treatment in traumatic spinal cord injury:a preliminary randomized comparative trial vs.methylprednisolone(MP)[J].Neurol Sci,2015,36(9):1567-1574.
[79]Guennoun R,Labombarda F,Gonzalez Deniselle MC,Liere P,De Nicola AF,Schumacher M.Progesterone and allopregnanolone in the central nervous system:response to injury and implication for neuroprotection[J].J Steroid Biochem Mol Biol,2015,146:48-61.
[80]Cox A,Varma A,Barry J,Vertegel A,Banik N.Nanoparticle estrogen in rat spinal cord injury elicits rapid anti-inflammatory effects in plasma,cerebrospinal fluid,and tissue[J].J Neurotrauma,2015,32(18):1413-1421.
[81]Hunt MJ,Kasicki S.A systematic review of the effects of NMDA receptor antagonists on oscillatory activity recorded in vivo[J].J Psychopharmacol,2013,27(11):972-986.
[82]Omi A,Satomi K.Anesthetic management of spinal cord injury(unstable cervical spine)[M].//Neuroanesthesia and Cerebrospinal Protection,Tokyo:2015:405-414.
[83]Winkler T,Sharma HS,Stålberg E,Badgaiyan RD,Gordh T,Westman J.An L-type calcium channel blocker,nimodipine influences trauma induced spinal cord conduction and axonal injury in the rat[J].Acta Neurochir Suppl,2003,86(86):425-432.
[84]Aureli M, Mauri L, Ciampa MG,Prinetti A,Toffano G,Secchieri C,et al.GM1 Ganglioside:past studies and future potential[J].Mol Neurobiol,2016,53(3):1824-1842.
[85]Haller J,Bice M,Lawrence B.Mediating the secondary effects of spinal cord injury through optimization of key physiologic parameters[J].J Am Acad Orthop Surg,2016,24(3):160-171.
[86]Kwon BK,Okon E,Hillyer J,Mann C,Baptiste D,Weaver LC,et al.A systematic review of non-invasive pharmacologic neuroprotective treatments for acute spinal cord injury[J].J Neurotrauma,2011,28(8):1545-1588.
[87]Fatima G,Sharma VP,Verma NS.Circadian variations in melatonin and cortisol in patients with cervical spinal cord injury[J].Spinal Cord,2016,54(5):364-367.
[88]Wang X,Budel S,Baughman K,Gould G,Song KH,Strittmatter SM.Ibuprofen enhances recovery from spinal cord injury by limiting tissue loss and stimulating axonal growth[J].J Neurotrauma,2009,26(1):81-95.
[89]Willingale HL, Gardiner NJ, McLymont N,Giblett S,Grubb BD.Prostanoids synthesized by cyclo-oxygenase isoforms in rat spinal cord and their contribution to the development of neuronal hyperexcitability[J].Br J Pharmacol,1997,122(8):1593-1604.
[90]Banovac K,Williams JM,Patrick LD,Haniff YM.Prevention of heterotopic ossification after spinal cord injury with indomethacin[J].Spinal Cord,2001,39(7):370-374.
[91]van den Brand R, Heutschi J, Barraud Q,DiGiovanna J,Bartholdi K,Huerlimann M,et al.Restoring voluntary control of locomotion after paralyzing spinal cord injury[J].Science,2012,336(6085):1182-1185.
[92]CapogrossoM, WengerN, RaspopovicS,Musienko P,Beauparlant J,Bassi Luciani L,et al.A computational model for epidural electrical stimulation of spinal sensorimotor circuits[J].J Neurosci,2013,33(49):19326-19340.
[93]Gunaydin LA,Yizhar O,Berndt A,Sohal VS,Deisseroth K,Hegemann P.Ultrafast optogenetic contro[lJ].Nat Neurosci,2010,13(3):387-392.
[94]AdamantidisAR, ZhangF, AravanisAM,Deisseroth K,de Lecea L.Neural substrates of awakening probed with optogenetic control of hypocretin neurons[J].Nature, 2007, 450(7168):420-424.
[95]Minev IR,Musienko P,Hirsch A,Barraud Q,Wenger N,Moraud EM,et al.Biomaterials.Electronic dura mater for long-term multimodal neural interfaces[J].Science,2015,347(6218):159-163.
[96]Groah SL, Lichy AM, Libin AV, Ljungberg I.Intensive electrical stimulation attenuates femoral bone loss in acute spinal cord injury[J].PM R,2010,2(12):1080-1087.
[97]Lauer RT,Smith BT,Mulcahey MJ,Betz RR,Johnston TE.Effects of cycling and/or electrical stimulation on bone mineral density in children with spinal cord injury[J].Spinal Cord,2011,49(8):917-923.
[98]Jackson A.Spinal-cord injury:Neural interfaces take another step forward[J].Nature,2016,539(7628):177-178.
[99]Pham MH, Buser Z, Wang JC, Acosta FL.Low-magnitude mechanical signals and the spine:A review of current and future applications[J].J Clin Neurosci,2017,40:18-23.
[100]Coupaud S,Gislason MK,Purcell M,Sasagawa K,Tanner KE.Patient-specific bone mineral density distribution in the tibia of individuals with chronic spinal cord injury,derived from multi-slice peripheral quantitative computed tomography(pQCT)-A cross-sectional study[J].Bone,2017,97:29-37.
[101]Ellaway PH,Vásquez N,Craggs M.Induction of central nervous system plasticity by repetitive transcranial magnetic stimulation to promote sensorimotor recovery in incomplete spinal cord injury[J].Front Integr Neurosci,2014,8:42.
[102]Gomes-Osman J,Field-Fote EC.Improvements in hand function in adults with chronic tetraplegia following a multiday 10-Hz repetitive transcranial magnetic stimulation intervention combined with repetitive task practice[J].J Neurol Phys Ther,2015,39(1):23-30.
[103]Wang Z,Reynolds A,Kirry A,Nienhaus C,Blackmore MG.Overexpression of Sox11 promotes corticospinal tract regeneration after spinal injury while interfering with functional recovery[J].J Neurosci,2015,35(7):3139-3145.
[104]Kadoya K, Lu P, Nguyen K, Lee-Kubli C,Kumamaru H,Yao L,et al.Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration[J].Nat Med,2016,22(5):479-487.
[105]Becker D,McDonald JW 3rd.Approaches to repairing the damaged spinal cord:overview[J].Handb Clin Neurol,2012,109:445-461.
[106]Lombardi G,Musco S,Celso M,Del Corso F,Del Popolo G.Sacral neuromodulation for neurogenic non-obstructive urinary retention in incomplete spinal cord patients:a ten-year follow-up single-centre experience[J].Spinal Cord,2014,52(3):241-245.
[107]Blandeau M, Estrada-Manzo V, Guerra TM,Pudlo P,GabrielliF.Fuzzy unknown input observer for understanding sitting control of persons living with spinal cord injury[J].Eng Appl Artif Intel,2017,67:381-389.
[108]Capogrosso M,Milekovic T,Borton D,Wagner F,Moraud EM,Mignardot JB,et al.A brain-spine interface alleviating gait deficits after spinal cord injury in primates[J].Nature,2016,539(7628):284-288.
[109]Mignardot JB,Le Goff CG,van den Brand R,Capogrosso M,Fumeaux N,Vallery H,et al.A multidirectional gravity-assist algorithm that enhances locomotor control in patients with stroke or spinal cord injury[J].Sci Transl Med,2017,9(399):eaah3621(2017-07-19).http://stm.sciencemag.org/content/9/399/eaah3621.short
[110]Biering-Sørensen F,Alai S,Anderson K,Charlifue S,Chen Y, DeVivoM, etal.Commondata elements for spinal cord injury clinical research:a National Institute for Neurological Disorders and Stroke project[J].Spinal Cord,2015,53(4):265-277.
[111]Bourne PE,Lorsch JR,Green ED.Perspective:Sustaining the big-data ecosystem[J].Nature,2015,527(7576):S16-S17.
[112]Wilkinson MD,Dumontier M,Aalbersberg IJ,Appleton G,Axton M,Baak A,et al.The FAIR guiding principles for scientific data management and stewardship[J].Sci Data,2016,3:160018.

