湖北地区9 058例女性人乳头瘤病毒基因分型分析*
王京伟 赵礼文 吴 薇 陈 振 李 艳
湖北地区9 058例女性人乳头瘤病毒基因分型分析*
王京伟 赵礼文 吴 薇 陈 振 李 艳#
目的:分析湖北地区人乳头瘤病毒(HPV)感染状况及基因型分布。方法:2012-03-2015-11在本院体检、门诊或住院9 058例女性宫颈脱落细胞,采用流式点阵仪/液态芯片分析系统检测其HPV基因分型,分析所有受检者HPV基因型分布及单一、多重感染分布,比较不同年龄、不同就诊途径及不同疾病组间HPV 感染特点。结果:所有受检者中共检出HPV阳性2 524例,感染率27.86%。湖北地区最常见的四种HPV亚型为HPV16(7.37%)、52(5.05%)、58(4.03%)、18(2.27%)。单一基因型感染率最高(20.51%,1 858/9 058),二重-六重及以上感染逐渐减少。各年龄组HPV中低危型及高危型感染率差异有统计学意义(P<0.01),混合感染率差异无统计学意义(P>0.05)。中低危型感染以≤20岁组最高,高危型感染率以41-60岁组最高,同一年龄组内均以高危型感染为主。不同就诊途径受检者HPV各型感染率组间差异有统计学意义(P<0.01),各组中低危型感染率在体检组最高,明显高于其它两组(P<0.01);门诊组和住院组以高危型为主,明显高于体检组(P<0.01)。住院患者不同疾病组间中低危型HPV感染率差异无统计学意义(P>0.01);高危型HPV感染率差异有统计学意义(P<0.01),恶性肿瘤组高危型感染率最高,其它组最低(P<0.01);各组高危型HPV感染率均明显高于中低危感染率(P<0.05)。结论:应加强湖北地区女性HPV的筛查力度,特别是HPV16、52、58、18四种最常见基因型的筛查,尤其针对41-60岁年龄组人群,可有效降低宫颈癌和由HPV引发的其它肿瘤或疾病发生率。
宫颈癌;人乳头瘤病毒;基因分型
宫颈癌是仅次于乳腺癌的女性恶性肿瘤。人乳头瘤病毒(HPV)是一种嗜上皮性病毒,能导致人类多部位上皮的增生性病变,是宫颈癌的主要病因和必要条件。目前已发现的HPV有200多个亚型,其中30多个与生殖道感染有关, HPV致癌性分为高危和中低危。中低危型包括HPV6,11,42,43,44等,可致生殖器尖锐湿疣等良性病变,但有一定比例与高危型混合感染[1];高危型包括HPV16,18,31,33,35,39,45,51,52,56,58,59,68等,与宫颈、阴道、外阴、肛门、阴茎、口咽等部位恶性肿瘤的发生关系密切,99.7%的宫颈癌存在高危型HPV感染,且病毒量与宫颈病变程度有关[2, 3]。我国妇女83%的子宫浸润癌、84%的子宫颈鳞癌由HPV16或18型引起[4]。因此,适龄女性及相关疾病患者进行HPV基因分型检测很有必要。在宫颈癌筛查中大力推广HPV基因检测可极大提高宫颈癌早期检出率。
有关指南和权威机构[5,6]陆续发布指南建议对30岁以上女性定期进行宫颈癌筛查,尤其将HPV基因分型检测作为常规筛查手段,提高筛查灵敏度和特异性。国内一些地方已有较多报道,包括武汉地区的检测报道[7, 8],而湖北地区目前还缺乏大样本的数据分析。
因此,本研究收集2012-03-2015-11在本院体检、门诊及住院的不同年龄人群的宫颈上皮细胞样本9058例,采用流式点阵仪/液态芯片分析系统对其进行HPV基因分型检测,分析受检者HPV基因型分布及单一、多重感染分布,比较不同年龄,不同就诊途径及不同疾病组间HPV 感染特点。
1 资料与方法
1.1 对象和分组
收集2012-03-2015-11在本院体检、门诊及住院女性患者的宫颈上皮细胞样本9 058例进行HPV基因分型检测,均来自湖北省各市县及其周边地区。患者年龄9个月-87岁,平均41.49±11.04岁,根据受检者的年龄分为4组(≤20岁组,21-40岁组,41-60岁组,≥61岁组);根据就诊途径分为3组(体检组、门诊组和住院组);根据就诊患者疾病类型将住院患者分为4组(炎症组、良性肿瘤组、恶性肿瘤组和其它组)。
1.2 仪器和试剂
HPV基因分型检测试剂盒(上海透景生命科技股份有限公司);T100 PCR 扩增仪(美国Biorad公司);多功能流式点阵仪和Luminex200液相芯片分析系统(美国Luminex公司);MK-10干式恒温器(郑州南北仪器设备有限公司)。
1.3 标本采集
窥阴器暴露宫颈后,用干净棉拭子擦去宫颈口过多分泌物,将宫颈刷伸入宫颈口顺时针旋转3-5圈,折断刷柄后将刷头放入细胞保存液中,密封并尽快送检。若不能立即检测则置4℃冰箱保存,不合格标本需重新采样。对于未婚或无性生活史者直接取阴道分泌物进行检测。
1.4 HPV基因检测
1.4.1 DNA提取:充分洗脱宫颈刷后,取0.4ml洗脱液转移到1.5ml离心管中,14 000rpm离心3min,弃上清,保留沉淀物;向沉淀物中加入200μl脱落细胞核酸释放试剂,振荡混匀,100℃干式恒温器加热15min,14 000 rpm离心5min,当天检测,若不能当天检测,则吸取上清于-20℃冰箱保存待检。
1.4.2 PCR扩增: 取出PCR反应管,在管盖上做好标记,分别加入已提取待测样品5μl。加样结束后将PCR反应管放置扩增仪中进行扩增,扩增程序95℃ 5min,95℃ 30s,58℃ 30s,72℃ 30s,共5个循环,95℃ 30s,55℃ 30s,72℃ 30s,共35个循环,72℃ 3min, 4℃保存产物。
1.4.3 HPV DNA变性及杂交:在微孔杂交板内加入22μl微球杂交液和3μl扩增产物,抽吸混匀。封口膜封口。在扩增仪中进行变性和杂交,程序为95℃ 5min,48℃ 30min。杂交结束后每孔加入SA-PE溶液75μl,抽吸混匀,封口后在扩增仪内继续孵育(48℃,15min)。将微孔杂交板快速转移至预热48℃的Luminex 200上进行检测。
1.4.4 结果判定:HPV基因分型检测能使29种亚型同步检测,包括高危型19种:HPV16,18,26,31,33,35,39,45,51,52,53,56,58,59,66,68,73,82,CP8304;中低危型10种:HPV6,11,40,42,43,44,55,61,81,83。采用Luminex流式分析仪阅读,取每种复合物的微球编码及对应荧光信号,经透镜HPV专用分析软件对检测结果进行判读:阳性内对照Globin的信号大于150,且大于等于2.5倍背景信号值,表明实验成功。如果不符合前述条件,代表实验失败。可能的原因是样本中没有采集到细胞、某种试剂失效或者相关仪器设备故障。HPV亚型探针的信号>150,且≥2.5倍背景信号值,即可判断该探针对应的HPV型别为“阳性”,反之为“阴性”;若HPV亚型探针信号小于150,则该亚型检出无效,不输出结果。
1.5 统计学处理
采用Excel建立数据库,剔除重复数据,以首次结果录入,以SPSS 20.0统计软件进行统计分析。计数资料采用百分率(%)表示,组间差异比较采用χ2检验。统计各基因型HPV感染率时以感染株表示,统计高危型、中低危型及合计感染率时以感染例数计算。P<0.05为差异有统计学意义。
2 结 果
2.1 HPV基因型及感染率分布
9 058例受检者中HPV阳性2 524例(阳性率27.86%);共检出29种基因型3 434个HPV株,包括中低危型490株(14.27%),高危型2 944株(85.73%),后者显著高于前者(χ2=3 504.5,P<0.01)。高危型感染者以HPV16型最多,占全部被检病例的7.37%,其它基因依次减少,HPV52型占5.05%、HPV58型占4.03%、HPV18型占2.27%、HPV53型占2.19%、HPV33型占2.09%;中低危感染者以HPV11型较多,占全部被检病例的1.29%,HPV6型次之,占1.19%(表1)。HPV感染的单一基因型感染较多,达1 858例(20.51%),二重-六重及以上感染逐渐减少,分别为493例(5.44%)、127例(1.40%)、28例(0.31%)、13例(0.14%)、5例(0.04%),共666例(7.35%)。单一感染率明显高于多重感染率,差异有统计学意义(χ2=1 125.9,P<0.01)(图1)。

表1 HPV各基因亚型的感染率分布
注:*为有效检测总例数
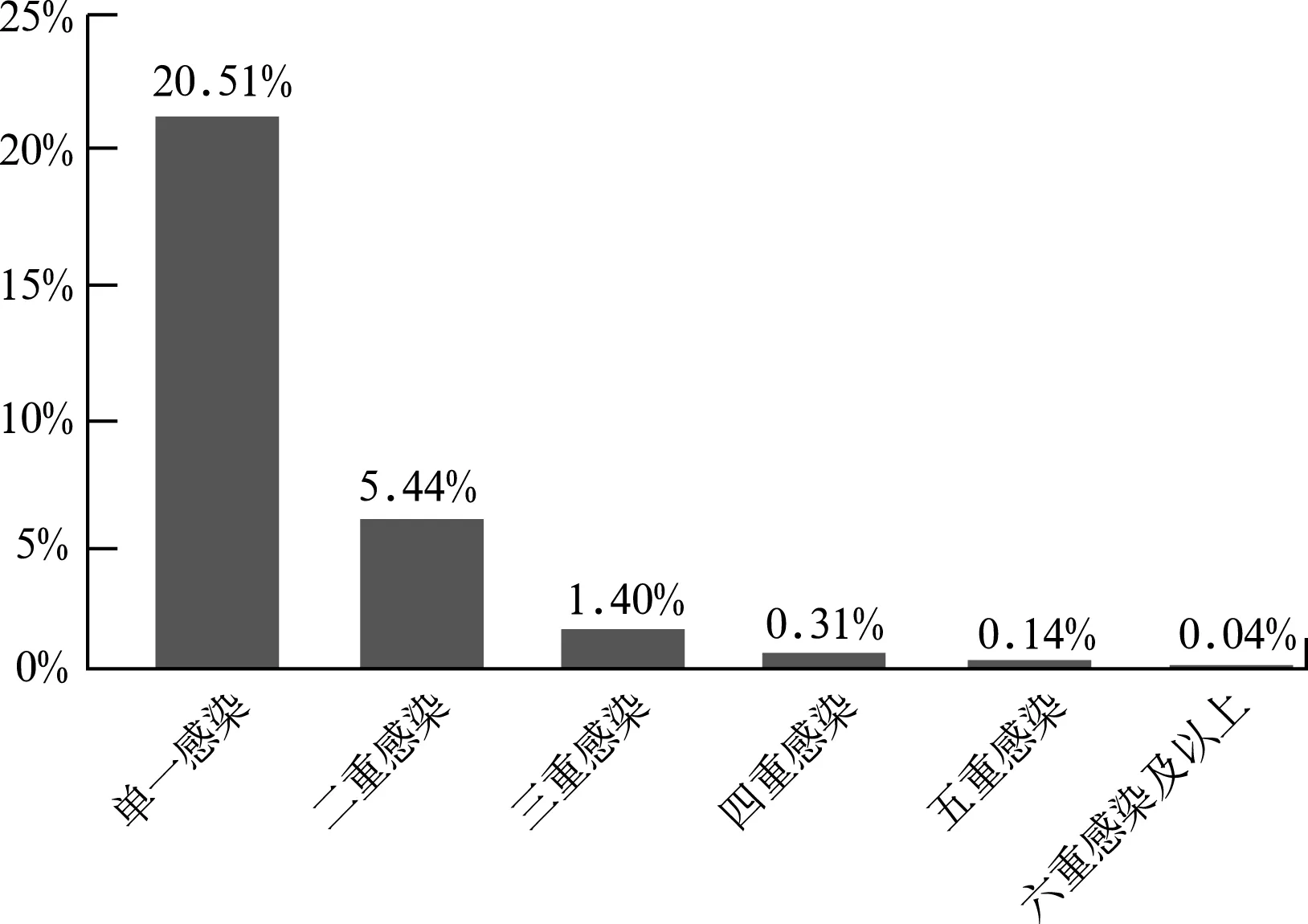
图1 HPV单一和多重基因型感染分布图
2.2 不同年龄组HPV基因型感染分布
9 058例受检者中有年龄记载的共8 816例,各年龄组中低危型、高危型感染率差异有统计学意义(均P<0.01),混合型感染率差异无统计学意义(P>0.01)。中低危型感染以≤20岁组最高,其它组间感染率相当;高危型感染率以41-60岁组最低,其它组间感染率相当。同一年龄组内中低危型、高危型及混合型感染率差异均有统计学意义(均P<0.01),且均以高危型感染率最高。见表2。

表2 不同年龄组HPV基因型感染分布
注:与≤20岁组比较,1)P<0.01;与21-40岁组比较,2)P<0.01;与41-60岁组比较,3)P<0.01;与同组中低危型感染比较,4)P<0.01;与同组高危型感染比较,5)P<0.01
2.3 不同就诊途径受检者HPV基因型感染分布
不同就诊途径受检者HPV各型感染率组间差异有统计学意义(均P<0.01)。体检组中低危型感染率最高(P<0.01);门诊组和住院组高危型感染率最高明显高于体检组(P<0.01)。体检组高危型感染率低于中低危型感染率;门诊组和住院组高危型感染率均高于中低危型感染率(均P<0.01)。见表3。
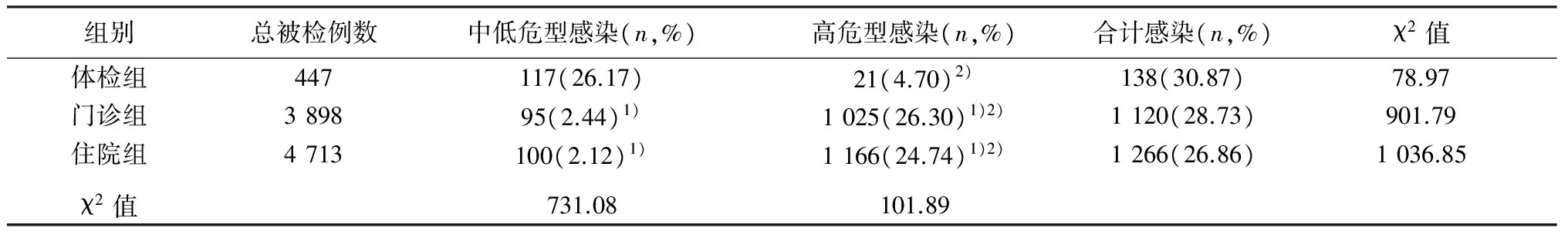
表3 不同就诊途径患者HPV基因型感染分布
注:与体检组比较,1)P<0.05;与同组中低危型感染比较,2)P<0.01
2.4 不同疾病组HPV基因型感染分布
住院患者不同疾病组间中低危型HPV感染率差异无统计学意义(P>0.05);高危型HPV感染率差异有统计学意义(P<0.01),恶性肿瘤组最高,其它组最低。不同疾病各组患者高危型HPV感染率均高于中低危型感染率(均P<0.01)。见表4。

表4 不同疾病组的HPV基因型感染分布情况
注:与炎症组比较,1)P<0.05;与良性肿瘤组比较,2)P<0.05;与同组中低危型感染比较,3)P<0.01
3 讨 论
宫颈癌是由高危型HPV的持续或者反复感染而诱发的女性第二大常见妇科恶性肿瘤,严重危害女性生殖健康[9]。对高危型HPV病毒的持续感染予以有效阻断能够阻滞癌前病变的发展,是防治宫颈癌的重要方法[10, 11]。因此,强化HPV筛查力度、提高检测灵敏度对宫颈癌的防治至关重要。
HPV各基因型分布与地区及经济发展程度有关。研究发现,较发达地区HPV感染率明显低于发展中及一般发达国家和地区,且以HPV 16最为常见[12]。国际癌症研究协会(IARC)调查显示,全球宫颈癌患者中最常见的10种亚型依次为(数据不包括中国人):HPV 16、18、45、31、33、52、58、35、59、56;亚洲相对流行的是HPV 52和58;其中东亚和中南亚地区为HPV 16、52、58;南亚和东非地区主要是HPV 16、18、31[13]。
本研究中HPV感染型别由高到低依次是HPV 16、52、58、18,该结果与东亚和东南亚地区感染型别一致,但与国内其它地区报道有差异,如河南省是HPV 16、58、18、31[14],陕西是HPV 16、58、52、53[15],天津是HPV 16、58、52、33[1],广州地区最常见的亚型依次是HPV 16、52、53、58和HPV CP8304型[16]。虽然各地区的优势基因型别排序及合计感染率不尽相同,但均以高危型感染居多,排在前三位的型别基本一致。本研究中HPV多重感染占7.35%,以二重感染为主,混合感染主要是以HPV 16、52、58、53、18这5个亚型之间的相互混合感染最为多见。表明这5种型别可能更易相互感染,但最终结论可能还要结合更多地区的大数据做进一步研究论证。
HPV多重感染的患者出现持续性感染的概率更高,多重HPV感染比单一型感染造成的癌前病变风险也更高[17]。本研究的上述结果提示应加强对湖北地区感染率最高的4种高危型HPV进行早期预防和监控。本研究也为湖北区域HPV耐药基因型的疫苗制备提供参考依据。
国内外研究表明,HPV感染与年龄相关。在本次研究中发现不同年龄组HPV高危、中低危型及感染率差异有统计学意义(P<0.01),中低危型感染以≤20岁组最高,高危型感染率以41-60岁组最高;各年龄组内均以高危型感染率最高。各年龄段中低危感染率、混合型感染率在≤20岁呈现峰值。其原因可能为≤20岁为性行为活跃期,卫生防护意识较薄弱,感染率相对较高,而其自我恢复能力较强,感染后多可自行恢复。而41-60岁组年龄段女性,分娩时产道的损伤,自身抵抗力随着卵巢功能衰退而逐渐下降,而此年龄段女性生活压力较大,导致免疫力下降,因此高危型HPV感染率明显上升。因此加强对31岁以后的女性进行HPV基因分型检测对宫颈癌及宫颈癌前病变的预防很有必要。
不同就诊途径患者间的HPV感染率也存在差异,其中体检组的HPV合计感染率最高(30.87%),以低危型HPV 6或11型为主。门诊患者组次之(28.74%),住院患者组的合计感染率相对最低(26.86%),但均以高危型HPV 16或18为主。相较门诊及住院患者,相对健康的体检人群中HPV感染率反而最高,提示应加强湖北地区“健康女性”的HPV的筛查。住院患者其恶性肿瘤组患者HPV合计感染率最高,且以高危型为主,可见高危型HPV感染与炎症与肿瘤之间关系密切。
目前国内通过接种HPV疫苗实现一级预防,通过癌前病变的检测和治疗来实现二级预防。每年的宫颈细胞涂片检查带来大量的假阳性和不必要的治疗[18]。大样本随机对照试验证实HPV筛查比细胞涂片报告的宫颈上皮内瘤变3级及以上(CIN3+)的检出率约高出50%,且半数以上的CIN3+患者细胞学检测正常。因此,HPV作为宫颈癌初筛方案或可降低CIN3+的发病率,而且还能提高宫颈腺癌的检出率,细胞学检测很难检测出宫颈腺癌。已有报道HPV筛查可将因缺乏有效筛查手段和干预措施而导致的宫颈癌新发病例减少70-80%,而采用HPV疫苗又可防止约80%的癌前病变发生。所以,HPV疫苗联合HPV DNA筛查可有效降低宫颈癌发生率[19,20]。
综上所述,湖北地区女性HPV感染不容忽视,应加强HPV筛查,特别是HPV 16、52、58、18型,可有效降低宫颈癌的的发生和发展具有重要意义。
◀
本文第一作者简介:
王京伟(1986-),女,汉族,博士,主治医师,主要从事分子诊断与个体化医疗研究
1 李 翀,郑 旭. 天津地区4232例妇女宫颈HPV感染基因谱分析[J]. 中国妇幼保健, 2015, 30(10): 1 571-1 573.
2 薛凤霞,刘宏图,刘朝晖.女性下生殖道人乳头瘤病毒感染诊治专家共识[J].中国实用妇科与产科杂志, 2015,(10): 894-897.
3 Infantolino C,FabrisP, Infantolino D, et al. Usefulness of human papilloma virus testing in the screening of cervical cancer precursor lesions: a retrospective study in 314 cases[J]. Eur J Obstet Gynecol Reprod Biol, 2000, 93(1): 71-75.
4 李 霓,代 敏. 人乳头瘤病毒流行病学研究进展[J]. 中华流行病学杂志, 2007, 28(10): 972-975.
5 李 霓,王 鹤,乔友林,等. 中国妇女子宫颈人乳头瘤病毒型别分布的Meta分析[J]. 中华流行病学杂志, 2007, 28(10): 941-946.
6 Huh WK,AultKA ,Chelmow D, et al. Use of primary high-risk human papillomavirus testing for cervical cancer screening: interim clinical guidance[J]. Gynecol Oncol, 2015, 136(2): 178-182.
7 Obstetricians American College of Gynecologists. Practice Bulletin No. 140: management of abnormal cervical cancer screening test results and cervical cancer precursors[J]. Obstet Gynecol, 2013, 122(6): 1338-67.
8 蒋燕成,张志珊,郑红云. 中国泉州、武汉两个地区女性宫颈HPV感染的差异性及其基因型分布[J]. 现代检验医学杂志, 2014, 29(5): 28-30.
9 汪 明,李 雯,袁乐永, 等. 湖北地区宫颈疾病患者HPV基因型及其年龄分布[J]. 微循环学杂志, 2014, 24(4): 49-53.
10 Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000. The global picture[J].Eur J Cancer, 2001, 37(Suppl 8):S4-66.
11 黄 英. 高危型人乳头瘤病毒感染与宫颈癌及癌前病变的相关性分析[J].深圳中西医结合杂志, 2015,15(1): 22-23.
12 Vinodhini K,Shanmughapriya S,Das BC, et al. Prevalence and risk factors of HPV infection among women from various provinces of the world[J]. Arch Gynecol Obstet, 2012, 285(3): 771-777.
13 伍军平,罗 新,吴小花. 宫颈癌筛查8463例结果分析[J/CD]. 中华妇幼临床医学杂志(电子版), 2011,7(3): 197-201.
14 王晓静,刘玉玲,汤福想, 等. 河南地区妇女宫颈病变HPV型别分布研究 [J]. 国际妇产科学杂志, 2011, 38(6): 585-587.
15 张晓艳,曹 云,薛 乐, 等. 陕西延安地区妇女人乳头瘤病毒基因分型检测及人群分布特征 [J]. 检验医学与临床, 2016, 13(5): 641-643.
16 方伟祯,蔡振华,李 健, 等. 广州地区8925例女性感染HPV基因亚型状况分析[J]. 中国微生态学杂志, 2015, 27(11): 1 336-1 338.
17 李 宁,佐 晶,黄 婴, 等. HPV分型检测在子宫颈高级别鳞状上皮内病变治疗后随访中的临床意义[J]. 中华妇产科杂志, 2015,50(4): 258-262.
18 Min LK,Kwon SH,Kim S, et al. Preventive vaccination against cervical cancer: Korean Society of Gynecologic Oncology Guideline[J]. J Gynecol Oncol, 2016, 27(3): e30.
19 Petry KU. HPV and cervical cancer[J]. Scand J Clin Lab Invest Suppl, 2014, 244: 59-62.
20 赵 超,魏丽惠. HPV疫苗的临床应用价值[J]. 国际生殖健康/计划生育杂志, 2015, 34(6): 462-466.
The Genetic Subtypes of HPV Infection in 9 058 Women in Hubei
WANG Jing-wei, ZHAO Li-wen, WU Wei, CHEN Zhen, LI Yan#
Department of Clinical Laboratory, Renmin Hospital of Wuhan University, Wuhan 430060, China;#
Objective: To investigate the relationship of HPV infection status and the genotype distribution in Hubei region with age, different clinic visit source and different disease types. Method: Cape flow-through hybridization was used to detect HPV genotyping in 9 058 local women patients in renmin hospital of wuhan university from March 2012 to November 2015. The distribution of HPV genotype and the distribution of single and multiple infections were analyzed. The HPV genotyping in different age groups, different clinic visit source groups and different disease type groups were compared and analyzed. The rates of single infection and multiple infections were analyzed. Results: Among the 9 058 patients, 2 524 were infected with HPV(27.86%). Out of 29 subtypes of HPV, HPV16 (7.37%), 52 (5.05%), 58 (4.03%) and 18(2.27%)were the most common types. 1 858 patients were single infection(20.51%), the rates of single infection were higher than multiple infection. The difference of HPV genotype in different age groups were significantly(P<0.01). The infection rate of middle and low-risk HPV infection and multiple infection were highest in ≤20 years old groups, while infection rate of high-risk HPV infection groups were highest in 41-60 years old groups. The infection rate of high-risk HPV were higher than middle and low-risk HPV infection in different age groups. The difference of HPV genotype in different sources of patients were significantly(P<0.01), the middle and low-risk HPV infection of patients from general population screen was highest,while the rates of outpatient took the top spot of high-risk HPV infection, the high-risk HPV infection from outpatient and inpatient groups were higher than general population screen. The high-risk HPV genotype in different disease groups were significantly(P<0.01), the high-risk HPV infection in different disease groups were higher than middle and low-risk HPV infection. Conclusion: It's important to promote HPV screening rate in women in Hubei region,especially screening for the most common HPV genotypes 16, 52, 58 and 18, and 41-60years old groups should draw extra attentions, which can effectively reduce cervical cancer and HPV caused by other tumor or disease incidence.
Cervical cancer; HPV; Genotype
国家自然基金项目(81200389),武汉大学青年教师自主科研项目(2042015kf0113)
武汉大学人民医院检验科, 武汉 430060;#
,E-mail:yanlitf1120@163.com
本文2016-11-24收到,2017-03-19修回
R737.33
A
1005-1740(2017)02-0037-06

