紫色红曲霉FBKL3.0018产酯化酶的酶学性质研究
胡娜,吴鑫颖*,李付丽,王艳,邱树毅,吴海
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳550025;2.贵州大学酿酒与食品工程学院,贵州贵阳550025;3.青酒集团有限公司,贵州黔东南556000)
紫色红曲霉FBKL3.0018产酯化酶的酶学性质研究
胡娜1,2,吴鑫颖1,2*,李付丽1,2,王艳1,2,邱树毅1,2,吴海3
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳550025;2.贵州大学酿酒与食品工程学院,贵州贵阳550025;3.青酒集团有限公司,贵州黔东南556000)
以从紫色红曲霉FBKL3.0018中固态发酵得到的粗酶制剂为研究对象,对该菌株的酯化酶酶学性质进行了较系统的研究。通过单因素实验确定该酶最适温度为40℃,在30℃条件下稳定性较好,最适pH值为6.5,在pH5.5~7.5条件下稳定性好。Fe2+、Na+、Mn2+、Mg2+、Li+、Zn2+对酯化酶酶活力有抑制作用,Ca2+在低浓度时有促进作用,高浓度时有抑制作用。K+对酯化酶酶活力有促进作用,并且随着K+浓度的升高,促进作用逐渐增强。吐温-80、十二烷基硫酸钠(SDS)、聚乙二醇6000、阿拉伯胶4种表面活性剂对酯化酶酶活力都有抑制作用。另外,甲醇和乙醇对该酯化酶酶活力有抑制作用,甲酸、乙酸、乳酸对酯化酶酶活力有促进作用。乙酸乙酯在低浓度时对酯化酶酶活力有抑制作用,含量为30%时反而有促进酶活力的作用。酯化酶最大反应速度Vmax为0.016 mol/(L·min),米氏常数Km为0.015 4 mol/L。
紫色红曲霉;固态发酵;酯化酶;酶学性质
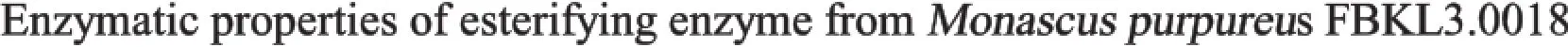
HU Na1,2,WU Xinying1,2*,LI Fuli1,2,WANG Yan1,2,QIU Shuyi1,2,WU Hai3
(1.Guizhou Key Lab of Fermentation Engineering and Biological Pharmacy,Guizhou University,Guiyang 550025,China;2.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;3.Qingjiu Group Co.,Ltd.,Qiandongnan 556000,China)
酯化酶包括脂肪酶和酯酶,酯酶(羧酸酯酶carboxylesterases)与脂肪酶功能相似,都可以催化酯类的水解与合成[1]。白酒生产上常用高产酯化酶的菌株以及酯化酶制剂来提高酯的合成,有利于增加白酒香味成分中酯的含量[2-5]。目前,关于酯化酶酶学性质的研究主要集中在酶的最适反应温度,最适pH值,温度稳定性,酸碱稳定性,金属离子、表面活性剂和有机溶剂等对酶活性的影响等[6]。
胡长浩等[7]对金黄色酿脓葡萄球菌(Staphylococcus aureus)FL-12产耐热性脂肪酶的酶学性质进行了研究,发现脂肪酶的最适温度是45℃,最适pH值为10,有较好的酸碱稳定性和温度稳定性。K+对该酶有激活作用,Pb2+、Ba2+有抑制作用,低浓度十二烷基硫酸钠(sodiumdodecylsulfate,SDS)抑制该酶的活性,低浓度乙二胺四乙酸(ethylenediaminetetraaceticacid,EDTA)对该酶几乎没有影响;1%的TritonX 100和吐温-80对酶活有促进作用。胡朝阳等[8]对不动杆菌GXL02产脂肪酶的酶学性质进行了研究,发现酶的最适温度为50℃,最适pH值为9.0,具有较好的温度稳定性和pH稳定性。王琰等[9]对真菌FL002产耐酸性脂肪酶的酶学性质进行研究,结果发现,最适pH为6.5,在pH6.0~8.5之间,酶的稳定性较好,40℃时酶具有很好的稳定性。研究还发现,Fe2+、Ca2+对脂肪酶活性产生抑制作用,Cu2+、Ni2+抑制作用明显,这跟其他脂肪酶的酶学性质研究结果不同。黑曲霉产生的脂肪酶的活性受到多种金属离子抑制,但对Ca2+却有依赖性[10],表明不同菌种来源的脂肪酶有不同的酶学性质。SDS对脂肪酶有很强的抑制作用,而Triton-100却有明显激活作用。另外,吐温-80对酶活性基本上没有影响[11]。
本研究从浓香型白酒酿造的中温大曲中筛选一株高产酯化酶的菌株(紫色红曲霉FBKL3.0018),以此菌株固态发酵所得的酯化酶粗酶制剂为研究对象,进行酶学性质研究,为浓香型白酒生产过程中产酯产香和黄水的回收利用等方面奠定良好的研究基础[12]。
1 材料与方法
1.1 材料与试剂
紫色红曲霉FBKL3.0018:保存于贵州省发酵工程与生物制药重点实验室。
所用原料为固态发酵所得的含酶培养物(简称粗酶制剂)。
Tris、盐酸磷酸二氢钠、甘氨酸、硫酸镁、体积分数95%乙醇、橄榄油、聚乙二醇、柠檬酸、柠檬酸钠、氢氧化钠、一水和硫酸锰、吐温80、SDS、七水和硫酸亚铁、无水硫酸镁、无水氯化钙、磷酸氢二钠、磷酸氢二钾(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
UV2550紫外可见分光光度计:日本岛津集团;MJX-250B-Z霉菌培养箱、BXM-30R立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;JJ-CJ-1FD洁净工作台:苏州市金净净化设备科技有限公司;DK-98-11电热恒温水浴锅:天津市泰斯特仪器有限公司;XW-80A旋涡混合仪:海门市杜琪贝尔仪器制造有限公司;BCD-215DK冰箱:青岛海尔股份有限公司。
1.3 实验方法
1.3.1 酶活测定方法
酯化酶酶活定义:1g含酶培养物于40℃、pH7.5的条件下,水解脂肪每分钟生成1μmol的脂肪酸定义为1个酶活力单位,U。
酯化酶酶活的测定方法:按照参考文献[13]的方法进行,并根据以下公式进行计算。
X=(B-A)×c/0.05 ×50 ×1/15 ×n=200/3 ×(B-A)×c ×n
式中:X为样品酶活力,U/g;B为滴定样品时消耗氢氧化钠标准溶液的体积,mL;A为滴定空白时消耗氢氧化钠标准溶液的体积,mL;c为氢氧化钠标准溶液浓度,mol/L;0.05为氢氧化钠标准溶液浓度换算系数;50为0.05mol/L氢氧化钠溶液1.00mL相当于脂肪酸50μmol;1/15为反应时间15 min,以1 min计;n为稀释倍数。
1.3.2 最适温度及其稳定性
按照酶活力测定方法,测定酯化酶在20℃、30℃、40℃、50℃、60℃环境中的酶活。以酶活力最高时为100%,计算相对酶活,确定酶的最适温度。
将酯化酶制剂分别在30℃、40℃、50℃温度环境中保温7 h,分别在1 h、2 h、3 h、5 h、7 h时测定酯化酶残余酶活。以保温处理前的初始的酶活力为100%,计算保温处理后残余的相对酶活。
1.3.3 最适pH及其稳定性
按照酶活力测定方法,测定酯化酶在pH5.5、pH6.5、pH7.5、pH8.5、pH9.5的缓冲溶液中的酶活。以酶活力最高时计为100%,计算相对酶活,确定酶的最适pH。
将酯化酶制剂在以上pH值条件下室温放置24 h,分别在0 h、4 h、8 h、12 h、24 h时测定酯化酶残余酶活。以处理前的初始的酶活力为100%,来计算处理后残余的相对酶活。1.3.4金属离子对酶活的影响
将酯化酶制剂与不同含量的FeSO4、MnSO4、MgSO4、CaCl2、ZnCl2、LiSO4、CuSO4、FeCl3溶液以1∶9(V/V)的比例混合均匀,使混合后的各离子浓度为1 mmol/L、5 mmol/L、10 mmol/L。室温(25℃)条件下放置1 h,最适条件下测定酶活力。对照组以相同体积的蒸馏水代替金属离子溶液,将对照组酶活力计为100%,计算各相对酶活。
1.3.5 表面活性剂对酶活的影响
将酯化酶制剂与不同浓度的吐温-80、SDS、聚乙二醇6000、阿拉伯胶溶液以1∶9(V/V)的比例混合均匀,使混合后的表面活性剂溶液含量为0.05%、0.1%、0.5%。室温(25℃)条件下放置2 h,最适条件下测定酶活力。对照组以相同体积的蒸馏水代替表面活性剂溶液,将对照组酶活力计为100%,计算各相对酶活。
1.3.6 有机溶剂对酶活的影响
将酯化酶制剂与甲醇、乙醇、甲酸、乙酸、乳酸、乙酸乙酯以适当比例混合均匀,使混合后的有机溶液含量分别为10%、15%、20%、25%、30%。室温(25℃)条件下放置24h,最适条件下测定酶活力。对照组采用相同体积的蒸馏水代替有机溶剂溶液,将对照组酶活力计为100%,计算各相对酶活。
1.3.7 酯化酶米氏常数Km和最大反应速度Vmax值的测定
分别配制100 mmol/L、120 mmol/L、140 mmol/L、160 mmol/L、180 mmol/L、200 mmol/L、300 mmol/L、400 mmol/L、500 mmol/L的不同浓度(S)橄榄油乳化液,在最适条件下进行反应,测定其水解反应速度(V)。绘制1/S与1/V的线性方程,计算酶反应的Km、Vmax值。
2 结果与分析
2.1 最适反应温度
酯化酶在不同的温度条件下其酶活的测定结果见图1。
由图1可知,酯化酶在40℃条件下反应时酶活力最高。在一定范围内,随着温度的升高,酶活升高。但过高的温度会使酶失活。以40℃反应时的酶活力为100%,30℃时酶活力为65%左右,超过40℃酶活力急剧下降。这与参考文献[14]中根霉产酯化酶最适温度40℃相符合。因此,该酯化酶的最适反应温度为40℃。

图1 温度对酯化酶酶活的影响Fig.1 Effect of temperature on esterifying enzyme activity
2.2 温度稳定性
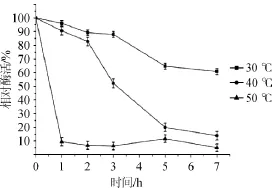
图2 酯化酶温度稳定性Fig.2 Temperature stability of esterifying enzyme activity
由图2可知,30℃条件下酯化酶酶活力下降较缓慢,3 h时酯化酶活力仍保持在87.93%左右,7 h时酯化酶残余酶活力为60.87%。40℃条件下,酯化酶酶活力在2 h时酶活力降为82.76%,之后酶活力下降迅速,7 h时酶活力仅剩初始酶活力的13.91%。50℃条件下,酯化酶酶活力下降非常迅速,1 h时酶活力仅为9.48%,7 h时酶活力仅为初始酶活力的5.22%。由此可以得出,该酯化酶在30℃条件下稳定性较好,随温度的升高稳定性变差,当温度达到50℃时,酯化酶的酶活力损失已经很大,该温度下酯化酶稳定性很差。
2.3 最适pH值
图3pH值对酯化酶酶活的影响Fig.3 Effect of pH on esterifying enzyme activity
由图3可知,随着pH值升高,酶活升高,在pH6.5条件下酶活力达到最高,之后随着pH值升高,酶活力迅速下降。在一定范围内,随着pH的升高,酶活升高,但过高的pH会使酶失活。因此,该酯化酶的最适pH值为6.5。该结果与大多数真菌酯化酶最适pH在弱酸性或中性范围内相符合[15]。
2.4 pH稳定性

图4 酯化酶的pH稳定性Fig.4 pH stability of esterifying enzyme
由图4可知,4 h时测定酯化酶活力结果发现,酯化酶活力下降,其中pH为6.5时酶活力下降最快,为初始酶活力的74.84%。pH为8.5时酶活力下降幅度最小,为初始酶活力的98.41%。4~12 h时,5个pH条件下酶活力都是持续下降。12~24 h时,pH8.5条件下酶活力下降最快且幅度最大,降至初始酶活力的39.68%,pH9.5时酶活力降至初始酶活力的42.68%。pH5.5、pH6.5、pH7.5条件下酶活力继续下降,但下降幅度较小。
从整体来看,偏碱性条件下,酯化酶的稳定性较差,仅24 h就降至初始酶活力的40%左右。pH5.5、pH6.5、pH7.5条件下,酯化酶的稳定性较好,其中pH7.5条件下,酯化酶的稳定性最好,24 h后酶活力为初始酶活力的68.70%。因此,该酯化酶在pH5.5~7.5稳定性较好。该实验结果与少根根霉(Rhizopus arrhizus)BUCT产酯化酶在pH6.0~8.0范围内酶活都较稳定相类似[16]。
2.5 金属离子对酶活的影响

图5 不同金属离子浓度对酯化酶活性的影响Fig.5 Effect of different metal ions concentration on esterifying enzyme activity
由图5可知,Fe2+、Na+在低浓度时对酯化酶酶活力有抑制作用,但随着金属离子浓度升高,Fe2+、Na+对酯化酶酶活力的抑制作用减弱,而且有促进作用。Ca2+却与此相反,低浓度时对酯化酶酶活力有促进作用,高浓度时对酯化酶酶活力有抑制作用。Mn2+、Mg2+、Li+对酯化酶酶活力有抑制作用,但随着金属离子浓度升高,这种抑制作用会减弱。Zn2+对酯化酶酶活力也有抑制作用,但随着金属离子浓度的升高,抑制作用逐渐增强。K+对酯化酶酶活力有促进作用,并且随着K+浓度的升高,促进作用逐渐增强。一般来说,Ca2+可提高酯化酶酶活稳定性和酶活,Zn2+和Mg2+在一定程度上也可抑制酯化酶活性[17]。
2.6 表面活性剂对酶活的影响
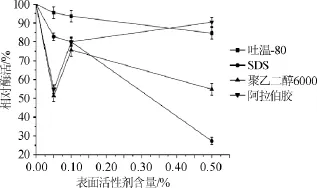
图6 表面活性剂对酯化酶活性的影响Fig.6 Effect of surface active agents on esterifying enzyme activity
由图6可知,4种表面活性剂对酯化酶酶活力都有抑制作用。其中,吐温-80对酯化酶酶活力在低浓度时抑制最低,当吐温-80含量达到0.5%时,酶活力为初始酶活力的84.55%,其酶活降低不大。SDS对酶活抑制作用在低浓度时就有抑制,但在高浓度时(0.50%)抑制作用最强,其残余酶活力仅为初始酶活力的27.27%。聚乙二醇6000及阿拉伯胶对酶活的抑制作用在高浓度时反而较弱,低浓度时较强。相比之下,阿拉伯胶抑制作用整体低于聚乙二醇6000。这与参考文献[18]中表面活性剂吐温-80对脂肪酶酶活影响不大,而SDS则起抑制作用相符合。
2.7 酯化酶对有机溶剂的耐受性
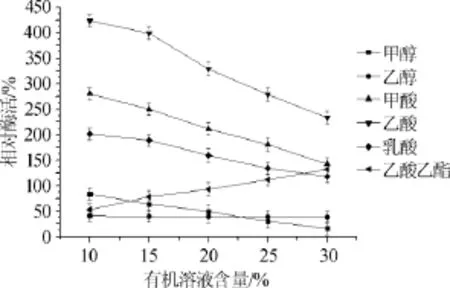
图7 酯化酶对有机溶剂的耐受性Fig.7 Tolerance of esterifying enzymes in organic solvents
由图7可知,甲醇和乙醇对该酯化酶酶活力有抑制作用,甲酸、乙酸、乳酸对酯化酶酶活力有促进作用。乙酸乙酯在低浓度时对酯化酶酶活力有抑制作用,含量为30%时反而有促进酶活力的作用。
甲醇在含量10%的条件下对酯化酶酶活力有较弱的抑制作用,残余酶活力为初始酶活力的83.33%,但含量为30%时,抑制作用显著增强,残余酶活力仅为初始酶活力的16.18%。乙醇在含量为10%时对酯化酶酶活力的抑制作用就较强,残余酶活力为初始酶活力的40.91%,乙醇含量为30%时抑制作用进一步加强,残余酶活力为初始酶活力的38.24%。甲酸含量为10%时对酯化酶酶活力促进作用较强,酶活力达到初始酶活力的280.30%,而在含量为30%时促进作用减弱,为初始酶活力的142.65%。乙酸含量为10%时对酯化酶酶活力的促进作用最强,达到初始酶活力的424.24%,含量为30%时促进作用减弱,为初始酶活力的233.82%。对乳酸而言,其含量为10%时酶活力为初始酶活力的200%,含量30%时促进作用减弱,为初始酶活力的118.17%。乙酸乙酯在含量10%时对酯化酶酶活力有抑制作用,酶活力为初始酶活力的53.03%,但是当乙酸乙酯含量达到30%时,对酯化酶酶活力反而有促进作用,酶活力为初始酶活力的132.35%。
2.8 酯化酶Km和Vmax值的测定
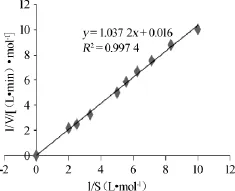
图8 酯化酶的酶促动力反应曲线Fig.8 Enzymatic dynamic response curve of esterifying enzyme
从图8可以得出,由双倒数法求得该酯化酶的最大反应速度Vmax为0.016mol/(L·min),米氏常数Km为0.0154mol/L。
3 结论
对紫色红曲霉固态发酵得到的粗酶粉制剂进行酶学性质研究发现,酶的最适反应温度为40℃,最适pH值为6.5,在30℃条件下稳定性较好,随温度的升高稳定性变差,在中性偏酸性条件下稳定性好。最大反应速度Vmax为0.016 mol/(L·min),米氏常数Km为0.015 4 mol/L。Fe2+、Na+、Mn2+、Mg2+、Li+、Zn2+对酯化酶酶活力有抑制作用,Ca2+在低浓度时有促进作用,高浓度时有抑制作用。K+对酯化酶酶活力有促进作用,并且随着K+浓度的升高,促进作用逐渐增强。吐温-80、SDS、聚乙二醇6000、阿拉伯胶4种表面活性剂对酯化酶酶活力都有抑制作用。另外,甲醇和乙醇对该酯化酶酶活力有抑制作用,甲酸、乙酸、乳酸对酯化酶酶活力有促进作用。乙酸乙酯在低浓度时对酯化酶酶活力有抑制作用,含量为30%时反而有促进酶活力的作用。
[1]李豆南,邱树毅.酱香大曲微生物菌群结构及微生物功能研究概述[J].中国酿造,2017,36(1):5-11.
[2]唐取来,李晶晶,郭学武,等.清香型大曲酯化酶活力的研究[J].中国酿造,2017,36(1):35-38.
[3]刘阳.中高温大曲中产酯化酶细菌的选育[D].芜湖:安徽工程大学,2013.
[4]杜礼泉,唐聪,杨徐才,等.控制杂菌污染提高酯化酶粗酶制剂的质量[J].中国酿造,2003,22(6):41-42.
[5]任佳明,李付丽,吴鑫颖,等.紫色红曲霉FBKL3.0018液态发酵产酯化酶的研究[J].中国酿造,2016,35(7):69-73.
[6]黄丹,张强,严芳,等.浓香型大曲中酯化酶细菌的分离鉴定及产酶条件研究[J].中国酿造,2009,28(8):57-59.
[7]胡长浩,施文芳,沈麟,等.脂肪酶菌种的筛选、鉴定及酶学性质研究[J].生物技术,2009,19(2):53-57.
[8]胡朝阳,韦晗宁,李春苑,等.产脂肪酶菌株的筛选及酶学特性研究[J].广西农业生物科学,2006,25(3):261-264.
[9]王琰,张志敏,王斌,等.耐酸性脂肪酶产生菌的筛选及酶学性质研究[J].饲料工业,2011,32(10):29-33.
[10]舒正玉,杨江科,闰云君.黑曲霉F044脂肪酶的分离纯化及酶学性质研究[J].生物工程学报,2007,23(1):96-100.
[11]SHARMA R,SONI S K,VOHRA R M.Purification and characterization of a thermostahlc alkaline lipase from a new thermophilicBacillus sp.RSJ-1[J].Process Biochem,2002,37(10):1075-1084.
[12]初春玲,徐世江.利用酯化酶制剂生产黄水酯化液[J].中国酿造,2000,19(2):27-31.
[13]中华人民共和国卫生部.GB 25594—2010食品工业用酶制剂[S].北京:中国标准出版社,2010.
[14]潘运国.根霉酯化酶液态培养、酶学特性及应用[D].泰安:山东农业大学,2006.
[15]DHARMSTHITI S,LUCHAI S.Production,purification and characterization of thermophilic lipase fromBacillussp.THL027.[J].FEMS Microbiol Lett,2013,27(2):1792-1798.
[16]杨学昊,尹春华,傅四周,等.根霉脂肪酶发酵优化和酶性质的研究[J].中国油脂,2004(7):29-32.
[17]SVENDSEN A,BORCH K,BARFOED M,et al.Biochemical properties of cloned lipases from thePseudomonasfamily[J].Biochim Biophy Acta,1995,1259(1):9-17.
[18]吴义真.异常毕赤酵母1003胞外脂肪酶的分离纯化及表征研究[D].福州:福建师范大学,2008.
TS261.1
0254-5071(2017)05-0123-05
10.11882/j.issn.0254-5071.2017.05.026
2017-01-16
贵州省科技合作计划项目(黔科合LH字【2014】7675号);贵州省星火计划项目(黔科合成转字【2015】5337号)
胡娜(1993-),女,硕士研究生,研究方向为酶工程。
*通讯作者:吴鑫颖(1975-),女,副教授,硕士,研究方向为酶工程。

