温度对高温大曲液态培菌过程菌群结构的影响
邱增钰,王亚平,李博艺,谢彪,刘国峰,肖冬光*
(1.天津科技大学生物工程学院天津市工业微生物重点实验室,天津300457;2.金开生物工程有限公司,四川成都611130;3.尤特尔生物科技有限公司,山东邹城273500)
温度对高温大曲液态培菌过程菌群结构的影响
邱增钰1,王亚平1,李博艺1,谢彪2,刘国峰3,肖冬光1*
(1.天津科技大学生物工程学院天津市工业微生物重点实验室,天津300457;2.金开生物工程有限公司,四川成都611130;3.尤特尔生物科技有限公司,山东邹城273500)
选用高温大曲在30℃、37℃、40℃、43℃和53℃不同温度条件下液体培养,对培养过程中微生物菌群结构和代谢产物的变化进行了分析。结果表明,较低的培养温度有利于酵母菌和乳酸菌的生长,而较高的培养温度有利于耐高温细菌和霉菌的生长。其中,酵母菌在37℃培养60 h数量最多,霉菌在53℃培养48 h数量最多,乳酸菌在37℃培养24 h数量最多,总细菌在40℃培养24 h数量最多。从代谢产物的分析结果看,酒精度和总酸含量在37℃时含量最高,乙酸乙酯、总酯含量在30℃时最高,α-氨基酸态氮含量在53℃时最高。可根据增强发酵活力、提高酒度和酯含量等需求,延长不同培养温度范围的保持时间。
高温大曲;菌群结构;代谢产物;液态培养

QIU Zengyu1,WANG Yaping1,LI Boyi1,XIE Biao2,LIU Guofeng3,XIAO Dongguang1*
(1.Tianjin Key Lab of Industrial Microbiology,College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457, China;2.Jinkai Biological Technology Company,Chengdu 611130,China;3.Youter Bio-Technology Co.,Ltd.,Zoucheng 273500,China)
酱香型白酒是中国白酒的典型香型之一,其“四高一长”(高温制曲、高温堆积、高温发酵、高温流酒和长期贮存)的独特工艺造就了酱香型白酒独特的风味特征,在世界范围内产生了广泛的影响[1]。高温大曲在白酒发酵过程中具有重要的地位,因其开放型的发酵工艺、自然接种,让微生物种类、数量和消长情况极为复杂[2],至今尚未完全研究透彻大曲在酿酒发酵过程中各种微生物的作用机理[3-4]。而其生产工艺的堆积工序,是大曲酒工艺中的独特方式,堆积发酵是富集有益微生物、酶类的重要工序,也是在多种酶类共同作用下合成风味物质和风味前体物质的重要过程[5]。据多年的生产经验,温度是培菌过程中的主要控制指标,大多通过堆积厚度、大小、形状和室温来控制,一般收堆温度控制在28~32℃,堆积发酵56~72 h,局部堆积温度高达54.6~58.5℃,所产酒酱香比较突出[6]。近年来,有许多关于酱香型白酒堆积过程微生物演替规律和代谢产物分析的报道,如张荣[7]从高温大曲中筛选出三株产酱香功能细菌,并发现55℃高温环境是菌株BL-L1发酵产生酱香香气的重要条件;王贵军等[8]对酱香型白酒酒醅堆积和窖内发酵过程中微生物、理化性质、工艺研究进展等方面进行了总结,得出窖内发酵上、中、下层次就的风格不同,上层产的基酒酱味突出,下层酒窖香突出的理论;黄永光等[9]对酱香型白酒生产堆积发酵过程酒醅中的酵母菌进行分离、形态学初筛和鉴定分析,从堆积酒醅中共分离鉴定出酿酒酵母,拜氏接合酵母,胶红酵母等属种酵母并对发酵性能及其发酵代谢风味成分贡献进行研究;申孟林等[10]依据大曲原料和制作工艺,对大曲中微生物的来源、主要微生物类群以及各类微生物的主要功能进行分析。在堆积过程中,由于各处物料温度、湿度、供氧的差异,导致了酿酒微生物及其代谢产物的多样性。在研究微生物菌群结构和代谢时不同取样点微生物的种类和代谢产物相差很大,所得的结果各不相同,对生产的指导意义有限。
由于不同温度对高温大曲培菌过程菌群结构及代谢产物的影响不同,收堆温度为28~32℃,局部堆积温度高达54.6~58.5℃,高温大曲堆积发酵时间一般为56~72 h,获得培菌成熟醅(即酒精度不再变化),因此该文通过采用液态培菌法,选取30℃、37℃、40℃、43℃和53℃条件下培养72 h获得培菌液,并分析培养过程中各个时间点下霉菌、酵母菌、细菌和乳酸菌的菌群结构[11]以及代谢产物的变化,总结高温大曲不同培菌温度下菌群结构的演替规律,观察代谢产物与菌群结构的对应关系,为酱香型白酒高温堆积工艺的改进和完善提供一些理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高粱(含淀粉63.71%):产地东北;酱香大曲:贵州国台酒业有限公司;液化酶(酶活2×104U/mL):丹麦诺维信公司。
1.1.2 主要培养基
(1)马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L,葡萄糖20 g/L,氯霉素100 μg/mL,琼脂2%。
(2)酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose,YPD)培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,氯霉素100 μg/mL,琼脂2%。
(3)MRS培养基(乳酸细菌琼脂培养基):蛋白胨10g/L,牛肉膏10 g/L,酵母膏5 g/L,柠檬酸氢二铵2 g/L,葡萄糖20 g/L,吐温-80 1 mL/L,乙酸钠5 g/L,磷酸氢二钾2 g/L,硫酸镁0.58 g/L,硫酸锰0.25 g/L,放线菌酮25 μg/mL,pH 6.2~6.6,琼脂2%。
(4)LB培养基(细菌基础琼脂培养基):酵母浸粉5g/L,蛋白胨10 g/L,氯化钠10 g/L,放线菌酮25 μg/mL,琼脂2%。
1.2 仪器与设备
UVmini-1240分光光度计:岛津仪器(苏州)有限公司;Agilent 7890B气相色谱仪、Agilent HP-INNOWAX色谱柱(30 m×320 μm×0.25 μm):美国安捷伦科技有限公司。
1.3 方法
1.3.1 高温大曲培菌液制备方法
取高粱粉20 g,加入80 mL的水和16 μL液化酶,搅拌均匀,加热至85~90℃,液化1 h。在0.1 MPa、121℃下糊化30 min,冷却至30℃,加入5 g的高温大曲,补水至120 mL,混匀,在不同温度下培菌72 h,培菌温度及升温方式见表1。培菌过程每12 h取样分析,培养72 h为培菌成熟醅。

表1 不同温度培菌控制方式Table 1 Control modes of microbial culture at different temperature
1.3.2 微生物菌群计数
(1)平板菌落计数法。在无菌操作下,将三角瓶中培菌液摇匀,取1 mL菌液进行10倍稀释法,稀释到合适的浓度,取100 μL加入装有培养基的培养皿中,涂布均匀,同一稀释度操作三个平行样品,倒置培养。培养一段时间后,取平板生长数量在20~100之间的平板进行计数,三个平行数据取平均值,绝对误差小于5%。
(2)霉菌用PDA培养基[12],酵母菌用YPD培养基[13],乳酸菌用MRS培养基[14],总细菌数用LB培养基[15]。
1.3.3 主要理化指标测定
培菌液酒精度的测定:将培菌成熟醅进行蒸馏,取100mL蒸馏液,用酒精计法测量[16]。还原糖测定:菲林滴定法[17]。α-氨基酸态氮测定:茚三酮法[18]。总酸测定:酸碱滴定指示剂法[19]。总酯测定:酸碱滴定指示剂法[19]。
1.3.4 主要风味物质测定
取培菌蒸馏液进行气相色谱测定:气相色谱检测条件:Agilent HP-INNOWAX色谱柱(30 m×320 μm×0.25 μm);载气为高纯氮气(纯度>99.999%);柱流速为0.8 mL/min;进样口温度200℃;检测器温度150℃;程序升温:起始温度50℃保持8 min,以5℃/min升至150℃,保持15 min;进样体积为1 μL;分流进样,分流比为10∶1。
2 结果与分析
2.1 高温大曲不同温度下培菌过程微生物菌群结构分析
高温大曲培菌过程中的微生物种类很多,培菌过程中微生物菌群的演替规律对酒质的好坏和风味物质的含量有着很大的影响。由于各种微生物生长与代谢的最适温度不同,通过调节温度即可以调节不同微生物的比例和动态变化,进而调节风味物质的比例和酒质。白酒发酵过程中的主要功能菌群为霉菌、酵母菌、细菌,其中乳酸菌对于平衡各类微生物的生长和代谢有很大影响,所以同时对高温大曲不同培菌温度下乳酸菌的演替规律进行分析。
2.1.1 30℃条件下培菌过程中菌群结构的变化
高温大曲30℃条件下培菌过程中霉菌、酵母菌、乳酸菌和总细菌数的变化情况结果见图1。由图1可知,霉菌菌量从培养开始逐渐减少,在36h左右菌落数几乎为零,分析原因,可能是由于霉菌为好氧菌[20],当酵母菌和细菌生长较快,使培养液中的含氧量很快耗尽导致霉菌死亡。酵母菌在60h达到峰值1.0×108CFU/mL(菌数对数值为8.00)。乳酸菌数和总细菌数在24h达到峰值,其含量分别为1.4×108CFU/mL(菌数对数值8.15)、1.8×108CFU/mL(菌数对数值为8.26),此后其数量有所减少,乳酸菌所占比重增加,分析原因乳杆菌属是发酵中后期的绝对优势菌属,是乳酸的主要产生菌属[21]。

图1 高温大曲30℃培菌过程中微生物数量变化Fig.1 Changes of microbial count at 30℃during high temperature Daqu cultivation
2.1.2 37℃条件下培菌过程中菌群结构的变化
高温大曲37℃条件下培菌过程中霉菌、酵母菌、乳酸菌和总细菌数的变化情况结果见图2。由图2可知,霉菌菌落的变化规律与30℃培菌时差别不大。酵母菌在60 h达到峰值3.1×108CFU/mL(菌数对数值为8.49),明显高于30℃培养时的酵母菌量。乳酸菌和总细菌数在24h量达到峰值,分别为5×108CFU/mL(菌数对数值8.90)和1.1×109CFU/mL(菌数对数值为9.04),然后逐渐减少,其中酵母菌、乳酸菌和细菌总数的峰值数明显高于30℃培养时的菌数峰值数。
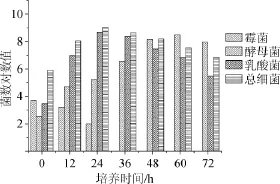
图2 高温大曲37℃培菌过程中微生物数量变化Fig.2 Changes of microbial count at 37℃during high temperature Daqu cultivation
2.1.3 高温大曲40℃条件下培菌过程中菌群结构的变化
高温大曲40℃条件下培菌过程中霉菌、酵母菌、乳酸菌和总细菌数的变化情况结果见图3。由图3可知,霉菌菌数从培养开始越来越少,在60h左右菌落数几乎为零,其变化规律与30℃、37℃大致相同;酵母菌在60h达到峰值1.0×108CFU/mL(菌数对数值为8.00),其菌落数与30℃时相当,但比37℃有所减少;乳酸菌和总细菌菌落数在24 h达到峰值,分别为3×108CFU/mL(菌数对数值为8.48)和2.6×109CFU/mL(菌数对数值为9.42),其中乳酸菌菌落数比37℃时有所减少,而总细菌菌落数比37℃时有所增加。

图3 高温大曲40℃培菌过程中微生物数量变化Fig.3 Changes of microbial count at 40℃during high temperature Daqu cultivation
2.1.4 高温大曲43℃条件下培菌过程中菌群结构的变化
高温大曲43℃条件下培菌过程中霉菌、酵母菌、乳酸菌和总细菌数的变化情况结果见图4。由图4可知,霉菌菌量在前12 h有所增加,12 h至48 h有所减少,48 h后菌落数又开始增加,至72 h达最高值,为培养开始时的3.8倍。霉菌菌量有所增长,可能是由于培养温度较高,其他菌群繁殖速度减慢或停止生长,耗氧量减少,所以霉菌繁殖增加。酵母菌在24 h时有所减少,在36 h后又开始增加,至60 h达到峰值2.8×107CFU/mL(菌数对数值为7.45)。分析原因,可能是升温阶段,许多非耐高温的酵母菌逐渐减少,耐高温的酵母菌凸显生长优势,开始生长繁殖,所以43℃时酵母菌数峰值延迟。乳酸菌和总细菌菌落数在24h达到峰值,分别为1×108CFU/mL(菌数对数值为8.00)和1.1×109CFU/mL(菌数对数值为9.04),后随之减少,其中乳酸菌和总细菌菌落数较40℃时有所减少。

图4 高温大曲43℃培菌过程中微生物数量变化Fig.4 Changes of microbial count at 43℃during high temperature Daqu cultivation
2.1.5 高温大曲53℃下培菌过程中菌群结构的变化
高温大曲53℃下培菌过程中霉菌、酵母菌、乳酸菌和总细菌数的变化情况结果见图5。由图5可知,霉菌菌量前12h有所增加,在12h后开始减少,36h后又开始增加,后又开始减少。而酵母菌在12 h后开始减少,在48 h达到峰值3.4×103CFU/mL(菌数对数值3.53)后几乎为零,分析原因,可能是53℃培养时,只有升温培养阶段的前24 h酵母菌菌落数增加,培养至36h后培养温度逐渐升高到达53℃,由于培养温度过高,酵母菌开始大量死亡,48 h已无活的酵母菌。乳酸菌在12 h达到峰值8.3×107CFU/mL(菌数对数值7.92)后随之减少,在36 h之后几乎为零,由于培养温度逐步升高,乳酸菌开始死亡。总细菌菌落数在12 h量达到峰值3.3×108CFU/mL(菌数对数值8.52)后遂渐减少,在培养过程中随着温度和酸度的升高,其细菌数量逐渐减少,后期生存的细菌大部分为耐高温耐酸细菌[22-24],所以总细菌数量较其他四个温度明显减少。

图5 酱香大曲53℃培菌过程中微生物数量变化Fig.5 Changes of microbial count at 53℃during high Moutai flavor Daqu cultivation
2.2 高温大曲不同温度下培菌过程理化指标分析
2.2.1 不同温度培菌液的理化指标
(1)不同温度培菌成熟醅酒精度情况分析

图6 不同培养温度对培菌液酒度的影响Fig.6 Effect of different culture temperature on alcohol content of fermentation broth
高温大曲在不同温度下培菌72 h培菌液的酒精度检测结果见图6。由图6可知,30℃、40℃、43℃条件下酒精度差别不大,在37℃时酒精度最高,53℃时其酒精度几乎为零。分析原因,37 ℃时酵母菌数量最多,因此酒精度最高。
(2)不同温度培菌液α-氨基酸态氮情况分析
高温大曲在不同温度下培菌液的α-氨基氮含量检测结果见图7。由图7可知,在30℃、37℃、40℃、43℃条件下培养时,培养24 h时的α-氨基酸态氮含量最高,其含量范围为140~180 mg/L;而53℃培养时,在72 h时的α-氨基酸态氮含量最高,达到226 mg/L。分析原因,蛋白酶的最适作用温度在40℃左右,37℃培养时,α-氨基酸态氮在24 h后逐渐下降,主要是37℃培养时微生物的生长总量最多,微生物的生长消耗了较多的α-氨基酸态氮;53℃培养时,微生物的生长总量最少,微生物的消耗的α-氨基酸态氮也最少,至72 h时积累了较多的α-氨基酸态氮。

图7 不同培养温度对培菌液α-氨基氮含量的影响Fig.7 Effect of different culture temperature on α-amino nitrogen content of fermentation broth
(3)不同温度培菌成熟醅总酸情况分析
高温大曲在不同温度下培菌液总酸含量检测结果见图8。由图8可知,37℃时酸度最高,其次为40℃和30℃,53℃时,总酸含量最少,约为37℃时的1/9。分析原因,在30℃、37℃、40℃培菌液中,总酸含量较大,说明嗜酸菌生长温度更适合30~40℃;而37℃时酸度最高,与之对应的乳酸菌含量最多;53℃培养时,24h后乳酸菌大量死亡,因而其总酸含量较少。
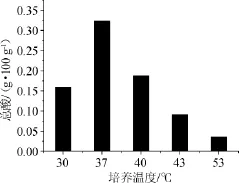
图8 不同培养温度对培菌液总酸含量的影响Fig.8 Effect of different culture temperature on total acid content of fermentation broth
(4)不同温度培菌成熟醅总酯情况分析
高温大曲在不同温度下培菌液总酯含量检测结果见图9。由图9可知,在30℃时,总酯含量最高,其次为53℃和40℃,37℃时酯含量最低。分析原因,由于酵母产酯适合在较低温度,故30℃时酯含量高;化学合成温度越高越快,因此53℃时,酯含量也较高;40℃左右是酯化酶合成最适温度,所以40℃时酯的含量中等。

图9 不同培养温度对培菌液总酯含量的影响Fig.9 Effect of different culture temperature on total ester content of fermentation broth
2.2.2 高温大曲不同培菌温度下培菌成熟醅风味物质分析
高温大曲不同培菌温度下培养72 h后培菌成熟醅中常见风味物质的分析数据检测结果见表2。由表2可知,30℃培菌成熟醅中的乙酸乙酯含量到达210 mg/L左右,明显高于其他温度时的含量,说明乙酸乙酯合成适宜温度为30℃,在37℃培菌培菌成熟醅中乙酸含量高达150mg/L,说明乙酸合成适宜温度为37℃,在30℃、37℃、40℃、43℃时高级醇中异丁醇、异戊醇、苯乙醇的含量差别不大,乙酸异丁酯只有30℃时有少量含量,53℃培菌成熟醅中常见风味物质含量较低。
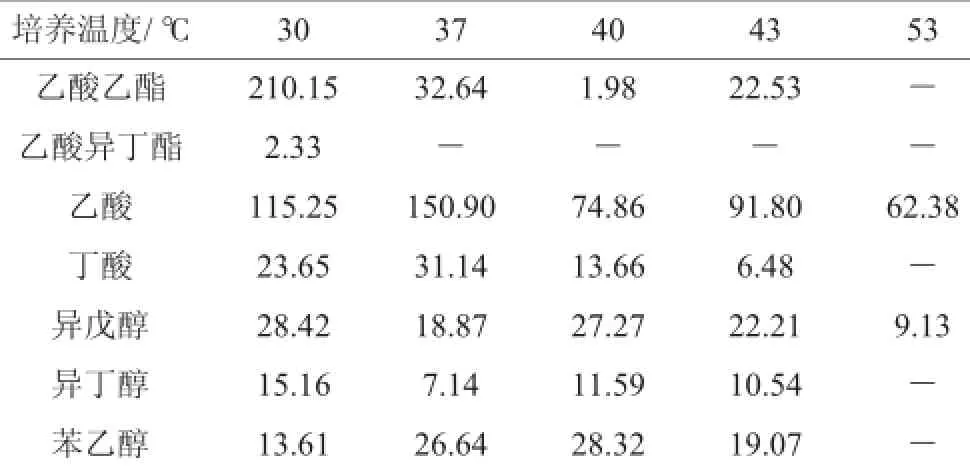
表2 主要风味物质含量分析结果Table 2 Results of main flavor substance contents analysis mg/L
3 结论
从不同温度下培菌过程微生物菌群结构来看,实验结果表明,霉菌为好氧菌,在43℃培养12 h时菌落数最多。酵母菌在37℃培养至60 h时菌落数最多。乳酸菌在37℃培养至24 h时菌落数最多。细菌在40℃培养至24 h时菌落数最多。
从理化指标来看,酒精度在37℃培养时最高,53℃培养时酒精度几乎为零。比较不同培养时间α-氨基酸态氮的变化情况,24 h时培养温度为37℃时α-氨基氮含量最高,48 h时培养温度为40℃时α-氨基酸态氮含量最高,72 h时培养温度为53℃时α-氨基酸态氮含量最高。从总酸情况来看,37℃培养时酸度最高,53℃培养时酸度最低。从总酯含量看,30℃时总酯含量最高,其次是53℃和40℃。从常见风味物质含量看,30℃时,风味物质的种类和总量都最多,随着培养温度的上升,风味物质总量逐渐下降。53℃时,非耐高温菌逐渐失活,常见风味物质含量较低,但耐高温菌的生长繁殖,产生特殊的酱香风味成分,分析原因,高温培养环境,是芽孢杆菌富集,芽孢杆菌属细菌可以产生吡嗪、芳香族类、有机酸类物质,它们可能对白酒的风味产生重要作用[25]。
从实验结果来看,温度对高温大曲培菌过程菌群结构及代谢产物有很大影响,如果要提高霉菌量,以生产多种酿酒酶系,就应适当加强供氧量,提高堆积的松散度或减少堆积厚度;如要增强发酵活力,提高酒度和酯含量,就应适当延长温度在30~37℃范围内的时间,以促进酵母菌的生长与代谢,并合成较多的乙酸酯类物质;如要提高酸度和乳酸酯的含量,就应适当延长温度在37~40℃范围内的时间,以促进乳酸菌等产酸菌群的生长。如要增加风味前体物质α-氨基氮的含量,促进酱香风味物质的形成,就应适当提高堆积厚度,增加43~53℃的高温区域,从而提高耐高温菌群的数量。
4展望
微生物在白酒发酵过程中发挥着至关重要的作用,生物多样性与后期发酵风味的产生密切相关,各菌种相互平衡、协同作用,有利于发酵的进行。因此研究高温大曲在堆积培菌过程中的菌群结构变化,对提高酒质,稳定酱香白酒品质有着重要的影响,也为实现高温大曲堆积培菌过程中微生物的可控性提供依据。
由于高温大曲培菌过程中微生物种类繁多,结构复杂,受环境影响大,其不可控性较高,了解其微生物的生长规律性,即可获得较为成熟的培菌方式,逐渐揭开酱香白酒主要风味物质的神秘面纱。探究微生物生长规律,对酱香白酒具有非常重要的学术意义和应用价值。
[1]唐玉明,任道群,姚万春,等.酱香型酒糟醅堆积过程温度和微生物区系变化及其规律性[J].酿酒,2007,34(5):54-58.
[2]WANG X D,XU J,ZHOU H X,et al.Characterization ofEurotium cristatusisolated from maotai-flavored Daqu,a traditional Chinese Maotai-flavored liquor fermentation starter,for its abilities to produce en-zymes and aromas[J].Food Sci,2016,37(11):154-159.
[3]万自然.大曲培养过程中微生物及酶的变化[J].酿酒,2004,31(4):25-26.
[4]罗惠波,李浩,黄治国,等.BIOLOG微生物鉴定系统在大曲微生物多样性研究中的应用初探[J].中国酿造,2009,28(4):92-94.
[5]胡鹏刚,邱树毅,龚万和,等.酱香型大曲稳定堆积发温发酵的生产方法102181341A[P].2011-09-14.
[6]杨国华,邱树毅,黄永光.酱香白酒生产中产香微生物研究[J].中国酿造,2011,30(4):24-27.
[7]张荣.产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学,2009.
[8]王贵军,沈才洪,张洪远,等.酱香型白酒糟醅堆积与窖内发酵工艺研究[J].酿酒科技,2011,32(5):36-41.
[9]黄永光,谌永前,吴广黔,等.酱香白酒堆积发酵过程酒醅中酵母菌的分析研究[J].酿酒科技,2013,34(6):8-13.
[10]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[11]ZHU D,WU Z,LUO A,et al.Characterization and detection of toxiflavin-producingBurkholderiain rice straws and Daqu for Chinese Maotai-flavor liquor brewing[J].J Inst Brew,2015,121(2):290-294.
[12]王世宽,潘明,徐艳丽,等.浓香型大曲发酵过程中霉菌消长情况的研究[J].中国酿造,2010,29(1):42-45.
[13]徐军,罗惠波,崔德宝,等.大曲中酵母菌的分离及其鉴定[J].酿酒,2008,35(3):95-97.
[14]陈健凯.蔬菜中乳酸菌的分离鉴定及产酸性能的研究[J].福建热作科技,2007,32(4):1-4.
[15]马校卫,颜林春,汤二将,等.高温大曲中产耐热性蛋白酶芽孢杆菌的筛选和鉴定[J].食品工业科技,2012,34(15):169-173.
[16]牟建楼,王颉,张伟,等.乙醇的测定方法综述[J].酿酒,2006,33(2):46-48.
[17]李雪梅,杨俊慧,张利群,等.还原糖测定方法的比较[J].山东科学,2008,21(2):18-20.
[18]林梅香.浅谈麦汁中α-氨基氮的测定[J].啤酒科技,2002,9(9):37-40.
[19]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2012:35-36.
[20]陈笔.酱香型白酒酿造过程中霉菌群落结构以及霉菌与酵母相互作用的研究[D].无锡:江南大学,2014.
[21]梁晨,杜海,徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[M].生物学通报,2017,44(2):384-393.
[22]王婧,王晓丹,罗晓叶,等.酱香大曲中高产蛋白酶功能细菌的筛选及鉴定[J].中国酿造,2015,34(10):43-46.
[23]姚粟.芝麻香型白酒高温大曲细菌群落多样性研究[D].北京:北京林业大学,2013.
[24]王婧.酱香大曲中产吡嗪类物质芽孢杆菌的筛选及其应用研究[D].贵阳:贵州大学,2016.
[25]黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
TS261.1
0254-5071(2017)05-0030-06
10.11882/j.issn.0254-5071.2017.05.007
2016-12-03
国家高技术研究发展计划‘863计划’项目(2012AA022108);中国白酒3C计划项目(1400040024)
邱增钰(1992-),女,硕士研究生,研究方向为发酵工程。
*通讯作者:肖冬光(1954-),男,教授,博士,研究方向为发酵工程。

