酸浓度和pH值对浓香型大曲酯化酶催化活力的影响
张浩,胡智慧,刑爽,李镇江,谢彪,肖冬光*
(1.天津科技大学生物工程学院,天津300457;2.成都金开生物工程有限公司,四川成都610000)
酸浓度和pH值对浓香型大曲酯化酶催化活力的影响
张浩1,胡智慧1,刑爽1,李镇江2,谢彪2,肖冬光1*
(1.天津科技大学生物工程学院,天津300457;2.成都金开生物工程有限公司,四川成都610000)
研究了己酸、乳酸、丁酸、乙酸的浓度以及pH值对浓香型大曲酯化酶催化合成四种酯(己酸乙酯、乳酸乙酯、丁酸乙酯、乙酸乙酯)的影响。结果表明,大曲酯化酶催化合成四种酯的最适酸质量浓度分别为己酸8 g/L,乳酸1 g/L,丁酸9 g/L,乙酸12 g/L;在同一酸浓度条件下,大曲酯化酶催化合成己酸乙酯、丁酸乙酯、乙酸乙酯最适pH值均为4.5,乳酸乙酯最适pH值为6.0;大曲酯化酶催化相同物质的量浓度混合酸的试验结果表明,己酸乙酯的合成以酯化酶催化反应为主,而乳酸乙酯和丁酸乙酯的合成以化学反应为主。
酸浓度;pH;浓香型大曲;酯化酶
ZHANG Hao1,HU Zhihui1,XING Shuang1,LI Zhenjiang2,XIE Biao2,XIAO Dongguang1*
(1.College of Bioegineering,Tianjin University of Science and Technology,Tianjin 300457,China; 2.Chengdu Biological Engineering Co.,Ltd.,Chengdu 610000,China)
酯类化合物是白酒中的主要风味物质,其含量在白酒风味物质中所占比例最大[1]。白酒中的酯类有100多种,其中乙酸乙酯、己酸乙酯和乳酸乙酯为白酒中的主要酯,含量之和占总酯的90%~95%[2]。酯的合成在化学和酶的作用下均可进行,因此白酒中的酯和相应前体酸的含量以及其量比关系,直接影响白酒的质量和风味[3]。
浓香型大曲是以生料小麦为主要原料经固态发酵而成的发酵剂[4]。大曲具备糖化发酵、投粮、酒化和生香的功能,为白酒发酵提供内在动力,有“大曲是酒之骨”之称[5]。由于在制曲过程中网罗了自然环境中的大量有益微生物,再经发酵培菌管理,使成品大曲中含有丰富的酿酒微生物菌系和酶系[6-7]。大曲酶系中的酯化酶对催化合成浓香型白酒中己酸乙酯、乳酸乙酯、丁酸乙酯和乙酸乙酯等重要酯类具有重要的作用,在保证白酒品质方面也有极其重要的作用[8]。
从生物化学方面讲,凡是酶,其本质都是蛋白质(除自催化的核糖核酸酶外),在催化反应时均存在反应底物及产物、反应温度、反应时间、反应环境的酸碱度和反应介质(反应溶剂类型)等因素的影响而导致产物酯的生成量的不同[9-10]。同时,酶的催化过程是一个可逆反应,在一定条件下会将已生成的酯分解成相应的酸和醇,同样会影响酯的生成量[11-12]。
本实验研究了四种酸(己酸、乳酸、丁酸、乙酸)的浓度及pH值对浓香型大曲酯化酶催化合成四种酯(己酸乙酯、乳酸乙酯、丁酸乙酯、乙酸乙酯)的影响,通过比较不同酸浓度和不同pH值条件下浓香型大曲酯化酶催化合成酯的多少,确定浓香型大曲酯化酶催化合成酯的最适酸浓度和最适pH值,以期为白酒发酵过程中酯类物质的积累起到指导作用。
1 材料与方法
1.1 材料与试剂
浓香型大曲(酯化酶活力为18.16 U/g曲):某酒业有限公司。
己酸、乙酸、丁酸、乳酸、乙醇、氢氧化钠、硫酸均为国产分析纯。
1.2 仪器与设备
EL20实验室pH计:梅特勒仪器(上海)有限公司;DHP恒温培养箱:上海智诚分析仪器制造有限公司;BXW-360 SD-G立式压力灭菌锅:上海博讯实业有限公司;Agilent7890B气相色谱仪(gas chromatograph,GC):美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 乙醇体积分数对大曲中微生物生长代谢的影响
(1)在乙醇体积分数分别为5%、10%、15%、20%和25%的乙醇溶液(100 mL)中,分别添加相同浓度的酸配制成反应液(用稀硫酸溶液调整酸度,稀硫酸浓度为1 mol/L),加入5 g浓香型大曲粉末,30℃静置反应,第0天和第7天时分别测定不同乙醇体积分数的反应液中总糖含量变化。
(2)将不同乙醇体积分数(5%、10%、15%、20%、25%)的10mL反应液加入5支试管中,并加入0.5g浓香型大曲粉末,分别在试管中加入杜氏小管(避免加入时杜氏小管内部产生气泡),30℃静置反应,观察杜氏小管中气泡产生情况。
1.3.2 单一酸浓度对大曲酯化酶合成酯的影响
在乙醇体积分数20%的100 mL乙醇溶液中,分别添加不同浓度的己酸、乙酸、丁酸和乳酸配制成反应液,实验组加入5g正常浓香型大曲粉末,对照组加入5 g灭活的浓香型大曲粉末,30℃静置反应7 d[13],测定酯含量。
1.3.3 pH值对大曲酯化酶合成单一酯的影响
在乙醇体积分数20%的100 mL乙醇溶液中,保持单一酸浓度(模拟白酒发酵时的酸浓度范围,取己酸质量浓度为11.60 g/L,乙酸质量浓度为12.00 g/L,丁酸质量浓度为2.46 g/L,乳酸质量浓度为13.50 g/L)不变,实验组加入5 g正常浓香型大曲粉末,对照组加入5 g灭活的浓香型大曲粉末,并分别用1mol/L的NaOH溶液和1mol/L的H2SO4溶液调节反应液的pH值为6.0、5.0、4.5、4.0、3.5、3.0,30℃静置反应7 d,测定酯含量。
1.3.4 pH值对大曲酯化酶合成混合酯的影响
将乙醇体积分数20%的100mL乙醇溶液配制成相同物质的量浓度(0.02mol/L)的己酸、乙酸、乳酸和丁酸反应液,实验组加入5g正常浓香型大曲粉末,对照组加入5 g灭活的浓香型大曲粉末,分别用1 mol/L的NaOH溶液和1 mol/L的H2SO4溶液调节反应液的pH值为6.0、5.0、4.5、4.0、3.5、3.0,30℃静置反应7 d,测定酯含量。
1.3.5 酯含量的测定
(1)蒸馏:将反应7 d的试样倒入1 000 mL蒸馏烧瓶中,量取100 mL蒸馏水充分洗涤装酯化液的三角瓶,将洗液一并倒入烧瓶中蒸馏,取蒸馏液100 mL[14]。
(2)气相色谱检测条件:色谱柱Agilent HP-INNOWAX(30 m×320 μm×0.25 μm);载气为高纯氮气(>99.999%);柱流速为0.8mL/min;进样口温度200℃;检测器温度200℃;程序升温:起始温度50℃,保持8min,以5℃/min升至150℃,保持15 min;进样体积为1 μL;分流进样,分流比为10∶1[15]。
1.3.6 总糖含量的测定
将反应溶液摇晃均匀,取10.00 g于250 mL三角瓶,加入100 mL体积分数2%的盐酸溶液,轻轻摇动三角瓶。瓶口安上长约1 m的长玻璃管,于沸水浴中回流水解2 h。取出,迅速冷却用氢氧化钠溶液调pH值至7.0左右。然后用脱脂棉过滤,滤液用500 mL容量瓶接收,用水充分洗涤三角瓶和残渣,洗液全部滤入容量瓶中,最后用水定容至刻度,再用斐林试剂法滴定糖含量。
2 结果与分析
2.1 乙醇体积分数对大曲中微生物的生长代谢的影响
不同乙醇体积分数的反应液中总糖含量及产气情况如表1及表2所示。
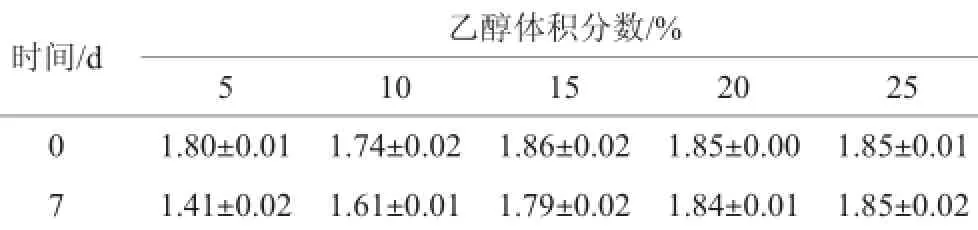
表1 不同乙醇体积分数反应液中的总糖含量变化Table 1 Changes of total sugar content in the reaction solution with different alcohol content%
由表1可知,当乙醇体积分数为5%~15%时,反应液中总糖含量均减少,并且随乙醇体积分数的升高总糖消耗量逐渐减少;当乙醇体积分数≥20%时,总糖含量基本不变。

表2 不同乙醇体积分数反应液中的产气情况Table 2 Gas production in the reaction solution with different alcohol content
由表2可知,当乙醇体积分数<20%时,随反应时间延长产气逐渐增多,并且随乙醇体积分数的升高产气逐渐较少;当乙醇体积分数≥20%时,无产气现象。
根据不同乙醇体积分数的反应液中总糖含量变化和杜氏小管的充气情况,推断反应液乙醇体积分数为20%时,微生物基本无生长代谢情况,因此研究大曲酯化酶催化活性时可使用乙醇体积分数20%的反应液。
2.2 酸浓度对大曲酯化酶合成酯的影响
2.2.1 己酸质量浓度对大曲酯化酶催化合成己酸乙酯的影响
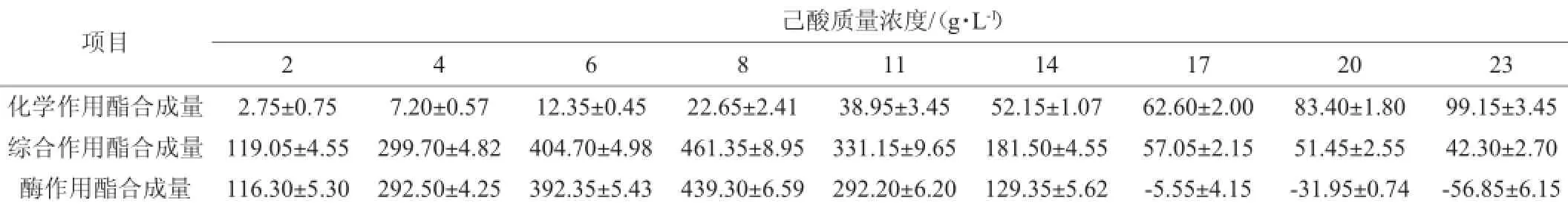
表3 己酸质量浓度对大曲酯化酶合成己酸乙酯的影响Table 3 Effect of hexanoic acid concentration on the synthesis of ethyl hexanoate by Daqu esterifying enzymemg/L
由表3可知,在不同的酸浓度条件下,大曲酯化酶合成和分解酯的情况不同。加灭活曲时,大曲中酯化酶已失活,反应系统因单纯的化学合成作用而合成己酸乙酯,并且随着己酸的浓度在一定范围内逐渐增大,己酸乙酯的合成量不断增加。加正常曲时,己酸乙酯的合成量呈先升高后降低的趋势。当己酸质量浓度<8 g/L时,己酸乙酯的合成量随己酸浓度的增大而增加;己酸质量浓度为8 g/L时,己酸乙酯的合成量最大;继续增大己酸的浓度,己酸乙酯的合成量逐渐减少。至己酸质量浓度达17 g/L时,综合作用(加正常大曲反应系统)的己酸乙酯合成量<化学作用(加灭活曲反应系统)的己酸乙酯合成量,酯化酶催化反应合成己酸乙酯的量为负值,此时酯化酶的作用表现为酯分解反应。这是因为酶的催化反应过程为可逆的,即酯合成作用和酯分解作用同时存在,当己酸质量浓度>17 g/L时,理论上,综合作用的酯包括化学合成酯和酯化酶合成酯两部分,即综合作用酯合成量应>化学作用酯合成量,而实际,综合作用酯的合成量<化学作用酯的合成量,由此可见,大曲酯化酶分解了部分酯,主要表现为酯的分解作用;而当反应系统的己酸质量浓度<17 g/L时,综合作用合成酯>化学作用合成酯,大曲酯化酶主要表现为酯的合成作用。因此己酸质量浓度为8 g/L时,最适合合成己酸乙酯。2.2.2乳酸质量浓度对大曲酯化酶催化合成乳酸乙酯的影响
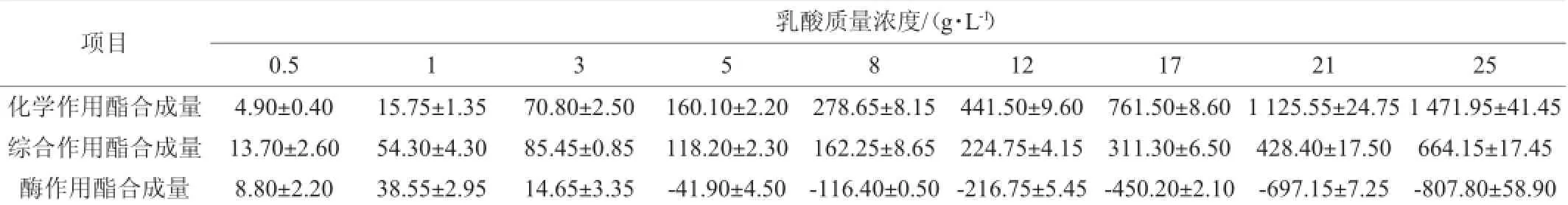
表4 乳酸质量浓度对大曲酯化酶合成乳酸乙酯的影响Table 4 Effect of lactic acid concentration on the synthesis of ethyl lactate by Daqu esterifying enzymemg/L
由表4看出,当乳酸质量浓度为1 g/L时,酯化酶催化合成乳酸乙酯的量最高,继续加大乳酸浓度,乳酸乙酯合成量逐渐减小;当乳酸质量浓度为5 g/L时,酶催化反应合成乳酸乙酯的量为负值,综合作用的乳酸乙酯合成量<化学作用的乳酸乙酯合成量;此后,随着乳酸浓度的提高,化学反应起主导作用。在白酒生产中,酒醅中的乳酸质量浓度一般达10~30 g/L,可见,在白酒发酵过程中乳酸乙酯的合成方式以化学合成作用为主。因此乳酸质量浓度为1 g/L时,最适合合成乳酸乙酯。
2.2.3 丁酸质量浓度对大曲酯化酶催化合成丁酸乙酯的影响

表5 丁酸质量浓度对大曲酯化酶合成丁酸乙酯的影响Table 5 Effect of butyric acid concentration on the synthesis of ethyl butyrate by Daqu esterifying enzymemg/L
由表5可知,在丁酸质量浓度为1~21 g/L时,加正常曲和加灭活曲反应系统的丁酸乙酯含量都随酸浓度的增加而增加;从酶合成作用看,当丁酸质量浓度为9 g/L时丁酸乙酯的合成量最大,此后随着酸浓度的增加酶合成作用有所减弱;从化学合成作用与酶合成作用的比较看,除酶作用的最适酸质量浓度(9 g/L)外,丁酸乙酯的化学合成作用都>酯化酶合成作用。因此丁酸质量浓度为9 g/L时,最适合合成丁酸乙酯。
2.2.4 乙酸质量浓度对大曲酯化酶催化合成乙酸乙酯的影响
由表6可知,加正常曲时,乙酸质量浓度为15 g/L时,乙酸乙酯的合成量最大;继续增加酸质量浓度,乙酸乙酯的合成量逐渐减少。从酶合成作用看,当乙酸质量浓度为12 g/L时,酶合成乙酸乙酯的量最大;至乙酸质量浓度达27 g/L时,酯化酶作用合成乙酸乙酯的量为负值,大曲酯化酶表现为分解作用。因此丁酸质量浓度为12 g/L时,最适合合成乙酸乙酯。
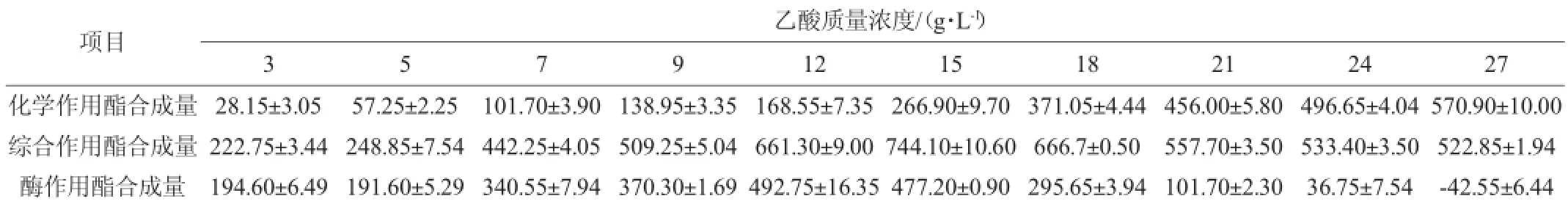
表6 乙酸质量浓度对大曲酯化酶合成乙酸乙酯的影响Table 6 Effect of acetic acid concentration on the synthesis of ethyl acetate by Daqu esterifying enzymemg/L
2.3 pH值对大曲酯化酶催化合成单一酯的影响
2.3.1 pH值对大曲酯化酶催化合成己酸乙酯的影响
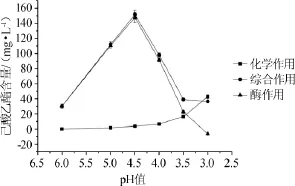
图1pH值对大曲酯化酶合成己酸乙酯的影响Fig.1 Effect of pH value on the synthesis of ethyl hexanoate by Daqu esterifying enzyme
从图1可知,pH值对大曲酯化酶合成己酸乙酯有很大影响。当反应液的pH值为4.5时,酶作用合成己酸乙酯的量最大;当pH值>4.5时,化学作用合成己酸乙酯的量的变化可忽略,酶作用合成己酸乙酯的量随pH值的下降而上升;当pH值<4.5时,化学作用合成己酸乙酯的量随pH值的下降逐渐上升,而酶作用合成己酸乙酯的量逐渐下降;至pH值为3.0时,酯化酶作用合成己酸乙酯的量为负值,此时大曲酯化酶表现为酶分解作用。因此合成己酸乙酯的最适pH值为4.5。
2.3.2 pH值对大曲酯化酶催化合成乳酸乙酯的影响
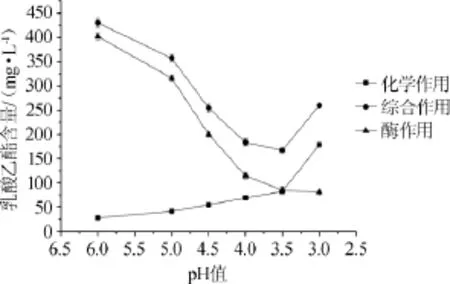
图2pH值对大曲酯化酶合成乳酸乙酯的影响Fig.2 Effect of pH value on the synthesis of ethyl lactate by Daqu esterifying enzyme
由图2可知,当反应液pH值为3.0时,化学作用合成酯的量大于酶作用合成酯的量,由于该pH值时化学作用合成的乳酸乙酯的量很大,并且综合作用中的酯是由化学和酶的双重作用合成的,所以此时综合作用合成乳酸乙酯的量突然升高;当pH值>3.5时,化学作用合成乳酸乙酯的量逐渐降低,而酶作用合成乳酸乙酯的量逐渐上升;至pH值为6.0时,酶作用合成乳酸乙酯的量最大。pH值在3.0~6.0范围内时,酶作用合成乳酸乙酯的合成量随pH值升高有增强的趋势。因此合成乳酸乙酯的最适pH值为6.0。
2.3.3 pH值对大曲酯化酶催化合成丁酸乙酯的影响
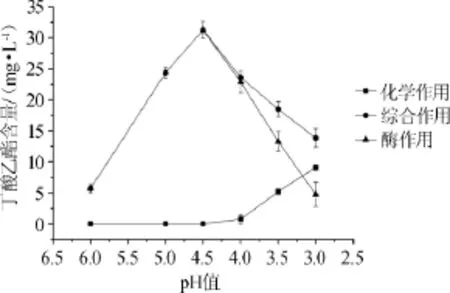
图3pH值对大曲酯化酶合成丁酸乙酯的影响Fig.3 Effect of pH value on the synthesis of ethyl butyrate by Daqu esterifying enzyme
由图3可知,当反应液的pH值为4.5时,酶作用合成丁酸乙酯的量最大;当pH值>4.5时,化学反应合成丁酸乙酯的量为零,而酶作用合成乙酸乙酯的量随pH值的下降而上升;当pH值<4.5时,化学作用合成丁酸乙酯的量逐渐上升,而酶作用合成丁酸乙酯的量逐渐下降;至pH值为3.0时,化学合成作用>酶合成作用。因此合成丁酸乙酯的最适pH值为4.5。
2.3.4 pH值对大曲酯化酶催化合成乙酸乙酯的影响
由图4可知,当反应液的pH值为4.5时,酶作用合成乙酸乙酯的量最大;当pH值>4.5时,化学作用合成乙酸乙酯的量可基本忽略,酶作用合成乙酸乙酯的量随pH值的下降而上升;当pH值<4.5时,化学作用合成乙酸乙酯的的量逐渐上升,而酶作用合成乙酸乙酯的量逐渐下降;至pH值为3.0时,化学合成作用>酶合成作用。因此合成乙酸乙酯的最适pH值为4.5。

图4pH值对大曲酯化酶合成乙酸乙酯的影响Fig.4 Effect of pH value on the synthesis of ethyl acetate by Daqu esterifying enzyme
2.4 pH值对大曲酯化酶催化合成混合酯的影响
为了更加直观的比较不同pH值条件下大曲酯化酶催化合成四种酯的能力以及化学作用合成四种酯的强弱情况,特将混合酸溶液中己酸、乳酸、丁酸和乙酸的质量浓度换算为相同的摩尔浓度,并且将合成酯的结果单位同样以摩尔浓度表示,其结果如表7所示。
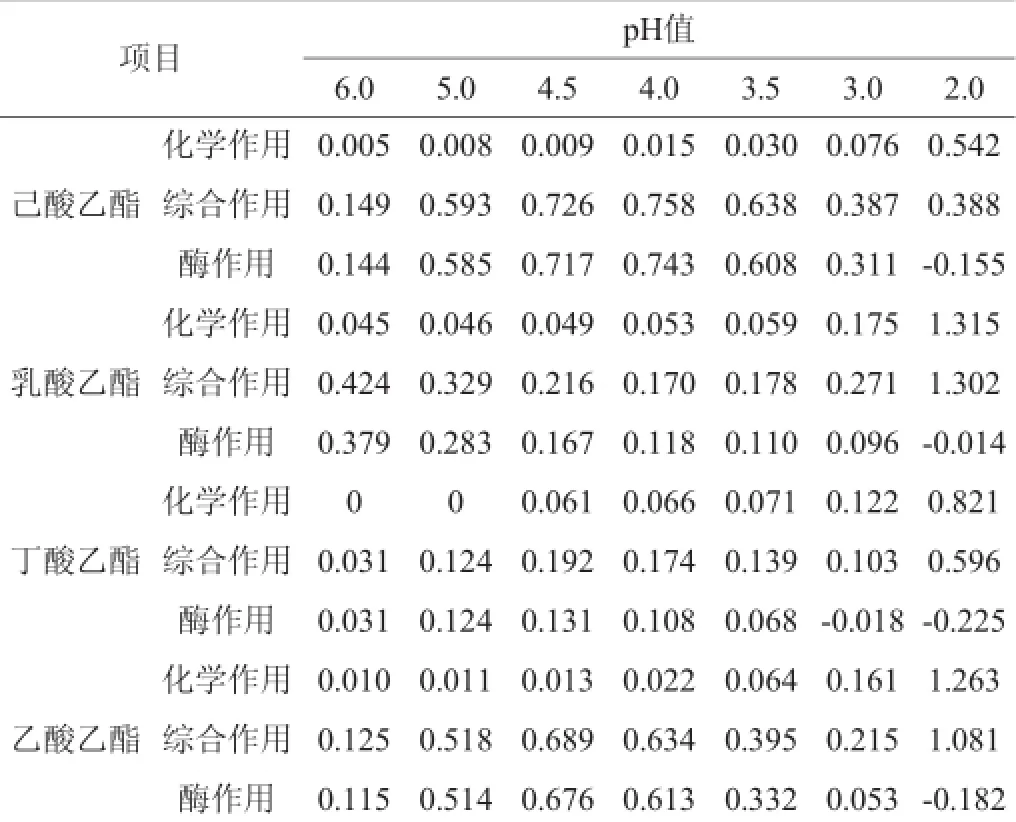
表7pH值对大曲酯化酶合成混合酯的影响Table 7 Effect of pH on the synthesis of mixing ester by Daqu esterifying enzymemmol/L
从表7看出,大曲酯化酶催化合成不同酯的最适pH值有所不同,其中乳酸乙酯为6.0,己酸乙酯、丁酸乙酯和乙酸乙酯为4.0~4.5。从化学作用合成酯的效果看,乳酸乙酯的合成量最大,其次为乙酸乙酯和丁酸乙酯,己酸乙酯的化学合成量最少。从酯化酶作用合成酯的效果看,己酸乙酯的合成量最大,其次为乙酸乙酯和乳酸乙酯,丁酸乙酯的酶作用合成量最少。从酯化酶作用与化学作用合成酯的比例看,酶作用合成酯最大值与化学作用合成酯最大值的比值分别为己酸乙酯1.371,乳酸乙酯0.288,丁酸乙酯0.160,乙酸乙酯0.540,其中己酸乙酯的比值最大,乙酸乙酯次之,丁酸乙酯和乳酸乙酯的比值较小,由此可见,己酸乙酯的合成主要以酯化酶催化作用为主,而丁酸乙酯和乳酸乙酯的合成以化学作用为主。
3 结论
酸质量浓度对浓香型大曲酯化酶催化合成四种酯的含量有很大影响,其最适酸质量浓度分别为己酸8 g/L,乳酸1 g/L,丁酸9 g/L,乙酸12 g/L,高于最适酸质量浓度时其合成相应酯的能力明显下降。
在同一酸浓度下,pH值对大曲酯化酶合成酯的含量有很大影响,其中合成己酸乙酯、丁酸乙酯和乙酸乙酯的最适pH值为4.5,合成乳酸乙酯最适pH值为6.0。当pH≤3.0时,大曲酯化酶催化合成四种酯的作用都<化学合成作用。
从大曲酯化酶作用合成酯与化学作用合成酯的比例看,己酸乙酯的比值最大,乙酸乙酯次之,丁酸乙酯和乳酸乙酯的比值最小,由此可见,己酸乙酯的合成主要以酯化酶催化作用为主,而丁酸乙酯和乳酸乙酯的合成以化学作用为主。
[1]唐取来,李晶晶,郭学武,等.清香型大曲酯化酶活力的研究[J].中国酿造,2017,36(1):35-38.
[2]滕巍,李国莹,刘小波,等.大曲中产酯化酶菌株的分离鉴定及固体发酵工艺优化[J].食品与生物技术学报,2016,35(9):971-977.
[3]任佳明,李付丽,吴鑫颖,等.紫色红曲霉FBKL3.0018液态发酵产酯化酶的研究[J].中国酿造,2016,35(7):69-73.
[4]陈洋.耐乙醇醋酸菌特性研究及应用[D].武汉:湖北工业大学,2016.
[5]乔晓梅.清香大曲糖化力酯化力功能及真菌群落结构分析[D].临汾:山西师范大学,2015.
[6]张家庆.浓香型白酒窖泥养护与制曲关键技术研究[D].武汉:湖北工业大学,2015.
[7]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:34-41.
[8]张志刚,吴生文,陈飞.大曲酶系在白酒生产中的研究现状及发展方向[J].中国酿造,2011,30(1):13-16.
[9]MARTINS A B,GRAEBIN N G,LORENZONI A S G,et al.Rapid and high yields of synthesis of butyl acetate catalyzed by Novozym 435:reaction optimization by response surface methodology[J].Process Biochem, 2011,46(12):2311-2316.
[10]PIYATHEERAWONG W,LWAASKI Y G,XU X B,et al.Dependency of water concentration on ethanolysis of trioleoylglycerol by lipases[J]. J Mol Catal B-Enzym,2004,28(1):19-24.
[11]李付丽.紫色红曲霉产酯化酶的研究[D].贵阳:贵州大学,2015.
[12]张武斌.清香大曲糖化酶的提取及宏蛋白质组学分析[D].临汾:山西师范大学,2014.
[13]中华人民共和国工业和信息化部.QB/T 4257—2011酿酒大曲通用分析方法[S].北京:中国标准出版社,2012.
[14]李海龙,黄卫星,沈才洪,等.浓香型白酒蒸馏过程实验研究[J].高校化学工程学报,2011(5):745-750.
[15]张超,胡可萍,端裕树,等.快速气相色谱法分析白酒中的香味组分[J].色谱,2007(4):586-589.
TS261.1
0254-5071(2017)05-0041-05
10.11882/j.issn.0254-5071.2017.05.009
2017-01-10
国家高技术研究发展计划‘863计划’项目(2012AA022108);中国白酒3C计划项目(1400040024)
张浩(1989-),男,硕士研究生,研究方向为现代酿造技术。
*通讯作者:肖冬光(1956-),男,教授,博士,研究方向为发酵工程。

