高效液相色谱法测定魔芋精粉中葡甘聚糖的含量
陈彦杰+褚银玲+韩超轶+张洁

[摘要]目的 建立HPLC方法测定魔芋精粉中葡甘聚糖(konjac glucomannan,KGM)含量,并对高效液相色谱(HPLC)法与比色法测定结果进行比较。方法 魔芋葡甘聚糖用2.5 mol/L的H2SO4溶液110℃水解2 h,生成D-甘露糖、D-葡萄糖,经与1-苯基-3-甲基-5-吡唑啉酮(PMP)反应得到衍生物。HPLC法中采用的色谱柱为TOSOH TSK-GEL ODS,流动相A(乙腈)∶流动相B(0.45 g磷酸二氢钾、0.5 ml TEA、100 ml乙腈、900 ml纯水混合,pH=7.5)进行梯度洗脱,流速为1.0 ml/min,检测波长250 nm,柱温30℃;比色法参照GB/T 18104-2000进行测试。结果 HPLC法测定中D-甘露糖和D-葡萄糖分别在21.2~159.3 μg(r=0.9998)和21.5~154.2 μg(r=0.9999)范围内线性关系良好;KGM平均回收率为98.9%,RSD为2.2%。与比色法比含量少5%~7%。结论 HPLC法与比色法相比测定KGM含量更准确,可更好地用于魔芋精粉质量控制和分级。
[关键词]魔芋;葡甘聚糖;比色法;高效液相色譜法;含量测定
[中图分类号] R927.2 [文献标识码] A [文章编号] 1674-4721(2016)12(c)-0125-04
Determinination of konjac glucomannan in konjac refined powder by HPLC
CHEN Yan-jie CHU Yin-ling HAN Chao-yi ZHANG Jie
ENNOVA Health Science and Technology Co.,Ltd. of ENN Group,Langfang 065001,China
[Abstract]Objective To establish an HPLC method for content determination of konjac glucomannan (KGM) in konjac refined powder,and compare with results of colorimetric assay.Methods KGM was hydrolyzed with H2SO4 (2.5 mol/L) at 110℃ for 2 hours,which reacted with 1-phenyl-3-methyl-5-pyrazolone (PMP) before HPLC separation and formed two monosaccharides,D-mannose and D-glucose.HPLC was performed on the column of TOSOH TSK-GEL ODS with gradient elution of mobile phase A (acetonitrile) and mobile phase B (0.45 g potassium dihydrogen phosphate,0.5 ml TEA,100 ml acetonitrile,900 ml water,pH=7.5).The flow rate was 1.0 ml/min,detection wavelength was 250 nm,and column temperature was 30℃.Colorimetric method was tested with reference to GB/T18104-2000.Results Linearity of D-mannose was good in range of 21.2-159.3 μg (r=0.9998);while D-glucose in range of 21.5-154.2 μg (r=0.9999).The average recovery of KGM was 98.9% (RSD 2.2%).The contents were less 5%-7% than that by colorimetry.Conclusion HPLC method is more accurate than colorimetry to determine content of KGM in konjac refined powder,and would be better for quality control and grading of konjac refined powder.
[Key words]Konjac;Glucomannan;Colorimetry;HPLC;Content determination
魔芋精粉是从多年生草本植物魔芋(Amorphophallus rerieri)块根中经干燥、粉碎、风选等步骤后获得。从营养学角度看,魔芋精粉是一种低热、低脂、低糖和高膳食纤维的食品。随着研究的深入,人们对膳食纤维的认识逐渐从“无营养物质”到今天具有重要的生理作用[1-2],并被营养学界认定为第7类营养素。研究表明富含膳食纤维的魔芋精粉具有降血脂、降血糖、通便和保护肝脏等作用[3-6]。
魔芋葡甘聚糖(konjac glucomannan,KGM)是魔芋精粉主要功效成分,也是评价魔芋精粉和相关产品质量的关键指标[7-8],其中GB/T 18104-2000中就是依据KGM的含量对魔芋精粉进行分级。KGM属于可溶性半纤维素,结构包含由D-葡萄糖和D-甘露糖通过β-1,4糖苷键聚合而成的主链,以及在主链甘露糖上由β-1,3糖苷键聚合的支链[9]。KGM具有亲水性、增稠性、稳定性好和口感平滑细腻等多种特征,同时又具有多种保健功能,广泛应用于普通食品、保健食品甚至药品中[10-12]。KGM含量测定方法包括比色法[7]、气相色谱法[8]和高效液相色谱(HPLC)法[13-15]等。HPLC法中有采用糖分析柱或者氨基柱结合示差检测器测定含量,不需要衍生的步骤,但是对色谱柱和检测器要求较高;也有采用PMP衍生化后用C18色谱柱结合紫外检测器测定含量。本实验通过优化PMP衍生条件建立反相高效液相色谱测定魔芋精粉中KGM的含量;同时参照GB/T18104-2000用比色法测定魔芋精粉中KGM含量,分析比较两种测定方法的优缺点。
1 仪器与材料
1.1仪器和设备
Agilent 1100高效液相色谱仪配备二级管阵列(DAD)检测器,美国安捷伦公司;UV-2102紫外可见分光光度计,尤尼柯(上海)仪器有限公司;十万分之一分析天平,瑞士Mettler-Toledo公司;L420离心机,长沙湘仪离心机仪器有限公司。
1.2药品与试剂
魔芋精粉从陕西秦东魔芋食品有限公司(样本1)、宣城市百草植物工贸有限公司(样本2)、陕西龙飞魔芋食品有限公司(样本3)和武汉市清江魔芋制品有限公司(样本4~9)。D-甘露糖和D-葡萄糖均购自于中国食品药品检定研究院(批号分别为140651-201403;110833-201205);L-鼠李糖,北京化学试剂公司;乙腈为色谱纯,水为超纯水。除非另有说明,在分析中所用试剂均为分析纯试剂。
2方法与结果
2.1色谱条件
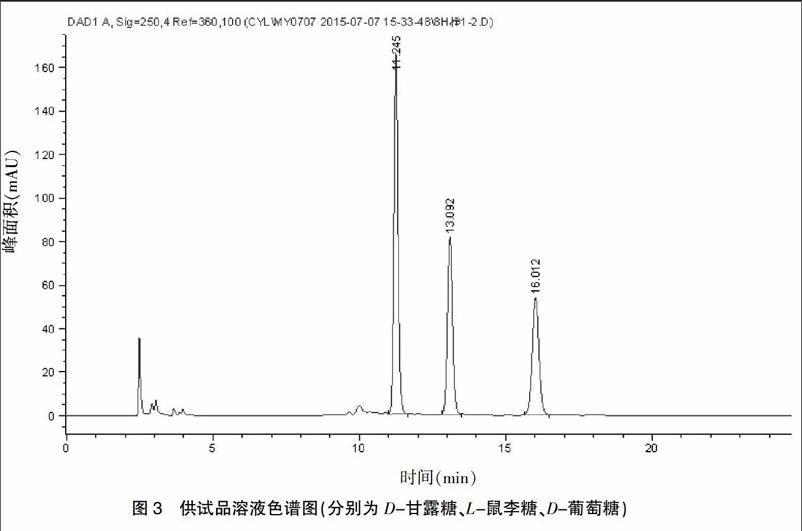
色谱柱:TOSOH TSK-GEL ODS色谱柱(4.6 mm×250 mm,5 μm),流动相A(乙腈)∶流动相B(0.45 g磷酸二氢钾、0.5 ml TEA、100 ml乙腈、900 ml纯水混合,pH=7.5)进行梯度洗脱,梯度洗脱程序为0.0~4.0 min 94% B,4.0~5.0 min 94%~88% B,5.0~30.0 min 88% B,流速1.0 ml/min,柱温30℃,检测波长250 nm;进样量5 μl,按上述色谱条件,测定结果见图1~3。
2.2溶液的制备
2.2.1 对照品溶液的制备 分别精密称取D-甘露糖和D-葡萄糖对照品适量,置于2 ml量瓶中,用高纯水溶解,制成浓度分别为0.56 mg/ml和0.60 mg/ml混合对照品溶液。精密吸取混合对照品溶液20、50、100、120、150 μl于5支5 ml具塞玻璃试管中,加入内标50 μl L-鼠李糖(1.08 mg/ml)储备液,按照“2.2.2”项下供试品溶液的制备④进行衍生化,即得。
2.2.2供试品溶液的制备 ①魔芋精粉中游离还原糖的分离:精密称取魔芋精粉0.12~0.15 g至150 ml烧杯中。加入85%乙醇50 ml,在50 ℃恒温水浴中保温30 min并不断搅拌,取出、静置、吸出上清液。再用85%乙醇提取两次,分离出溶于乙醇中的游离还原糖,小心收集全部去除了游离还原糖的魔芋精粉,蒸去乙醇,备用。②魔芋葡甘聚糖提取液的制备:将已处理的魔芋精粉,加高纯水60 ml,室温下搅拌1~2 h溶胀过夜。然后用高速匀浆机匀浆40 s,注入100 ml容量瓶中,用高纯水多次洗尽匀浆机转头和烧杯,洗液移入100 ml容量瓶中,用高纯水定容。以4000 r/min转速离心20 min,取上清液即得。③水解:吸取上述溶液100 μl,加入70 μl (2.5 mol/L H2SO4),110℃烘箱中水解2 h,取出冷却后,用70 μl(5 mol/L NaOH),涡旋混匀中和,加入内标50 μl L-鼠李糖(1.08 mg/ml),室温减压干燥。④衍生化:上述水解液再加200 μl PMP甲醇溶液(0.5 mol/L)与100 μl NaOH溶液(0.3 mol/L),渦旋混匀;在70℃恒温水浴中反应60 min,取出放置10 min冷却至室温;加入100 μl HCl (0.3 mol/L)中和,加入纯水1 ml;再加氯仿2 ml,重复萃取三次,水相经0.45 μm微孔滤膜过滤,即得供试液。
2.3 检测限和定量限
以信噪比为3∶1时的色谱峰为检出限,以信噪比为10∶1的色谱峰为定量限。结果D-甘露糖的检测限和定量限分别为1.032、1.543 nmol;D-葡萄糖的检测限和定量限分别为2.537、3.319 nmol。
2.4 线性关系考察
分别精密吸取“2.2.1”项下所得不同浓度对照品溶液,按照“2.1”项下的色谱条件分析,以对照品的峰面积与内标峰面积之比为纵坐标(y),以对照品的量(nmol)为横坐标(x),进行线性回归,得D-甘露糖的回归方程为y=1.1470x+0.0088(0.9998),D-葡萄糖的回归方程为y=0.9726x+0.0036(0.9999)。结果表明,D-甘露糖和D-葡萄糖的检测线性范围分别为1.179~8.842 nmol、1.141~8.559 nmol。
2.5 精密度试验
取同一份魔芋精粉按“2.2.2”项下的步骤操作,所得供试液按照“2.1”项下的色谱条件连续进样6次,记录峰面积,计算出含量。结果,D-甘露糖和D-葡萄糖含量的RSD分别为0.77%、0.18%,表明仪器精密度良好。
2.6稳定性试验
取同一份魔芋精粉按“2.2.2”项下的步骤操作,所得供试液分别于放置0、2、4、6、8、12、24 h按照“2.1”项下的色谱条件进样测试,根据测得D-甘露糖、D-葡萄糖质量,计算KGM含量,其平均值为79.41%,RSD为0.22%,表明供试品液在24 h内稳定性良好。
2.7重复性试验
取同一份魔芋精粉按“2.2.2”项下的步骤操作,平行制备6份供试品溶液,按照“2.1”项下色谱条件进样,根据测得D-甘露糖、D-葡萄糖质量,计算KGM含量RSD为1.48%,表明本方法重复性良好。
2.8加样回收率试验
供试品溶液制备中①和②步完全按照GB/T18104-2000操作,因此,本实验中笔者只考察酸水解和衍生过程中的加样回收率。精密吸取供试品溶液制备中②步获得的KGM提取液50 μl共6份,分别加入50 μl已知浓度的KGM对照品溶液。按照“2.2.2”项下供试品溶液制备的③和④步骤操作,所得供试液按照“2.1”项下中色谱条件进样,计算KGM加样回收率,测得的结果见表1。
2.9样品含量测定
根据建立的方法用HPLC-UV的方法对购买于不同厂家9份魔芋精粉中KGM含量进行测定。同时,严格按照GB/T18104-2000的要求应用比色法测定魔芋精粉中KGM含量。两种方法的测定结果见表2。
3讨论
供试品制备过程中,发现衍生过程中加入PMP[16-17]和NaOH的量很关键,通过摸索确定本实验中的量为最佳。酸水解时间和温度参照文献方法都能水解完全[7,18-19]。
与比色法相比,HPLC方法的供试品制备过程稍复杂,时间稍长。但是从实验结果上看,HPLC法测定值均比比色法小5%~7%。KGM分子中只含有葡萄糖和甘露糖, HPLC法是针对水解产物中葡萄糖和甘露糖进行含量测定;而比色法则针对水解产物中所有还原糖进行测定。由此推测本实验确定的HPLC法测定魔芋原料中葡甘聚糖的含量与GB/T18104-2000采用比色法测定的含量相比可能更加准确,能够更有效地控制魔芋精粉的质量和进行魔芋精粉的分级。
[参考文献]
陈会永,黄河.膳食纤维的抗炎作用[J].肿瘤代谢与营养,2015,2(4):63-68.
[2]黄素雅,钱炳俊,邓云.膳食纤维功能的研究进展[J].食品工业,2016,37(1):273-277.
[3]谢建华,林常青,庞杰.魔芋精粉的应用及研究进展[J].河南科技大学学报(农学版),2004,24(3):60-63.
[4]黄合飞,徐永清,李福兵.魔芋葡甘聚糖在医学中的研究进展[J].西南国防医药,2015,25(2):212-215.
[5]杜茂波,鞏桥.魔芋精粉对CCl4所致小鼠急性肝损伤的保护作用[J].中国民族民间医药,2014,23(11):23.
[6]袁萍,吴平.魔芋膳食纤维生物活性研究进展[J].农产品加工,2015,19(10):65-67.
[7]魔芋精粉.中华人民共和国标准[S].GB/T18104-2000.
[8]魔芋凝胶食品.湖南省地方标准[S].DB-43/354-2007.
[9]李斌,谢笔钧.魔芋葡甘聚糖分子链形态研究[J].中国农业科学,2004,37(2):280-284.
[10]史丽英.魔芋葡甘聚糖的研究利用[J].河南科技,2013,14(7):53-57.
[11]冯莉,刘瑞雪,张波.魔芋低聚糖作为新食品原料的应用研究[J].中国食品添加剂,2014,(7):153-157.
[12]魏恩慧,吴继红,刘冰,等.魔芋葡甘聚糖的性质及在食品中的应用[J].食品工业,2016,(5):239-242.
[13]李斌,廖勇城,谢笔钧.高效液相色谱法测定魔芋精粉中魔芋葡甘聚糖含量[J].食品工业科技,2002,23(8):82-84.
[14]谢小波,李桂贞.高效液相色谱法测定魔芋葡甘露聚糖[J].华东理工大学学报(自然科学版),2002,28(4):406-409.
[15]袁忠海,吴道澄,赵燕,等.高效液相色谱法测定魔芋精粉中葡甘聚糖的含量及其单糖组成[J].中国中药杂志,2003,28(7):621-623.
[16]张璐瑶,赵峡,陈欢欢.糖类化合物PMP衍生分析进展[J].分析检测学报,2016,35(3):367-372.
[17]朱照武,庄洋,向春林,等.单糖柱前PMP衍生HPLC测定方法探讨[J].湖北民族学院学报(自然科学版),2015, 33(3):337-341.
[18]田灵敏,邱雪梅,潘子敬,等.新型糖组成高效液相色谱分析技术的构造及其水飞蓟多糖质控中的应用[J].药学学报,2010,45(4):498-504.
[19]Li WY,Li P,Li XQ,et al.Simultaneous quatification of uronic acid,amino sugar,and neutral sugar in the acidic polysaccharides extracterd from the roots of Angelica sinensis (Oliv.) Diels by HPLC[J].Food Anal Meth,2015, 8(8):2087-2093.

