基于芒果果肉颜色的品质检测技术
李敏 高兆银 苏增建 朱迎迎 弓德强 张正科 郑淑英 胡美姣

摘 要 以芒果品种‘贵妃为试材,利用光谱仪测定L、a、b值,同时测定果实的硬度及糖酸度,采用偏最小二乘法(PLS)建立基于颜色值的可溶性固形物(SSC)、硬度及可滴定酸(TA)的品质预测模型。预测模型的建模相关系数R可溶性固形物含量、硬度及可滴定酸含量分别为0.962 2、0.946 4和0.959 2;均方误差分别为0.658 1%、0.992 7 kg/cm2及0.827 5 g/L。预测集拟合方程的相关系数分别为0.965 6、0.949 0和0.925 7;均方误差分别为0.626 7%、1.159 0 kg/cm2和0.999 2 g/L。结果表明:芒果预测模型的预测准确度,可溶性固形物高于硬度和可滴定酸,基于‘贵妃芒果采后品质的果肉颜色值快速检测可行。
关键词 ‘贵妃芒果;Lab颜色值;采后品质;快速检测
中图分类号S667.7 文獻标识码 A
Quality Evaluation of Mango by Fresh
Colorimetric Measurements
LI Min1, GAO Zhaoyin1, SU Zengjian2, ZHU Yingying2, GONG Deqiang1,
ZHANG Zhengke3, ZHENG Shuying1, HU Meijiao1 *
1 Environment and Plant Protection Research Institute, CATAS, Haikou, Hainan 571101, China
2 College of Environment and Plant Protection, Hainan Univerity, Haikou, Hainan 570228, China
3 College of Food Science and Technology, Hainan University, Haikou, Hainan 570228, China
Abstract The establishment of mango quality prediction model was tested based on soluble solids content(SSC), firmness and titratable acid(TA)of Guifei mango, color value by color spectrometer, combined with the partial least squares(PLS)method. The model set correlation coefficient R about SSC, firmness and TA prediction model structured by PLS was 0.962 2, 0.946 4 and 0.959 2 respectively; Root mean square error of the model set was 0.658 1%, 0.992 7 kg/cm2 and 0.827 5 g/L, respectively. The prediction set correlation coefficient R about SSC, firmness and the TA prediction model was 0.965 6, 0.949 0 and 0.925 7, respectively;The root mean square error of the prediction set was 0.626 7%, 1.159 0 kg/cm2 and 0.999 2 g/L, respectively. The SSC prediction model of Guifei mango prediction accuracy was slightly better than the firmness and titratable acid model. The rapid detection on mango postharvest quality such as SSC, firmness and TA by fresh color value was feasible, and it would provide a scientific basis for fast judging the quality of mango.
Key words ‘Guifeimango; lab color value; postharvest quality; rapid detection
doi 10.3969/j.issn.1000-2561.2017.01.029
果实颜色是农产品重要的品质特征之一,颜色、长势及营养状况之间存在密切相关性[1-2]。Lab颜色模型是以数值化方式描述人类视觉感应的一种颜色系统。其优势在于不仅表现了色域的宽阔,同时表现了色彩的均匀性[3]。目前,利用颜色信息进行农产品质量检测、病虫害识别等相关研究越来越多。
芒果(Mangifera Indica Linn.)是重要的热带水果,素有热带果王之美誉。其果实颜色由叶绿素和类胡萝卜素等含量决定。果皮颜色多样,成熟时呈现绿、红、黄等多种色泽[4]。Namb[5]利用果皮Lab颜色值将2个印度芒果品种‘Alphonso和‘Banganapalli的成熟度进程定性划分为5个阶段。Fukuda[6]开展基于芒果果皮颜色的品质无损伤检测研究结果发现,套袋果实果皮颜色变化均匀,可以利用建立的预测模型较为精确地估测果实可溶性固形物(SSC)、硬度和维生素C(Vc)含量,而果皮颜色变化剧烈的品种预测模型精确性降低。说明芒果果皮颜色的不均匀性在一定程度上限制了利用果皮颜色进行品质的无损伤检测。
果实的损伤性品质检测耗时耗力,但结果准确。虽然近年来无损伤检测技术发展迅速,而目前仍不能成熟应用,不能取代损伤性品质检测技术。芒果果肉颜色相对较一致,不同品种随着发育及成熟,果肉的叶绿素含量降低,总类胡萝卜素含量均匀增加至完熟时达最高,果肉均由白、绿色变为橙、黄色[7-8]。鉴于果肉颜色均匀性的特点和颜色测定简单方便的特性,利用果肉颜色值预测其它品质参数的快速检测技术研究具有可能和必要性。果肉颜色变化与可溶性固形物等指标之间的关系究竟如何,基于芒果果肉颜色值的重要品质参数的快速检测技术是否能够实现,迄今未有详细的研究报道。本文拟以海南主栽芒果品种‘贵妃为对象,在贮藏期间开展芒果果肉Lab颜色参数与果实硬度、可溶性固形物、可滴定酸等重要品质参数间的关系研究,建立基于果肉颜色参数的品质参数检测技术。以期为芒果颜色与品质关系研究提供理论依据,为芒果品质的快速检测和监测技术研发提供技术支撑。
1 材料与方法
1.1 材料
‘贵妃芒果采自三亚果园。采后6 h内运回实验室,挑选成熟度8~9成,大小一致,无机械伤及病虫害的果实约180个,置于(25±1)℃贮藏。
1.2 方法
1.2.1 处理 在第0、2、4、6、8、10天取样,每次随机选取果实30个,共180个果实。每个果实测定颜色参数、硬度、可溶性固形物及可滴定酸。
1.2.2 项目测定 (1)品质参数测定[9]。每个果实切去约1 mm厚果皮,赤道处2个对称点取样测定以下参数:硬度采用GY-3硬度计测定;可溶性固形物使用MASTER-M手持折光仪测定;可滴定酸采用滴定法测定。
(2)果肉颜色测定。上述果实切去约1 cm果肉组织,采用颜色光谱仪(NOLTA/QE 65000),对赤道处2个对称点果肉分别进行颜色值测定,记录L(明度值),a(红绿色度值,正值代表红色度,负值代表绿色度),b(黄蓝色度值,正值代表黄色度,负值代表蓝色度)。
1.2.3 品质检测模型建立方法及评价 剔除异常果后,150个果被分为建模集和预测集,其中120个作为建模样品集,以颜色值a,b为自变量,芒果可溶性固形物(SSC)、硬度、可滴定酸(TA)为因变量,采用偏最小二乘法(PLS)建立芒果SSC、硬度和TA预测模型,并利用剩余30个样本作为预测样品集,用于评价模型的预测能力和稳定性。
模型采用外部验证法对其性能进行评价,即由相关系数(R)、建模均方均根误差(RMSEM)和预测均方根误差(RMSEP)进行评价。R越大,RMSEC和RMSEP越小,模型的预测能力越强。
1.3 数据处理
采用软件Excel 2003、SPSS 19.0及Minilab 17.0进行数据处理和模型构建。
2 结果与分析
2.1 芒果后熟过程中的生理生化变化
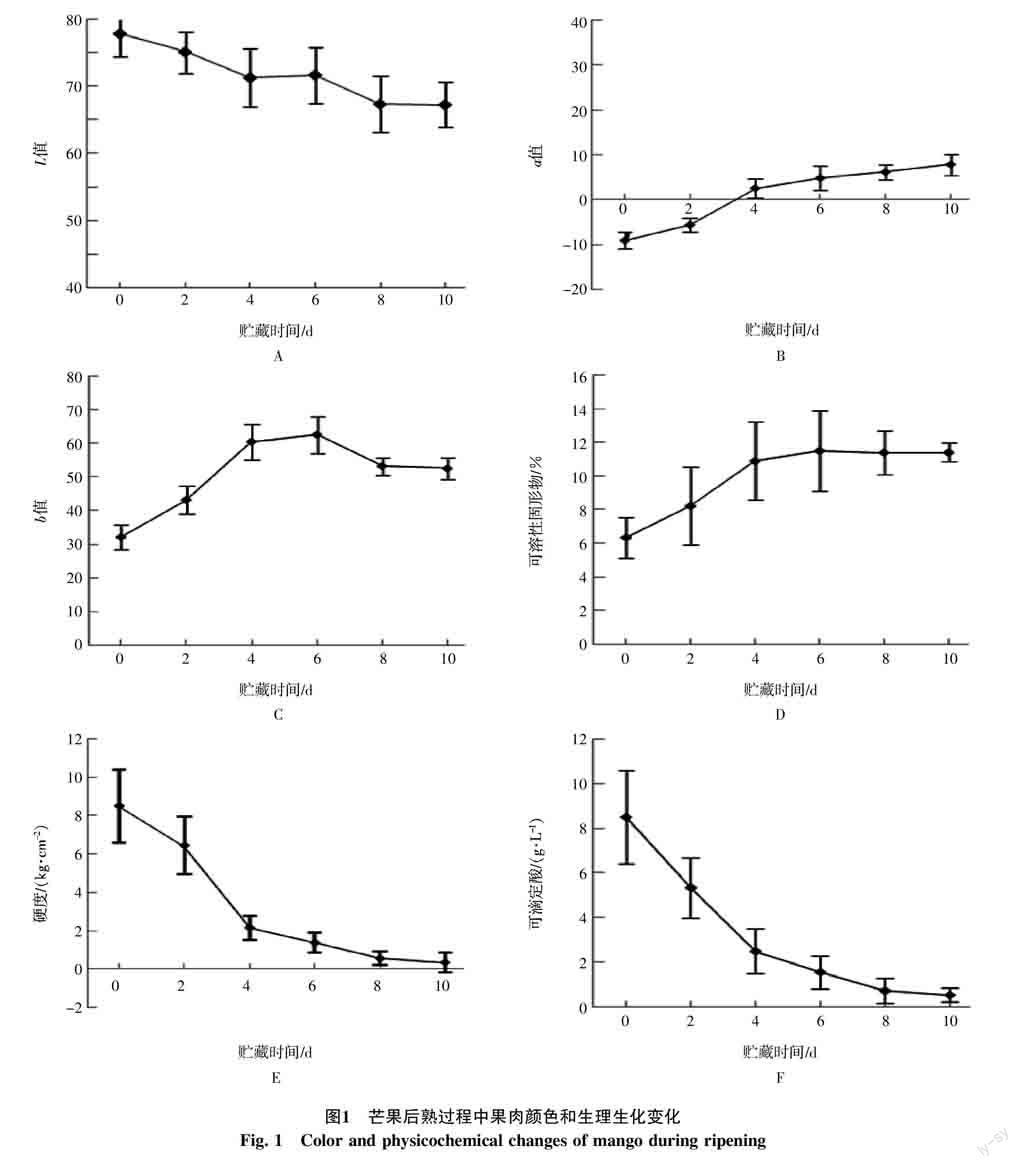
‘贵妃芒果果肉颜色在后熟过程中持续改变(图1-A~C)。L值均为正值,且随着后熟进程表现出下降趋势,由贮藏0 d的77.8逐渐降至贮藏10 d的67.3,表明果肉初时颜色较明亮,后亮度逐渐转暗。a值初始值为-9.1,在后熟过程中逐漸升高,由负值变为贮藏10 d的7.8,表明果肉颜色由浅绿色逐渐过渡为浅红色。b值在贮藏期间逐渐增加,贮藏后期缓慢下降,峰值出现在第6天,为62.7。表明果肉表现为黄色,且在后熟过程中,该色度维持黄色水平。
‘贵妃芒果果实硬度和可滴定酸在后熟过程可溶性固形物含量不断升高,贮藏后期增加趋势减缓(图1-D)中不断降低(图1-E~F)。
2.2 果肉颜色与品质指标的相关性分析
皮尔逊相关性分析结果表明(表1),a值与3组品质指标的相关性最强,与SSC表现为正相关,相关系数为0.963,与硬度和TA表现为负相关,相关系数分别为-0.947和-0.934。b值表现出与a值相似的趋势,与SSC也为正相关,与硬度和TA表现为负相关,相关系数分别为0.872,-0.836和-0.759。L值与前二者相反,与SSC表现为负相关,与硬度和TA表现为正相关,相关系数分别为-0.736,0.733和0.725。说明果肉的颜色变化与SSC、硬度和TA的变化有很高的相关性。其中,果肉褪绿(a值变化)和转黄(b值变化)与品质改善高度相关。
2.3 基于果肉颜色的品质指标预测
2.3.1 基于果肉颜色的溶性固形物含量预测分析
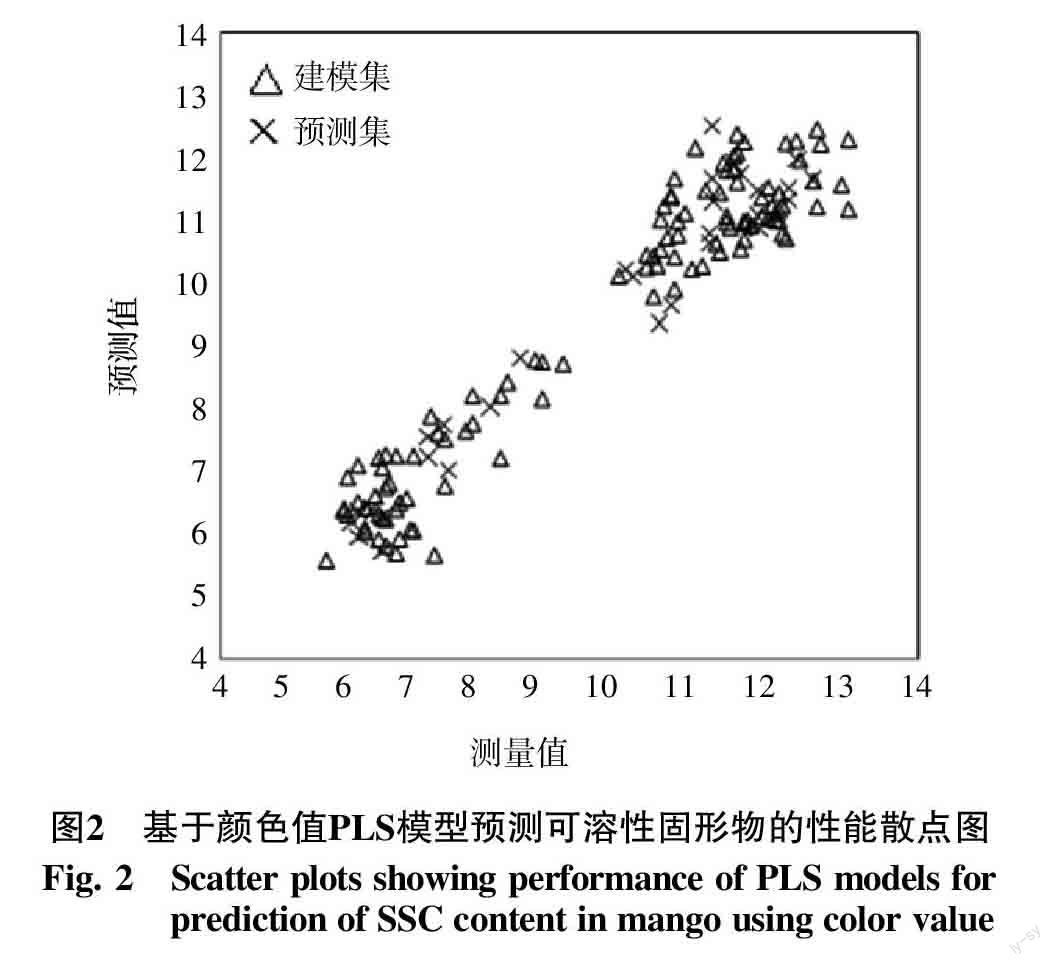
皮尔逊相关性分析结果表明(表1),颜色值a和b与可溶性固形物含量的相关系数高,与颜色值L相关系数较低。以120个果实果肉测得的a值和b值为自变量,采用PLS方法,构建可溶性固形物的预测方程(表2),即y(可溶性固形物/%)=8.94+0.31 a+0.01 b。并用另外的30个果实对预测准确性进行验证(图2),结果表明,建模集的拟合方程相关系数高达0.962 2,均方根误差0.658 1%,而预测集拟合方程的相关系数达到0.965 6,预测均方根误差为0.626 7%,说明拟合方程的精确度较高,预测模型可以用于可溶性固形物含量的预测分析。
2.3.2 基于果肉颜色的硬度预测分析 同样采用2.3.1的方法构建基于颜色a值和b值的果实硬度预测模型,并对预测模型的精确性进行验证。结果表明,预测方程为y(硬度kg/cm2)=2.87-0.44 a+0.01 b。建模集的拟合方程相关系数0.964 6,均方根误差0.992 7 kg/cm2,而预测集拟合方程的相关系数达到0.949 0,预测均方根误差为1.159 0 kg/cm2(图3,表2)。拟合方程的相关系数大于90%,均方根误差较小,说明预测方程的精确度较高。
2.3.3 基于果肉颜色的可滴定酸含量预测分析
同2.3.1方法构建的基于颜色a值和b值的可滴定酸含量预测方程为:y(可滴定酸g/L)=-0.06-0.52 a+0.08 b。建模集的拟合方程相关系数为0.959 2,均方根误差0.827 5 g/L,而预测集拟合方程的相关系数达到0.925 7,预测均方根误差为0.999 2 g/L(图4,表2)。预测集拟合方程的相关系数大于90%,且均方根误差相对较小,说明预测方程的精确度较高。
3 讨论
本研究结果表明,果肉绿色减弱和黄色增强的颜色变化与可溶性固形物含量变化表现为正相关,与硬度和可滴定酸含量变化表现为负相关,果肉亮度减弱的变化与可溶性固形物含量变化则表现为负相关,与硬度和可滴定酸含量变化呈现正相关。Nambi等[5]研究了‘Alphonso和‘Banganalli2个品种近果核处果肉颜色与品质参数之间的相关性,也得出相似的结论。但通过比较发现,不同的品种,取样的部位不同,颜色值与品质参数相关系数高低存在较大差异。这说明果实颜色和品质参数相关性高低取决于品种和颜色测量部位。
可溶性固形物、硬度、可滴定酸及Vc等是水果食用品质的基本参数,本文利用PLS方法建立了基于颜色值的可溶性固形物、硬度、可滴定酸的预测模型,其中可溶性固形物预测模型的精确度最高。硬度、可滴定酸预测精确度次之,更为精确的建模方法有待进一步探讨。Fukuda等[6]利用随机森林算法建立了基于芒果果皮颜色的可溶性固形物、硬度和Vc含量预测模型,预测模型精度表现为颜色均匀变化的套袋品种‘Nam Dokmal优于果皮颜色变化剧烈的品种‘Irwin。β-胡萝卜素是芒果中一种重要的营养成分,也是决定芒果颜色深浅的重要原因[10]。有研究结果表明,芒果中β-胡萝卜素的含量与芒果Lab颜色值具有较高的相关性,并用PLS方法建立了基于果皮和果肉Lab颜色参数的β-胡萝卜素含量预测模型,发现果肉颜色预测模型优于果皮颜色预测模型[11]。上述研究结果均表明,基于颜色值进行芒果采后品质指标的预测能够实现。
参考文献
[1] Baiano A, Terracone C, Peri G, et al. Application of hyperspectral imaging for prediction of physico-chemical and sensory characteristics of table grapes[J]. Computers and Electronics in Agriculture, 2012, 87(9): 142-151.
[2] Abdullah M Z, Guan L C, Lim K C, et al. The applications of computer vision system and tomographic radar imaging for assessing physical properties of food[J]. Journal of Food Engineering, 2004, 61(1): 125-135.
[3] 刘浩学. 均匀颜色空间与色差公式的应用[J]. 北京印刷学院学报, 2003, 11(3): 3-8.
[4] Gouado I, Schweiger F J, Ejoh R A, et al. Systemic levels of carotenoids from mangoes and papaya consumed in three forms (juice, fresh and dry slice)[J]. European Journal of Clinical Nutrition, 2007, 61(10): 1 180-1 188.
[5] Nambi V E, Thangavel K, Jesudas D M. Scientific classification of ripening period and development of colour grade chart for Indian mangoes (Mangifera indica L.) using multivariate cluster analysis[J]. Scientia Horticulturae, 2015, 193(7): 90-98.
[6] Fukuda S, Yasunaga E, Nagle M, et al. Modelling the relationship between peel colour and the quality of fresh mango fruit using Random Forests[J]. Journal of Food Engineering, 2014, 131(2): 7-17.
[7] Vasquez-caicedo A L, Heller A, Neidhart S, et al. Chromoplast morphology and β-carotene accumulation during postharvest ripening of mango cv. Tommy Atkins[J]. Journal of Agricultural and Food Chemistry, 2006, 54(16): 5 769-5 776.
[8] Ullah R, Khan S, Bilal M, et al. Non-invasive assessment of mango ripening using fluorescence spectroscopy[J]. Optik-International Journal for Light and Electron Optics, 2016, 127(13): 5 186-5 189.
[9] 李 敏, 高兆銀, 朱迎迎, 等. 基于电子鼻的 ‘贵妃 芒果糖度酸度无损伤检测技术应用[J]. 热带作物学报, 2016, 37(8): 1 553-1 557.
[10] Ornelas-paz J D J, Yahia E M, Gardea-bejar A. Identification and quantification of xanthophyll esters, carotenes, and tocopherols in the fruit of seven Mexican mango cultivars by Liquid Chromatography-Atmospheric Pressure Chemical Ionization-Time-of-Flight Mass Spectrometry [LC-(APcI(+))-MS][J]. Journal of Agricultural and Food Chemistry, 2007. 55(16): 6 628-6 635.
[11] Rungpichayapichet P, Mahayothee B, Khuwijitjaru P, et al. Non-destructive determination of β-carotene content in mango by near-infrared spectroscopy compared with colorimetric measurements[J]. Journal of Food Composition and Analysis, 2015, 38: 32-41.

