内生菌与雷公藤细胞悬浮共培养的生理生化特性
宋欢 宋萍 封磊 洪伟 吴承祯 王一惠 申露文


摘 要 将2株雷公藤内生真菌Fusarium oxysporum NS33与Penicillium steckii NS6、2株内生细菌Enterobacter cloacae sub sp LG3与Serratia marcescens LY1及其组合分别与雷公藤细胞悬浮共培养,对不同培养体系内雷公藤细胞的生长及其生理生化特征进行研究。结果显示,在共培养前期,与对照相比,接种单一内生菌株提高了细胞的干重,其中菌株NS6的促生效果最明显;而在共培养后期,无论是单一内生菌还是混合内生菌均对细胞生长具有抑制作用。内生真菌和菌株组合处理的培养液pH值有明显的升高,而内生细菌LY1则明显降低了培养液的pH值,其具有产酸性。另外,当雷公藤细胞同混合菌株共培养时,培养基中总糖消耗量是最大的,而接种单独菌株时则对细胞可溶性蛋白含量具有一定的提高作用。接种内生菌会影响雷公藤细胞的POD、CAT及SOD活性,与对照相比,接种单独菌株会更加提升POD与CAT的活性,而细胞MDA含量则明显下降。
关键词 内生菌;悬浮细胞;雷公藤;生理生化
中图分类号 S567 文献标识码 A
Abstract In this study, two endophytic fungi, Fusarium oxysporum NS33 and Penicillium steckii NS6, and two endophytic bacteria, Enterobacter cloacae sub sp LG3 and Serratia marcescens LY1, isolated from Tripterygium wilfordii, and their combinations were co-cultured with T. wilfordii cells, respectively. The growth and physio-biochemical properties of T. wilfordii suspension cells were studied in the various co-culture systems. The results showed that in the early stage of co-culture all the single strain promoted the T. wilfordii cell growth and the NS6 strain exhibited the most significant effect, however, during the late period all the endophytic strains and their combinations acted a negative role on the plant cell growth. When T. wilfordii cells were co-cultured with the two endophytic fungi and the strain combinations, the pH values of supernatants increased obviously, but for the T. wilfordii cells and LY1 strain co-culture system, the pH values decreased. In addition, the sugar consumption of supernatants was the highest when T. wilfordii cells were co-cultured with the mixed strains, and the soluble protein content was enhanced as the strains were inoculated singly. The activities of POD, CAT and SOD of T. wilfordii cells were influenced by the endophytes. Compared with the control, the single strain inoculation made T. wilfordii cells exhibited the higher activities of POD and CAT and the lower MDA content.
Key words Endophyte; suspension cell; Tripterygium wilfordii; physiology and biochemistry
doi 10.3969/j.issn.1000-2561.2017.02.017
雷公藤(Tripterygium wilfordii)屬卫矛科雷公藤属,是一种珍贵的药用植物[1],体内含有多种具有抗菌、抗炎、抗肿瘤、抗艾滋病毒以及免疫抑制等功能的活性物质[2-3]。由于具有广泛的药理作用,雷公藤的市场需求量巨大,然而近年来野生雷公藤资源滥砍乱挖现象严重,加之人工栽培生长周期缓慢,致使该药用植物的蕴藏量逐年下降,远远无法满足国内外市场的需求。
由于植物次生代谢产物结构的复杂性,化学合成难度较大。细胞悬浮培养,被认为是一种解决药用植物资源短缺的有效途径。但在培养过程中,由于植物细胞自身生长速率慢、稳定性差,以及易受操作条件影响等原因,该类技术的广泛应用受到限制。因此,如何促进药用植物悬浮细胞的快速生长,一直是国内外相关领域的研究热点。近年来的研究发现,药用植物内生菌对宿主植物具有显著的促生长作用,从而引起了研究者的广泛关注。Li等[4]将红豆杉细胞与内生真菌Fusarium mairei进行共培养,发现该株内生真菌不但能促进宿主细胞的生长,还可以有效提升共培养系统内活性物质的生成;张宝俊等[5]将梨树内生细菌LP-5与梨树进行共生长研究,结果表明该菌株可明显促进梨树幼苗的生长;张瑞芬等[6]从盾叶薯蓣中分离的内生真菌可以提高盾叶薯蓣无菌苗和培养细胞的薯蓣皂苷的含量和产量;陈世苹等[7]在研究内生真菌感染对黑麦草叶片内相关酶活性的影响时发现,感染叶片内SOD和POD活性明显高于正常植株;Carvalho等[8]的研究表明,Rhizoctoniasolani诱导子与纯天仙子细胞悬浮共培养能引起细胞生长及营养物质含量的巨大变化。综上所述,国内外学者已分别就药用植物的内生细菌、内生真菌对宿主的促生作用进行了较为深入的研究。然而作为生长在植物体内的两类主要微生物,内生真菌与内生细菌必然存在着一定的联系,而这种联系又会对宿主植物的生长有何影响,目前与此相关的研究尚未见报道。
鉴于此,本研究将分离自雷公藤植株内部、具有益生作用的2株内生真菌、2株内生细菌以及两者的组合接种于雷公藤细胞悬浮培养体系中,分析雷公藤悬浮细胞对内生菌的生理生化响应,考察内生真菌与内生细菌之间、单一菌株与混合菌株之间对雷公藤细胞的影响是否具有明显的差异,从而为雷公藤细胞悬浮培养系统生物诱导子的应用奠定基础,并为植物生长调节菌剂的开发提供理论依据。
1 材料与方法
1.1 材料
雷公藤愈伤组织为实验室保藏,由叶片诱导而来,种源地为福建泰宁。经连续继代培养3代以上后,挑选质地疏松,生长快,容易分散的淡黄色愈伤组织作为悬浮培养的材料。
供试菌株分别为2株内生真菌Fusarium oxysporum NS33,Penicillium steckii NS6和2株内生细菌Enterobacter cloacae subsp LG3,Serratia marcescens LY1,均分离自健康雷公藤植株,由实验室保藏。内生真菌和内生细菌进行两两组合共形成4组菌株组合,即NS33-LG3、NS33-LY1、NS6-LG3、NS6-LY1。
1.2 方法
1.2.1 菌株的活化培养 内生真菌在PDA固体培养基上活化5 d后,转接到新的PDA固体培养基上继续培养7 d待用;内生细菌则在LB固体培养基上活化2 d后,转接于LB液体培养基上继续培养至指数阶段,4 ℃,8 000 ×g离心10 min获取菌体。
1.2.2 雷公藤细胞悬浮培养 将0.4 g生长状况良好的连续继代培养3代以上的雷公藤愈伤组织转接到装有40 mL预先灭菌的培养液的三角瓶中,培养基成分为MS+0.5 mL 2,4-D+0.5 mL IBA+0.1 mL KT[9],将三角瓶置于120 r/min、25 ℃的摇床上悬浮暗培养,7 d后在超净台下分别进行菌株添加处理,其中4个处理为内生真菌或内生细菌菌株的单独接种,4个处理为内生真菌和内生细菌的混合接种。真菌采用打孔器挑起d=5 mm的菌块直接投入每瓶培养基中。将细菌用无菌水清洗3次,稀释成OD值为0.5的菌悬液,然后将1 mL菌悬液加入到雷公藤愈伤培养液中。以添加无菌水的处理作为空白对照(CK),分别于第1、2、4、6天取样。
1.2.3 细胞干重的测定 将新鲜细胞在60 ℃恒温烘箱中,烘干至恒重,用天平称其质量。
1.2.4 培养液pH值的测定 采用PHS-2型精密酸度计测定培养液pH值。
1.2.5 总糖含量的测定 采用蒽酮比色法测定培养液中的总糖含量。
1.2.6 生理生化指标的测定 将雷公藤愈伤组织用无菌水冲洗数次后,加入0.1 mol/L、pH7.8的磷酸盐缓冲液5 mL,在预冷的研钵中进行冰浴匀浆,在4 ℃下、12 000 ×g离心10 min,取上清液進行生理生化指标的测定。超氧化物歧化酶(SOD)采用核黄素-氯化硝基氮蓝四唑(NBT)光化还原法测定;过氧化物酶(POD)采用愈创木酚比色法测定;丙二醛(MDA)含量采用硫代巴比妥酸(TBA)加热显色法测定;过氧化氢酶(CAT)采用紫外吸收法法测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法测定。详细方法见参照文献[10-11]。
1.3 数据分析
采用Microsoft Excel 2007软件对数据进行处理和绘图,采用SPSS18.0统计分析软件进行差异显著性分析。
2 结果与分析
2.1 对细胞生长的影响
不同的内生菌加入雷公藤细胞悬浮培养体系后,对细胞的生长都产生了一定的影响。由图1可见,在共培养前期,接种菌株NS33、NS6、LG3能够促进细胞的生长,细胞干重高于对照,尤其是菌株NS6,具有明显的促生效果,在第4天时细胞干重约是对照的2倍。随着共培养时间的延长,无论接种单一菌株还是混合菌株,对细胞生长均产生抑制作用。
2.2 对培养液pH值的影响
向雷公藤悬浮细胞培养体系中加入内生真菌、内生细菌及两者的组合后,其pH值的变化情况如图2所示。与对照相比,随着共培养时间的增加,添加内生真菌单一菌株NS33和NS6提高了培养液的pH值,在共培养第4天时明显高于对照,第6天时最大。添加内生细菌菌株LG3和LY1处理的培养液pH值则相对比较稳定,但与对照相比,LG3处理的培养液pH值在共培养1 d时有明显提高,其后则与对照相近,至6 d时又低于对照;而菌株LY1处理2 d后的培养液pH值均明显低于对照。内生真菌和内生细菌的组合添加处理亦明显提高了培养液的pH值,其变化趋势与单一内生真菌的处理相似,处理4 d和6 d时pH值明显高于对照。
2.3 对培养液总糖消耗的影响
向雷公藤悬浮细胞培养体系中加入内生真菌、内生细菌及两者的组合后,培养液中总糖含量的变化如图3所示。可见,随着共培养时间的增加,对照组的总糖消耗最少,下降最缓慢;内生真菌单菌株的处理相对于内生细菌单菌株的处理,总糖消耗量更多,总糖含量下降更快;4组内生真菌与内生细菌组合处理的总糖含量变化趋势比较一致,总糖含量的下降速度是所有处理中最快的。
2.4 对细胞可溶性蛋白含量的影响
向雷公藤细胞悬浮培养体系中加入内生真菌、内生细菌及两者的组合后,细胞可溶性蛋白含量的变化情况如图4所示。随着共培养时间的增加,接种单一菌株的细胞可溶性蛋白含量呈现逐渐增加的趋势,其中接种内生真菌菌株NS6的细胞可溶性蛋白含量的增加速度最快,至第4天时明显高于其他处理,在第6天时最大。而对照和接种了混合菌株(除了NS33-LG3)的细胞的可溶性蛋白含量在共培养6 d时均出现下降,此时,接种单一菌株NS6、LG3、LY1及混合菌株NS33-LG3处理的细胞可溶性蛋白含量明显高于对照。
2.5 对细胞POD活性的影响
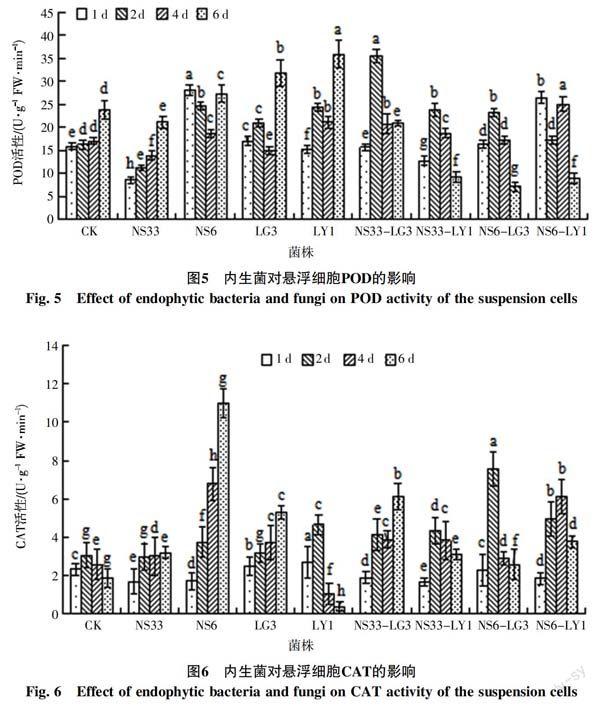
POD是植物细胞内重要的活性氧清除剂,是植物细胞壁形成和木质素合成的关键酶,在植物体内活性与植物的抗性有关。由图5可见,随着共培养时间的增加,对照组的悬浮细胞POD活性在共培养初期变化不大,共培养6 d时则有明显的增加,出现峰值;接种菌株NS33的悬浮细胞POD活性随着共培养时间的延长呈现不断增加的趋势;接种菌株NS6的悬浮细胞POD活性则在第1天即达到一峰值,之后呈下降趋势,至第6天时再次上升出现第2个峰值;接种内生细菌菌株LG3、LY1的悬浮细胞POD活性则表现为先升后降再升的变化,至第6天时升高至一峰值。由此可见,对照和单一菌株处理的悬浮细胞POD活性均在培养后期,即第6天出现峰值,此时单菌处理(除NS33处理外)的细胞POD活性高于对照。不同于对照和接种单一菌株的处理,接种混合菌株NS33-LG3、NS33-LY1和NS6-LG3的悬浮细胞POD活性随着共培养时间的增加呈现先升后降的变化,均在第2天达到极大值,且明显高于对照。而接种混合菌株NS6-LY1的悬浮细胞POD活性则在第1天和第4天具有较大值。
2.6 对细胞CAT活性的影响
由图6可见,随着共培养时间的增加,对照组悬浮细胞的CAT活性呈小幅度的先升后降,但总体变化不大。与菌株LY1、NS33-LY1、NS6-LG3共培养的悬浮细胞CAT活性亦呈先升后降的变化,第2天时出现峰值,此时CAT活性均高于对照。与菌株NS33、NS6、LG3和NS33-LG3共培养的悬浮细胞CAT活性则呈上升趋势,共培养6 d时CAT活性最大,明显高于对照,其中与菌株NS6共培养的细胞CAT活性变化率最大,第4天和第6天时的活性明显高于对照和其他处理。与混合菌株NS6-LY1的悬浮细胞CAT活性则随着共培养时间的延长而先较快速增加而后下降,在第2天时明显高于对照,第4天时活性最大。
2.7 对细胞SOD活性的影响
SOD是植物体内最重要的保护酶之一,该酶与植物的衰老及抗逆性密切相关,其与POD、CAT酶进行协同作用,能及时清除自由基和活性氧,提高植物组织的抗氧化能力。从图7可以看出,对照组的悬浮细胞SOD活性随着共培养时间的增加呈现下降趋势,第1天时SOD活性最大。随着共培养时间的增加,与单一菌株NS6、LG3、LY1和混合菌株NS33-LG3共培养的悬浮细胞SOD活性均呈下降趋势,SOD活性在第1天时最大,但与对照相比,没有明显的增加或降低,至第6天时则均低于对照。与菌株NS33和NS33-LY1、NS6-LG3、NS6-LY1共培养的悬浮细胞则在第4天或第6天时SOD活性更高,并高于对照。
2.8 对细胞MDA含量的影响
植物在逆境或衰老状态下,会发生膜脂过氧化作用,MDA是膜脂过氧化的产物之一,其可以间接反映出在逆境状态下植物细胞的受损程度。从图8可以看出,与内生菌共培养初期,悬浮细胞的MDA的含量有所增加,在第1天时都高于对照组,其中,与菌株NS33共培养的细胞MDA含量最大,其次是与混合菌株NS33-LG3共培养的细胞MDA含量。随着共培养时间的增加,对照的细胞MDA含量先上升后保持相对的稳定,而与菌株NS33、NS6、LY1共培养的悬浮细胞MDA含量則具有明显的下降,与混合菌株NS33-LY1、NS6-LG3、NS6-LY1共培养的细胞MDA含量则有小幅上升或保持稳定。但共培养至第6天时,大部分共培养的悬浮细胞MDA含量有较大的降低,明显低于对照。
3 讨论
植物内生菌与宿主长期协同进化中,彼此形成了一种互利共生的关系,其促进植物生长发育的功能已得到广泛证实[12]。本研究中,将雷公藤内生真菌、内生细菌及两者的组合接种到细胞悬浮培养体系中,在共培养初期,单一内生菌株促进了细胞生长,其中菌株NS6的促生作用最明显。研究显示,雷公藤内生菌具有一定的固氮、溶磷、分泌IAA、产铁载体等能力[13],菌株的这些植物促生特性可能是其促进悬浮细胞生长的机制之一。但随着菌株与细胞悬浮共培养时间的延长,内生菌株反而抑制了细胞的生长,这可能是由于营养消耗加大,彼此间的竞争增强所致,也可能是菌株代谢物中含有抑制细胞生长的物质,或是共培养过程中菌株诱导细胞产生了一些自毒物质[14]。内生真菌和内生细菌的组合对雷公藤悬浮细胞并未显示出促生长的作用,反映出两者在促进植物生长方面可能不具有协同效应。
向雷公藤细胞悬浮培养体系添加内生真菌及内生真菌与内生细菌的组合后,培养液的pH值有明显的升高。石岳香等[15]研究内生真菌导子对长春花悬浮细胞及生物碱合成的影响时,其培养液的pH值也有所提高。而雷公藤内生细菌尤其是菌株LY1则降低了培养液的pH值,说明菌株LY1具有产酸性,而该菌株较高的溶磷能力[13]可能也与其产酸性有较大关系。在植物细胞培养中,高量的糖常会促进细胞的生长[16]。在雷公藤细胞与内生菌悬浮共培养体系中,总糖消耗量从大到小依次为内生真菌菌株与内生细菌菌株组合处理、单一内生真菌处理、单一内生细菌处理、对照组。可见,内生菌与植物细胞共培养时,需要消耗更多的糖分来满足两者的生长需要,而相对于单菌,混合菌株需要消耗的糖分亦更多。可溶性蛋白质可以反映植物细胞总体代谢水平的高低。随着培养时间的增加,雷公藤悬浮细胞的可溶性蛋白呈现增加的趋势,与内生真菌菌株NS6共培养的细胞可溶性蛋白增加量最多,反映出菌株NS6对细胞可溶性蛋白的合成可能具有一定的诱导作用。除此之外,接种单一内生细菌菌株对悬浮细胞可溶性蛋白含量亦具有一定的提高作用。而接种混合菌株在共培养后期对悬浮细胞的可溶性蛋白的合成显示出了抑制作用。
植物在遭受各种逆境胁迫时,体内POD、CAT等抗氧化酶协同作用能够能防御和减缓活性氧及其他过氧化自由基过量累积对细胞系统的伤害,从而增强植物的抵抗能力[17-19]。雷公藤细胞在与单一内生菌悬浮共培养过程中,细胞的POD、CAT活性多在共培养后期出现峰值,并且各峰值高于对照,表明在培养后期系统出现氧化胁迫,抗氧化酶活性受到促进,而单一内生菌在一定程度上又提高了抗氧化酶活性。因而,此阶段与单一菌株共培养的细胞MDA含量出现明显的下降,反映出抗氧化酶活性的提高减轻了细胞的过氧化损伤。内生真菌与内生细菌组合悬浮共培养的细胞,POD、CAT活性多在共培养初期出现明显升高,可能是菌株的添加诱导了细胞的抗氧化酶活性的提高;而在培养后期,POD活性有明显的降低,MDA含量则较高,显示细胞膜脂过氧化较严重,细胞生长受到抑制。雷公藤细胞的POD、CAT活性升高时,SOD活性反而下降了,这与颜晓艺等[17]、周珩等[20]的实验结果相一致。
参考文献
[1] 李家实. 中药鉴定学[M]. 上海: 上海科学技术出版社, 2000: 132.
[2] 洪 伟, 李 键, 吴承祯, 等. 雷公藤栽培及利用研究综述[J]. 福建林学院学报, 2007, 27(1): 92-96.
[3] 刘明星, 董 静, 杨亚江, 等. 雷公藤甲素的研究进展[J]. 中国中药杂志, 2005, 30(3): 170-174.
[4] Li Y C, Tao W Y, Cheng L. Paclitaxel production using co-culture of Taxus suspension cells and paclitaxel-producing endophytic fungi in a co-bioreactor[J]. Applied Microbiology and Biotechnology, 2009, 83(2): 233-239.
[5] 張宝俊, 张家榕, 韩巨才, 等. 梨树内生细菌LP-5的鉴定及其促生作用研究[J]. 核农学报, 2010, 24(2): 249-253.
[6] 张瑞芬, 李培琴, 赵江林, 等. 盾叶薯蓣内生真菌及其对宿主培养物生长和皂苷元生产的影响[J]. 天然产物研究与开发, 2010, 22(1): 11-15.
[7] 陈世苹, 高玉葆, 梁 宇, 等. 水分胁迫下内生真菌感染对黑麦草叶内保护酶系统活力的影响[J]. 应用与环境生物学报, 2001, 7(4): 348-354.
[8] Carvalho E B, Curtis W R. Effect of elicitation on growth, respiration, and nutrient uptake of root and cell suspension cultures of Hyoscyamusmuticus[J]. Biotechnology Progress, 2002, 18(2): 282-289.
[9] 李建娟, 洪 伟, 吴承祯, 等. 雷公藤优良无性系组织培养技术的研究[J]. 福建林学院学报, 2009, 29(4): 315-319.
[10] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006.
[11] Sofo A, Dichio B, Xiloyannis C, et al. Effects of different irradiance levels on some antioxidant enzymes and on malondialdehyde content during rewatering in olive tree[J]. Plant Sci, 2004, 166(2): 293-302.
[12] 李 群, 汪 超, 唐 明, 等. 灰毡毛忍冬 ‘渝蕾1号 内生菌对其悬浮细胞生物量及绿原酸含量的影响[J]. 植物生理学报, 2015, 51(11): 1 997-2 005.
[13] 许进娇, 宋 萍, 封 磊, 等. 雷公藤内生细菌的促生作用及其对雷公藤甲素生成的影响[J]. 应用生态学报, 2014, 25(6): 1 681-1 687.
[14] Lan W Z, Yu L J, Li M Y, et al. Cell death unlikely conributes to taxolproduction infungalelicitor-induced cell suspension cultures of Taxuschinensis[J]. Biotechnol Lett, 2003, 25 (1): 47-49.
[15] 石岳香, 周 敏, 杨 华, 等. 内生真菌和诱导子对长春花悬浮细胞及生物碱合成的影响[J]. 现代生物医学进展, 2009, 9(5): 886-889.
[16]韩素菊, 黎云祥. 巫山淫羊藿悬浮培养细胞的生长特性研究[J]. 中草药, 2011, 42(8): 1 609-1 613.
[17] 颜晓艺, 赵 丹, 吴承祯, 等. 4种诱导剂对雷公藤幼苗叶片生长及内酯醇含量的影响[J]. 应用与环境生物学报, 2015, 21(4): 607-615.
[18] Vranová E, Inzé D, Van B F. Signal transduction during oxidative stress[J]. Journal of Experimental Botany, 2002, 53: 1 227-1 236.
[19] Zhang J X, Kirkham M B. Drought-stress-induced changes in activities of superoxide dismutase, catalase, and peroxidase in wheat species[J]. Plant Cell Physio1, 1994, 35 (5): 785-791.
[20] 周 珩, 郭世荣, 邵慧娟, 等. NaCl和Ca(NO4)2胁迫对黄瓜幼苗生长和生理特性的影响[J]. 生态学报, 2014, 34(7): 1 880-1 890.

