EMS处理对豇豆生长发育的影响
张忠武 孙信成 杨友伟 田军 杨连勇 詹远华 柏秀芳 刘峰


摘 要 为了使EMS诱变在豇豆育种中发挥最佳效果,获得优质的诱变材料,对豇豆品种‘天畅9号、‘银豇王进行了3种EMS浓度、3种处理时间的诱导处理,并对当代的种子萌发、幼苗生长、植株主要农艺性状及生化指标的变化进行研究。结果表明:EMS能导致豇豆种子的发芽力和生长速率下降,叶片变小,而种子浸出液电导率、幼苗SOD活性及可溶性蛋白质含量增加;对银豇王的叶绿素含量、一级分枝数、结荚性有增加倾向,而天畅9号表现相反。处理剂量以浓度0.3% EMS、时间3~4 h为宜。
关键词 豇豆;EMS;生长发育
中图分类号 S643.4 文献标识码 A
Abstract In order to get the best results in the EMS mutagenesis of cowpea breeding and obtain quality mutagenic material, the cowpea varieties of‘Tianchang 9and‘Yin-jiang-wangwere treated under 3 EMS concentrations and 3 treatment time, and the effect of contemporary seed germination, seedling growth, main agronomic characters of plant, and major biochemical indices were studied. The results showed that the germination ability of seeds and growth rate, leaf size decreased, while the conductivity of the leaching liquid, SOD activities and soluble protein content of seeds increased by EMS treatment. The chlorophyll content, the first-class branch number, podding-habit of‘Yin-jiang-wangwere tended to increase, while on the contrary to‘Tianchang 9. The concentration of 0.3% EMS, and treatment time 3-4 h by EMS treatment of cowpea seeds were appropriate.
Key words Vigna unguiculata; EMS; growth and development
doi 10.3969/j.issn.1000-2561.2017.02.006
化学诱变是一种专一性强、周期短、改良效果明显的新型育种方法。采用化学诱变剂人为诱导作物发生突变,能够产生自然界原来没有的或一般常规方法难以获得的新类型、新性状、新基因,再通过突变体的多世代筛选和鉴定直接或间接地培育出生产上可以利用的作物新品种[1]。
甲基磺酸乙酯(ethyl methane sulfonate,EMS)被认为是一种应用最好的诱变剂,与常规育种方法相比,具有方法简便、育种周期短、效果好等特点,在改良作物品种和创造新种质方面发挥着巨大作用,并在作物突变体库的构架与反向遗传学等基础研究中发挥了重要作用,尤其是与杂交育种技术结合,育种效果更为显著[2]。在豆类作物中,前人通过EMS处理,先后育成了大豆、四棱豆等新品种[3-5]。
豇豆(Vigna unguiculata L.)作为我国主要蔬菜作物之一,EMS诱变的研究鲜见。本试验通过不同剂量EMS处理豇豆种子,对种子浸出液电导率、种子萌发特性、幼苗超氧化物歧化酶(Superoxide Dismutase,简称SOD)活性、可溶性蛋白质含量及植株生长发育的变化进行研究,明确EMS的诱变效应,找出最佳诱变方法,为建立突变体库、诱变育种及反向遗传学等基础研究提供有益参考。
1 材料与方法
1.1 材料
以常德市农林科学研究院蔬菜研究所生产的‘天畅9号和‘银豇王为试材。‘天畅9号为2015年生产,其荚条为嫩绿色,长度75 cm左右,春季播种至始收60 d左右;‘银豇王为2014年生产,其荚条为银白色,长度70 cm左右,春季播种至始收55 d左右。参试材料均保存在-8 ℃冰柜中。
1.2 方法
1.2.1 EMS处理 试验采用3因素完全随机设计。因素1为品种(P),即P1为‘天畅9号,P2为‘银豇王;因素2为浓度(N),设EMS为3个浓度水平,即0.3%(N1)、0.5%(N2)、0.9%(N3);因素3为诱导时间(H),设诱导时间4 h(H1)、6 h(H2)、8 h(H3)。以清水處理为对照(CK),共计20个处理,3次重复。每处理种子为500粒,方法是用清水浸种4 h(常温18 ℃左右),再用EMS浸泡,并每隔30 min搅动1次,使诱导剂与种子接触均匀,处理后用0.1 mol/L Na2S2O3中和20 min,再用流动的自来水漂洗2 h[6]。沥干水分后用54 cm×28 cm×5.5 cm的72孔塑料穴盘播种,每穴2粒,基质为湖南省湘晖农业技术开发有限公司配制的草炭基质,播种环境为塑料大棚,未作辅助加温,白天温度20~22 ℃,夜间温度18~20 ℃。
1.2.2 大田栽植 播种后10 d移栽至塑料大棚避雨栽培,地面覆盖银黑双面地膜。穴距0.8 m×行距0.4 m,双株定植,每小区栽植20株。苗数不足的小区以保护行材料补齐密度,统计中按小区内有效单株的平均值补缺进行统计。
1.2.3 电导率的测定 将EMS处理并清水漂洗后的种子,每份取樣20粒,用滤纸吸干水分后,置入小烧杯中,倒入10 mL蒸馏水浸泡,30 min后测定电导率,以空白蒸馏水为对照[7],电导率仪采用上海雷磁泾仪器有限公司生产的DDS-11A数显电导率仪。
1.2.4 种子发芽势和发芽率的测定 各处理在播种后6 d统计发芽势,8 d后统计种子发芽率。以子叶完全出土,且真叶露出子叶为发芽。相对发芽率为处理发芽率与对照的比率[8],即处理种子发芽率/对照发芽率×100%。
1.2.5 半致死剂量的计算 以播种后8 d的相对发芽率为统计资料,通过Excel 图表功能,以诱导时间为自变量,相对发芽率为因变量自动绘制趋势线,并显示线性方程、指数方程及其判定系数R2,计算相对发芽率为50%的反函数,得出半致死剂量的诱导时间[9]。
1.2.6 幼苗SOD活性及可溶性蛋白质含量的测定
播种后9 d,取各处理幼苗叶片0.5 g,提取酶液后进行SOD活性及可溶性蛋白质含量的测定。SOD活性测定采用氯化硝基四氮唑蓝(NBT)光还原法[10],可溶性蛋白质含量测定采用考马斯亮蓝法[10]。
1.2.7 生长速率的测定 以播种后36 d的植株为统计对象,每处理随机选取10株,测量植株顶端距地面的垂直距离,取其平均值(L),除以总生长时间(T),计算出播种后36 d内的生长速率(R)。
生长速率(R)=总生长量(L)/总生长时间(T)
1.2.8 叶绿素及类胡萝卜素含量的测定 在植株开花期,剪取主蔓顶端以下的第3片真叶进行测定,取样时间为16 : 30,晴天,光照强度32 200 lx,大棚内空气温度38.1 ℃。测定方法为分光光度法[10]。
叶绿素a的含量(Ca)=12.21×OD663-2.81×OD646
叶绿素b的含量(Cb)=20.13×OD646-5.03×OD663
类胡萝卜素含量(Cc)=(1 000×OD470-3.27×Ca-104×Cb)/229
相对含量=C处理/CCK×100%
1.2.9 叶片大小测定 以主茎中部的最大复叶片的中间叶长代表叶片大小。在植株开花期,随机选取10株主茎中部的最大复叶片的中间叶,以刻度直尺测量叶长[11]。通过Excel表格自动运算各种处理下的算术平均值(Average)、标准偏差(Standard deviation),再计算变异系数CV(Coefficient of Variation)。
变异系数(CV)=标准偏差/算术平均值×100%。
1.2.10 主蔓一级分枝数的统计 在豇豆成熟期,主茎上一级分枝,不论结荚与否,分枝以长达2节以上为准,每小区选取10株完整植株为观测对象进行目测计数[11]。
1.2.11 有效花梗数的统计 在豇豆成熟期,每小区选取10株完整植株,目测法统计主茎上结有成熟荚及可食嫩荚的花梗总数,未能结荚的非正常花梗不作统计。
1.2.12 单株结荚数的统计 在豇豆成熟期,每小区选取10株完整植株,目测法统计植株上结荚总数[11]。
2 结果与分析
2.1 对种子浸出液电导率的影响
由图1、2可知,豇豆种子通过EMS处理后,种子浸出液的电导率急剧升高。‘银豇王的电导率峰值时间为处理4 h左右;‘天畅9号出现稍晚,在0.9%浓度下诱导6 h达到峰值,在0.3%和0.5%浓度下则为8 h。
2.2 对种子萌发的影响
由表1可知,EMS处理对豇豆种子萌发产生了抑制作用,并随浓度增加及处理时间的延长,发芽势和发芽率均呈逐渐下降趋势,其值也都在50%以下,其中‘银豇王下降幅度更大。从回归方程看(表2),线性方程的判定系数R2平均值为0.831 6,而指数方程的为0.917 5,高于前者,说明指数方程更能准确描述诱导时间与相对发芽率之间的函数关系。运用指数方程得出半致死剂量的诱导时间,‘天畅9号在0.3%、0.5%、0.9% EMS浓度下,半致死剂量时间分别为4.41、3.63、3.59 h,‘银豇王在上述3种浓度下分别为2.04、0.84、0.79 h。
2.3 对幼苗SOD活性及蛋白质含量的影响
如图3、4所示,随着EMS处理时间的延长,豇豆幼苗的SOD活性总体上表现为先降后升,再下降;但两品种处理组的SOD活性峰值表现不一样,其中‘银豇王的SOD活性峰值时间在处理6 h附近,‘天畅9号在8 h左右。幼苗的可溶性蛋白质含量有所升高(图5、6),低剂量下变化不明显,高剂量下则上升幅度较大。在0.9% EMS诱导8 h下,‘银豇王的可溶性蛋白质含量高出对照29.0%,‘天畅9号高出59.7%。
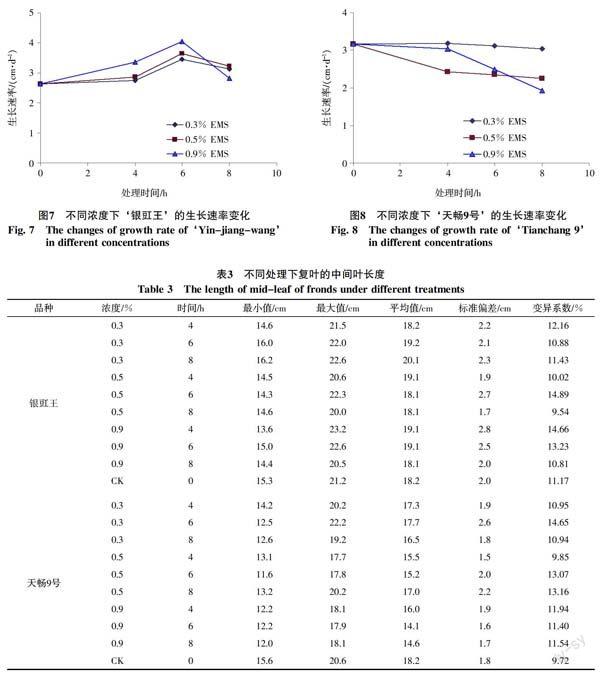
2.4 对植株生长速率的影响
EMS处理后,出现一些旺长株和矮化株,植株高矮不齐。由图7、8可知,2个品种在EMS处理后,高浓度下生长速率均有下降表现。‘银豇王在处理时间低于6 h时,生长速率加快,但处理8 h后速率很快下降。 ‘天畅9号在各种处理下均表现为生长速率下降,其中在0.9% EMS处理4 h后速率下降不明显,但随后随着处理时间的延长,生长速率下降的幅度加大,处理8 h后速率达到最低水平。
2.5 EMS对植株叶片大小的影响
由表3可知,通过EMS处理后,豇豆叶片的变异系数不大。‘银豇王的叶片没有规律性变化。‘天畅9号则随浓度的加大略有缩小趋势,但变异系数均在9.54%~14.89%之间。
2.6 对植株叶片中叶绿素及类胡萝卜素含量的影响
由表4可知,2个品种对EMS的诱变效应各不相同。‘银豇王在EMS作用下,叶绿素a和叶绿素b有含量增加的表现,而类胡萝卜素变化不明显。‘天畅9号通过EMS处理后,叶绿素a和叶绿素b的含量均下降,但类胡萝卜素却大幅增加,最大增幅达到48.5%。
2.7 对分枝性的影响
由表5可知,在不同处理下,2個品种的一级分枝数变化不同。‘银豇王在EMS处理下,分枝数有增多的倾向,剂量越大,分枝数越多,证明在EMS高剂量处理下植株发生分枝现象已很普遍。‘天畅9号表现相反,分枝数有减少的倾向,证明EMS处理后一部分植株的分枝已减少甚至不分枝。
2.8 对结荚性能的影响
由表6可知,2个品种在各种处理下,有效花梗的总数量变化趋势不同。‘银豇王表现为有效花梗数增加,浓度高、时间长则增幅更大,在0.9% EMS处理8 h下,有效花梗最高达到7.12个/株。而‘天畅9号在EMS处理后有效花梗数减少,一般在3.44~4.80个/株之间,均低于对照的5.63个/株。在单株结荚数方面,2个品种的变化趋势与有效花梗数相近。‘银豇王在EMS处理后结荚数增多,其中在0.9% EMS处理6 h,单株结荚数达到9.12条/株,达到最大值。‘天畅9号在处理后的单株结荚数为5.53~6.76条/株,均低于对照的8.90条/株。
3 讨论
EMS处理种子后,细胞膜遭受一定程度损害,导致细胞内物质渗漏,种子浸出液电导率上升,而且出苗率下降,幼苗的SOD活性升高,本研究结果与前人研究结论一致[12-14]。半致死剂量是衡量敏感性的主要指标,也是诱变育种适宜剂量的参考[15]。本研究中,估算出‘天畅9号在0.3%、0.5%、0.9% EMS浓度下,半致死剂量处理时间分别为4.41 h、3.63 h、3.59 h,‘银豇王在上述3种浓度下则分别为2.04 h、0.84 h、0.79 h。
EMS处理种子后,幼苗的可溶性蛋白质含量在低剂量下变化不明显,高剂量下有增加的趋势,与前人的研究结论不同[16]。EMS对生长速率有一定的抑制作用,但低剂量处理对‘银豇王播种后36 d内的生长速率反而有促进作用。另外,EMS对叶绿素及类胡萝卜素的含量产生一定影响,‘银豇王的叶绿素a、叶绿素b有含量增加的表现,而类胡萝卜素变化不明显。‘天畅9号的叶绿素a和叶绿素b的含量均下降,而类胡萝卜素的含量却增加。
EMS诱变处理后,化学物质扰乱了植物生理活动,会出现一些畸变现象。大豆会产生植株矮化,熟性提早或延迟现象[17],分枝数和单株荚数的变异系数增大[18]。本研究中发现,因供试豇豆品种不同而产生结果不一样,EMS处理后‘银豇王的分枝数、有效花梗数、结荚数有增多的倾向,而‘天畅9号表现相反。
人工诱导能够诱发基因突变,改良植物特性而获得优良突变体,诱导剂量适宜与否是诱变育种成功的关键之一。过低剂量则不足以引起突变或突变率低,剂量过高则因严重损伤而突变致死,从而掩盖其他突变,因此,为了获得更多的变异类型、较高的突变率及足够的可供选择的群体,就必须选择适宜剂量[19]。笔者建议,EMS诱导豇豆种子的适宜剂量控制在浓度0.3%,时间3~4 h。
参考文献
[1] 杨富军, 王绍伦, 高华援, 等. 不同基因型花生EMS诱变条件分析及突变系筛选[J]. 安徽农业科学, 2014, 42(33): 11 778-11 781.
[2] 杜园园, 刘永忠, 李万星, 等. 大豆EMS化学诱变处理条件分析[J]. 安徽农业科学, 2012, 40(35): 16 995-16 996.
[3] 于秀普, 杜连恩, 魏玉昌, 等. 大豆新品种冀豆8号的选育[J].中国油料作物学报, 1994(2): 58-59.
[4] 李占军, 魏玉昌, 杜连恩. 大豆新品种化诱5号的选育及栽培技术[J]. 河北农业科学, 2005, 9(2): 63-64.
[5] 全妙华, 陈东明, 蒋向辉. 四棱豆新品种湘棱豆3号的选育[J]. 中国蔬菜, 2011(16): 112-114.
[6] 李林章, 余珊珊, 宋 慧. EMS处理青刀豆最佳诱变剂量的选择[J]. 长江蔬菜, 2015(24): 48-49.
[7] 毛培胜, 常淑娟, 王玉红, 等. 人工老化处理对羊草种子膜透性的影响[J]. 草业学报, 2008, 17(6): 66-70.
[8] 徐小玉, 张凤银, 曾庆微. NaCl和Na2SO4盐胁迫对波斯菊种子萌发的影响[J]. 东北农业大学学报, 2014(4): 55-59.
[9] 张明刚. 用EXCEL对农业试验数据进行回归分析的方法[J]. 贵州农业科学, 2009, 37(6): 256-258.
[10] 邹 琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.
[11] 王佩芝, 李锡香, 等. 豇豆种质资源描述规范和数据标准[M]. 北京: 中国农业出版社, 2006.
[12] 卢 银, 刘梦洋, 王彥华, 等. EMS处理对大白菜种子萌发及主要生化指标的影响[J]. 中国蔬菜, 2014(11): 20-24.
[13] 原小燕, 李加纳, 刘列钊. EMS对油菜种子萌发的影响[J]. 西南师范大学学报(自然科学版), 2010, 35(3): 217-221.
[14] 王幼平, 徐晓霞, 高宏波, 等. EMS和60Co对海甘蓝种子萌发及其M1代农艺性状的影响[J]. 植物研究, 1999(1): 64-67.
[15] 耿兴敏, 王良桂, 李 娜, 等. 60Co-γ射线对桂花种子萌发及幼苗生长的影响[J]. 核农学报, 2016, 30(2): 216-223.
[16] 温 岚, 龚友才, 陈基权, 等. EMS和60Co-γ射线辐照复合诱变黄麻突变体苗期生理生化特性研究[J]. 中国麻业科学, 2014, 36(5): 226-231.
[17] 吴秀红. 春大豆EMS诱变M1、 M2代主要农艺性状的遗传变异及相关性[J]. 大豆科学, 2011, 30(5): 760-763.
[18] 王丕武, 刘宗昭. EMS诱发大豆农艺性状的遗传变异[J]. 中国油料作物学报, 1991(2): 9-13.
[19] 司述明, 等. 53种植物γ射线辐照适宜剂量范围[M]//王琳清. 诱发突变与作物改良. 北京: 原子能出版社, 1995: 379-384.

