巴西橡胶树HbSERK1启动子的克隆及功能鉴定
王颖 贾瑞 李辉亮 郭冬 朱家红 陈雄庭 彭世清


摘 要 利用Genome Walker方法从巴西橡胶树中克隆了HbSERK1起始密码子上游1 395 bp的5′调控序列,序列分析表明,该序列A/T含量高达66.2%,符合真核生物启动子序列的特征。HbSERK1启动子序列中含有多个典型的真核生物启动子基本元件,如:TATA-box,CAAT-box等,同时存在其它应答元件,如:CAT-box、02-site、ERE、ARE、TCA-element、GCN4-motif、ACA-motif等。将HbSERK1启动子进行5′缺失,并构建了5个植物缺失表达载体。利用真空渗透法和农杆菌介导法将植物缺失表达载体转化烟草,对烟草转化植株进行GUS活性定量分析结果表明,除了SP5外,其它缺失表达载体均可以驱动GUS蛋白的表达,说明在HbSERK1啟动子-1 395~-252 bp区域可以驱动GUS的表达,表明HbSERK1启动子是具有生物活性的启动子。
关键词 巴西橡胶树;HbSERK1启动子;功能鉴定
中图分类号 S794.1 文献标识码 A
Abstract The 5′ regulatory region of HbSERK1 from Hevea brasiliensis was cloned using GenomeWalker strategy. A/T content in this sequence is up to 66.2%, and meet the characteristic of eukaryotic promoter sequence. TATA box, CAAT box CAT-box, 02-site, ERE, ARE, TCA-element, GCN4-motif, ACA-motif were found in this promoter region. In order to verify HbSERK1 promoter function, Five deletions plant expression vector were constructed and transformed to the tobacco by Agrobacterium-mediated vacuum infiltration method and Agrobacterium-mediated. GUS activity analysis revealed that the region from -1 395~-252 bp nt drived expression of the GUS gene except SP5 deletion(-252 bp). The results of transient expression and stable expression suggest HbSERK1 promoter possess bioactivity.
Key words Hevea brasiliensis; HbSERK1 promoter; functional characterization
doi 10.3969/j.issn.1000-2561.2017.02.018
巴西橡胶树是天然橡胶商业生产的唯一来源,在国民经济中占有举足轻重的地位。从1904年巴西橡胶树引入中国一个世纪以来,中国在橡胶树的选育种工作中取得了很大的成绩。中国热带农业科学院的橡胶树育种工作者根据橡胶树阶段发育的原理,建立了培育橡胶树幼态无性系的一系列技术,其中通过组织培养获得的花药体细胞植株及其芽接树(幼态无性系)比花药供体(老态无性系)产量提高了10%~42%[1-3],但一些高产橡胶树品种在组织培养过程中很难由愈伤组织产生体细胞胚而获得再生植株,从而限制了自根幼态无性系在橡胶树生产中的进一步应用。因此,通过研究橡胶树体细胞胚胎发生相关基因的分子机制,进而利用生物技术改变关键因子的表达将是获得橡胶树优良品种的幼态无性系的有效途径。
植物胚胎发生相关类受体蛋白激酶基因(SERK)是一个能使植物细胞获得胚性能力的蛋白质,属于LRR-RLK超级家族。首个SERK基因DcSERK来自于胡萝卜下胚轴的胚性细胞中,且SERK是在胡萝卜体细胞胚中特异表达的蛋白[4]。拟南芥AtSERK1 是胚胎发生信号途径中的重要因子,在胚珠发育和胚胎形成初期表达[5],且过量表达后促进胚胎发育[6]。在玉米中发现SERK可能参与了体细胞胚胎发育过程和信号传导[7]。LsSERK的缺失降低了莴苣组织培养过程中形成体细胞胚的能力[8]。在许多植物中,SERKs都有几个家族基因[9-11],且参与胚胎发育、免疫应答或其他生长发育过程[12-22]。本研究组研究人员已经克隆了橡胶树HbSERK1,且证明HbSERK1主要在橡胶树体细胞胚发生的早期表达,可能参与了体细胞胚发生[23]。笔者利用Genome Walker的方法分离得到HbSERK1的启动子,并对其功能进行初步的研究,为HbSERK1在橡胶树体细胞胚胎发生中的表达调控机制打下理论基础。
1 材料与方法
1.1 材料
用于总DNA提取的巴西橡胶树(无性系热研7-33-97)叶片采自热带生物技术研究所实验基地;用于转基因的三生烟草为本实验室保存。
LA PCRTM in vitro Cloning Kit购自TaKaRa公司,试剂盒提供正向巢式引物C1和C2;限制性内切酶EcoRⅠ,BamHⅠ,HindⅢ等购于Formentas公司;根癌农杆菌(Agrobacterium tumefaciens)GV3101菌株、植物表达载体pCAMBIA1301、植物表达载体pCAMBIA1381Z由本实验室保存。
1.2 方法
1.2.1 橡胶树基因组DNA的提取 参照安泽伟[24]的方法提取橡胶树叶片的基因组DNA。
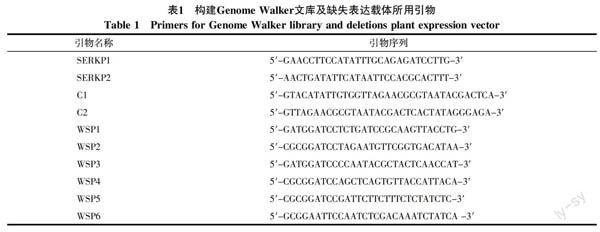
1.2.2 引物设计与合成 根据HbSERK1的序列设计2条反向巢式PCR特异引物SERKP1和SERKP2,正向巢式引物为Genome Walker试剂盒引物C1和C2。根据已获得的HbSERK1启动子序列,设计缺失表达载体引物WSP1,WSP2,WSP3,WSP4,WSP5,WSP6(表1)。
1.2.3 Genome Walker文库构建及GenomeWalker DNA Walking 参照LA PCRTM in vitro Cloning Kit产品说明书,将提取的橡胶树基因组DNA用SpeⅠ、Sau3AⅠ、HindⅢ、EcoRⅠ、Xma J、XbaⅠ、EcoT22Ⅰ、和MflⅠ8种酶进行酶切消化,进而纯化酶切后的DNA。最后将纯化的DNA与接头连接(由LA PCRTM in vitro Cloning Kit提供),构建成8种Genome Walker文库(SpeⅠ文库、Sau3AⅠ文库、HindⅢ文库、EcoRⅠ文库、EcoT22Ⅰ文库、MflⅠ文库、Xma J文库、XbaⅠ文库)。
PCR-based DNA Walking:(1)第一轮PCR:在8个0.2 mL PCR管中分别加入8种DNA文库1 μL,然后依次加入10×LA PCR BufferⅡ 2 μL、2.5 mmol/L的dNTP 2 μL、 Primer C1 0.4 μL、Primer SERKP1 0.2 μL、 TaKaRa LA Taq 0.2 μL,总反应体系为20 μL。混匀后进行第一轮PCR,扩增程序:94 ℃预变性3 min;35×(94 ℃ 30 s,57 ℃ 2 min,72 ℃ 80 s);72 ℃ 5 min。(2)第二轮PCR:将第一輪PCR反应产物稀释后各取1 μL做模板,然后依次加入10×LA PCR BufferⅡ 2 μL、2.5 mmol/L的dNTP 2 μL、Primer C2 0.4 μL、Primer SERKP2 0.2 μL、TaKaRa LA Taq 0.2 μL,总反应体系为20 μL。混匀后进行第二轮PCR,扩增程序:94 ℃预变性3 min;35×(94 ℃ 30 s,62 ℃ 2 min,72 ℃ 80 s);72 ℃ 5 min。PCR产物经回收、纯化后克隆到pMD19-T载体上送往中科瑞泰公司进行测序。
1.2.4 HbSERK1启动子缺失表达载体的构建
(1)用PCR扩增不同大小的5′缺失启动子。50 μL反应体系如下:10×Taq Buffer(MgCl2-)5 μL,MgCl2 5 μL,10 mmol/L dNTP 5 μL,引物各2.5 μL,Taq 1 μL,Temple,5 μL。扩增程序:94 ℃预变性3 min;28×(94 ℃ 30 s,58 ℃ 40 s,72 ℃ 5 min);72 ℃ 5 min。将PCR产物回收后克隆到pMD19-T载体上送去测序。
(2)分别对表达载体PCAMBIA1381Z和插入了缺失启动子片段的pMD19-T Simple Vector用BamHⅠ和HindⅢ进行双酶切,回收目的片段并连接,将连接产物转化到大肠杆菌感受态细胞中,PCR检测为阳性的菌液提取质粒DNA送去测序。
(3)构建好的缺失表达载体示意图如下(图1)。
1.2.5 HbSERK1启动子各缺失表达片段转化烟草及GUS定量分析 (1)将各缺失表达载体质粒转化到根癌农杆菌GV3101感受态中,菌液二次扩大培养后,收集重悬菌体,将大小相同的三生烟草叶片浸泡在重悬菌液中,在0.85 Mp压力下,真空渗透40 min。取出叶片,将叶片平铺于MS培养基上,光照培养箱中暗培养2 d。
(2)用农杆菌介导叶盘法将构建好的各缺失表达载体转化烟草,将共培养后的烟草叶片转入筛选分化培养基(MS+100 mg/L Timetin+50 mg/L潮霉素B)上。烟草转化植株叶片DNA是参照Plant DNA Isolation Kit(FOREGENE公司)说明进行提取,对烟草转化植株进行PCR验证时使用各缺失片段特异引物,扩增程序:94 ℃ 预变性3 min;28×(94 ℃ 30 s,58 ℃ 40 s,72 ℃ 5 min);72 ℃ 5 min。
(3)植物总蛋白的提取:取0.3 g三生烟草叶片,加液氮快速研磨,将研磨好的粉末转到预冷的0.5 mL蛋白提取液的离心管中。涡旋,冰上充分反应30 min,4 ℃ 11 000 r/min离心10 min。用移液器轻轻吸取上清至新的离心管中,将其放于冰上待用。总蛋白浓度的测定:采用Bradford法测定植物总蛋白浓度。
(4)GUS蛋白活性定量测定(Jeferson法):取20 μL蛋白提取液加入到37 ℃预热的180 μL GUS蛋白分析Buffer中,37 ℃反应;40 min后加入800 μL的0.2 mol/L Na2CO3 Buffer终止反应。吸取200 μL样品转入酶标板上,使用发光检测仪检测荧光强度(λ365 nm/455 nm)。GUS蛋白活性计算,结果以所生成的4-MU的量与总蛋白含量和时间的比值pmol·min-1·mg-1表示。所有实验至少重复3次。
2 结果与分析
2.1 Genome walker文库的构建
将提取的橡胶树基因组DNA用SpeⅠ、Sau3AⅠ、HindⅢ、EcoRⅠ、EcoT22Ⅰ、MflⅠ、Xma J和XbaⅠ8种限制性内切酶进行酶切消化,进而纯化酶切后的DNA。最后将纯化的DNA与接头连接,构建成8种Genome Walker文库(SpeⅠ库、Sau3AⅠ库、HindⅢ库、EcoRⅠ库、EcoT22Ⅰ库、MflⅠ库、Xma J库、XbaⅠ库)(图2)。
2.2 HbSERK1启动子的克隆
根据HbSERK1的序列设计2条反向巢式PCR特异引物SERKP1和SERKP2,正向巢式引物为Genome Walker试剂盒引物C1和C2。经过两轮PCR扩增后,在Hind III文库中扩增出一条清晰的条带。将其克隆后测序,与已知的HbSERK1序列比对。结果表明,分离得到HbSERK1翻译起始位点上游的1 395 bp序列,且该片段序列A/T含量高达66.2%,符合真核生物启动子序列的特征(图3)。
2.3 HbSERK1启动子顺式作用元件预测
用Softberry网站对HbSERK1的5′调控序列预测,发现该序列中含有真核生物典型的核心启动子区域,其可能的转录起始位点位于翻译起始位点上游466 bp处。用Plant CARE数据库对HbSERK1 5′调控序列的顺式作用元件分析,预测结果显示该序列含有启动子核心序列TATA-box,增强子元件CAAT-box等多个典型的真核生物启动子基本元件。同时存在胚乳表达元件GCN4-motif,分生组织表达元件CAT-box,玉米蛋白代谢元件02-site,还有厌氧诱导元件ERE,光响应元件SP1、ACA-motif,ATCT-motif,水杨酸响应元件TCA-element,乙烯利响应元件ARE(图4)。
2.4 HbSERK1启动子的功能分析
为了验证HbSERK1启动子的调控方式,构建了HbSERK1启动子的5种植物缺失表达载体,PCR扩增和酶切鉴定结果显示目的片段与预期片段大小一致(图5,图6)。经测序证明HbSERK1启动子已经正向插入pCAMBIA1381Z上。将缺失表达载体分别命名为SP1、SP2、SP3、SP4、SP5。
HbSERK1啟动子各缺失片段在烟草中瞬时表达后,GUS蛋白活性定量分析结果表明,与35S驱动的pCAMBIA 1301对照比较,含有SP1、SP2、SP3、SP4烟草的叶片均具有GUS活性,说明HbSERK1启动子驱动基因的表达具有一定的专一性。HbSERK1启动子在叶片中的GUS活性随着启动子5′端的不断缺失而不断下降,含有SP5的烟草叶片没有检测到GUS活性(图7)。
为了进一步验证HbSERK1启动子上游区段对GUS基因的调控作用,共获得烟草转化植株约200株。PCR检测结果证明SP1、SP2、SP3、SP4、SP5已整合到烟草基因组中(图8)。各缺失片段转化烟草叶片的GUS蛋白活性定量分析结果表明,与35S驱动的pCAMBIA 1301对照比较,SP1、SP2、SP3、SP4均具有GUS活性,且GUS活性随着启动子5′端的不断缺失而不断下降,而SP5几乎没有GUS活性(图9)。
3 讨论
本研究根据前期已克隆的HbSERK1基因设计引物,用Genome Walker的方法分离得到HbSERK1翻译起始位点上游的1 395 bp序列,且该片段序列A/T含量高达66.2%,符合真核生物启动子序列的特征,生物信息学分析预测含有真核生物典型的核心启动子区域和顺式作用元件。
本研究为了验证HbSERK1启动子上游区段对GUS基因的调控作用,构建了SP1、SP2、SP3、SP4、SP5 5种HbSERK1启动子缺失表达载体,缺失片段瞬时表达和稳定表达结果均显示SP1、SP2、SP3、SP4具有GUS活性,而SP5几乎没有GUS活性。因此,笔者推测-661~-252 bp区段对HbSERK1启动子的活性至关重要,进一步的研究发现,在-661~-252 bp间存在一个分生组织元件CAT,是与胚胎发育相关的作用元件,由此笔者推测CAT可能是HbSERK1启动子调控组件中的关键基序。Hecht等[25]研究结果发现,AtSERK1在胚珠发育和体细胞胚形成早期出现,是一个与胚胎形成信号途径相关的基因。Schellenbaum等[6]研究结果发现,葡萄VvSERK1在体细胞胚中大量表达。Ma等[26]研究结果发现,凤梨AcSERK1主要参与了体细胞胚诱导和发育过程。这一推测也符合本研究组前期发现的HbSERK1可能参与体细胞胚发生的过程[23]。随后对照HbSERK1启动子顺式作用元件预测图发现,在-1 394~-1 223 bp,-1 223~-952 bp,-661~-252 bp各区段间均存在增强子元件CAAT-box,这可能是GUS活性随着启动子缺失片段的减小而不断降低的原因。
基因的表达调控极其复杂,预测的启动子顺式作用元件中还有水杨酸响应元件TCA-element,乙烯利响应元件ARE,厌氧诱导元件ERE,光响应元件SP1、ACA-motif,ATCT-motif,下一步可通过在橡胶树组织培养过程中改变上述激素、光照、氧环境等因素,深入研究HbSERK1基因的表达调控机制,为利用生物技术改变HbSERK1基因的表达获得橡胶树优良品种的幼态无性系提供理论依据。
参考文献
[1] 陈雄庭, 王泽云, 吴蝴蝶, 等. 橡胶树新型种植材料-幼态自根无性系[J]. 热带作物学报, 2002, 23(1): 19-23.
[2] 郝秉忠, 吴继林. 巴西橡胶树幼态无性系的高产特性[J]. 热带农业科学, 1996(2): 1-8.
[3] 王泽云, 曾宪松, 陈传琴. 从离体花药诱导巴西橡胶植株[J]. 热带作物科技通讯, 1978(4): 1-7.
[4] Schmidt E D, Guzzo F, Toonen M A J, et al. A leu-cine-rich repeat containing receptor-like kinase marks somatic plant cell competent to form embryos[J]. Development, 1997, 124(10): 2 049-2 062.
[5] Hecht V, Calzada J P V, Hartog M V, et al. The Arabidopsis somatic embryogenesis receptor kinase1 gene is expressed in developing ovules and embryos and enhances embryogenic competence in culture[J]. Plant Physiol, 2001, 127(3): 803-816.
[6] Schellenbaum P, Jacques A, Mailot P, et al. Characterization of VvSERK1, VvSERK2, VvSERK3 and VvL1L genes and their expression during somatic embryogenesis of grapevine (Vitisvinifera L.) [J]. Plant Cell Rep, 2008, 27(12): 1 799-1 809.
[7] Baudino S, Hansen S, Brettschneider R, et al. Molecular characterisation of two novel maize LRR receptor-like kinases, which belong to the SERK gene family[J]. Planta, 2001, 213(1): 1-10.
[8] Santos M O, Romano E, Vieira L S, et al. Suppression of SERK gene expression affects fungus tolerance and somatic embryogenesis in transgenic lettuce[J]. Plant Biol, 2009, 11(1): 83-89.
[9] Hu H, Xiong L, Yang Y. Rice SERK1 gene positively regulates somatic embryogenesis of cultured cell and host defense response against fungal infection[J]. Planta, 2005, 222(1): 107-117.
[10] Nolan K E, Irwanto R R, Rose R J. Auxin up-regulates MtSERK1 expression in both Medicago truncatula rootforming and embryogenic cultures[J]. Plant Physiol, 2003, 133(1): 218-230.
[11] Thomas C, Meyer D, Himber C, et al. Spatial ex-pression of a sunflower SERK gene during induction of somatic embryogenesis and shoot organogenesis[J]. Plant Physiol Biochem, 2004, 1(42): 35-42.
[12] Sanjeev K S, Steve M, Ingo H, et al. Cloning and molecular characterisation of a potato SERK gene transcriptionally induced during initiation of somatic embryogenesis[J]. Planta, 2008, 228(2): 319-330.
[13] Song D H, Li G J, Song F M, et al. Molecular characterization and expression analysis of OsBISERK1, a gene encoding a leucine-rich repeat receptor-like kinase, during disease resistance responses in rice[J]. Mol Biol Rep, 2008, 35(2): 275-283.
[14] Alam M M, Sharmin S, Nabi Z, et al. A putative leucine-rich repeat receptor-like kinase of jute involved in stress response[J]. Plant Mol Biol Rep, 2010, 28(3): 394-402.
[15] Antolin-Llovera M, Ried M K, Binder A, et al. Receptor kinase signaling pathways in plant-microbe interactions[J]. Annu Rev Phytopathol, 2012, 50(50): 451-473.
[16] Sun Y, Li L, Macho A P, et al. Structural basis for flg22-induced activation of the Arabidopsis FLS2-BAK1 immune complex[J]. Science, 2013, 342(6 158): 624-628.
[17] 蔡英卿. 龍眼体胚发生过程中SERK等胚性相关基因的克隆与表达分析[D]. 福州: 福建农林大学, 2011.
[18] 翁 浩, 賴钟雄. 金花茶体细胞胚胎Cn-SERK基因的克隆及其生物信息学分析[J]. 热带作物学报, 2013, 34(9): 1 699-1 707.
[19] 张丽杰. 苹果属无融合生殖相关SERK基因克隆与表达分析及遗传转化的研究[D]. 沈阳: 沈阳农业大学, 2013.
[20] Ma J, He Y H, Hu Z Y, et al. Characterization of the third SERK gene in pineapple (Ananas comosus) and analysis of its expression and autophosphorylation activity in vitro[J]. Genetics and Molecular Biology, 2014, 37(3): 530-539.
[21] Tang J, Han Z, Sun Y, et al. Structural basis for recognition of an endogenous peptide by the plant receptor kinase PEPR1[J]. Cell Res, 2015, 25(1): 110-120.
[22] Ahmadi B, Masoomi-Aladizgeh F, Shariatpanahi M E, et al. Molecular characterization and expression analysis of SERK1 and SERK2 in Brassica napus L.: implication for microspore embryogenesis and plant regeneration[J]. Plant Cell Rep, 2016, 35(1): 185-193.
[23] 王 颖, 陈 洁, 李辉亮, 等.橡胶树体细胞胚胎发生相关类受体蛋白激酶基因(HbSERK1)的克隆及表达分析[J]. 热带作物学报, 2011, 32(8): 1 494-1 498.
[24] 安泽伟, 黄华孙. 一种提取橡胶树叶中总DNA的方法[J]. 植物生理学通讯, 2005, 41(4): 513-515.
[25] Hecht V, Vielle-Calzada J P, Hartog M V, et al. The Arabidopsis somatic embryogenesis receptor kinase 1 gene is expressed in developing ovules and embryos and enhances embryogenic competence in culture[J]. Plant Physiol, 2001, 127(3): 803-816.
[26] Ma J, He Y H, Wu C H, et al. Cloning and molecular characterization of a SERK gene transcriptionally induced during somatic embryogenesis in Ananas comosus cv. Shenwan[J]. Plant Molecular Biology Reporter, 2012, 30(1): 195-203.

