小粒咖啡叶片解剖结构和综合抗旱性评价
王睿芳 马剑 潘耕耘 陈国松 赵万里


摘 要 以7个品种的小粒咖啡为供试材料,通过测定叶片厚度(LT)、角质层厚度(CT)、栅栏组织厚度(PT)、海绵组织厚度(ST)、气孔密度(SD)和叶片小脉密度(VD),并计算出叶片组织结构紧密度(MTR)、叶片组织结构疏松度(MLR)和气孔面积指数(SPI),分析其抗旱能力的差异,为小粒咖啡栽培和筛选抗旱性状提供理论依据。结果表明,所选9个抗旱性指标,品种间差异显著,运用主成分分析方法结果显示,PT和MTR载荷较高,是反映小粒咖啡抗旱性信息的主要因子,可以作为评价小粒咖啡抗旱性的主要指标。其中德热169、P7963和矮卡综合抗旱能力较强,CCCA24较弱,P2,德热296和铁毕卡居中。
关键词 小粒咖啡;叶片解剖结构;栅栏组织厚度;抗旱性
中图分类号 S571.2 文献标识码 A
Abstract Leaf anatomical characteristics of 7 Coffea arabica cultivars were investigated to reveal the drought-resistant strategies in Puer, Yunnan. The stomatal density(SD), leaf thickness(LT), cuticle thickness(CT), palisade mesophyll thickness(PT), spongy mesophyll thickness(ST)and vein density(VD), and calculated mesophyll structure tense ratio(MTR), mesophyll structure loosened ratio(MLR)and stomatal pore area index(SPI)were measured. Results showed that 9 leaf anatomical characteristics were significantly different among cultivars. PT and MTR could be effective indicators of drought resistance for C. arabica based on principal component analysis. Dere169, P7963 and Aika were the most drought-resistant cultivars, the remaining cultivars were more drought-resistant than CCCA24.
Key words Coffea arabica; leaf anatomical characteristic; palisade mesophyll thickness; drought resistance
doi 10.3969/j.issn.1000-2561.2017.02.010
干旱胁迫是影响植物生存、生产和分布最普遍的非生物逆境之一,植物的一生中频繁遭受空气和土壤水分的胁迫[1]。因此,植物对干旱胁迫的响应与适应机制一直是植物生理生态学研究的热点。叶片既是水分在植物体中运输进行光合作用的瓶颈,也是植物进行水分蒸腾、运输的门户[2-3]。由于叶片受环境因子的影响显著,对干旱等逆境反应敏感,其形态结构特征直接影响到植物的生理活动和生态功能,对于评价植物的抗旱性能具有不可替代的作用[4-5]。
长期生长在干旱环境中的植物叶片通常表现出叶片厚度大、角质层厚、栅栏组织厚、海绵组织厚度小、叶片组织结构紧密度高、疏松度低和气孔密度高等解剖结构特点[6-9]。叶片小脉(Minor vein density)则是叶片水分分发系统,高的小脉密度可以提高水分在叶肉组织中运输所覆盖的表面积,减少水从叶脉末端到达蒸腾位置的距离[10]。通常生长在干旱地区的植物具有较高的叶脉密度[11]。因此,叶片的许多解剖结构指标可以表征植物的抗旱能力,如何综合叶片的旱生结构特征,对于评价植物的抗旱性有重要意义[12]。
小粒咖啡(Coffea arabica L.)是浅根性经济作物,原是热带雨林的林下成分,在系统发育过程中形成了喜湿润的生态习性,属于对干旱敏感的植物[13-14]。轻度水分胁迫即可导致光合速率下降[15-17]。随着水分胁迫的加剧,导致叶绿素降解[18],抗坏血酸过氧化物酶、过氧化氢酶、谷胱甘肽还原酶等酶活性及渗透调节物质脯氨酸和丙二醛含量增加,蔗糖转化酶、蔗糖磷酸合酶及果糖-1,6-二磷酸酶增加,促使可溶性糖类物质增加而淀粉含量减少[19],整个植株光合碳积累减少,下部叶片变黄凋落,上部新形成的叶片变厚变小[20]等生理生化和形态上的响应。然而,作为“云南高原特色农业”的小粒咖啡种植主要分布于云南干热区的山地、坡地,灌溉条件差,而且冬春干旱和夏秋间歇性干旱在云南咖啡种植区普遍发生,咖啡的产量和品质得不到保障。近年来,许多学者开展了咖啡的抗旱性生理生化特征研究[14-23],而缺乏通过叶片解剖结构定量分析多个品种间抗旱性差异的研究。本研究运用解剖学方法,研究特定生境下云南小粒咖啡现有主要品种叶片的抗旱性特征,以期为选育抗旱品种提供必要的理论依据。
1 材料与方法
1.1 材料
选用7个品种的小粒咖啡,分别为P7963,矮卡,铁毕卡,CCCA24,P2,德热169,德热296。取样地点位于云南省普洱市思茅区的云南省小粒咖啡良种苗木繁育基地(22°67′N,100°88′E;1 000~1 100 m)。实验用地位于东南坡,坡度为20 ℃。选择生长在同一水平阶上长势一致的6年生小粒咖啡为实验材料,种植密度为4 950株/hm2。實验地土壤为赤红壤,土层0~20 cm有机质3.07 g/kg,全C 13.69 g/kg,全N 1.35 g/kg,全P 0.38 g/kg,全K 2.30 g/kg。土壤容重为1.49 g/cm3,田间持水量为23.98%。实验地常规施肥分4次进行:第1次3月,过磷酸钙150 g/株;第2次6月,复合肥150 g/株,尿素100 g/株;第3次8月,复合肥150 g/株;第4次12月,有机肥6 000 g/株(由咖啡果皮和咖啡银皮堆沤而成),钙镁磷肥200 g/株。实验地采用滴灌供水(仅在旱季11月至翌年4月)。
2016年4月对目标树种取样,从至少5棵不同个体上采集5~10个成熟阳生叶片。叶片采下后立刻放入FAA(Formalin-acetic acid-alcohol,70%酒精90 mL+冰醋酸5 mL+福尔马林5 mL)固定,加入5 mL甘油以防止蒸发和材料收缩变硬。所有样品取样时间为晴天上午9 : 00~11 : 00 am。
1.2 方法
1.2.1 叶片的横切结构观察与测定 叶片横切需要避开主脉,采用徒手切片方法制作叶片的横切临时装片。在双筒光学显微镜(Leica DM2500,Leica-Microsystems,Wetzlar,Germany)下20倍和40倍下观察并拍照,每个叶片拍摄 5~7 个视野,共取25个重复。用 ImageJ(v.1.48;developed by National Institute of Mental Health,Bethesda,Maryland,USA)图形处理软件测定叶片厚度(Leaf thickness;LT)、角质层厚度(Cuticle thickness;CT),栅栏组织厚度(Palisade mesophyll thickness;PT)和海绵组织厚度(Spongy mesophyll thickness;ST),并计算叶片组织结构紧密度(Mesophyll structure tense ratio;MTR=PT/LT)和叶片组织结构疏松度(Mesophyll structure loosened ratio;MLR=ST/LT);所有样品测定在中国科学院西双版纳热带植物园热带森林重点实验室进行。
1.2.2 气孔特征 剪取叶片中部2~3 cm叶段,避开主脉把叶段分为两部分,用刀片轻轻刮去叶肉组织,观察下表皮气孔特征。因咖啡是典型的叶片下表皮气孔植物[20],取下表皮制成临时装片。每个叶片在显微镜40倍镜头下拍摄5~7个视野,共取25个重复。用ImageJ软件测出保卫细胞长度并数出单位面积内气孔数量,计算气孔密度(Stomatal density,SD)和气孔面积指数(Stomatal pore area index,SPI)。
1.2.3 小叶脉长度和叶脉密度 为了测量小叶脉密度,剪取叶片中部1 cm2的区域,25个重复。将剪下的样本放入盛有5%氢氧化钠溶液的试管中,置于恒温水浴槽(中国常州,诺基,DKZ-450B)中。水浴槽的温度设置在70 ℃,转速设置在每分钟60转。试管中的氢氧化钠溶液每天更换,直到叶肉组织被清除,叶脉显现出来为止。将处理过的样本在蒸馏水中浸泡30 min后制片装片,用光学显微镜DM2500观察并拍照。每个图片中叶脉的长度用图像处理软件ImageJ测量,叶脉密度(Vein density,VD)是单位面积内叶脉的总长度。
1.2.4 不同抗旱性指标的抗旱性评价 对7个品种的小粒咖啡的9项叶片解剖结构指标进行隶属函数值的计算,其公式[9]:
X(μ)=(X-Xmin)/(Xmax-Xmin)
式中μ为品种代号,X(μ)表示该品种的隶属函数值,X表示各指标的测定值,Xmax和Xmin分别表示各处理组所对应指标的最大和最小测定值。
1.2.5 綜合抗旱性排名 对所有抗旱性生理指标运用主成分分析方法,进行综合抗旱性评价。即用主成分分析法提取累计方差贡献率≥80%的公因子,计算小粒咖啡不同品种的公因子得分,再以各主成分的方差贡献率为权数,对所提取的得分进行加权求和,得到各品种的抗旱性综合评分。
1.3 数据处理和分析
采用单因素一元方差分析(One-Way ANOVA,Ducan test)来检验每一指标不同品种间的差异显著性。统计分析在SPSS 18.0软件中进行。
2 结果与分析
2.1 小粒咖啡植株叶片解剖特征比较和相关性分析
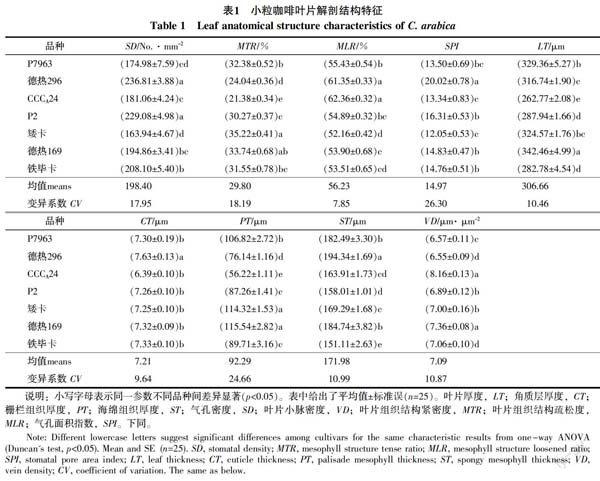
7个品种的小粒咖啡各解剖特征存在显著差异(表1)。在测定的9个叶片性状中,MLR为52.16%~62.36%,变异系数最小(7.85%);SPI为12.05%~20.02%,变异系数最大(26.30%);其余的性状变异系数介于9.64%~24.66%之间。P7963、矮卡和德热169的叶片和栅栏组织较厚,栅栏组织在叶片中的分配比例较高,使得这3个品种的MTR较高。而较高的海绵组织分配比例,使得德热296的MLR较高。叶表皮气孔密度差异显著,其中德热296的SD最高,为236.81 No./mm2,而矮卡的SD最低,为163.94 No./mm2。德热169和CCCA24的VD显著差异,但显著高于其他5个品种,其中德热296的VD最小,为6.55 μm/μm2。7个品种之间的CT变异较小,其中德热296的CT最厚,为7.63 μm,显著高于其它6个品种。
为了验证植物特征之间是否存在相关性关系,对叶片解剖性状的9个指标进行了两两分析并发现一些特征间存在显著的相关关系(表2)。比如,LT 与MTR之间显著正相关,与MLR之间显著负相关,说明随着LT的加厚,叶片的PT所占比例增加,ST所占比例减少。CT与LT和MTR存在极显著的正相关关系,与MLR呈极显著的负相关关系,说明随着叶片致密度和叶片厚度的增加,角质层厚度增加。VD与LT和MTR显著的负相关,与MLR显著的正相关,说明随着叶片厚度和栅栏组织比例的增加,单位叶片面积的叶脉变短。
2.2 不同抗旱指标下小粒咖啡抗旱性排序
运用隶属函数法对7个小粒咖啡的抗旱性进行了排序(表3),均值越大,表明抗旱性越强。其中德热169在CT,MTR和SD抗旱性优势强于其它品种,抗旱性强。P7963和矮卡分别在ST和LT上的表现出抗旱性优势,抗旱性较强。而CCCA24只有LT较有抗旱性优势,其它指标均表现出较弱的抗旱性。德热296,P2和铁毕卡分别在SPI,MLR,ST和VD上表现出抗旱优势,但其它指标抗旱性相对较弱。
2.3 主成分分析和小粒咖啡抗旱性综合排序
由表2可以看出,多数指标相关性达到显著相关性关系,过多地选入密切相关的指标,不利于揭示类型特征,选择彼此独立的有代表性的指标才能获得最优的方案。因此,为了更全面地评价小粒咖啡的抗旱性,对9个叶片解剖指标进行主成分分析。各指标在主成分中的载荷值越大,表明其对该主成分的贡献越大,典型性越强。由表4可以看出,前2个主成分能够解释9个叶片解剖性状总变异的63%,其中第一主成分对总变异的贡献率为39%,第二主成分的贡献率为24%。对第一主成分贡献较大的性状是MTR,PT和MLR,反映了叶片解剖结构中栅栏组织厚度和分配比例的信息;对第二主成分贡献较大的性状是SPI和SD,反映了气孔的分布信息。第三主成分中,ST因子载荷最高,反映了叶片海绵组织的状况。前3个主成分的累计方差贡献率为80.695%,基本能代表出7个小粒咖啡品种9个抗旱性解剖结构性状的重要信息。
将各因子载荷换算为规格化特征向量后,可以得到反映综合抗旱性的3个主成分表达式:
F1=-0.103x1+0.430x2-0.356x3-0.055x4+0.428x5+0.199x6+0.482x7+0.155x8-0.174x9;F2=0.382x1-0.246x2+0.362x3+0.470x4+0.267x5+0.136x6-0.073x7+0.517x8-0.208x9;F3=0.508x1+0.204x2-0.305x3+0.424x4-0.194x5+0.331x6+0.072x7-0.406x8-0.198x9。
将7个品种的小粒咖啡的9个叶片解剖指标的标准化值x1~x9分别代入3个表达式得出不同小粒咖啡的抗旱性综合得分(表5)。结果表明,德热169,P7963和矮卡综合得分分别为0.994、0.806、0.662,抗旱能力强;CCCA24和P2综合得分分别为-1.824和-0.388,抗旱能力较弱,且低于其它小粒咖啡品种。
3 讨论
发达的栅栏组织可避免干旱地区和旱季强烈光照对叶肉细胞中光合器官的损伤,栅栏组织越厚,栅栏组织与叶厚度的比值越大,则植物利用光能的效率越高。矮卡、德热169和P7963的PT和MTR显著高于其它4个品种,并在第一主成分中载荷最大,这和张义等[12]评价西宁园林植物抗旱性,王勇[24]等评价黄花蒿干旱耐受选择的指标相同,说明PT和MTR是评价植物抗旱性的重要指标。此外,小粒咖啡在空气CO2浓度和饱和光的条件下,其最大瞬时光合速率保持在4~11 μmol CO2/(m2·s),是树木中光合较低的一种常绿灌木[25]。但是根据小粒咖啡光合速率和胞间CO2浓度拟合曲线,预测小粒咖啡叶片的最大光合速率可超过20 μmol CO2/(m2·s)[25]。Batista[26]认为,小粒咖啡较低的光合速率,源于CO2在叶片中扩散阻力较大。矮卡和德热169叶肉栅栏组织较厚,且海绵组织相对减少,该特征有助于缩短 CO2从气孔下室到光合作用场所的传导距离,从而提高植物对水分的利用率,表现出较高的综合抗旱适应性。
在干旱环境下生长的植物,叶片经常表现出较高的气孔密度,而在潮湿或者光照较弱的环境下,植物倾向于拥有较大的气孔[27]。叶脈密度和气孔密度在应对湿度和光照的变化时表现出相同的趋势[28]。在本研究中,德热296的SD值分别高于综合抗旱性较强的矮卡44.45%,去掉表皮细胞大小的影响后,其SPI仍高于矮卡66.14%,VD差异不显著。高的气孔密度一方面使得单位叶片表面保卫细胞/表皮细胞的比例增加,另一方面单位面积的气孔更小,从而使得气孔可以较快速地应对环境因子变化[29]。且隶属函数分析也表明,德热296的SPI具有较强的抗旱性优势。
4 结论
总的说来,7个品种的小粒咖啡叶片解剖结构特征差异显著,隶属函数值也表明不同品种抗旱性优势指标不同。因此,7个品种的小粒咖啡在干旱条件的适应能力和抗旱机制不同。通过主成分分析法可知,PT、MTR是反映小粒咖啡抗旱能力较为敏感的叶片解剖性状,德热169综合抗旱能力最强。植物的抗旱性除了受到叶片形态解剖结构的影响,还与叶片内部生理生化活动和自身发育进程相关,也受到生境中环境条件的影响。本研究仅从叶片解剖水平对7个品种小粒咖啡的综合抗旱性进行了评价,有一定局限性。在今后的研究中,可从生物量分配、根系特征、细胞渗透调节和酶活性等多个抗旱性特征对多个品种进行深入的比较研究。对云南干热地区的特色经济作物小粒咖啡不同品种的叶片解剖优势抗旱特征及其它抗旱性特征的综合研究有助于选育抗旱新品质,培育新品种,将对保护脆弱的山地生态系统、合理持续利用植物资源具有重要的理论和指导意义。
参考文献
[1] Chaves M M, Pereira J S, Maroco J, et al. How plants cope with water stress in the field[J]. Photosynthesis and growth. Annals of Botany, 2002, 89: 907-916.
[2] 金 鹰, 王传宽. 植物叶片水力与经济性状权衡关系的研究进展[J]. 植物生态学报, 2015, 39: 1 021-1 032.
[3] Niklas K J. A mechanical perspective on foliage leaf form and function[J]. New Phytologist, 1999, 143: 19-31.
[4] 任 磊, 赵夏陆, 许 靖, 等. 4种茶菊对干旱胁迫的形态和生理响应[J]. 生态学报, 2015, 35: 5 131-5 139.
[5] 吴丽君, 李志辉, 杨模华, 等. 赤皮青冈幼苗叶片解剖结构对干旱胁迫的响应[J]. 应用生态学报, 2015, 26: 3 619-3 626.
[6] Brodribb T J, Feild T S, Sack L. Viewing leaf structure and evolution from a hydraulic perspective[J]. Functional Plant Biology, 2010, 37: 488-498.
[7] 杨 超, 梁宗锁. 陕北撂荒地上优势蒿类叶片解剖结构及其生态适应性[J]. 生态学报, 2008, 28: 4 732-4 738.
[8] 潘 昕, 邱 权, 李吉跃, 等. 基于叶片解剖结构对青藏高原25种灌木的抗旱性评价[J]. 华南农业大学学报, 2015, 61-68.
[9] Nautiyal S, Badola H K, Pal M, et al. Plant responses to water stress changes in growth, dry matter production, stomatal frequency, and leaf anatomy[J]. Biologia Plantarum, 1994, 36: 91-97.
[10] Sommerville K E, Gimeno T E, Ball M C. Primary nerve (vein) density influences spatial heterogeneity of photosynthetic response to drought in two Acacia species[J]. Functional Plant Biology, 2010, 37: 840-848.
[11] Sack L, Scoffoni C, McKown A D, et al. Developmentally based scaling of leaf venation architecture explains global ecological patterns[J]. Nature Communications, 2012, 3: 837.
[12] 张 义, 王得祥, 宋 彬, 等. 基于叶片解剖结构的西宁市11种城市森林植物抗旱性评价[J]. 西北农林科技大学学报: 自然科学版, 2014, 42: 86-92.
[13] 吴 枫, 陈爱国. 咖啡的庇荫[J]. 热带农业科学, 1999, 40-44.
[14] DaMatta F M, A R M Chaves, H A Pinheiro, et al. Drought tolerance of two field-grown clones of Coffea canephora[J]. Plant Science, 2003, 164: 111-117.
[15] Cai C T, Cai Z Q, Yao T Q, et al. Vegetative growth and photosynthesis in coffee plants under different watering and fertilization managements in Yunnan, SW China[J]. Photosynthetica, 2007, 45: 455-461.
[16] Dias P C, W L Araujo, G A B K. Moraes, et al. Morphological and physiological responses of two coffee progenies to soil water availability[J]. Journal of Plant Physiology, 2008, 164: 1 639-1 647.
[17] Matta, F M D, M Maestri, R S Barros. Photosynthetic performance of two coffee species under drought[J]. Photosynthetica, 1998. 34: 257-264.
[18] CAI, Z Q, Y J CHEN, Y H GUO, et al. Responses of two field-grown coffee species to drought and re-hydration[J]. Photosynthetica, 2005, 43: 187-193.
[19] Praxedes S C, F M DaMatta, M E Loureiro, et al. Effects of long-term soil drought on photosynthesis and carbohydrate metabolism in mature robusta coffee (Coffea canephora Pierre var. kouillou) leaves[J]. Environmental and Experimental Botany, 2006, 56: 263-273.
[20] Cavatte, P C, A A G Oliveira, L E Morais, et al. Could shading reduce the negative impacts of drought on coffee? A morphophysiological analysis[J]. Physiologia plantarum, 2012, 144: 111-122.
[21] 劉小刚, 徐 航, 程金焕, 等. 水肥耦合对小粒咖啡苗木生长和水分利用的影响[J]. 浙江大学学报(农业与生命科学版), 2014, 40: 33-40.
[22] 張珍贤, 王 华, 蔡传涛, 等. 施肥对干旱胁迫下幼龄期小粒咖啡光合特性及生长的影响[J]. 中国生态农业学报, 2015, 23: 832-840.
[23] Pinheiro H A, F M DaMatta, A R M Chaves, et al. Drought tolerance in relation to protection against oxidative stress in clones of Coffea canephora subjected to long-term drought[J]. Plant Science, 2004, 167: 1 307-1 314.
[24] 王 勇, 梁宗锁, 龚春梅, 等. 干旱胁迫对黄土高原4种蒿属植物叶形态解剖学特征的影响[J]. 生态学报, 2014, 34: 4 535-4 548.
[25] Silva E A, Damatta F M, Ducatti C, et al. Seasonal changes in vegetative growth and photosynthesis of Arabica coffee trees[J]. Field Crops Research, 2004, 89: 349-357.
[26] Batista K D, Araújo W L, Antunes W C, et al. Photosynthetic limitations in coffee plants are chiefly governed by diffusive factors[J]. Trees, 2012, 26: 459-468.
[27] Drake P L, Froend R H, Franks P J. Smaller, faster stomata: scaling of stomatal size, rate of response, and stomatal conductance[J]. Journal of Experimental Botany, 2013, 64: 495-505.
[28] Murphy M R C, Jordan G J, Brodribb T J. Acclimation to humidity modifies the link between leaf size and the density of veins and stomata[J]. Plant, Cell and Environment, 2013, 37: 124-131.
[29] Galmes J, Medrano H J. Photosynthetic limitations in response to water stress and recovery in mediterranean plants with different growth forms[J]. New Phytologist, 2007, 175: 81-93.

