敌百虫在乌鳢体内和水环境中的代谢动力学及残留研究
尹文林 姚嘉赟 盛鹏程 徐洋 潘晓艺 蔺凌云 沈锦玉


摘要 [目的]明确敌百虫在水产养殖中的安全性。[方法]全池泼洒0.5 mg/L敌百虫,采用气相色谱法测定敌百虫在乌鳢体内的代谢动力学和残留消除规律。[结果]乌鳢组织和水样中敌百虫的最低检测限为0.02 μg/mL。随着时间的延长,敌百虫在乌鳢血液中的浓度逐渐升高,120 h达最高,为0.072 mg/kg,至360 h时未检出。肌肉中12 h内未检出,24 h浓度为0.023 mg/kg,120 h检出最大浓度0.051 mg/kg,至288 h未检出。肝脏8 h未检出,12 h检出浓度为0.026 mg/kg。使用敌百虫后,乌鳢体内的药物残留量均低于我国的兽药最高残留限量要求,但在养殖水体中的残留时间较长,降解半衰期为35.19 h。[结论]为确保敌百虫使用后对水生态环境及食品安全,建议敌百虫使用后的休药期为150 ℃·d。
关键词 敌百虫;乌鳢;药代动力学;残留;休药期
中图分类号 S482.3 文献标识码 A 文章编号 0517-6611(2017)06-0041-02
Study on Metabolism and Residue Dynamics of Trichlorfon in Channa argus
YIN Wen-lin, YAO Jia-yun, SHENG Peng-cheng, SHEN Jin-yu* et al
(Agriculture Ministry Key Laboratory of Healthy Freshwater Aquaculture,Key Laboratory of Fish Health and Nutrition of Zhejiang Province,Zhejiang Institute of Freshwater Fisheries,Huzhou, Zhengjiang 313001)
Abstract [Objective] To study the safety of trichlorfon in aquaculture. [Method] The whole pool on 0.5 mg/L trichlorfon, the pharmacokinetics and residue elimination of trichlorfon in aquaculture water and Channa argus were determined by using the method of gas chromatography. [Result]
The minimum detection limit in tissue of and water samples was 0.02 ug/mL. With the extension of time, the blood concentration of trichlorfon in Channa argus increased gradually, the maximum concentration was 0.072 mg/kg at 120 h, and it was not detected at 360 h. The muscle tissue was not detected trichlorfon within 12 h, and the concentration of trichlorfon was 0.023 mg/kg at 24 h, the maximum concentration reached 0.051 mg/kg, and it was not detected at 288 h. The liver tissue was not detected trichlorfon within 8 h, and the concentration of trichlorfon was 0.026 mg/kg at 12 h. The drug residues of Channa argus were lower than the maximum residue limits of veterinary drugs in China, but the residual time in aquaculture water was longer, and the degradation half-life was 35.19 h.
[Conclusion]In order to ensure the use of trichlorfon water ecological environment and food safety, the study recommended withdrawal period was 150 ℃·d after using richlorfon.
Key words Trichlorfon;Channa argus;Pharmacokinetics;Residue elimination;Drug withdrawal period
敌百虫学名O,O-二甲基-(2,2,2-三氯-1-羟基乙基)膦酸酯,属有机磷类杀虫剂,是農业生产中运用广泛的杀虫剂之一。在淡水水产养殖生产中,敌百虫的药效和安全性较好,常用于驱杀三代虫、指环虫、中华鳋、线虫等,在苗种生产过程中杀灭枝角类、桡足类等[1-2]。杀虫机理是水解后的产物能与虫体的胆碱酯酶相结合,使虫体神经肌肉功能失常,先兴奋,后麻痹,直至死亡[3-5]。90%晶体敌百虫在生产中的使用剂量为0.2~0.5 mg/L,苗种用量减半。敌百虫对鱼类寄生虫具有高效、低毒等特点,使用时主要采用全泼洒、浸浴等方法。长期以来,有关敌百虫在水产动物体内的吸收、代谢和残留及其使用风险评估方面的研究较少。我国兽药标准和使用说明,敌百虫的休药期只能用500 ℃·d表示。为此,笔者研究敌百虫在养殖水体及乌鳢体内的代谢动力学和残留情况,旨在为全面评估敌百虫的使用风险提供科学依据。
1 材料与方法
1.1 材料
1.1.1 药品试剂。
试验用的晶体敌百虫由江苏南通江山农药化工厂生产,实测含量为(90.4±0.8)%。敌百虫的对照品购自中国兽药检验所,100 mg/瓶,编号为H0211104。
试验用丙酮和乙酸乙酯为色谱纯,甲苯、无水乙酸钠等试剂均为分析纯,分析用水为去离子水(≥18 MΩ)。
1.1.2 材料鱼。
试验鱼购自浙江省湖州市菱湖镇,规格为(265.3±11.4) g/尾,在水池中暂养7 d后开始试验,试验期间的水质:pH 7.37,水温(22±1) ℃,溶解氧>3.00 mg/L,氮氨含量0.05~0.15 mg/L,亚硝酸盐氮含量0.05~0.24 mg/L,符合GB 1167《渔业水质标准》;放养密度为1.5 m深的水池中 5~7尾/m2,符合NY 5165《无公害食品 乌鳢养殖技术规范》中池塘单养的技术要求。
1.1.3 仪器与设备。
Aglient 6890N 气相色谱仪,配FPD检测器;涡旋振荡器(国产);氮吹仪(国产);高速冷冻离心机(eppendorf 5424)。
1.2 试验方法
1.2.1 色谱条件。
VARIAV CP7821色谱检测柱(30 m×0.25 mm);升温程序:35 ℃保持1 min,20 ℃/min升到150 ℃,保持2 min。进样口温度180 ℃,载气流速 1.0 mL/min,尾吹29 mL/min,H2流速4.3 mL/min,空气流速175 mL/min,检测器温度300 ℃。
1.2.2 标准曲线和最低检测限。
取敌百虫对照品0.001 g,用甲苯溶解并定容至10 mL,配制成100 μg/mL的母液,依次用甲苯稀释成0.04、0.10、0.50、1.00、5.00、10.00、15.00、20.00 μg/mL的标准溶液,各标准溶液分别取1 μL进行气相测定。同时,以浓度为横坐标,峰面积为纵坐标做直线回归分析,分别求出回归方程和相关系数。以检测器产生的响应信号为噪声值(S/N)3倍时的量为最低检测限。
1.2.3 组织和水样中敌百虫的提取和净化。
将组织匀浆后,称取匀浆组织或血液0.50~2.00 g于25 mL具塞离心管中,加入乙酸乙酯10 mL,再加入1 g无水乙酸钠,充分混匀3 min后,将上层乙酸乙酯吸入50 mL离心管中,残渣继续用乙酸乙酯10 mL提取1次,合并2次乙酸乙酯提取液,氮吹仪吹至约3 mL,待净化。
敌百虫的净化采用酸性氧化铝固相萃取法,净化前用5 mL甲醇和5 mL纯化水活化,然后将提取液过固相萃取柱(1滴/s),再用5 mL乙酸乙酯淋洗(1滴/s),淋洗液在氮吹仪上吹干后,用1.0 mL甲苯溶出,0.22 μm滤膜过滤,取1 μL进样测定。
水样直接用酸性氧化铝柱固相萃取。固相萃取方法:酸性氧化铝柱用5 mL甲醇和5 mL纯化水活化后,取25 mL水样过柱(1滴/s),然后用5 mL乙酸乙酯淋洗(1滴/s),淋洗收集于50 mL离心管中,在氮吹仪吹干后,用1.0 mL甲苯溶出,0.22 μm滤膜过滤,取1 μL进样测定。
1.2.4 样品回收率。
取10尾乌鳢,将血液、肌肉、肝脏分别混合后,均分为20组,同时取500 mL养殖池水,均分成20组;其中10组用于本底的测定,另10组分别加入敌百虫标准溶液,使组织中敌百虫浓度为0.5 mg/kg,按“1.2.3”提取净化后,测定样品回收率和日间变异系数。
1.2.5 给药方法和样品采集。
乌鳢暂养7 d后,称取适量的晶体敌百虫,用池水溶解后,0.5 mg/L全池泼洒,用药后0.5、1.0、2.0、4.0、8.0、12.0、24.0、48.0、72.0、96.0 h及5、6、7、9、12、15、17、20 d分别采集5尾乌鳢和水样50 mL。
样品采集后,用纱布拭干,取血液、肌肉、肝等组织后,于-20 ℃保存,待测。水样则当天提取和净化,次日测定。
2 结果与分析
2.1 色谱条件
在该色谱条件下,敌百虫与杂质分离较好,基线平稳,峰形对称,出峰快,保留时间为5.49 min。
2.2 标准曲线和最低检测限
敵百虫在0.05~20.00 mg/L的浓度范围内,有良好的线性,回归方程为y=12 544x+239.21,R2=0.999 4(图1)。以检测器产生的响应信号为噪声值(S/N=3),最低检测限为0.02 μg/mL。
2.3 本底和样品回收率
测定的10尾乌鳢血液、肌肉、肝脏混合样品中均未检出敌百虫,这表明试验用乌鳢无敌百虫污染,可用于药代动力学和残留测定。
由表1可知,在乌鳢组织样品中平均回收率在80.60%~94.40%,日间变异系数为1.91%~4.47%。
2.4 敌百虫在乌鳢体内的代谢和残留
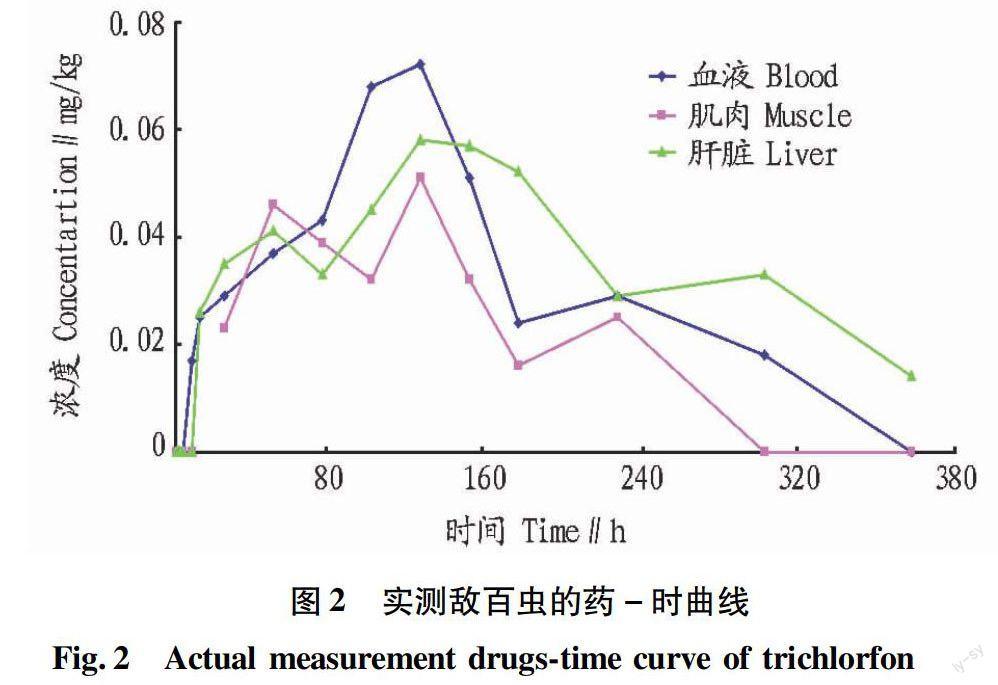
0.5 mg/L敌百虫全池泼洒后,乌鳢血液和组织中4 h内均未检出敌百虫。8 h后血液中敌百虫的检出浓度为0.017 mg/kg,之后逐日增高,120 h达到0.072 mg/kg(最高浓度),144 h开始逐日降低,至360 h未检出。肌肉中12 h内未检出敌百虫,24 h时检测0.023 mg/kg,120 h检出最大浓度0.051 mg/kg,144 h浓度开始下降,至288 h未检出敌百虫。而肝脏的情况较为复杂,8 h未检出敌百虫,12 h检出浓度为0.026 mg/kg,在48~168 h浓度在0.033~0.058 mg/kg,216 h肝组织中敌百虫迅速减少,至360 h未检出(图2)。
2.5 敵百虫在养殖水体中的降解
在pH为7.37,水温(22±1) ℃环境条件下,用90%晶体敌百虫全池泼洒后(敌百虫的浓度为0.45 mg/L)泼洒后,敌百虫在养殖水体中缓慢降解,降解公式为y=0.459 7e-0.020 3t,R2=0.990 4,降解半衰期为35.19 h(图3)。
3 讨论与结论
(1)在水产养殖生产中,敌百虫是最常用的渔用杀虫剂之一,具有使用时间长、使用效果稳定、对鱼类安全等特点,但由于我国渔用药物的研究主要集中在药效学和毒理学等方面,因此对敌百虫等常用渔用药物缺乏系统的使用风险评估。而敌百虫作为一种有机磷杀虫剂,可显著抑制乙酰胆碱酯酶活性[6]、诱导产生氧化损伤[7]、降低机体免疫力[8]等毒副作用,在水产动物、养殖水体和水域生态环境中的蓄积、迁移和残留有一定潜在风险,如对罗氏沼虾仔虾的96 h LC50仅为0.017 mg/L,对罗氏沼虾幼虾的96 h LC50为0.047 mg/L,因此敌百虫在水产动物、养殖水体和水域生态环境中的蓄积、迁移和残留存在着一定的潜在风险[7,9]。同时在使用上有一定的盲目性,如敌百虫在国标使用说明上标注的休药期为500 ℃·d。为此,对常用渔用药物的风险进行评估,降低水产动物体内的残留,提高水产品的品质具有重要意义,更重要的是要防止渔用药物对水域生态环境造成压力,在保护生态环境的前提下,合理高效地使用渔用药物。
(2)在敌百虫检测方面,基本采用“水产品中敌百虫残留量的测定——气相色谱法”等相应的国家标准、行业标准和地方标准。但在样品前处理上,国家标准采用乙腈水溶液提取后,用大剂量的三氯甲烷萃取净化,该方法使用的有机溶剂量较大,样品处理时间较长,而用固相萃取法,则可以对样品进行批量处理,样品的溶缩和净化速度快,适用于大批量的样品处理。这2种方法的色谱条件、精密度、检出限等均无明显差异。因此,建议在大批量样品处理较多时,采用固相萃取法,以节约样品处理时间。
(3)该研究表明,敌百虫0.50 mg/L全池泼洒,乌鳢体内的药物残留量符合我国食品兽药最高残留限量,但在养殖水体中的残留时间较长,降解半衰期为35.19 h,为确保敌百虫使用后的水生态环境及食品安全,建议敌百虫使用后的休药期为150 ℃·d。
参考文献
[1] 张学祖.飞速发展中的有机磷杀虫剂“敵百虫”[J].新疆农业科学,1959(2):70-72.
[2] 张为农.敌百虫供求趋势继续看好:2007年农业需求量有望突破万吨[J].农化新世纪,2005(12):23.
[3] 高希武,郭艳春.新编实用农药手册[M].郑州:中原农业出版社,2002:116-119.
[4] CRISP T M,CLEGG E D,COOPER R L,et al.Environmental endocrine disruption:An effects assessment and analysis[J].Environmental health perspectives,1998,106(S1):11-56.
[5] Office of Research and Development Washington,DC.Fact sheet,EPA special report on endocrine disruption[R].1997.
[6] 杨先乐,湛嘉,黄艳平.有机磷农药对水生生物毒性影响的研究进展[J].上海水产大学学报,2002,11(4):378-382.
[7] CHANG C C,LEE P P,LIU C H,et al.Trichlorfon,an organophosphorus insecticide,depresses the immune responses and resistance to Lactococcus garvieae of the giant freshwater prawn Macrobrachium rosenbergii[J].Fish & shelllish immunology,2006,20(4):574-585.
[8] FENG T,LI Z B,GUO X Q,et al.Effects of trichlorfon and sodium dodecyl sulphate on antioxidant defense system and acetylcholinesterase of Tilapia nilotica in vitro[J].Pesticide biochemistry and physiology,2008,92(3):107-113.
[9] TIAN S Z, LIU Z, WENG J H,et al. Growth of Chlorella vulgaris in cultures with low concentration dimethoate as source of phosphorus[J].Chemosphere,1997,35(11):2713-2718.
——白乌鳢

