地下水中溶解性硅、铁和锰的同步去除*
陶辉 赖连花 陈清 白新征
(1.河海大学 浅水湖泊综合治理与资源开发教育部重点实验室, 江苏 南京 210098;2.河海大学 环境学院, 江苏 南京 210098; 3.苏州立升净水科技有限公司, 江苏 苏州 215152)
GB 5749—2006《生活饮用水卫生标准》[1]中规定,饮用水中铁和锰两项指标的限值分别为0.3和0.1 mg/L.虽然该标准中未规定硅的限值,但研究表明高硅饮食的人群中发现局灶性肾小球肾炎、肾组织中含硅量明显增高的个体[2];长期过量摄取硅还会导致人体抗氧化功能降低,有可能使硅在泌尿系统堆积,生成尿结石[3].当生活用水中的硅含量达到一定值时,管道、厨房等处的水滴蒸发会形成白斑(主要由硅、少量碳酸钙及其他矿物质组成),影响用水质量[4],因此硅在水中的含量越来越受到关注.而铁元素摄入过量时,会在体内大量积累,引起胰腺、肝脏和皮肤的损坏,导致糖尿病和各种皮肤病甚至心脏病的发生[5- 6].锰元素摄入过量时,易引发佝偻病以及中枢神经系统、呼吸系统方面的疾病[7- 8];当水中铁锰过量时,洗涤衣服时会生成锈色斑点,在光洁的卫生用具上以及与水接触的墙壁和地板上都能着上黄褐色斑点,甚至影响产品质量[9].因此,地下水中硅、铁、锰元素的含量控制应引起重视.
目前,水中硅的去除方法主要有化学混凝除硅[10- 14]、离子交换除硅[15]和超滤除硅[15]等.混凝除硅主要是利用某些金属氧化物或氢氧化物与硅的吸附、凝聚或絮凝来达到除硅的目的.铁和锰的去除方法主要有氧化法[9,15- 16]、吸附法[9,17- 18]、化学混凝法[9,11]、超滤膜法[19]和生物滤池法[20- 21].文中针对某地地下水中硅、铁和锰含量均较高的情况,考虑控制处理成本及简化运行管理两方面的因素,结合硅、铁和锰的去除机理,选择氧化法、曝气+混凝法开展地下水中硅、铁和锰的同步去除试验研究.
1 材料及方法
1.1 试验材料
试验中所采用的主要化学试剂包括硅酸钠、硫酸亚铁、硫酸锰、氢氧化钙、三氯化铁、氧化镁、钼酸铵和草酸等,均为分析纯.
经检测某地地下水中污染物主要为硅、铁、锰,其中溶解性硅酸盐含量(以SiO2计)为50~60 mg/L,铁含量为0.8~1.0 mg/L,锰含量为0.4~0.6 mg/L,pH值为7.0~7.5.由于该地区较为偏远,不具备相关的试验及检测设备,故试验中采用去离子水为本底,根据原水水质特性配制所需水样,通过实验室小试试验开展相关研究.所配制水样的水质指标见表1.

表1 所配制水样的水质指标
1.2 方法
1.2.1 试验方法
由于地下水中的铁和锰以二价离子状态存在,在进行混凝试验前先对水样进行如下氧化处理:曝气氧化或投加次氯酸钠氧化30 min.为充分氧化水中的二价铁和锰,气水体积比设为15∶1,保证曝气结束后溶解氧含量大于6 mg/L.混凝、沉淀试验使用深圳市中润水工业技术发展有限公司生产的ZR4- 6型六联混凝实验搅拌机,搅拌杯容量为1 L.搅拌程序分3个阶段:第1阶段以300 r/min快搅30 s;第2阶段以150 r/min慢搅15 min;第3阶段为静沉阶段,静沉时间为30 min.加入水样和相应的混凝剂后,开启搅拌装置,程序运行结束后,从每个烧杯中取适量上清液测定浊度,并取200 mL上清液经定性滤纸过滤后测定浊度、pH值和硅、铁、锰含量.
1.2.2 测试方法
水样中的二氧化硅含量按SL 91.1—1994《二氧化硅(可溶性)的测定(硅钼黄分光光度法)》[22]进行;铁、锰含量按GB 5750—2006《生活饮用水标准检验方法》的要求采用ICP法测定;浊度采用美国Hach公司产2100N型台式浊度仪测定;pH值采用德国季尔国际贸易(上海)有限公司产赛多利斯PB- 10型酸度计/pH计测定.
2 结果与讨论
2.1 曝气+三氯化铁同步去除硅、铁和锰的效能
曝气+三氯化铁混凝技术对水中溶解性硅、铁和锰的去除效能及相应的pH值变化情况、出水浊度变化情况分别如图1、2所示.可见:曝气+三氯化铁技术对水中的硅、铁、锰和浊度具有一定的去除效果;FeCl3投加量(以Fe3+计,下同)达到16.8 mg/L时,硅、铁、锰的去除率仅分别达到12.6%、10.1%、38.6%;继续增大FeCl3投加量,硅和锰的去除率呈下降趋势,而铁的去除率基本稳定,出水浊度均小于0.5 NTU;随着FeCl3投加量的增大,水样的pH值逐渐由7.4降至5.8,此时水中的硅主要以H2SiO4形态存在,对硅的去除产生了不利影响,同时pH值的降低也会对铁和锰的氧化产生不利影响.
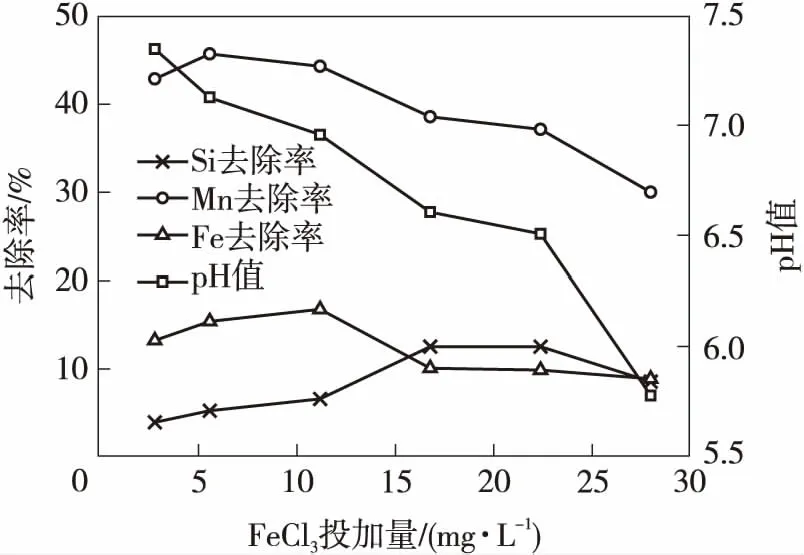
图1 FeCl3投加量对溶解性硅、铁、锰的去除效果及pH值随FeCl3投加量的变化
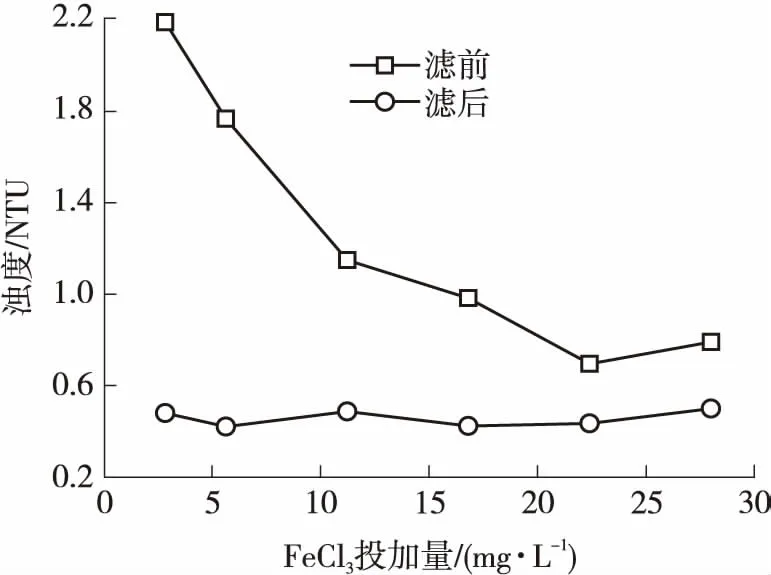
图2 FeCl3投加量对浊度的影响
水中溶解氧对Fe2+的氧化速率可以用式(1)表达.随pH值下降,Fe2+的氧化速率呈下降趋势,一般认为曝气氧化除铁过程只有在水呈中性或碱性时才可顺利进行.Mn2+氧化过程与Fe2+类似,但Mn2+的氧化对pH值的变化更为敏感,一般情况下,曝气除锰过程只有在水的pH值高于9.0时才可顺利进行.
(1)
式中,K为速率常数,t为反应时间.
随FeCl3投加量增大,水的pH值降低;当FeCl3投加量仅为5.0 mg/L时,水的pH值已降低至7.0左右;而当投加量增大至25.0 mg/L时,水的pH值已降低至6.0左右,因此严重影响了铁和锰的氧化及去除.
2.2 次氯酸钠+三氯化铁同步去除硅、铁和锰的效能
溶解氧对水中Fe2+和Mn2+的氧化受pH值影响较大,而NaClO是另一种常用于氧化水中少量Fe2+和Mn2+的氧化剂,且其受pH值的影响较小.薛长安等[16]认为,通过NaClO预氧化完全可以达到除铁、除锰的效果.因此文中研究了NaClO氧化+FeCl3混凝技术对水中溶解性硅、铁和锰的同步去除效果,FeCl3投加量为16.8 mg/L,结果如图3、4所示.
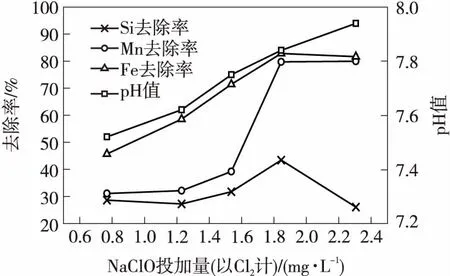
图3 NaClO投加量对溶解性硅、铁、锰的去除效果及pH值随NaClO投加量的变化
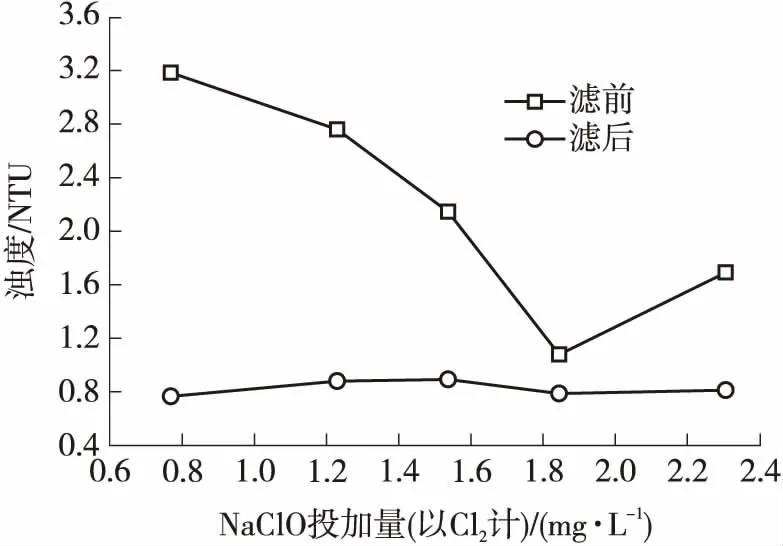
图4 NaClO投加量对浊度的影响
由图3可见,投加NaClO后,水中的溶解性硅去除率呈先上升后下降的趋势,铁、锰的去除率则是先上升,之后随着NaClO投加量的继续增大趋于稳定.通过理论计算可知,完全氧化水样中的铁、锰所需的NaClO量共约为1.6 mg/L(以Cl2计,余同),试验中分别以0.5、0.8、1.0、1.2、1.5倍完全氧化水中铁、锰的NaClO投加量进行,结果显示:当NaClO投加量约为1.9 mg/L时处理效果最好,此时水中溶解性硅、铁、锰的去除率分别为43.4%、82.9%、79.7%,剩余铁、锰的含量分别为0.19和0.10 mg/L,符合GB 5749—2006《生活饮用水卫生标准》的要求.但是,NaClO+FeCl3混凝技术对水中溶解性硅的去除率仍不理想,最高去除率仅为43.4%,出水残余硅含量仍高达30 mg/L左右.
图4为不同NaClO投加量下水中浊度的变化.可见,随着NaClO投加量的增大,沉淀后(滤前)水样浊度先减小后上升,而经定性滤纸过滤后浊度均在0.9 NTU以下.
2.3 曝气+氢氧化钙同步去除硅、铁和锰的效能
Ca(OH)2也是一种常见的除硅药剂,其呈碱性,使用后会造成水的pH值升高,从而避免采用FeCl3时带来的pH值下降并进而影响铁和锰去除的问题,因此,文中考察了曝气+Ca(OH)2技术对水中溶解性硅、铁和锰的同步去除效果,结果如图5、6所示.
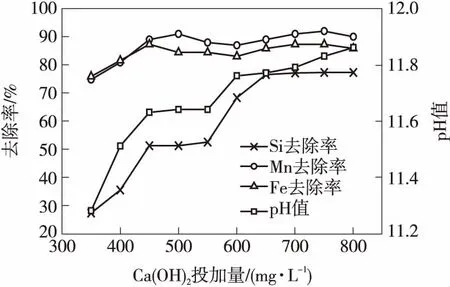
图5 Ca(OH)2投加量对硅、铁、锰的去除效果及pH值随Ca(OH)2投加量的变化
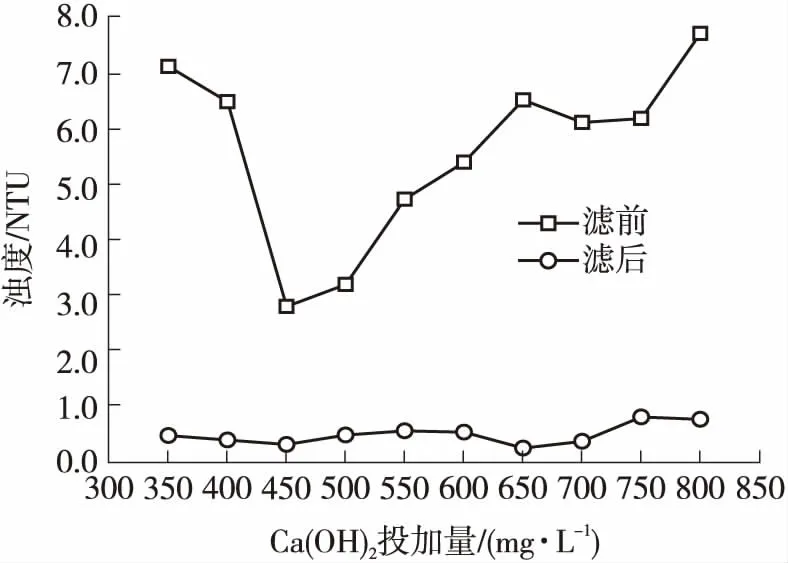
图6 Ca(OH)2投加量对浊度的影响
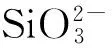
大量或过量的Ca(OH)2固体可以保证溶液的氢氧化钙量处于该温度下的饱和溶解度,维持反应向右进行并最终达到平衡[14].而投加Ca(OH)2后水样呈碱性(pH>11),有效地加快了Fe2+和Mn2+的氧化速率,并强化了二者的去除.
由图5还可以看出,当Ca(OH)2投加量达到500 mg/L时,硅、铁、锰的同步去除率分别为51.2%、84.3%、90.9%,均高于采用次氯酸钠+FeCl3混凝时的情况.但应注意到,采用曝气+Ca(OH)2技术后出水pH值处于较高水平,超过了GB 5749—2006《生活饮用水卫生标准》的要求,需进行酸化处理后才能正常使用.
图6为不同Ca(OH)2投加量下水中浊度的变化.可见,随着Ca(OH)2投加量的增大,滤前浊度去除率出现先升高后降低的现象.这是因为原水中ζ电位为负,当大量Ca2+涌入吸附层以致扩散层变薄甚至消失时,ζ电位减小,胶体开始产生明显的聚集和沉淀,出水浊度降低.随Ca(OH)2投加量的增大,混凝后的絮体电荷重新分布,小絮体表面电荷比混凝前均匀,小絮体之间自由电荷排斥,降低了它们的碰撞过程[23];并且Ca(OH)2在水中的溶解度不大,随着其投加量的增大,部分Ca(OH)2颗粒悬浮在水中,导致水中浊度增大.经定性滤纸过滤后浊度大大降低,大部分在0.2~0.9 NTU之间.
2.4 曝气+三氯化铁/氢氧化钙同步去除水中硅、铁和锰的效能
根据2.1和2.3节试验结果,考察了在曝气后采用FeCl3和Ca(OH)2复配絮凝剂同步去除水中硅、铁和锰的效果.根据2.3节的试验结果,选取除硅效果较好的Ca(OH)2含量(即500 mg/L)作为不变因素,复配不同含量的FeCl3进行试验,结果如图7所示.由图可知:随着FeCl3投加量的增大,硅和锰的去除率较不投加铁盐时有所增加,硅的去除率从仅投加Ca(OH)2时的68.2%增加到FeCl3含量为16.8 mg/L时的76.8%,之后随着铁盐的继续投加,硅的去除率变化不大;锰的去除率从仅投加Ca(OH)2时的90.9%增至铁盐质量浓度为16.8 mg/L时的97.8%,之后随着铁盐的继续投加,锰的去除率可达99.1%,在pH值约为9.2时其去除率基本保持不变,这与以前的研究结果一致[11];铁的去除率随着FeCl3投加量的增大先有小幅度的增加,随后呈下降趋势,这可能是由于FeCl3复配量增大所致.而随着FeCl3复配量增大,出水pH值呈不断下降的趋势,当FeCl3复配量达22.4 mg/L时,出水pH值为8.5,浊度为0.65 NTU,满足GB 5749—2006《生活饮用水卫生标准》的要求,同时对硅、铁和锰的去除效果(出水残余硅含量为13.74 mg/L、铁含量为0.15 mg/L、锰含量为0.005 mg/L)亦优于不复配FeCl3时的情况.
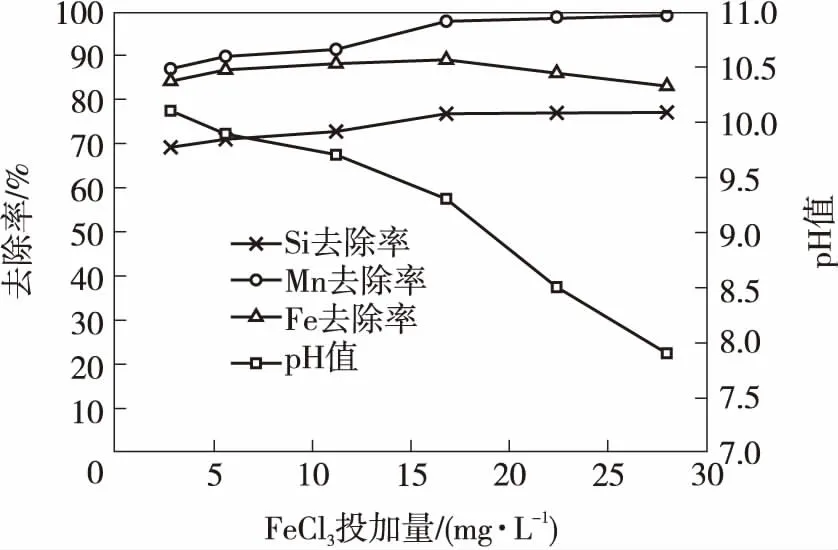
图7 Ca(OH)2含量为500 mg/L时FeCl3投加量对硅、铁、锰的去除效果及pH值随FeCl3投加量的变化
图8为Ca(OH)2投加量为500 mg/L、复配不同含量的FeCl3时出水浊度的变化.可以看出,滤后水浊度较低,增加铁盐后强化了絮凝过程,细小的CaSiO3形成了可经过滤去除的絮体(滤后水浊度低于0.71 NTU),从而强化了对硅的去除.
图8 Ca(OH)2含量为500 mg/L时FeCl3投加量对浊度的影响
2.5 次氯酸钠+氢氧化钙同步去除水中硅、铁和锰的效能
NaClO氧化+Ca(OH)2技术同步去除水中硅、铁和锰的效能如图9所示,对浊度的影响如图10所示.随着NaClO/Ca(OH)2投加量的增大,硅、铁、锰的去除率基本上呈增加的趋势,且较2.2和2.3节所述情况有所提高,当NaClO/Ca(OH)2投加量为1.2/550(单位均为mg/L)时,硅、铁、锰的去除率分别达到75.0%、88.0%、97.0%,水中硅、铁、锰的含量降至约15.00、0.10、0.02 mg/L,与2.4节所述情况一致.但采用NaClO+Ca(OH)2技术处理后的水样呈碱性(pH>11),需经酸化处理后才能正常使用.由图10可知,随着NaClO/Ca(OH)2投加量的增大,沉淀后出水浊度逐渐增大,但滤后水浊度均小于0.52 NTU,对浊度有较好的去除效果.
图9 NaClO/Ca(OH)2投加量对硅、铁、锰的去除效果及pH值随投加量的变化
图10 NaClO/Ca(OH)2投加量对浊度的影响
2.6 不同处理方案的比较
根据前述几种处理方案对目标物质的去除效果,在出水铁含量(≤0.3 mg/L)、锰含量(≤0.1 mg/L)、浊度(<1 NTU)均达到饮用水生活标准的前提下,对3种方案的试剂投加量及处理费用(不包括后续pH处理费用)进行比较,结果见表2.可见,曝气+Ca(OH)2/FeCl3方案的出水pH值最低,硅去除率最高,且后续投加量的少量增大能较大程度地提高硅、铁、锰的去除率并降低pH值,后续处理费用小于另外两种方案.
表2 3种处理方案的对比
3 结论
文中通过对地下水中溶解性硅酸盐、铁和锰的同步去除试验研究,得到以下结论:
(1)采用曝气氧化方法时,将三氯化铁作为混凝剂会导致水样pH值大幅下降,从而影响铁和锰的去除,同时除硅效果也较差;采用氢氧化钙作为混凝剂时,能够实现硅、铁和锰的同步去除,但出水呈碱性,不符合水质要求;而复配氢氧化钙/三氯化铁作为混凝剂时,能够进一步强化硅、铁和锰的同步去除,同时出水pH值也符合水质要求.
(2)采用次氯酸钠作为氧化剂、三氯化铁作为混凝剂时,可有效去除铁和锰,但对硅的去除效果较差;采用采用次氯酸钠作为氧化剂、氢氧化钙作为混凝剂时,可实现硅、铁和锰的同步去除,但出水呈碱性,不符合水质要求.
(3)综合考虑对硅、铁、锰的去除效果,采用次氯酸钠作为氧化剂、氢氧化钙作为混凝剂以及采用曝气氧化方法、复配氢氧化钙/三氯化铁作为混凝剂两种方案均可行,但前者出水pH值较高,会增加后续处理成本,故建议采用曝气+氢氧化钙/三氯化铁复配混凝剂作为同步去除地下水中硅、铁和锰的方法.当氢氧化钙投加量为500 mg/L、三氯化铁投加量为22.4 mg/L时,出水残余硅、铁和锰的含量分别为13.74、0.15和0.005 mg/L,浊度为0.65 NTU,pH值为8.5,符合GB 5749—2006《生活饮用水卫生标准》的要求.
:
[1] 生活饮用水卫生标准:GB 5749—2006 [S].
[2] 侯建明.硅的生理作用研究近况 [J].河北中医学院学报,1995,10(4):38- 39.
HOU Jian-ming.Research on the physiological role of silicon [J].Journal of Hebei Traditional Chinese Medicine and Pharmacology,1995,10(4):38- 39.
[3] 吴茂江.硅与人体健康 [J].微量元素与健康研究,2012,29(2):65- 67.
WU Mao-jiang.The relationship between silicon and human health [J].Studies of Trace Elements and Health,2012,29(2):65- 67.
[4] BOOTH Stephen,FRIEDMAN Melinda Friedman.Distribution system water quality evaluation:final-silica white paper [R].Longview:[s.n.],2014:1- 16.
[5] QIN S,MA F,HUANG P,et al.Fe(Ⅱ) and Mn(Ⅱ) removal from drilled well water:a case study from a biological treatment unit in Harbin [J].Desalination,2009,245(1):183- 193.
[6] BEAL E J,HOUSE C H,ORPHAN V J.Manganese and iron dependent marine methane oxidation [J].Science,2009,325(5937):184- 187.
[7] SHARMA S,KAPPELHOF J,GROENENDIJK M,et al.Comparison of physicochemical iron removal mechanisms in filters [J].Aqua,2001,50(4):187- 198.
[8] MAZUELOS A,PALENCIA I,ROMERO R,et al.Ferric iron production in packed bed bioreactors:influence of pH,temperature,particle size,bacterial support material and type of air distributor [J].Minerals Engineering,2001,14(5):507- 514.
[9] 杨启峰,李鑫,刘秀芝.地下水中铁、锰的危害及去除方法 [J].黑龙江环境通报,1999,23(4):47- 48.
YANG Qi-feng,LI Xin,LIU Xiu-zhi.The harmfulness of Fe and Mn in groundwater and the basic method of Fe and Mn removal when in traditional treatment [J].Heilongjiang Environmental Journal,1999,23(4):47- 48.
[10] HERMOSILLA Daphne,ORDONEZ Ruth,BLANCO Laura,et al.Ph and particle structure effects on silica removal by coagulation [J].Chem Eng Technol,2012,35(9):1632- 1640.
[11] SHEIKHOLESLAMI R,BRIGHT J.Silica and metals removal by pretreatment to prevent fouling of reverse osmosis membranes [J].Desalination,2002,143(3):255- 267.
[12] AI-REHAILI Abdullah M.Comparative chemical clarification for silica removal from RO groundwater feed [J].Desalination,2003,159(1):21- 31.
[13] LATOUR Isabel,MIRANDA Ruben,BLANCO Angeles.Silica removal with sparingly soluble magnesium compounds:partⅠ [J].Separation and Purification Technology,2014,138:210- 218.
[14] LATOUR Isabel,MIRANDA Ruben,BLANCO Angeles.Silica removal with sparingly soluble magnesium compounds:part Ⅱ [J].Separation and Purification Technology,2015,149:331- 338.
[15] CHENG Hsuhui,CHEN Shiaoshing,YANG Shuru.In-line coagulation/ultrafiltration for silica removal from brackish water as RO membrane pretreatment [J].Separation and Purification Technology,2009,70(1):112- 117.
[16] 薛长安,王娟珍,王志勇.次氯酸钠应用于地下水除铁锰试验研究 [J].海峡科技与产业,2013(7):60- 61.
XUE Chang-an,WANG Juan-zhen,WANG Zhi-yong.The application of sodium hypochlorite in the removal of Fe and Mn in groundwater [J].Technology and Industry Across the Straits,2013(7):60- 61.
[17] AKINWEKOMI Vhahangwele,KEFENI Kebede K,MAREE Jannie P,et al.Integrated acid mine drainage treatment using Mg(OH)2or Mg(HCO3)2and Ca(OH)2:implications for separate removal of metals and sulphate [J].International Journal of Mineral Processingy,2016,155:83- 90.
[18] KAMARUDZAMAN Ain Nihlan,CHAY Tay Chia,AMIR Amnorzahira.Biosorption of Mn(Ⅱ) ions from Aqueous Solution byPleurotusspent mushroom compost in a fixed-bed column [J].Procedia-Social and Behavioral Sciences,2015,195:2709- 2716.
[19] 郭绍东,梁恒,陈杰,等.超滤膜组合工艺处理含铁地下水的效能 [J].中国给水排水,2014,30(17):5- 8.
GUO Shao-dong,LIANG Heng,CHEN Jie,et al.Efficiency of membrane combined process for treating iron-containing groundwater [J].China Water & Wastewater,2014,30(17):5- 8.
[20] BAI Y H,CHANG Y Y,LIANG J S,et al.Treatment of groundwater containing Mn(Ⅱ),Fe(Ⅱ),As(Ⅲ) and Sb(Ⅲ) by bioaugmented quartz-sand filters [J].Water Research,2016,106:126- 134.
[21] CAI Y,LI D,LIANG Y W,et al.Effective start-up biofiltration method for Fe,Mn,and ammonia removal and bacterial community analysis [J].Bioresource Technology,2016,176(16):149- 155.
[22] 二氧化硅(可溶性)的测定(硅钼黄分光光度法):SL 91.1—1994 [S].
[23] 杜文婷,王兵,刘光全,等.化学混凝法同步除炼油污水中硅和浊度的研究 [J].石油与天然气化工,2014,43(3):326- 329.
DU Wenting,WANG Bing,LIU Quanguang,et al.Removal of silicon and turbidity from oil refinery effluent by chemical coagulation progress [J].Chemical Engineering of Oil & Gas,2014,43(3):326- 329.

