Myceliophthora thermophila 漆酶与木质素模型物的对接研究
刘浩 孙见良 Puneet K. SINGH 杨文萍 付时雨
(1.华南理工大学 轻工科学与工程学院, 广东 广州 510640; 2.华南理工大学 数学学院, 广东 广州 510640)
漆酶(EC 1.10.3.2)是一类直接催化氧化酚类化合物成为游离基、同时还原O2成H2O的含铜多酚氧化酶.漆酶具有合成与降解双重作用,一方面,漆酶氧化生成的游离基通过非催化偶联作用生成聚合物,这是植物合成木质素和昆虫合成色素的重要途径[1];另一方面,真菌和少数细菌的漆酶利用小分子酚类底物作为天然介体,在体外降解木质素,这是生态系统碳循环的一个关键环节[2].漆酶的催化依赖其4个Cu离子组成的活性中心,其中T1Cu离子是还原性底物的氧化位点,有蓝光(600 nm)吸收,呈电子顺磁性;T2Cu离子没有可见光吸收,也是电子顺磁特征;T3Cu离子有2个,皆呈电子反磁性,它们与T2Cu离子组成三核铜簇,这是O2捆绑与还原的位点[3].4个Cu离子与高度保守的氨基酸残基结合,底物在T1Cu离子附近失去电子成为游离基,电子经T1Cu离子和三核铜簇传递给O2,后者最终还原成H2O[3- 4].
近年来,借助于分子模拟技术,人们对漆酶催化机理的研究不断深入.在酶与配体相互作用方面,Chen等[5]将木质素单体与Trametesversicolor(Tve)漆酶对接,计算得到的结合能因底物结构不同而变化很大,推测是疏水作用而非氢键在特异性结合中起主要作用.Zhang等[6]的研究表明,苯酚通过氢键和疏水作用结合到Tve漆酶活性口袋中,而Triton X- 100与漆酶仅存在疏水作用,这种作用促进了漆酶对水体中苯酚的催化降解.在空间位阻效应方面,Prasad等[7]发现有些染料具有平面芳环结构且分子尺寸大,因空间位阻而不能接近T1活性口袋,因而无法有效捆绑.Awasthi等[8]比较了Tve漆酶、植物漆酶与木质素模型物对接的差异,发现配体与Tve漆酶结合较稳定,四聚体仍能粘连在Tve漆酶活性口袋区,在植物漆酶上则随时间变化逐渐从活性口袋区向外移出.通常配体的疏水(如—OCH3)和亲水性官能团(如—COOH)决定其进入活性口袋的方向及捆绑的位点,但至今在漆酶分子模拟中关于官能团因素还未得到研究.
分子模拟还常用于预测未知酶的结构与功能、辅助分析酶的底物谱宽、筛选稳定剂和抑制剂、指导定向进化[9].现有报道集中于细菌和担子菌的漆酶,仅Melanocarpusalbomyces(Mal)、Thielaviaterrestris等少数几种子囊菌的漆酶得到了研究,其二级结构(特别是在底物捆绑口袋附近)与担子菌漆酶存在显著差异[10- 11],因此有必要对子囊菌漆酶进行更广泛的结构研究.Myceliophthorathermophila(Mth)也是一种重要的产漆酶子囊菌,由Aspergillussp.表达的Mth漆酶已在Novozyme A/S公司商品化生产,该酶耐热性好,pH适宜范围宽,在纸浆漂白、废纸脱墨和纤维改性等方面的应用已趋成熟[12- 13],但Mth漆酶的结构及与木质素模型物的相互作用尚未见报道.文中运用同源模建技术构建Mth漆酶的3D模型,然后与木质素模型物进行分子对接,探讨甲氧基、羧基和单体同键型(β-O- 4)聚合度对底物在T1活性口袋区捆绑的影响.
1 材料与方法
1.1 蛋白质序列比对
从专利US7622287B2[14]中获得Mth漆酶序列,编号MthNov.根据资料,含Mth漆酶基因的质粒被克隆到Aspergillusoryzae中,再经诱变育种得到高产菌株[15],用于商品酶生产.另从NCBI Protein Database获得2份Mth漆酶序列,Accession ID分别是AEO58496(含616个氨基酸残基,文中编号为Mth616)和 AEO54598(595个残基,文中编号为Mth595).将MthNov、Mth616、Mth595与13种真菌漆酶的序列上传至Clustal Omega在线工具做多序列比对,使用MEGA 6 软件建立系统发育树.
1.2 同源模建
将目标蛋白质的FASTA序列文件提交到Swiss-Model在线服务器,系统自动生成模板列表后,选择一致性较好的模板构建3D模型结构.分别用Swiss-Model提供的模型质量复合评分函数(QMEAN4)、全球性模型质量估测函数(GMQE)以及Ramachandran Plot在线软件对模型的可靠性进行评估.
1.3 分子对接
从PubChem数据库下载木质素单体模型物的3D构象文件,并使用Chimera转换为PDB格式.参考美国农业部林产品实验室提供的木质素模型物数据库[16],用ChemBio3D Ultra 14.0按最稳定构象绘制木质素二聚体和寡聚体的3D模型.在Autodock v.1.5.6软件中进行分子对接,将中心设置在漆酶的T1Cu格点附近(0.728,5.862,13.760),x、y、z值分别为70、126和70,保持Spacing值为0.375.最终对接的结果保存为DLG文件.在Autodock软件中分析可能的对接位点,选择能量最低的结合方式,保存为PDBQT文件,在Chimera和Ligplot v.1.4.5软件中分别显示底物在活性口袋的捆绑及与氨基酸残基的相互作用.
2 结果与分析
2.1 氨基酸序列比对
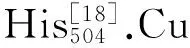
“*”表示完全一致,“:”表示相似度高,“.”表示相似度较低
分析Mth漆酶与其他真菌漆酶的同源性,得到系统发育树(如图2所示).M.thermophila与M.albomyces、Thielaviaarenaria亲缘关系最近,在发育树中处于同一分枝,在分类学上同属子囊菌纲粪壳菌目毛壳科.与毛壳科许多种属相似,M.thermophila也是一类嗜热营腐生菌,在细胞外分泌漆酶、纤维素酶、木聚糖酶,分解木质纤维素能力强[21].另外,子囊菌纲柔膜菌目核盘菌科的BotrytisAclada与M.thermophila的亲缘关系也很近,它们都能通过产生木质纤维素降解酶破坏植物组织,进而引起严重的植物病害[22].

图2 M. thermophila漆酶的系统发育树
对3个Mth漆酶序列进行比较可以看出,MthNov和Mth616最接近,完全一致的氨基酸残基占MthNov残基总数的97.9%,二者最显著的差异是Mth616的N端比MthNov多了47个氨基酸,因此,专利US7622287B2[14]公开的MthNov序列是可靠的.但Mth595与MthNov相差甚远,它们完全一致的氨基酸仅占MthNov残基数的30.9%,由此推测,Mth595序列可能不是M.thermophila漆酶的序列.
2.2 同源模建
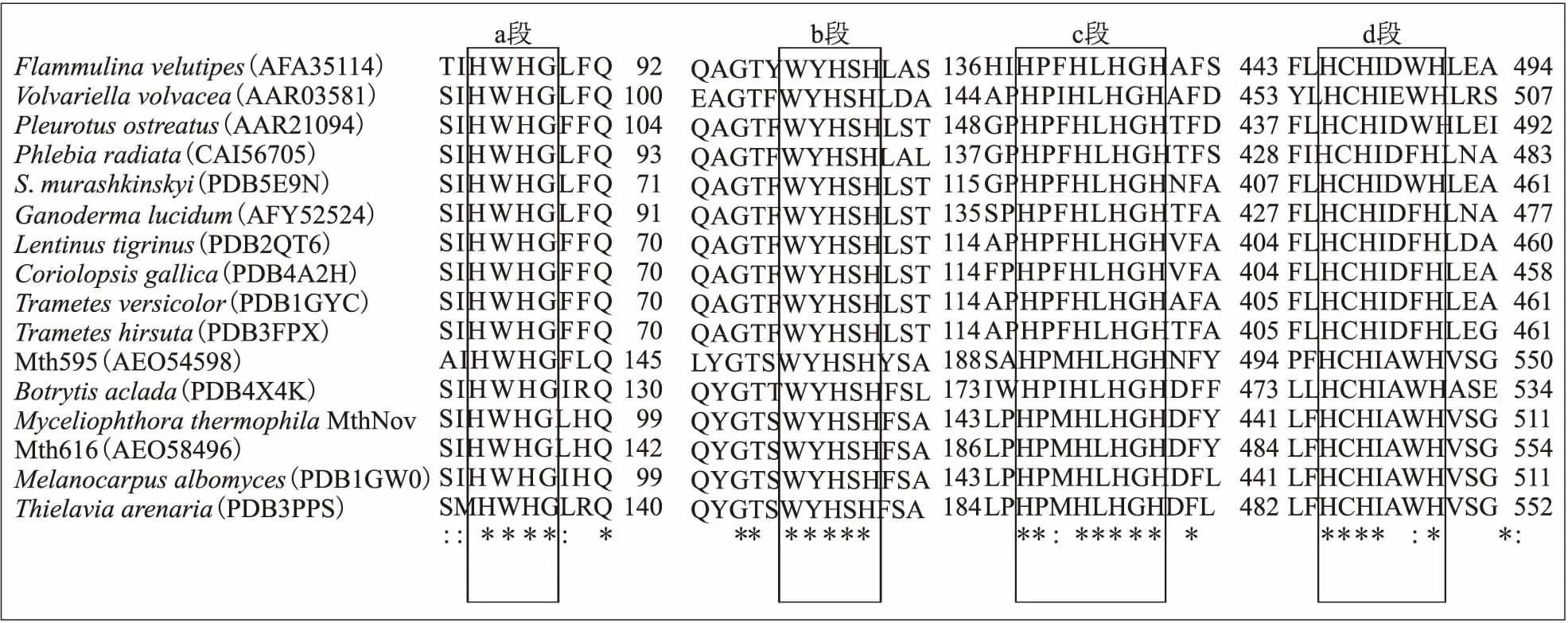
将氨基酸序列提交到Swiss-Model在线程序后,服务器筛选出模板并按Identity值排列.模板1gw0和3dkh得分最高,与MthNov的一致性超过74%,高于专利US7622287B2[14]用的Coprinuscinereus漆酶模板得到的分数(56.5%).1gw0和3dkh都是Mal漆酶,与Mth漆酶亲缘关系近,1gw0是原株产生的单体蛋白[10],3dkh是变异株基因表达在Saccharomycescerevisiae中产生的同源二聚体[18].文中以1gw0作为模板来生成Mth漆酶(MthNov)的3D结构(见图3(a)),其中α螺旋和β折叠的氨基酸数分别为62和173.由于序列相似度高,MthNov Cu离子结合区和模板1gw0也高度一致,T1Cu离子结合位点也是His431、Cys503和His508,T1Cu活性口袋(见图3(b))呈“回旋镖”或“》”形,长约2 nm,宽约0.6 nm,长侧拐点到两个侧端为强疏水区(橙红色),短侧拐点附近为弱疏水区(燕麦棕色).口袋内部有3个槽,位于拐点附近的是疏水槽,离T1Cu离子最近,另外两个是亲水槽,其中一个沿着“回旋镖”上侧端深入蛋白质分子内部(称为“内槽”),另一个在下侧端且离蛋白表面很近(称为“外槽”).显然,底物分子的大小受限于T1口袋的尺寸.从亲、疏水角度看,T1口袋外缘是由5个环结构围成的,分别包含SGAP、E235、LLCG、LF和PFT等残基或片段.其中Leu(L)和Phe(F)的疏水值>1[23],组成口袋外缘强疏水区;Glu(E)、Gly(G)和Ala(A)的疏水值为0.4~0.9[23],它们和亲水残基Ser(S)、Pro(P)组成口袋外缘的弱疏水区.口袋内槽则处于两个α螺旋之间,指向蛋白质C末端的一段亲水性无规则区.内槽的Lys188和Trp507连同口袋边缘的几个残基(Ala191、Pro192、Glu235、Phe371和Phe427)对酚类底物的有效捆绑十分重要[18].
图3 M. thermophila漆酶的3D结构模型及Ramachandran Plot分析结果
Swiss-Model 在线程序提供GMQE和QMEAN4评分函数用于评价模型质量.GMQE是相较于目标模板的质量估计,Mth漆酶模型的GMQE值为0.92,接近1,表明此模型十分接近实验值.QMEAN4提供Z分数在PDB数据库所有蛋白质中的分布,数值越接近0质量越高,Mth漆酶模型的QMEAN4值为0.27,接近于0.Meshram等[24]提出的P.cinnabarinus漆酶模型中,QMEAN4分数只有0.83,Tamboli等[25]在对5种真菌漆酶和5种细菌漆酶做同源模建的基础上,得到QMEAN4值在0.60~0.81之间.
文中还使用Ramachandran Plot法对Mth漆酶3D模型中每个氨基酸构象的正确性进行评估(见图3(c),图中φ和ψ分别表示一个肽单元α碳左边C—N键和右边C—C键的旋转角度).图3(c)中,深蓝色区域和深黄色区域分别表示脯氨酸(Pro)最适区和甘氨酸(Gly)最适区,落在这两个最适区域内的氨基酸数目越多,3D模型中氨基酸的构象越可靠.浅蓝色和浅黄色分别表示Pro允许区和Gly允许区,这些区域的氨基酸构象是可信的.白色区域的点通常表示氨基酸的构象不合理.对于Mth-Nov的模型,96.9%的氨基酸位于深蓝和深黄区,剩余3.1%落在浅蓝和浅黄区,没有构象错误的氨基酸.
2.3 漆酶与木质素模型物的分子对接
2.3.1 单体的捆绑位点及与氨基酸的相互作用
木质素是对香豆醇(PA)、松柏醇(CA)和芥子醇(SA)经酶催化聚合而成的天然高分子,这3种单体的疏水性和尺寸随甲氧基数目依次增加.木质素降解后会衍生出多种酚酸,包括对香豆酸、阿魏酸和芥子酸,其亲水性好,可用作漆酶的介体[26].研究中用这6种单体与Mth漆酶对接,结果(见表1)表明,这些单体均能进入T1Cu活性口袋,侧链端进入亲水的内槽,芳环端靠近疏水槽和T1Cu离子.与单体捆绑的氨基酸残基主要有Thr187、Lys188、Ser190、Gly191、Ala192、Phe371、Trp373、Trp507、His508和Gly511,其中单体Ⅰ-Ⅵ的酚羟基与Ala192的氨基以氢键结合,单体Ⅰ-Ⅲ的醇羟基与Lys188的伯氨基、Trp507的羧基形成氢键,单体Ⅳ-Ⅵ的羧基与Lys188氨基形成氢键.若脂肪链端的羟基转变为羧基,则Trp507与单体的相互作用由原来的氢键变成疏水作用,结合能(绝对值)略有降低.
从甲氧基的角度来看,松柏基型与对香豆基型单体的结合能相近,但芥子基型的结合能明显低于前两者,其主要原因可能是芥子基的双甲氧基形成空间位阻,影响了苯环与疏水氨基酸的相互作用.结合能反映酶与底物复合体的稳定性,结合能趋于零,则底物不能有效捆绑、催化.但底物在活性口袋的捆绑是催化反应的必要不充分条件,也就是说,捆绑不一定发生催化(如酶的抑制剂),但催化必须首先捆绑底物.除结合能外,酚羟基邻位基团的供电子效应也是影响漆酶催化木质素模型物氧化效率的重要因素.根据D’Annibale等[27]的研究结果,担子菌漆酶催化与芥子酸的最大反应速率为2.98 μkat/mg,略高于阿魏酸(2.47 μkat/mg),约是对香豆酸(0.526 μkat/mg)的6倍,其原因是甲氧基同时具有供电子共轭效应和吸电子诱导效应,供电子效应居于主导,底物在T1Cu口袋区捆绑后失去电子,甲氧基的供电子效应能促进电子转移,对漆酶起到活化的作用[27].另外,Chen等[5]研究愈创木酚、2,6- 二甲氧基苯酚、香草醇、阿魏酸和芥子酸与Tve漆酶的分子对接时采用了盲对接的计算方式,这种做法更适合描述底物大量存在时酶与之结合的所有活性区域,但由于没有集中在T1Cu活性口袋区,对接实验得到的结合能很难与催化建立关系.
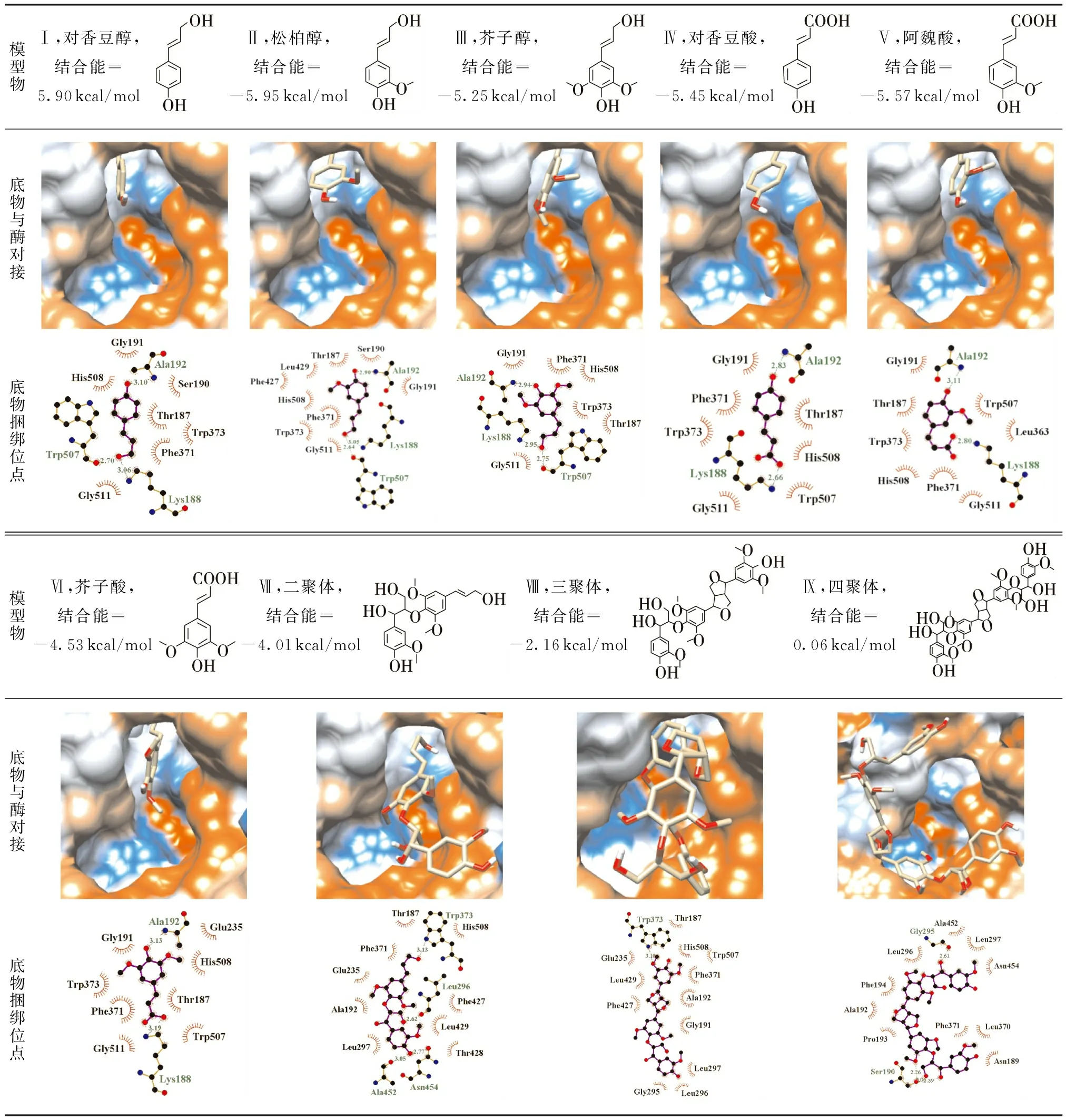
表1 M. thermophila漆酶与木质素模型物的分子对接结果
2.3.2 二聚体和寡聚体的捆绑
木质素单体通过多种C—C键和/或C—O—C键连接在一起,其中β-O- 4连接占比最高,如在桦木磨木木质素中,β-O- 4结构占60%,其次是β-β′连接(占8%)[28],单体的聚合度和连接方式共同决定了木质素的3D结构.研究中使用了CA(β-O- 4)SA二聚体(Ⅶ)、CA(β-O- 4)SA(β-β)SA三聚体(Ⅷ)和CA(β-O- 4)SA(β-β)SA(4- O-β)CA四聚体(Ⅳ).二聚体Ⅶ能进入T1Cu活性口袋,其方向与单体相似,若用M1和M2分别表示含酚羟基和脂肪链的两个苯丙烷单元,则M2的脂肪链羟基端伸向内槽亲水区,与Trp373氢键结合,M2的甲氧基、芳环和侧链分别与Ala192、Glu235和Phe371存在疏水作用力,M1的醇羟基与口袋内疏水槽中的Leu296形成氢键,M2的酚羟基端则与口袋边缘的两个氨基酸Ala452和Asn454结合.
随着聚合度的增加,木质素模型物在口袋区的结合能逐渐降低(数据见表1),聚合度与结合能呈线性关系,反映了口袋尺寸对底物大小的限制,即空间位阻效应.表1中三聚体和四聚体的捆绑构象图直观地反映了空间位阻带来的影响.三聚体与二聚体不同,所有单体的脂肪链都参与了醚键和C—C键的形成,代之以M3苯丙烷单元的芳环端与Trp373氢键结合,由于醚键和C—C键造成了分子链的弯曲,M1的芳环端无法进入活性口袋,只能在口袋边缘与Gly295、Leu296和Leu297形成疏水性结合.因氢键数目少,三聚体Ⅷ的结合能显著低于单体或二聚体.而四聚体尺寸更大,无法进入口袋,只能在外缘与Ser190和Gly295结合,其疏水基团不能充分地与氨基酸捆绑,结合能接近于零,因此,酶与四聚体的复合体不稳定,难以直接催化氧化,这就需要小分子介体,包括人工合成的化合物和天然化合物(如对香豆酸、香草醛、紫丁香酮等)[2,26].
在相关的研究报告中,Martínez-Sotres等[29]论证了三聚体CA(β-O- 4)CA′(β-O- 4)CA′′在Tve漆酶T1Cu活性口袋区是有效捆绑的.Awasthi等[8]报道了4种聚合度的木质素模型物在Tve漆酶的对接,分别是SA单体、G(4- O- 5)G′二聚体、S(β-O- 4)S′(β-O- 4)SA三聚体和G(β-O- 4)S(β-β)S′(β-O- 4)G′四聚体,其中G和S分别表示愈创木基和紫丁香基,尽管分子模拟证明了空间位阻效应,但由于二聚体和四聚体中都没有苯丙烷结构,分子量低于文中使用的模型物Ⅶ-Ⅸ,其结论指出由G和S组成的四聚体能有效结合在Tve漆酶的底物口袋区,显然,这不能用来推测或解释木质素苯丙烷基模型物的捆绑行为.
3 结论
文中使用分子模拟手段从分子水平层面分析了Myceliophthorathermophila漆酶与木质素模型物的相互作用,得到以下结论:①Mth漆酶的Cu离子结合位点由高度保守的4个氨基酸片段组成,其与Melanocarpusalbomyces漆酶亲缘关系最近,序列一致性高于74%;②以Mal漆酶为模板可构建出高质量的Mth漆酶模型,QMEAN4和GMQE函数评分分别为0.27和0.92,Ramachandran Plot分析证明所有氨基酸构象位于合理区域;③木质素苯丙烷结构单体通过氢键与Mth漆酶T1Cu活性口袋区的Ala192、Lys188和Trp507结合,单体脂肪链深入口袋内槽,酚羟基端指向疏水槽,脂肪链端羧基化会影响Trp507位点形成氢键,而酚羟基邻位若被两个甲氧基取代,会降低单体的结合能;④模型物的聚合度越高,结合能越接近零,二者具有线性相关性,三聚体仍能进入活性口袋,但四聚体因空间位阻不能在口袋区有效捆绑,需要介体才能被Mth漆酶催化氧化.
:
[1] ZHAO Q,NAKASHIMA J,CHEN F,et al.Laccase is ne-cessary and nonredundant with peroxidase for lignin polymerization during vascular development inArabidopsis[J].The Plant Cell,2013,25(10):3976- 3987.
[2] CAMARERO S,MARTNEZ M J,MARTNEZ A T.Understanding lignin biodegradation for the improved utilization of plant biomass in modern biorefineries [J].Biofuels,Bioproducts and Biorefining,2014,8(5):615- 625.
[3] DWIVEDI U N,SINGH P,PANDEY V P,et al.Structure-function relationship among bacterial,fungal and plant laccases [J].Journal of Molecular Catalysis B Enzymatic,2011,68(2):117- 128.
[4] 葛宏华,武赟,肖亚中.漆酶空间结构、反应机理及应用 [J].生物工程学报,2011,27(2):156- 163.
GE Hong-hua,WU Yun,XIAO Ya-zhong.Structure,cataly-tic mechanism and applications of laccases:a review [J].Chinese Journal of Biotechnology,2011,27(2):156- 163.
[5] CHEN M,ZENG G,LAI C,et al.Molecular basis of laccase bound to lignin:insight from comparative studies on the interaction ofTrametesversicolorlaccase with various lignin model compounds [J].RSC Advances,2015,5(65):52307- 52313.
[6] ZHANG Y,ZENG Z,ZENG G,et al.Effect of Triton X- 100 on the removal of aqueous phenol by laccase analyzed with a combined approach of experiments and molecular docking [J].Colloids Surf B Biointerfaces,2012,97(22):7- 12.
[7] PRASAD N K,VINDAL V,NARAYANA S L,et al.In silico analysis ofPycnoporuscinnabarinuslaccase active site with toxic industrial dyes [J].Journal of Molecular Modeling,2012,18(5):2013- 2019.
[8] AWASTHI M,JAISWAL N,SINGH S,et al.Molecular docking and dynamics simulation analyses unraveling the differential enzymatic catalysis by plant and fungal lacca-ses with respect to lignin biosynthesis and degradation [J].Journal of Biomolecular Structure and Dynamics,2015,33(9):1835- 1849.
[9] SANTIAGO G,DE SALAS F,LUCAS M F,et al.Computer-aided laccase engineering:toward biological oxidation of arylamines [J].ACS Catalysis,2016,6(8):5415- 5423.
[10] HAKULINEN N,KIISKINEN L L,KRUUS K,et al.Crystal structure of a laccase fromMelanocarpusalbomyceswith an intact trinuclear copper site [J].Nature Structu-ral Biology,2002,9(8):601- 605.
[11] BERKA R M,GRIGORIEV I V,OTILLAR R,et al.Compa-rative genomic analysis of the thermophilic biomass-degrading fungiMyceliophthorathermophilaandThielaviaterrestris[J].Nature Biotechnology,2011,29(10):922- 927.
[12] 王燕蓬,徐清华,秦梦华,等.漆酶与半纤维素酶用于旧报纸浆脱墨 [J].纸和造纸,2009,28(3):51- 53.
WANG Yan-peng,XU Qing-hua,QIN Meng-hua,et al.Enzymatic deinking of old newsprint by hemicellulase combined with laccase-mediator system [J].Paper and Paper Making,2009,28(3):51- 53.
[13] WIDSTEN P,KANDELBAUER A.Laccase applications in the forest products industry:a review [J].Enzyme & Microbial Technology,2008,42(4):293- 307.
[14] SVENDSEN A,XU F.Myceliophthorathermophilalaccase variants:US7622287B2 [P].2009- 11- 24.
[15] BERKA R M,SCHNEIDER P,GOLIGHTLY E J,et al.Characterization of the gene encoding an extracellular laccase ofMyceliophthorathermophilaand analysis of the recombinant enzyme expressed inAspergillusoryzae[J].Applied and Environmental Microbiology,1997,63(8):3151- 3157.
[16] RALPH S A,RALPH J,LANDUCCI L L,et al.NMR database of lignin and cell wall model compounds [DB/OL].(2014- 06- 01)[2017- 05- 12].http:∥ars.usda.gov/Services/docs.htm.
[17] 李蓉,邸泽梅,陈国亮.金属螯合亲和色谱中固定金属与蛋白质的作用 [J].分析化学,2002,30(5):552- 555.
LI Rong,DI Ze-mei,CHEN Guo-liang.Interaction between immobilized metal and protein in metal chelate affinity chromatography [J].Chinese Journal of Analytical Chemistry,2001,30(5):552- 555.
[18] KALLIO J P,AUER S,JNIS J,et al.Structure-function studies of aMelanocarpusalbomyceslaccase suggest a pathway for oxidation of phenolic compounds [J].Journal of Molecular Biology,2009,392(4):895- 909.
[19] SHI X,LIU Q,MA J,et al.An acid-stable bacterial laccase identified from the endophytePantoeaananatis,Sd- 1 genome exhibiting lignin degradation and dye decolorization abilities [J].Biotechnology Letters,2015,37(11):2279- 2288.
[20] NITTA K,KATAOKA K,SAKURAI T.Primary structure of a Japanese lacquer tree laccase as a prototype enzyme of multicopper oxidases [J].Journal of Inorganic Biochemistry,2002,91(91):125- 131.
[21] KOLBUSZ M A,DI FALCO M,ISHMAEL N,et al.Transcriptome and exoproteome analysis of utilization of plant-derived biomass byMyceliophthorathermophila[J].Fungal Genetics and Biology,2014,72(1):10- 20.
[22] STAATS M,VAN BAARLEN P,VAN KAN J A L.Mole-cular phylogeny of the plant pathogenic genusBotrytisand the evolution of host specificity [J].Molecular Biology and Evolution,2005,22(2):333- 346.
[23] FAUCHEREAND J L,PLISKA V.Transformational homologies in amino acid sequence [J].Eur J Med Chem,1983,18:369- 375.
[24] MESHRAM R J,GAVHANE A J,GAIKAR R B,et al.Sequence analysis and homology modeling of laccase fromPycnoporuscinnabarinus[J].Bioinformation,2010,5(4):150- 154.
[25] TAMBOLI A S,RANE N R.Physicochemical characte-rization,structural analysis and homology modeling of bacterial and fungal laccases using in silico methods [J].Network Modeling Analysis in Health Informatics and Bioinformatics,2015,4(1):1- 12.
[26] CAMARERO S,CAAS A I,NOUSIAINEN P,et al.p-Hydroxycinnamic acids as natural mediators for laccase oxidation of recalcitrant compounds [J].Environmental Science & Technology,2008,42(17):6703- 6709.
[27] D’ANNIBALE A,CELLETTI D,FELICI M,et al.Substrate specificity of laccase fromLentinusedodes[J].Acta Biotechnologica,1996,16(4):257- 270.
[28] CAPANEMA E A,BALAKSHIN M Y,KADLA J F.A comprehensive approach for quantitative lignin characte-rization by NMR spectroscopy [J].Journal of Agricultural and Food Chemistry,2004,52(7):1850- 1860.

