离子色谱测定壳寡糖聚合度研究
邵 波
(浙江树人大学,浙江 杭州 310015)
实验室与分析
离子色谱测定壳寡糖聚合度研究
邵 波
(浙江树人大学,浙江 杭州 310015)
采用离子色谱方法研究壳寡糖聚合度(DP)与其保留因子(k’)的相关关系。利用实验数据建立线性回归方程,并对样品中的未知壳寡糖样品的聚合度进行分析,并改变流速和淋洗液的条件进行验证,误差 ≤1.97。因此,可以利用离子色谱分离保留因子计算壳寡糖的聚合度。
壳寡糖;保留因子;聚合度
近年来,壳寡糖逐渐应用于食品、医药、饲料、农业等各领域[1]。目前壳寡糖产品检测中聚合度的分析尤为关键,但是其检测的方法尚不成熟。常用检测方法有液相色谱法[2]、毛细管电泳法[3-4]及费时的衍生荧光法。离子色谱积分脉冲安培检测法是报道的检测糖类最好的方法[5],但这些方法都需要使用标准品进行验证[6],壳寡糖的标准样品不但价格昂贵,且供应商极少因而较难购全,这给壳寡糖聚合度的验证带来很大的困难。根据色谱中保留值规律,通过实验研究其聚合度与保留因子之间的关系非常有意义,可以在缺乏标准品的情况下,对未知的壳寡糖进行聚合度的分析,以获得高活性壳寡糖产品。
1 材料与方法
1.1 仪器和试剂
戴安DX-600离子色谱仪:配电化学检测器,分析柱系统为CarboPac PA10 4mm×50mm,保护柱为CarboPacPA10 4mm×250 mm。
壳2~壳6糖标准物质(含量大于90%)。超纯水(18.2MΩ)。壳寡糖试样。
1.2 实验方法
壳寡糖标准混合液:分别称取壳2~壳6糖的标准物质各10.00mg用超纯水分别溶解于10mL容量瓶中定容,配成浓度为1.0 mg·mL-1的储备液。使用液分别用超纯水稀释至10μg·mL-1。
壳寡糖样品溶液:称取壳寡糖样品1.0g,用超纯水溶解后定容至10mL,用0.45μm水性滤膜过滤,滤液作为储备液备用,使用时用超纯水稀释至10μg·mL-1。
1.3 色谱条件
色谱柱及检测池温度20℃,进样量25μL,ED40A电化学检测器配 Au工作电极及Ag-AgCl 参比电极,积分脉冲安培法检测。
淋洗液1:A:100 mmol·L-1氢氧化钠;B:超纯水;20%A+80%B(V/V) 等度洗脱。
淋洗液2:A:100 mmol·L-1氢氧化钠;B:超纯水;10%A+90%B(V/V) 等度洗脱。
2 实验结果与讨论
2.1 壳寡糖聚合度与保留因子的计算
取壳寡糖样品溶液适当稀释后进样分析,流速0.60mL·min-1,淋洗液:20%NaOH+80%H2O(V/V),得到图1的色谱图。图1所示1~3号峰为未知聚合度壳寡糖,4~8号峰则使用标准物质进行定性确证,分别为壳6~壳2糖。计算保留指数及相关参数见表1。
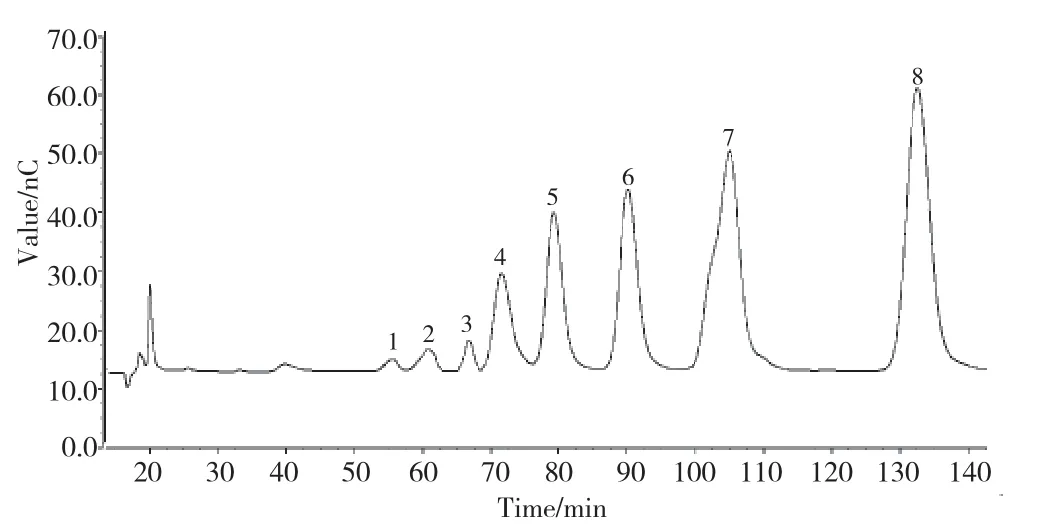
图1 壳寡糖样品色谱图Fig.1 Chromatogram of Chitosan Oligosaccharide sample
根据气相色谱的碳数规律,同系物的调整保留时间或保留因子(K′)的对数与碳数存在线性关系:logk′=A1n+B1,式中,k′为保留因子,A1为碳数规律常数,B1为常数,n为碳数值。直链壳寡糖是由氨基葡萄糖单体缩合而成的寡糖,其中的聚合度(DP)等同于碳数,但是由于链上有氨基,通过对壳寡糖聚合度DP与保留因子k′相关关系进行回归,发现聚合度DP与保留因子对数logk′具有指数相关关系。
2.2 未知峰聚合度的计算
先由表1的数据建立聚合度为2~6的壳寡糖对照品的logDP与logk′的相关关系。研究中发现,壳寡糖的保留值规律为:logk′=A1logDP+B1,将3号未知峰的logk′值数据代入上述方程,计算其“logDP”值,并由此“logDP”值计算其“DP”值及误差值。完成对该未知峰的定性后,为避免误差,再以该未知峰为最高聚合度,顺序向下建立新的回归方程,直至完成所有未知峰的聚合度计算。由计算可知,该样品中1~3个未知峰分别对应聚合度为11、9、7的壳寡糖。

表1 壳寡糖聚合度(DP)与保留因子(k′)数据计算Table 1 Data calculation of oligosaccharide polymerization degree (DP) and retention fator (k′)

表2 聚合度及误差计算Table 2 Calculation of (DP) and deviation with 15%NaOH+85%H2O(V/V) elution
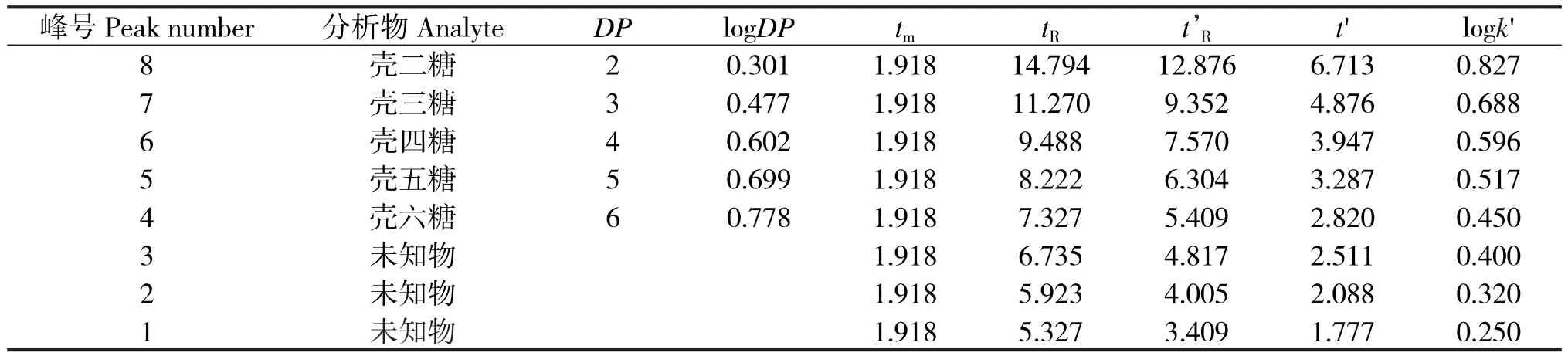
表3 壳寡糖对照品聚合度DP与保留因子k′数据计算Table 3 Data calculation of (DP) and retention fator (k′)
2.3 改变流速及淋洗条件的影响
将流速改变为0.80mL·min-1,淋洗液10% NaOH+90% H2O(V/V)等度洗脱,分离后的各项参数见表3和表4。保留因子的对数与聚合度的对数之间的线性关系依然存在。

表4 聚合度确定及其误差计算Table 4 Calculation of DP and deviation with 5%NaOH+95%H2O(V/V) elution
3 结论
实验表明,低聚壳寡糖聚合度的对数与保留因子的对数具有线性关系。根据建立的关系对壳寡糖样品进行聚合度的分析,改变流速和淋洗液比例后,误差不大于1.97%,可见该法可以在缺少相应的壳寡糖标准试剂时对其进行定性,以保证产品的生产质量和品质,可广泛运用于各行业的壳寡糖聚合度的检测。
[1] 马镝,吴元华,赵秀香.壳寡糖的制备、分离分析方法及在农业上的应用[J].现代农药,2007(2):1-5.
[2] Krokeide,I.M., Synstad.B., Gaseidnes.S., et al. Natural substrate assay for chitinases using high-performance liquid chromatography: a comparison with existing assays[J]. Anal. Biochem., 2007, 363: 128-134.
[3] ElRassi, Z. Recent developments in capillary electrophoresis and capillary electrochromatography of carbohydrate species[J]. Electrophoresis, 1999, 20: 3134-3144.
[4] Lee.K.B., Kim.Y.S., Linhardt.R.J. Capillary zone electrophoresis for the quantitation of oligosaccharides formed through the action of chitinase[J]. Electrophoresis, 1991(12): 636-640.
[5] 牟世芬,于泓,蔡亚岐.糖的高效阴离子交换色谱-脉冲安培检测法分析[J].色谱,2009,27(1):667-674.
[6] 陈梅兰,林智威,卢珩俊,邵波.离子色谱分离保留因子计算定性分析低聚壳寡糖的研究[J].药物分析杂志,2017,37(1):43-49.
[7] 陈金玲,黄雪松.薄层色谱法快速检测大蒜低聚果糖[J].广东农业科学,2012,39(9):103-105.
[8] 熊建飞,周光明,许丽,等. 离子色谱法测定奶粉中的葡萄糖、蔗糖和乳糖[J].食品科学,2012(8):176-179.
Determination of Polymerization Degree of Chitosan Oligosaccharide by Ion Chromatography
SHAO Bo
(Zhejiang Shuren University, Hangzhou 310015, China)
The relationship between the degree of polymerization ( DP ) of chitosan oligosaccharide and retention factor ( k ’ ) was studied by ion chromatography. The polymerization of unknown chitosan oligosaccharide samples was analyzed by using the experimental data to establish the linear regression equation and changing velocity and eluent conditions to verificate the method by error less than 1.97. Therefore, the retention factor could be separated by ion chromatography to calculate the degree of polymerization of chitosan oligosaccharide.
chitosan oligosaccharide; retaining factors; degree of polymerization
O 652.63
A
1671-9905(2017)05-0035-03
浙江省分析测试科技计划项目(编号2015C37039)
邵波,女,硕士,高级实验师,主持省分析测试基金、省教育厅、杭州市科委课题,参与国家级省级课题多项,发表论文30余篇,其中核心刊物20余篇,数篇文章被SCI、CA收录
2017-03-06

