猪圆环病毒2型荧光定量PCR检测试剂盒的研制及应用
任方方,胡瑞丽,倪建平,许 燕,李春华,赵 笑,杜亚楠,赵 凯
(1上海市农业科学院生物技术研究所,上海 201106;2上海师范大学,上海 201306;3上海佳牧生物制品有限公司,上海 201106;4宁夏大学,银川 750021;5上海市农业遗传育种重点实验室,上海 201106)
猪圆环病毒2型荧光定量PCR检测试剂盒的研制及应用
任方方1,2,胡瑞丽1,2,倪建平3,许 燕2,李春华3,赵 笑4,杜亚楠2,赵 凯1,5
(1上海市农业科学院生物技术研究所,上海 201106;2上海师范大学,上海 201306;3上海佳牧生物制品有限公司,上海 201106;4宁夏大学,银川 750021;5上海市农业遗传育种重点实验室,上海 201106)
为了开发针对猪圆环病毒2型(PCV2)的诊断技术及其试剂盒,对PCV2的ORF2基因设计相应的特异性引物和探针,采用荧光定量PCR方法检测PCV2。试验表明:该方法循环阈值(Ct)与标准DNA模板在101—107拷贝/μL浓度范围内具有极好的线性关系,相关系数为0.9999;重复性好,批内试验中Ct值的变异系数在0.59%—1.05%,批间试验的Ct值变异系数为1.9%—4.2%;研制的检测试剂盒与猪瘟病毒(HCV)、猪呼吸与繁殖障碍综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)不发生交叉反应,检测极限和定量极限分别为10和100拷贝数。用此方法对1 000个临床样品进行检测,结果710个被检测为阳性。结果显示,所研制的PCV2诊断试剂盒灵敏度高,特异性强,稳定性好,为PCV2的检测和流行病学的调查提供了一种简便快速的诊断方法。
猪圆环病毒2型;荧光定量;PCR检测;诊断试剂盒
猪圆环病毒(Porcine circovirus,PCV)属于圆环病毒科圆环病毒属,1974年最先由德国科学家发现,但在当时并未引起足够的重视。直到1991年,在加拿大猪群中,出现了一种被称为断奶仔猪多系统衰竭综合症的疾病,这种疾病给当地养猪产业带来了巨大的经济损失,才引起人们的关注。根据其抗原性,PCV可分为PCVl(Porcine circovirus type 1)和PCV2(Porcine circovirus type 2)两种类型。感染试验表明:PCVl不会对猪造成危害,但PCV2对猪具有一定的致病性,它与断奶后仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)、增生性坏死性肺炎(PNP)、猪呼吸道与繁殖综合症(PRRSV)、先天性颤抖、猪传染性胃肠炎(TGE)等临床症状相关,更为重要的是它会引起对免疫功能的抑制,并容易导致其他的病原微生物继发或并发感染。该疾病已在美国、法国、意大利、西班牙、德国、荷兰、丹麦等多个国家和地区广泛流行,给世界的养猪业带来了巨大的经济损失[1-5]。因此,猪圆环病毒2型引起了国内外学者的广泛关注。由于PCV2严重地破坏了猪的免疫系统,致使猪全身的淋巴系统出现病变并造成了免疫功能低下以及抵抗力极弱,因此一旦猪的体内存在其他的病毒或者原虫、细菌性感染,就会暴发性流行,并造成巨大的经济损失[6];PCV2感染在中国的某些区域非常普遍[7],而且由于免疫系统受到了严重的破坏,导致各种疫苗接种应答效果差,免疫失败,并且诱发其他疾病暴发。因此,迄今国内外尚无疫苗可进行免疫,并且也没有理想的化学药物对其进行有效防治。鉴于这种现状,PCV2感染的早期诊断和病猪的淘汰成为PMWS防治的重点。目前,对PCV2的分子诊断主要是依靠分子生物学检测技术和免疫学检测技术。但是由于免疫学技术自身的敏感性和特异性都较差,因此分子生物学检测技术在PCV2分子诊断上得到了迅速的发展,与普通PCR和ELISA相比,定量PCR是一种更有效、特异、快速的定量方法,并可以同时减少假阳性和污染。因此,定量PCR开始被广泛应用,并且成为主要的病原体检测方法[8]。另外,本研究的创新点和先进性在于不仅成功建立了Taqman实时荧光定量PCR方法,还将这种方法研制成试剂盒进行推广应用,这在该领域是比较少见的。
1 材料与方法
1.1 材料
(1)病毒PCV2毒株BJ0804和猪瘟病毒(HCV)、猪呼吸与繁殖障碍综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV),由上海市农业科学院畜牧所提供。(2)其他材料:血液组织细胞基因组提取试剂盒,购自天根生化科技(北京)有限公司;定性PCR用的dNTPs、Taq DNA聚合酶及其缓冲液、定量PCR用的dNTPs、Taq DNA聚合酶及其缓冲液,购自Takara宝生物工程(大连)有限公司;定量PCR引物、TaqMan探针,由Invitrogen生物有限公司合成;其余常规试剂(分析纯)均来自于上海国药集团化学试剂有限公司。
1.2 引物和探针
GenBank序列号为EU921257.1的PCV2毒株BJ0804,以其开放阅读框为模板设计引物和探针(表1)。引物和探针设计使用软件Primer Premier 5.0,Oligo DNAman 4.0和Primer Analysis。PCR产物长度为149 bp。

表1 PCV2引物和探针序列Table 1 Sequences of primers and probe of PCV2
1.3 荧光定量PCR扩增产物重组质粒
以猪圆环病毒2型BJ0804株为标准模板,F3和B3为上下游引物,按照PCR体系进行扩增,PCR反应体系为25μL体积包含:ddH2O 16.5μL,10×PCR buffer2.5μL,dNTP 2.0μL,F3 1.0μL,B3 1.0μL,Taq ploymerase(Takara Corp.)1.0μL,1.0μL提取的DNA。反应程序:95℃预变性5 min,进入PCR反应循环:95℃变性30 s,55℃退火30 s,72℃延伸30 s,共进行35个循环,最后72℃总延伸5min。设立阴性对照,进行常规PCR。反应结束后,取5μL PCR产物用2%琼脂糖凝胶电泳检测,得149 bp的扩增产物。
PCR产物的回收与纯化按照Omega公司E.Z.N.A.GelExtraction Kit说明书进行。回收产物与载体连接反应参照pMD18-T vector的使用说明进行。连接产物转化感受态细胞。采用菌落PCR法筛选阳性重组质粒。
1.4 标准品浓度的计算
参照3SSpin Plasmid Miniprep Kit V3.1的说明书小量制备质粒,将上述质粒做100倍稀释后,用紫外分光光度计测定其浓度,然后按照下面的公式转换成质粒的拷贝数:拷贝数=质粒浓度×阿氏常数/(一个碱基对的平均分子量×质粒的总长度),标准品作10倍梯度稀释。用紫外分光光度计测定阳性质粒的OD值,计算其浓度,并依次稀释成含质粒数量分别为108、107、…、101、100个拷贝共9个样品梯度作为标准品,-40℃保存备用。
1.5 实时荧光定量PCR检测方法的建立
操作方法:(1)试剂准备间:此房间放置PCR体系配制原料如Buffer、引物、探针、双蒸水等等,不可放置阳性参照等PCR反应模板,配制相应的PCR反应体系,阴性对照如果加入的是水可在该实验室加入,并盖严管盖;具体操作:1.5 mL离心管中加入除模板外的其余物质,涡旋混匀,瞬离,然后将混合物分装在荧光定量PCR管中,每管20μL。与之对照的组里每个管里加5μL的ddH2O。(2)样本处理间:此房间放置PCR反应模板,不可放置PCR体系配制原料,将在第一间配好的PCR体系在该实验室中加入模板,模板要从低拷贝到高拷贝顺序加入,加好一个立即盖严管盖。(3)扩增间:配好的PCR反应液放置PCR仪中进行扩增,确保进入该实验室前,所有管盖必须已经盖严,扩增完成的PCR管盖不可在此间打开;具体操作:将管子放进仪器里,进行反应。
PCR程序:94℃10 min;94℃30 s,54℃30 s,72℃31 s,45个循环。
25μL的反应终体系含有2.5μmol/L dNTP 2.5μL、10×PCR buffer2.5μL、Probe溶液0.4μL,Taq DNA聚合酶0.3μL,DNA模板5.0μL,灭菌双蒸水补足。MgSO4按3.0μL、4.0μL、5.0μL、6.0μL优化,Primer-1,Primer-2按0.6μL、0.7μL、0.8μL、0.9μL、1.0μL进行优化,具体优化组合参见表2。
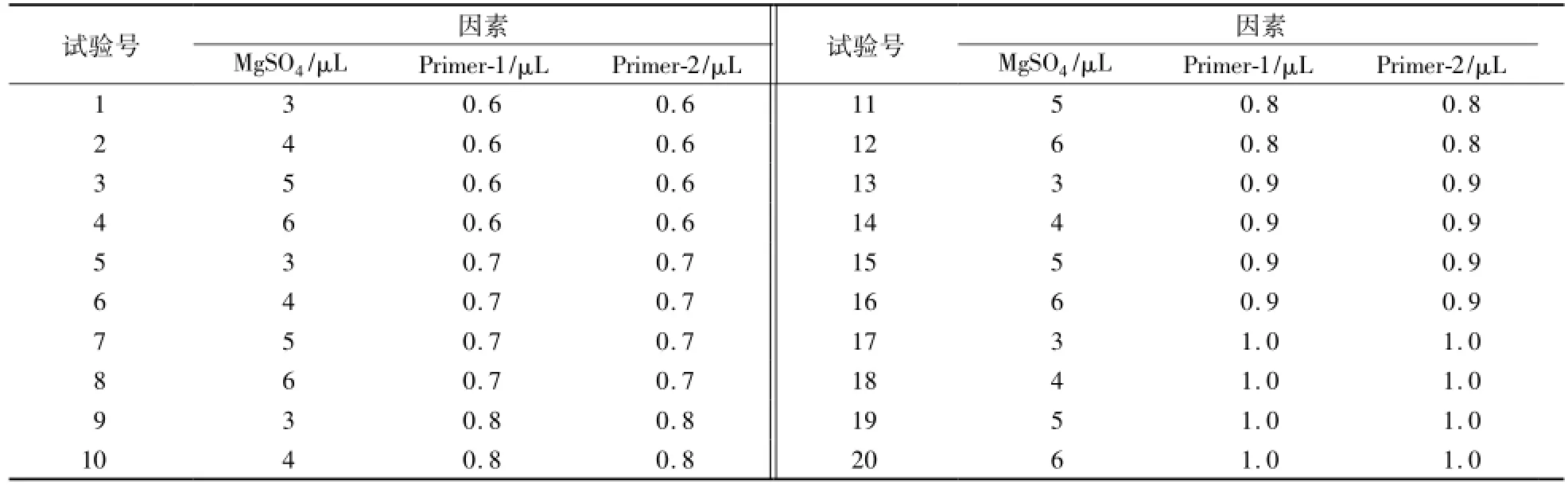
表2 体系优化Table 2 Optim ization of system
保持25μL的反应体系中2.5μmol/L dNTP、10×PCR buffer、Taq DNA聚合酶0.3μL、DNA模板5.0μL量不变,按照上面试验组合,逐一验证Probe溶液0.4μL、0.5μL、0.6μL试验效果。
所有的定量PCR中每个反应进行3次,每次每个样品含有3个重复。定量PCR反应条件为:94℃预变性10 min,进入PCR反应循环:94℃变性30 s,54℃退火30 s和72℃延伸31 s,共进行45个循环。最后在延伸阶段,收集荧光信号。
通过这样对体系中的条件逐一优化,选出最佳比例组合,完成优化过程,建立实时荧光定量PCR检测方法。
1.6 标准曲线的建立
将已知拷贝数的质粒做10倍系列稀释作为模板,进行荧光定量PCR扩增,得到相应的动力学曲线,并计算产生相应的标准曲线。
1.7 PCV2荧光定量PCR定量检测试剂盒的组装和说明书
猪圆环病毒2型荧光定量PCR检测试剂盒包装规格:200次,试剂盒组成如下:

运输及保存方法:低温运输,长期保存置于-80℃;产品融化后于4℃保存,并在6个月内用完。
产品介绍:使用本试剂盒快速简便,可对猪圆环病毒2型进行实时PCR的检测。
注意事项:(1)减少试剂分注、搅拌次数,保证正确的试剂分注,有效降低试验结果间的误差。(2)在移液操作前,要将试剂轻轻离心至容器底部。Taq DNA Polymerase粘度较高,在取液时一定要缓慢操作试剂,在混匀时要缓慢进行,避免产生气泡。(3)反应液的配制、分装一定用新的(无污染的)吸头、Microtube等,尽量避免污染。(4)为了确定试剂的有效性,应该同时做一管含有标准分子的阳性对照质控反应。(5)所有接触病料的物品均应合理处理,以免污染实验室。(6)把全部的试验分区域进行操作,严禁器材和试剂倒流。(7)显色剂低毒,应于室温条件避光保存,操作时应戴上手套。(8)不要让试剂盒中的各个成分受到污染。(9)严格遵守操作说明可以获得最好的结果。操作过程中移液、定时等全部过程必须精确。
操作步骤:(1)在无菌洁净的PCR管中,参考下面体系配制反应溶液:

(2)轻轻混匀后短暂离心,每个样品做3个重复。同时用标准分子101拷贝/μL、102拷贝/μL、103拷贝/μL、104拷贝/μL、105拷贝/μL PCV2质粒做标准曲线。置于PCR仪中启动反应程序,反应程序见下:94℃预变性10 min,进入PCR反应循环:94℃变性30 s,54℃退火30 s和72℃延伸31 s,共进行45或50个循环。在延伸阶段收集荧光信号。
结果分析与判断:(1)质控标准:阴性样品无Ct值或无扩增曲线;阳性样品对照Ct值应小于30.0,并出现典型扩增曲线;否则,此次试验视为无效。(2)结果描述与判断:阴性样品无Ct值或无扩增曲线,表示样品中无猪圆环病毒2型;阳性样品Ct值小于或等于30.0,且出现典型扩增曲线,表示样品中有猪圆环病毒2型;有效原则Ct值大于30.0的样品建议重做;重做结果无数值者为阴性,否则为阳性。
1.8 PCV2的荧光定量PCR检测试剂盒特异性试验
用该检测试剂盒对PCV2质粒、PCV2病毒样品、猪瘟病毒(HCV)、猪呼吸与繁殖障碍综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)的cDNA为模板和双蒸水进行荧光定量PCR检测,测定该检测试剂盒的特异性。
1.9 PCV2的荧光定量PCR检测试剂盒灵敏度试验
将上述重组质粒做梯度稀释,并用相应的引物探针进行Real-time PCR扩增,测试该检测试剂盒的灵敏度。
1.10 PCV2的荧光定量PCR检测试剂盒重复性试验
调水总干渠工程引水隧洞最大埋深1 100 m,埋深大于600 m的隧洞长约10 km,埋深大于900 m隧洞长约2.7 km,属深埋长隧洞,相应地应力很高。埋深130 m~600 m隧洞段最大水平应力约为6 MPa~20 MPa;埋深1 000 m左右的隧洞段最大水平应力近30 MPa。由于地应力的影响,在干燥和质地坚硬的岩层中可能发生岩爆,在软岩地层中极易发生塑性变形。
将试剂盒里105拷贝/μL、103拷贝/μL、101拷贝/μL的质粒溶液,作为模板进行扩增,每个样品设置10个重复,总共进行试验10次,然后计算每次试验同一浓度的各个样品以及各次试验中同一浓度的各个样品的Ct值的变异系数,进而对试剂盒的重复性就行验证。
1.11 临床样品检测
把标准品以及临床样品,分别作为模板,然后在同次试验中,进行荧光定量PCR反应,用研制的实时荧光定量PCR检测试剂盒对1 000份临床样品进行检测。
1.12 PCV2荧光定量PCR检测试剂盒的应用
委托上海博满生物科技有限公司、上海斯高勒生物科技有限公司、上海珺珏生物科技有限公司在上海市、江苏省、浙江省的畜牧养殖场中进行推广应用。
2 结果与分析
2.1 实时荧光定量PCR检测方法的建立
优化结果显示最佳比例组合为:(25μL的反应体系)ddH2O 6.5μL、2.5μmol/L dNTP 2.5μL、10×PC buffer 2.5μL、MgCl26μL、Primer-1 0.9μL、Primer-09μL、Probe 0.4μL、Taq DNA聚合酶0.3μL、DNA模板5.0μL。
利用最佳比例组合进行3次重复性试验,结果见图1。
2.2 标准曲线的建立
将已知拷贝数的质粒做10倍系列稀释作为模板,进行荧光定量PCR扩增,建立标准曲线。标准曲线在101—107拷贝/μL浓度范围内呈现极好的线性关系,相关系数为0.9999(图2)。
2.3 PCV2荧光定量PCR检测试剂盒
该试剂盒(图3)含有PCV2质粒、引物、探针、Buffer、dNTPMix、MgCl2和Taq DNA Polymerase,该试剂盒灵敏度高、特异性强、重复性好,具有较好的市场推广价值。

图1 PCV2实时荧光定量PCR结果Fig.1 Real-time fluorescent quantitation PCR of PCV2

图2 Ct值与PCV2质粒拷贝数对数之间的标准曲线Fig.2 Standard curve between Ct value and logarithm of PCV2 p lasm id copy number

图3 PCV2荧光定量PCR检测试剂盒Fig.3 Fluorescent quantitation PCR detection kit of PCV2
2.4 PCV2荧光定量PCR检测试剂盒的特异性试验
对供试的样品进行实时荧光PCR检测,引物Primer-1、Primer-2和探针在非PCV2病毒样品中均未出现荧光信号增幅,而在所有供试PCV2病毒样品中均有明显的荧光增幅,说明引物和探针特异于PCV2病毒样品检测。PCV2荧光定量PCR检测试剂盒特异性检测结果见图4。该方法能在3 h内报告样品的检测结果。
2.5 PCV2荧光定量PCR检测试剂盒的灵敏度试验
对PCV2质粒按拷贝数10倍梯度稀释的6组样品:101、102、103、104、105、106进行10倍梯度稀释。6个10倍梯度稀释样品均有明显荧光增幅,最低DNA浓度为10拷贝,即研制的PCV2实时荧光PCR检测试剂盒检测下限为10拷贝数,研制的PCV2实时荧光PCR检测试剂盒定量极限为100拷贝数,符合日常检测要求。PCV2荧光定量PCR检测试剂盒灵敏度检测结果见图5—图7。
2.6 PCV2的荧光定量PCR检测试剂盒重复性试验
批内试验中Ct值变异系数:0.59%—1.05%,批间试验的Ct值变异系数:1.9%—4.2%(表3)。
2.7 PCV2的荧光定量PCR检测试剂盒的临床样品检测
用该荧光定量检测试剂盒检测1 000个血清样品,看是否感染PCV2。结果检出其中有710个临床样品感染PCV2。

图4 PCV2荧光定量PCR的特异性试验Fig.4 Specific test for fluorescent quantitation PCR of PCV2

图5 PCV2荧光定量PCR的灵敏度试验(1)Fig.5 Sensitivity test for fluorescent quantitation PCR of PCV2(1)
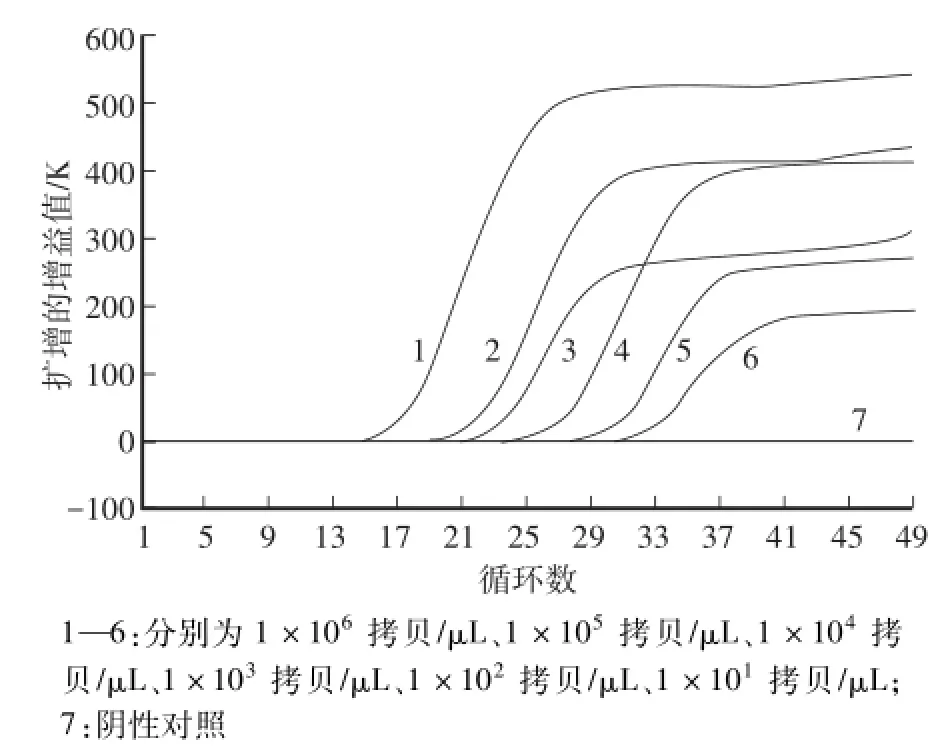
图6 PCV2荧光定量PCR的灵敏度试验(2)Fig.6 Sensitivity test for fluorescent quantitation PCR of PCV2(2)

图7 PCV2荧光定量PCR的灵敏度试验(3)Fig.7 Sensitivity test for fluorescent quantitation PCR of PCV2(3)
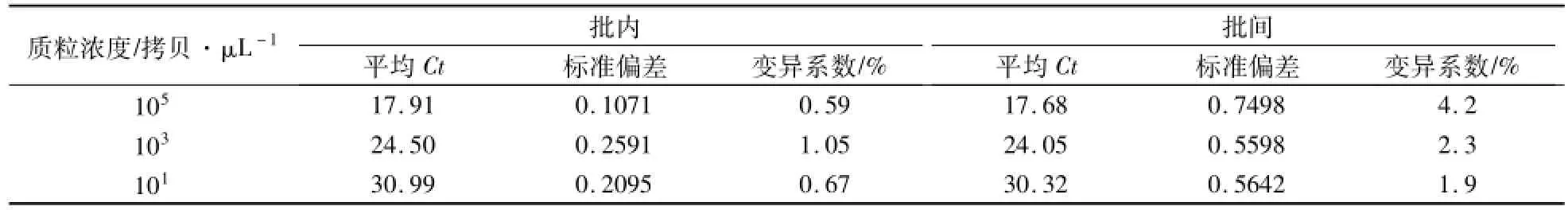
表3 PCV2的荧光定量PCR检测试剂盒批内试验和批间试验Table 3 Intra-and inter-lot tests for fluorescent quantitation PCR detection kit of PCV2
3 讨论
调查显示,欧洲部分国家、美国和加拿大100%的农场和受测样品经血清分析为PCV2阳性[1,9]。对中国7个省和自治区采集的样品经ELISA检测,高达42.9%为PCV2阳性[10]。
据报道,由PCV2引起的疾病在农场中造成的死亡占猪死亡率的2%—3%到14%—30%[11]。因此,对PCV2的快速、特异的检测和定量检测对猪的PMWS的防控以及试验研究都尤为重要。与普通PCR相比,Taqman PCR具有灵敏度高且污染少等优点。传统PCR在进行凝胶分析时,可能会造成产物污染,从而导致后续试验的假阳性等问题。因此实时荧光定量PCR已被广泛应用在多个领域,同时也提高了检测试验的灵敏度,也更加节约了试验所需的时间。
本研究首先对猪圆环病毒2型特异性基因组序列进行分析,通过多次的筛选得到了一个猪圆环病毒2型特异性基因所在的区域,即ORF2是PCV2的主要保守区域,可以作为检测PCV2的参考区域,这段区域与PCV1具有很大的差异性[12]。杂交探针已被用于检测PCV2,其检测结果也具有较高的灵敏度和特异性。Brunborg等[12]用Taqman探针检测到了ORF2中的一段84 bp的序列,从而对不同组织和血清样品进行PCV2进行定量。Chung等[13]和Yang等[14]人分别用Taqman和SYBRGreen I对PCV2进行了定量。
针对其特异性序列,本试验中设计不同的引物和探针,扩增了PCV2的149 bp的序列来检测PCV2。对该试验的重复性、灵敏度和特异性分别进行了鉴定,重复性试验检测结果显示:本研究中所建立的检测方法是稳定的、可靠的。也将其他病毒作为模板同时进行试验,试验结果显示:本试验所建立的方法具有很好的特异性,没有与其他病毒发生交叉反应。试验也对临床样品进行检测,这样评价了其作为特异性基因在猪圆环病毒2型实际样品的Taqman荧光定量PCR检测中的应用性。本试验建立的方法和开发的试剂盒不仅可以提供一种快速的检测PCV2的方法,也可能被应用于评价抗PCV2疫苗。本方法补充了PCV2检测和定量方法。
[1]ALLAN GM,ELLIS JA.Porcine circoviruses:a review[J].JVet Diagn Invest,2000,12:3-14.
[2]ELLIS J,CLARK E,HAINESD,et al.Porcinecircovirus-2 and concurrent infections in the field[J].Vet Microbiol,2004,98:159-163.
[3]SEGALES J,DOMINGOM.Postweaningmultisystemic wasting syndrome(PMWS)in pigs:a review[J].VetQ,2002,24:109-124.
[4]SEGALESJ,ROSELL C,DOMINGOM.Pathological findings associated with naturally acquired porcine circovirus type2 associated disease[J].VetMicrobiol,2004,98:137-149.
[5]BRUNBORG IM,JONASSEN C M,MOLDAL T,et al.Association of myocarditis with high viral load of porcine circovirus type 2 in several tissues in casesof fetal death and highmortality in piglets:a case study[J].JVet Diagn Invest,2007,19:368-375.
[6]ALLAN GM,MCNEILLY F,MEEHAN B M,et al.Isolation and characterization of circoviruses from pigs with wasting syndromes in Spain,Denmark and Northern Ireland[J].Vet Microbiol,1999,66:115-123.
[7]WU D M,CAO Y C,BIY J.Research progress of porcine circovirus:a review[J].Chin JPrev Vet Med,2004,26(1):76-78.
[8]LINSSEN B,KINNEY R M,AGUILAR P,et al.Development of reverse transcription-PCR assays specific for detection of equine encephalitis viruses[J].JClin Microbiol,2000,38:1527-1535.
[9]COTTRELL T S,FRIENDSHIP R M,DEWEY C E,et al.A study investigating epidemiological risk factors for porcine circovirus type II in Ontario[J].Pig J,1999,44:10-17.
[10]WALKER IW,KONOBY C A,JEWHURST V A,et al.Development and application of a competitive enzyme-linked immunosorbent assay for the detection of serum antibodies to porcine circovirus type 2[J].JVet Diagn Invest,2000,12:400-405.
[11]ESTHER S,CAROLE B,HEIDIG,et al.Cellular adaptive immune response againstporcine circovirus type 2 in subclinically infected pigs[J].BMC Vet Res,2009,5:45.
[12]BRUNBORG IM,MOLDAL T,JONASSEN C M.Quantitation of porcine circovirus type 2 isolated from serum/plasma and tissue samp les of healthy pigs and pigs with postweaningmultisystemic wasting syndrome using a TaqMan-based real-time PCR[J].JVirol Methods,2004,122(2):171-178.
[13]CHUNGW B,CHANW H,CHAUNG H C,et al.Real-time PCR for quantitation of porcine reproductive and respiratory syndrome virus and porcine circovirus type 2 in naturally-infected and challenged pigs[J].JVirol Methods,2005,124:11-19.
[14]YANG Z Z,HABIB M,SHUAIJB,et al.Detection of PCV2 DNA bySYBR Green I-based quantitative PCR[J].JZhejiang Univ Sci B,2007,8(3):162-169.
(责任编辑:程智强)
Development and application of fluorescent quantitation PCR detection kit of porcine circovirus type 2
REN Fang-fang1,2,HU Rui-li1,2,NIJian-ping3,XU Yan2,LIChun-hua3,ZHAO Xiao4,DU Ya-nan2,ZHAO Kai1,5
(1Biotech Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai201106,China;
2Shanghai Normal University,Shanghai201306,China;3Shanghai Jiamu Biological Products Company Limited,Shanghai201106,China;4Ningxia University,Yinchuan 750021,China;
5Shanghai Key Laboratory of Agricultural Genetics and Breeding,Shanghai201106,China)
In order to develop the diagnostic technique and diagnostic kit of porcine circovirus type 2(PCV2),specific primers and a probe for the PCV2 ORF2 gene were specially designed,and the PCV2 was detected by a fluorescentquantitation PCRmethod.The tests showed that the cycle threshold Ct and the standard DNA template had an excellent linear relationship between 101—107copies permicroliter,and their correlation coefficientwas 0.9999;The variation coefficient of Ct values was 0.59%—1.05%in the intra-lot test and 19%—4.2%in the inter-lot test,there being a good repeatability;The developed detection kit had no cross reaction with hog cholera virus(HCV),porcine respiratory and reproductive syndrome virus(PRRSV)and swine pseudorabies virus(PRV),and its detection and quantitation limitswere 10 and 100 copy numbers respectively.The detection of 1 000 clinical samples by thismethod showed that the 710 samples were positive.The result indicated that this kitwas high in sensitiveness,strong in specificity and good in stability,providing a simple and rapid method for PCV2 monitoring and epidemiological survey.
Porcine circovirus type 2;Fluorescent quantitation;PCR detection;Diagnostic kit
S852.65
:A
1000-3924(2017)02-089-07
10.15955j.issn1000-3924.2017.02.17
2016-03-15
上海市闵行区重大产业化专项(2014MH076)
任方方(1987—),女,硕士,主要从事基因工程研究。Tel:021-62203047,E-mail:renfangfang668@126.com
并列第一作者:胡瑞丽(1989—),女,硕士,研究方向:基因工程。Tel:021-62203047,E-mail:hrly524@163.com
,E-mail:kzhao118@163.com

