缺氧预处理后GSK3β/STAT3信号通路在大鼠缺血性脑损伤中的作用及机制※
唐智伟,肖宗宇,吴世政,唐超群
(1.青海大学医学院,青海 西宁 810016;2.青海大学附属医院神经外科,青海 西宁 810000;3.青海省人民医院神经内科,青海 西宁 810007)
缺氧预处理后GSK3β/STAT3信号通路在大鼠缺血性脑损伤中的作用及机制※
唐智伟1,3,肖宗宇2,吴世政3*,唐超群1
(1.青海大学医学院,青海 西宁 810016;2.青海大学附属医院神经外科,青海 西宁 810000;3.青海省人民医院神经内科,青海 西宁 810007)
目的 探讨GSK3β/STAT3信号通路在缺氧预处理大鼠缺血性脑损伤中的作用及机制。方法 将70只SD大鼠随机分为正常组(N组,10只)、假手术组(S组,12只)、脑梗死组(M组,12只)、缺氧预处理+脑梗死组(HM组,12只)、缺氧预处理+脑梗死+抑制剂组(HMI组,12只)、缺氧预处理+脑梗死+生理盐水组(HMN组,12只),采用Longa的改良线栓法建立大脑中动脉栓塞模型(MCAO),造模成功24小时后对大鼠进行神经功能评分,同时以TTC染色法测脑梗死的面积、免疫组织化学法检测NeuN、p-STAT3在梗死区纹状体的表达、Western blot法检测各组大脑皮质p-STAT3、p-GSK3β的表达情况。结果 HM、HMN、HMI组与M组相比较,大鼠神经功能评分及脑梗死体积较单纯M组的体积显著降低(P<0.05);p-GSK3β、p-STAT3的表达量较单纯M组显著减少(P<0.05),但NeuN表达较单纯M组增加。结论 缺氧预处理在大鼠缺血性脑损伤中有神经保护作用,大鼠缺血性脑损伤后引起了GSK3β/STAT3信号通路的激活,抑制该信号通路后可减少神经元的死亡,对神经功能起到保护作用。
缺血性脑损伤 大脑中动脉栓塞 GSK3β/STAT3信号通路
缺血性脑卒中最有效的治疗方法是介入取栓及动静脉溶栓,但两者的有效治疗时间窗必须在4~6小时内,这其中溶栓治疗方法虽然在一部分患者身上可以取得较明显的效果,但是对于梗死范围较大及发病超过6小时的患者而言,治疗效果已不明显,且再出血风险较高,因此限制了其在临床上的广泛应用。所以寻找缺血性卒中后有效的脑保护机制、改善神经功能已成为当今研究的热点。信号转导与转录激活因子3(STAT3)可通过介导多种细胞因子参与到相关细胞的活化、增殖和凋亡等多种生理过程发挥关键作用,是近年来细胞因子在该领域研究的热点[1]。其中GSK3β/STAT3信号转导通路参与了一系列中枢神经系统疾病的炎性病理过程[2]。但GSK3β/STAT3信号转导通路在大鼠脑梗死模型中的作用如何尚不明确。本研究通过建立大鼠大脑中动脉栓塞(MCAO)模型,通过GSK3β特异性抑制剂抑制该通路,观察NeuN、p-GSK3β、p-STAT3的表达水平、脑梗死体积及神经功能缺损等相关指标,探讨GSK3β/STAT3信号转导通路在MCAO中的作用及机制,为脑梗死的进一步研究提供新的参考策略。
1 材料与方法
1.1 动物及分组
雄性SD大鼠70只,质量200~250 g,由北京维通利华动物实验中心提供,随机分为正常组、假手术组、脑梗死组、缺氧预处理+脑梗死组、缺氧预处理+脑梗死+抑制剂组、缺氧预处理+脑梗死+生理盐水组。其中,正常组10只,其余各组均为12只。
1.2 主要试剂选择
兔抗小鼠NeuN单克隆抗体、兔抗鼠p-STAT3(pTyr705)单克隆抗体及p-GSK3β多克隆抗体购于Abcam公司,SABC免疫组化试剂盒及DAB显色试剂盒购自福州迈新生物技术开发公司,GSK3β/STAT3特异性通路阻断剂(SB216763)及2,3,5-三苯基氯化四氮唑(TTC染色剂)购自美国Sigma公司。
1.3 大脑中动脉梗塞模型的建立
大鼠大脑中动脉栓塞模型的制备参考Longa法。大鼠用10%的水合氯醛(3.6mL/kg)腹腔注射麻醉后常规消毒颈部皮肤,用眼科剪在颈部中线处剪开一个约1.5 cm的小口,用钝器依次分离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。用4号外科线结扎CCA的近心端,远心端用动脉夹夹毕,然后在距CCA分叉部4 mm处剪一小口,将栓线插入到ICA,从CCA分叉处算起,当插入深度约为18 mm或感轻微阻力时,证明大脑中动脉已闭塞。手术结束再次对切口处进行常规消毒并缝合切口。假手术组同样分离CCA、ECA、ICA,结扎近心端但不插线栓。术中及术后用热灯保持大鼠体温(直肠温度约在38℃)。
1.4 神经功能缺失情况评定
采用Longa的5级标准法在大鼠术后24 h进行神经功能评分,0分:无神经功能缺损症状;1分:不能完全伸展对侧前爪;2分:行走时向对侧转圈;3分:行走时向对侧倾倒;4分:不能自行行走,意识丧失;0分及意识丧失者剔除,评分越高说明神经元功能缺失症状越严重。
1.5 脑梗塞面积的测量
各组随机取4只大鼠,过度麻醉后取新鲜脑组织(去除小脑和覆盖在皮层表面的软脑膜)。然后将脑组织放入脑槽后沿冠状位切成约2 mm厚的切片,将切片放入2%的TTC溶液中,在37 ℃水浴箱中避光孵育10 min,用4%的多聚甲醛固定后拍照。梗死灶区呈白色、非梗死区呈红色。最后用ImageJ软件分析、计算脑梗塞面积。
1.6 组织切片的制备
随机取4只大鼠,充分麻醉后剪开腹部皮肤,逐步向上剪开膈肌,充分暴露心脏,经左心室向主动脉插管,待右心耳充盈后将其剪开。灌注时先用0.9%的生理盐水500 mL灌注,待肝脏逐渐变白后,再用4%的多聚甲醛磷酸盐缓冲液500 mL灌洗直到全身僵硬。灌注完毕后迅速断头取脑,将脑组织快速置于20%的蔗糖多聚甲醛溶液中,24 h后再将其置于30%的蔗糖多聚甲醛溶液中,使其充分脱水固定。常规OCT包埋剂包埋,准备冰冻切片,自前往后连续行冠状位切片,厚约30 μm,将脑片保存于新鲜的PBS溶液中,放置4 ℃冰箱冷藏备用。
1.7 NeuN及p-STAT3表达的检测
采用SABC法,步骤简述如下:(1)常规冰冻切片、挑片,将脑片放置于盛有PBS溶液的24孔板中;(2)用PBS(pH=7.4)溶液冲洗3次,每次5 min;(3)滴加内源性过氧化酶阻断剂3滴,水平圆周摇床慢摇30 min;(4)PBS(pH=7.4)溶液冲洗3次,每次5 min;(5)用山羊血清液3~4滴封闭60 min;(6)单孔分别滴加NeuN一抗(1:1000)、p-STAT3(1:500)约200 μL,室温孵育1 h后置4 ℃冰箱过夜;(7)将孔板从冰箱取出,室温孵育1 h;(8)用PBS(pH=7.4)溶液冲洗6次,每次5 min;(9)加二抗3~4滴室温孵育2 h;(10)用PBS(pH=7.4)溶液冲洗6次,每次5 min;(11)滴加链霉菌抗生物素蛋白-过氧化酶,室温孵育30 min;(12)用PBS(pH =7.4)溶液冲洗3次,每次5 min;(13)用DAB染色,待充分显色后再贴片,隔夜晾干;(14)用不同浓度酒精分别脱水,用二甲苯致透明化,用中性树胶封片,显微镜下观察。
1.8 p-STAT3及p-GSK3β表达的检测
各组随机取6只大鼠,充分麻醉后断头取脑,称取脑梗侧皮层脑组织约100 mg,以100:1:1的比例分别加入RIPA、PMSF和磷酸酶抑制剂匀浆后提取蛋白。用BCA法定量蛋白后,每个加样孔上样20 μg,等量加入5%浓缩胶中及12%的聚丙烯酰胺分离胶中电泳,完毕后切取目的条带胶段。将电流调至200 mA(30min至45min不等),将蛋白转移至PVDF膜上。用新鲜配制的5%脱脂奶粉封闭液封闭2 h,加入p-STAT3兔抗鼠单克隆抗体(1:2000)、p-GSK3β兔抗鼠多克隆抗体(1:1000)及抗β-actin(1:5000)抗体过夜(4℃)。用TBST洗膜3次,每次10 min,加入二抗(山羊抗兔IgG 1:5000,山羊抗小鼠IgG 1:5000)孵育,用TBST洗膜3次,每次10 min,以ECL发光液显色,记录实验结果。
过了几天,老福又去医院看母亲。母亲一本正经地说:“记得我上次跟你说的隔壁那个老罗吗?她叫罗素青,昨天出院了,听我说你是当警察的,还小有名气,叫我无论如何把你请到她家去,说是她知道有人要害死她。你就抽时间去一趟吧?医生觉得她虽然是小病大养,但精神紧张,对身体不好,你就帮着宽慰她一下吧。她没结过婚,一个人挺可怜的。”
1.9 统计学处理
采用SPSS21.0软件进行统计学分析,计量资料采用均数±标准差,多组间比较采用单因素方差分析,检验水准α=0.05。
2 结果
2.1 各组间神经功能缺损症状评分的比较(表1)
大脑中动脉闭塞术后24 h进行神经功能缺损症状评分。以Longa5为标准进行评分,结果显示HM组的大鼠神经缺损程度与单纯M组大鼠的神经缺损程度有明显差异,而给予抑制剂后,神经功能评分降低,显示神经功能的保护作用显现。
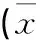
表1 M组、HM组、HMN组及HMI组大鼠脑梗死后神经功能评分结果表±s)Table 1 Neurological function score of M,HM,HMN,HMI group after cerebral infarction in ±s)
*:与M组相比较P<0.01;#:与HM比较P<0.01;Δ:与HMN组比较P<0.01.
2.2 脑卒中后梗塞面积的计算(表2)
本实验旨在研究缺氧预处理对大鼠脑梗死面积的影响,联合特异性通路阻断剂,预测GSK3β/STAT3信号转导通路在缺氧预处理大鼠脑梗死面积的影响。TTC染色后出现白色区域,表明大脑中动脉梗死模型制作成功。白色区域表示梗死区域、红色区域表示正常组织。
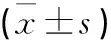
表2 M组、HM组、HMN组及HMI组大鼠脑梗死面积比较Table 2 Comparison of rats’ cerebral infarction area in group M,HM,HMN and ±s)
*:与M组相比较P<0.01;★:与HM比较P<0.01;Δ:与HMN组比较P<0.01.
2.3 各组大鼠NeuN表达的比较(图1)
图1 各组大鼠纹状体内NeuN的表达图(400×)
Figure 1 the expression of NeuN in striatum of rats(400×)
2.4 各组大鼠免疫组化p-STAT3表达的比较(图2)
图2 各组大鼠纹状体内p-STAT3(免疫组化)的表达图(400×)
Figure 2 The expression of p-STAT3 in striatum of rats(400×)
2.5 各组大鼠神经元NeuN阳性细胞及p-STAT3阳性细胞表达的比较(表3)
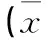
表3 各组大鼠神经元NeuN阳性细胞及p-STAT3阳性细胞表达的比较±s)Table 3 Comparison of the expression of NeuN positive cells and p-STAT3 positive cells in the neurons of each group in ±s)
Δ:与N组、S组相比较P<0.05;★:与HM、HMN组相比较P<0.05.
2.6 各组大鼠脑组织Western Blot的p-STAT3及其p-GSK3β蛋白表达的比较(图3)
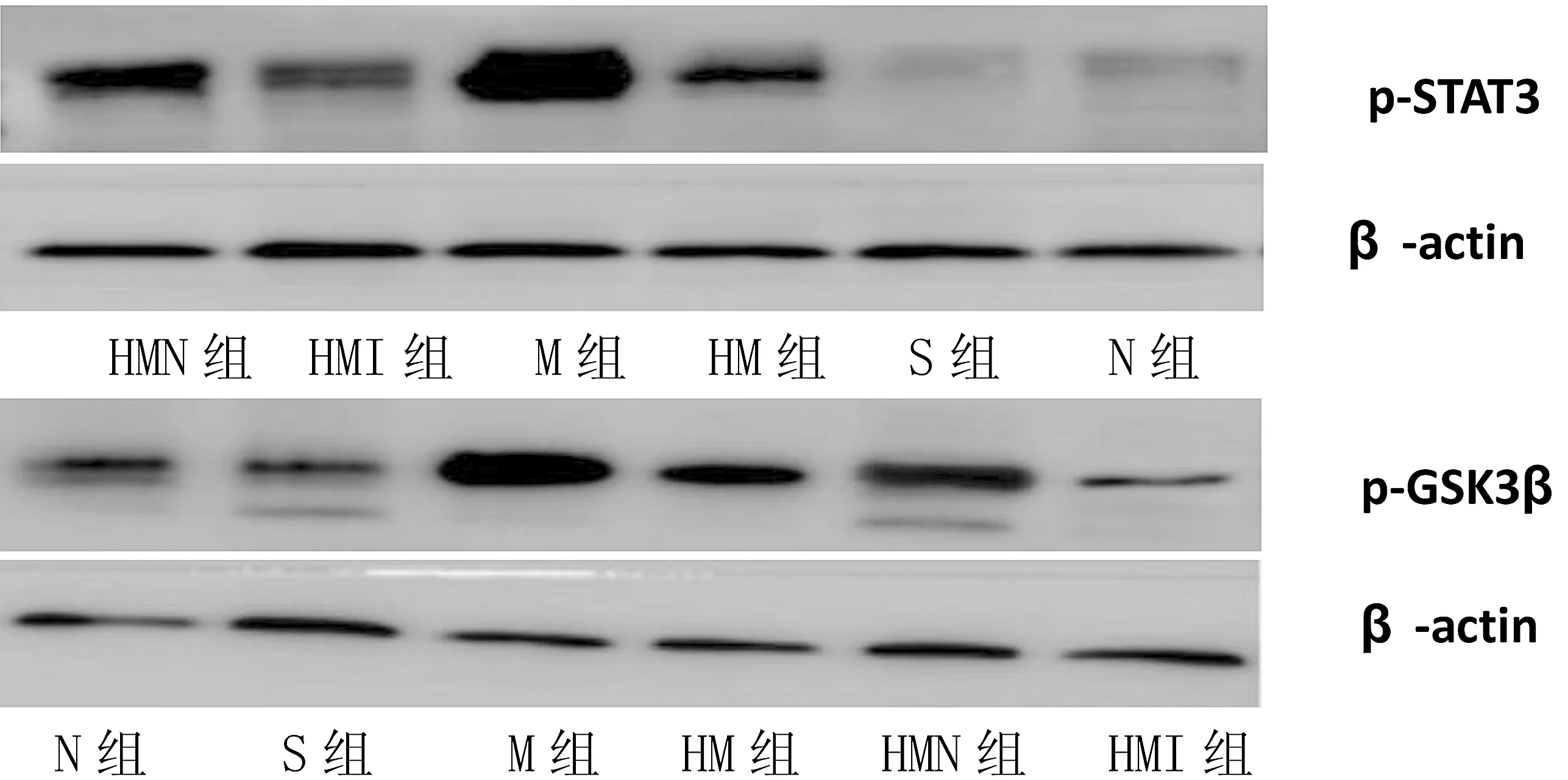
图3 各组大鼠脑组织Western Blot的p-STAT3及其p-GSK3β蛋白表达的比较图
Figure 3 Comparison of p-STAT3 and p-GSK3 protein expression in brain tissue of each group in rats
2.7 各组大鼠p-STAT3及p-GSK3β蛋白的相对表达量表达的比较(表4)
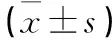
表4 各组大鼠p-STAT3及p-GSK3β蛋白的相对表达量表达的比较表Table 4 Comparison of the relative expression of p-STAT3 and p-GSK3 protein in rats of each ±s)
Δ:与N组、S组相比较,P<0.01;★:与HM比较P<0.01;*:与HM、HMN组相比较P<0.05.
3 讨论
糖原合成酶激酶(GSK-3),它是构成活性丝氨酸/苏氨酸的蛋白激酶[3],主要位于胞浆,在脑内含量丰富,在神经元及神经胶质细胞内均有存在[4],GSK-3由两个亚型组成:GSK-3a、GSK-3β。有研究认为GSK-3β激活后可能参与细胞的促凋亡机制,包括P53调控、Bax磷酸化、β-catenin降解等;另外GSK-3β在外周及脑组织炎症反应中的作用也已经被广泛证实,它参与Toll样受体受刺激后外周血单核粒细胞的促炎因子及抗炎因子的产生[5];它还可以促进小胶质细胞的迁移和活化,导致TNF-a的产生。STAT3是STAT家族的一个重要成员,目前已知的研究结果表明,STAT3的存在对神经系统的发育和分化起着至关重要的作用。此外,STAT3可以在许多信号传递过程系统中被激活而发挥作用。1996 年,Planas[6]首次报导,大鼠短暂性脑缺血4 天后,缺血区小胶质细胞活化,表达大量的STAT3,与此同时同侧皮层和纹状体内STAT3的表达大量增加。此后一系列实验证实:缺血后STAT3的活化与组织对缺血的反应密切相关。对STAT3活化时程的研究表明:缺血中心区的STAT3在3.5 h开始出现,24 h达到高峰,以后逐渐减少[7]。表明STAT3可能参与了缺血早期的反应。本实验发现,HM组及HMI组与单纯M组相比较,神经功能评分及TTC染色脑梗死面积明显降低(P<0.05),且两者差异有统计学意义。说明缺氧预处理后及该信号通路被抑制后,可通过减轻脑梗死急性期炎症反应在内的一系列病理过程从而减少脑梗死面积,最终起到神经功能叠加保护作用。此外NeuN作为在神经元内的特异性蛋白质,它被认为是神经元的特异性标记物,HM组与单纯M组相比较,NeuN阳性细胞表达明显增加,且抑制GSK3β/STAT3该信号通路后,NeuN的表达水平与HM组NeuN阳性细胞表达差异有统计学意义,表明经缺氧预处理和抑制该信号通路可改善因脑梗死而导致的神经细胞及神经胶质细胞的死亡,起到双重神经保护效应。另外在用Western Blot法检测p-GSK3β、p-STAT3的表达中也发现:M组与N及S组相比较,M组的p-GSK3β及p-STAT3β表达明显升高,前已述p-STAT3可在脑梗死后24 h表达达到最高峰,HM组及HMI组两者表达显著减少,且与单纯M组相比较表达差异有统计学意义,进一步表明抑制GSK3β/STAT3信号通路及行缺氧预处理后均可以通过减轻两者的表达来下调炎性因子表达、增加抗炎因子表达最终减轻炎症反应,改善神经功能缺损症状。
1986年Murry[8]等在研究心肌缺血中提出预处理的概念。预处理保护作用在多种动物身上已经得到明确证实。并且可以用缺氧预处理来模拟其保护作用,缺氧预处理是一个复杂的、多种因素及多机制参与的保护过程,近年的研究表明脑组织的缺氧预适应同样可产生内源性神经保护作用,其保护机制相当复杂,涉及神经化学、分子神经生物学等诸方面的变化[9]。目前缺氧预处理主要集中于机制研究,临床应用仍有一段距离,但由于其保护作用明确,在临床上有广泛的应用前景。在本实验中证实缺氧预处理对缺血性脑损伤具有的神经保护作用,可能与缺氧预处理的一系列内源性保护机制相关。本实验显示HM组与单纯M组相比较,p-GSK3β及p-STAT3的表达显著减少,在GSK3β/STAT3信号通路中,因GSK3β位于STAT3上游,目前已有研究证实缺氧预处理可以增加脑组织Toll样受体的表达。因此,我们推测缺氧预处理后可能出现以下两种保护机制:(1)缺氧预处理后,Toll样受体表达增加,其中的TLR5可能使通路下游的起保护作用的Akt(蛋白激酶B)磷酸化表达增加,P38表达下调;(2)缺氧预处理后可通过一系列通路使p-GSK3β表达减少,最终两者的共同通路是通过减少STAT3的表达最终下调炎性因子的表达、促进抗炎因子表达,发挥对脑梗死的内源性保护作用。
[1]Rawlings JS,Rosler KM,Harrison DA.The JAK/STAT signaling pathway[J].Journal of cell science,2004,117(8):1281-1283.
[2]Bright JJ,Kanakasabai S,Chearwae W,et al.PPAR regulation of inflammatory signaling in CNS diseases[J].PPAR research,2008,2008:658-660.
[3]Beurel E,Blivet-Van Eggelpo⊇l MJ,Kornprobst M,et al.Glycogen synthase kinase-3 inhibitors augment TRAIL-induced apoptotic death in human hepatoma cells[J].Biochemical pharmacology,2009,77(1):54-65.
[4]Perez-Costas E,Gandy JC,Melendez-Ferro M,et al.Light and electron microscopy study of glycogen synthase kinase-3β in the mouse brain[J].PLoS One,2010,5(1):e8911.
[5]Hoshi M,Takashima A,Noguchi K,et al.Regulation of mitochondrial pyruvate dehydrogenase activity by tau protein kinase I/glycogen synthase kinase 3beta in brain[J].Proceedings of the National Academy of Sciences,1996,93(7):2719-2723.
[6]Planas AM,Soriano MA,Berruezo M,et al.Induction of Stat3,a signal transducer and transcription factor,in reactive microglia following transient focal cerebral ischaemia[J].European Journal of Neuroscience,1996,8(12):2612-2618.
[7]Suzuki S,Tanaka K,Nogawa S,et al.Phosphorylation of signal transducer and activator of transcription-3(Stat3)after focal cerebral ischemia in rats[J].Experimental neurology,2001,170(1):63-71.
[8]Murry CE,Jennings RB,Reimer KA.Preconditioning with ischemia:A delay of lethal cell injury in ischemic myocardium[J].Circulation,1986,74(5):1124-1136.
[9]Shao G,Gong KR,Li J,et al.Antihypoxic effects of neuroglobin in hypoxia-preconditioned mice and SH-SY5Y cells[J].Neurosignals,2009,17(3):196-202.
Mechanism of GSK3 beta /STAT3 signaling pathway in hypoxic preconditioning in rats with ischemic brain injury
TANG Zhi-wei1,3,XIAO Zong-yu2,WU Shi-zheng3*,TANG Chao-qun1
(1.Medical College of Qinghai University,Xining,Qinghai,810001; 2.Department of Neurosurgery,Affiliated Hospital of Qinghai University,Xining,Qinghai 810001; 3.Department of Neurology,Qinghai Provincial People’s Hospital,Xining,Qinghai 810000)
Objective To investigate the role of GSK3β/STAT3 pathway in hypoxic preconditioning ischemic brain injury in rats.Methods 70 male SD rats were randomly divided into normal group(group N,10 rats),sham operation group(group S,12 rats),cerebral infarction group(group M,12rats),cerebral hypoxic preconditioning and obstruction group(group HM,12 rats),hypoxia preconditioning and brain obstruction and inhibitor group(group HMI,12 rats),hypoxia and cerebral obstruction treatment and saline group(group HMN,12 rats),the establishment of middle cerebral artery occlusion model with modified Longa line embolism method(MCAO),The neurological function score was performed 24 hours after modeling sullessful,cerebral infarction avea was measured by TTC staining,The expression of p-STAT3 and NeuN in the striatum of the infarct area was detected by immunohistochemistry.The expression of p-STAT3 and p-GSK3β in the cerebral cortex of each group were detected by Western Blot method.Results Compared with the M group,the neurological function score and infarct volume in HM,HMN,HMI groups were decreased significantly(P<0.05);the expression of p-GSK3β,p-STAT3 were significantly decreased(P<0.05)than M group;but the expression of NeuN was higher than M group.Conclusion Hypoxic preconditioning treatment has a neuroprotective effect on ischemic brain injury in rats.The ischemic injury of rat brain can cause the activation of GSK3β/STAT3 signaling pathway.Inhibition of this signaling pathway can reduce neuronal death and has the protective effect on the neural function.
Ischemic brain injury Middle cerebral artery occlusion GSK3β/STAT3 signaling pathway
R74
A
10.13452/j.cnki.jqmc.2017.01.007
2016-10-10
※:青海省科技厅自然科学基金青年项目(2015-ZJ-943Q);*:通信作者,教授,博士生导师,主任医师, E-mail: wushizheng2005@hotmail.com 唐智伟(1987~),男,汉族,湖南籍,在读硕士

