EPAS1、ANGPTL4基因多态性与慢性高原病遗传易感性※
胥 瑾,王 展,胡 蕾,张 婉,杨应忠
(1.青海大学医学院基础医学部;2.青海大学附属医院肝胆外科;3.四川大学2014级华西临床医学院护理系;4.青海大学医学院中医系13级中医班;5.青海大学医学院高原医学研究中心)
EPAS1、ANGPTL4基因多态性与慢性高原病遗传易感性※
胥 瑾1,王 展2,胡 蕾3,张 婉4,杨应忠△5
(1.青海大学医学院基础医学部;2.青海大学附属医院肝胆外科;3.四川大学2014级华西临床医学院护理系;4.青海大学医学院中医系13级中医班;5.青海大学医学院高原医学研究中心)
目的 探讨EPAS1和ANGPTL4基因的遗传多态性是否和慢性高原病(Chronic mountain sickness,CMS)易感性有关。方法 采用病例对照研究方法,将30例汉族CMS患者(CMS-s)、51例健康汉族者(CMS-r)和131例健康藏族者(HLT)作对照研究,所有研究对象都来自青海平均海拔3 760米的玉树地区。采用Sequenom MassARRAY 法检测研究对象EPAS1基因的SNP位点rs4953388和ANGPTL4基因的SNP位点rs2278236基因型分布,比较各SNP位点在三组之间的差异。结果EPAS1基因的SNP位点rs4953388基因型GG在CMS-s和 CMS-r两组分别有28例(93.4%)、32例(62.7%),P=0.004。rs4953388的基因型AA在HLT组的频率显著高于CMS-s、CMS-r组,分别为57例(44.2%)、1例(3.3%),P=0.0001;57例(44.2%)、5例(9.8%),P=0.0001。ANGPTL4基因的SNP位点rs2278236的基因型CC在CMS-s和 CMS-r两组的分布频率有显著性差异,分别为28例(93.4%)、39例(78.5%),P=0.027。基因型CT在HLT组的分布频率明显高于CMS-s组,分别为28例(21.7%)、1例(3.3%),P=0. 022。结论EPAS1基因和ANGPTL4基因的单核苷酸多态性不仅在CMS患者与同海拔健康汉族之间存在很大差异,而且在健康藏族和汉族人群中也存在巨大差异。这两个基因的遗传易感性既和CMS的易感性相关,又和藏、汉族对低氧环境的适应差异有关。
多态性EPAS1ANGPTL4 慢性高原病 易感性
青藏高原是世界上海拔最高的高原之一,慢性高原病(Chronic mountain sickness,CMS)发生在5%~18%的青藏高原居民中[1],其中大部分为移居高原的汉族[2]。虽然高原低氧环境被认为是高原居民发生CMS的始动因素,但CMS的具体发病机制还不十分清楚。
EPAS1、ANGPTL4(Endothelin receptors type A)基因是被XP-EHH(Cross Population Extended Haplotype Homozogysity)法和iHS(integrated haplotype score)法检测出与藏族低氧适应相关的正选基因[3]。是否CMS患者、移居高原的汉族和世居高原的藏族健康者具有不同的EPAS1、ANGPTL4基因基因型,是否EPAS1、ANGPTL4基因的多态性和CMS的易感性相关尚不十分清楚。本研究为了明晰EPAS1、ANGPTL4基因的多态性与CMS易感性间的可能关系,检测了青海玉树地区(海拔3700米以上)30例CMS患者(Chronic mountain sickness-susceptibility,CMS-s)、51例汉族健康者(Chronic mountain sickness-resistance,CMS-r)和131例藏族健康者(High altitude Tibetan,HLT)的EPAS1基因的SNP位点rs4953388、ANGPTL4基因的SNP位点rs2278236。
1 对象与方法
1.1 研究对象选择
收集青海玉树地区57例汉族CMS者(CMS-s,男性27例,女性30例,平均年龄42.89±8.17岁)、51例汉族健康者(CMS-r,男性44例,女性7例,平均年龄40.51±10.07 岁)和129例藏族健康对照者(HLT,男性74例,女性55例,平均年龄45.14±11.78岁)资料,汉族CMS和汉族健康者都为移居玉树地区时间≥3年以上者,藏族健康者都为世居玉树的青藏高原康巴藏族。CMS患者是在2011年5月至2013年6月在玉树州人民医院被诊断为CMS者。纳入标准为青海标准[2],男性血红蛋白浓度≥21 g/dL,女性血红蛋白浓度≥19 g/dL,并且伴有三种或更多以下症状:气短、心悸、睡眠紊乱、紫绀、头疼、耳鸣及感觉异常等。随机选择年龄、性别、工作条件和CMS组病例一致的在门诊常规体检的健康汉族、藏族者作为对照组。用迈德血液分析仪(BC-2300,深圳,中国)检测静脉血的血红蛋白(Hb)、红细胞压积(HCT);脉搏氧饱和度仪(Ohmeda 3700 Pulse Oximeter,Datex-Ohmeda,Boulder,Colorado,USA)检测血氧饱和度。所有的研究对象都没有呼吸病史和心脏病史。该项研究获得青海大学医学院伦理委员会批准。
1.2 DNA提取和分型检测
采用Gentra Puregene全血试剂盒(Qiagen, Germany),按照标准步骤从受试者的静脉血中提取基因组DNA。用分光光度计定量,琼脂糖凝胶电泳质检,基因组DNA电泳条带通常不小于20 kb。将质检合格的DNA将浓度调整到 50 ng/μL,转移至 384 孔板,-20 ℃储存备用。采用Sequenom MassARRAY®SNP(博奥生物集团有限公司)分型检测方法,经过多重PCR技术、MassARRAY iPLEX单碱基延伸技术和基质辅助激光解吸附电离飞行时间质谱分析质谱技术进行分型检测。将包含SNP位点区域的DNA模板通过PCR技术扩增,再使用特异的延伸引物与PCR产物进行单碱基延伸反应。由于多态性位点碱基不同,延伸产物不同的末端碱基将导致延伸后的产物分子量的差异,由SNP多态性引起的碱基差异通过分子量的差异体现出来,使用基质辅助激光解吸附电离飞行时间质谱分析质谱技术检测延伸产物分子量的大小进行SNP分型。使用Sequenom公司Genotyping Tools、MassARRAY Assay Design软件设计待测SNP位点的PCR扩增引物及单碱基延伸引物。
1.3 统计学方法
2 结果
2.1 一般表型资料结果
CMS患者和对照组的平均年龄、性别及动脉氧饱和度(SaO2)、血红蛋白(Hb)和血细胞比容(HCT)见表1。三组年龄做显著性检验无差异,性别做显著性检验发现男性CMS的发病率比女性高,符合已知的CMS在男性中高发的倾向[2]。CMS-s组和CMS-r组、HLT组比较,SaO2明显降低,Hb和HCT明显升高(P<0.05)。
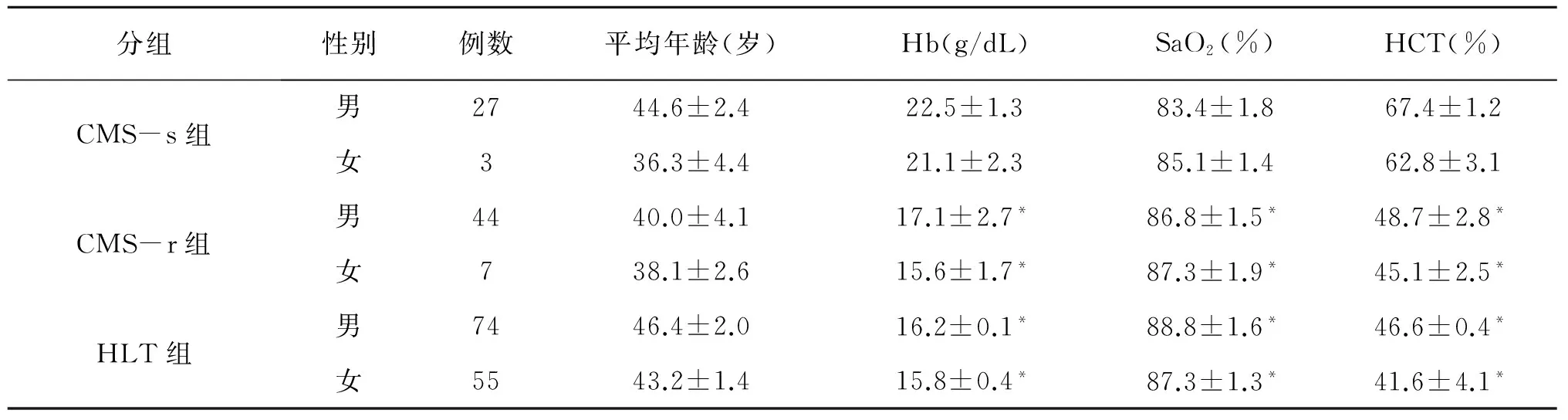
表1 CMS-s组、CMS-r组和HLT组的一般表型资料Table 1 Phenotype parameters of the CMS-s,CMS-r and HLT group
*:与CMS-s组同性别比较,P<0.05.
2.2 基因型和等位基因的分布结果
CMS-s组和对照组都符合Hardy-Weinberg平衡分布。我们比较了基因型、等位基因频率分布及比值比(OR)、95%可信区间(95%CI)发现,EPAS1基因的SNP位点rs4953388的基因型GG在CMS-s和CMS-r两组之间有明显差异,见表2。该基因型人群CMS发病的风险率高[OR(95%):12.250(1.513-99.158),P=0.004]。同时,等位基因G在CMS-s组中的频率明显高于CMS-r组[OR(95%):5.846(1.679-20.362),P=0.002]。rs4953388的基因型AA在HLT组的频率显著高于CMS-s、CMS-r组,分别为[133.000(16.458-1074.797),P<0.0001]和[30.400(9.825-94.064),P<0.0001]。等位基因A在HLT组中的频率显著高于CMS-s、CMS-r ,分别为[39.357(11.975-129.348),P<0.0001]、[6.732(3.977-11.397),P<0.0001]。
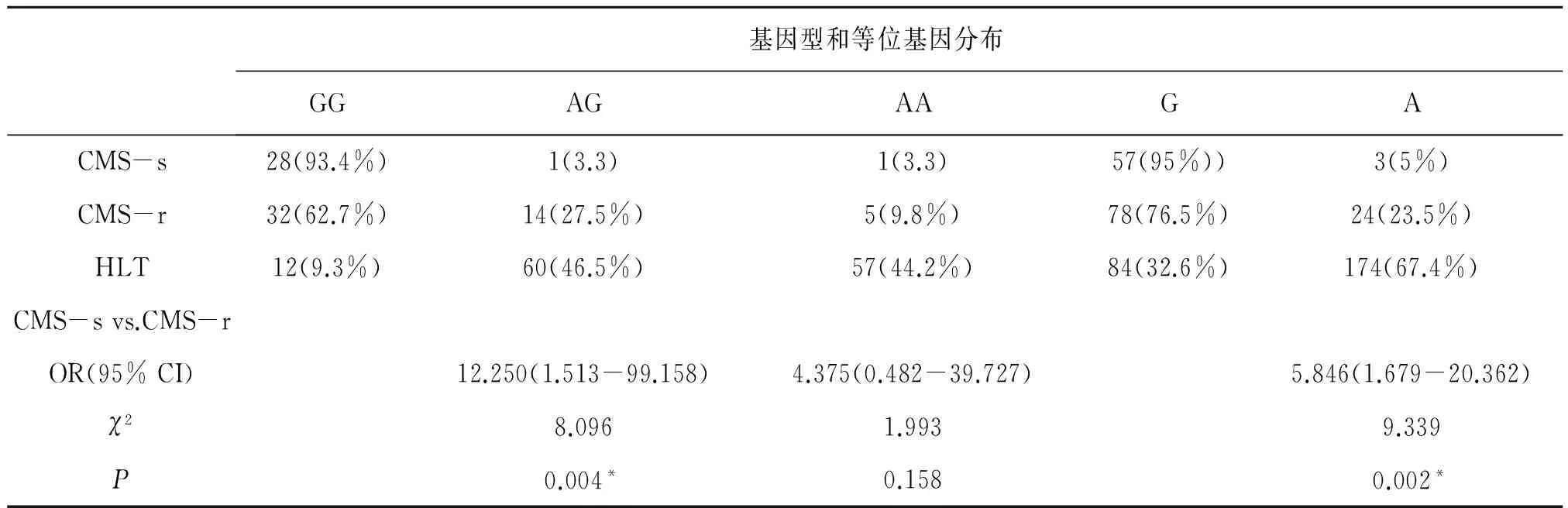
表2 rs4953388在CMS-s组、CMS-r组和HLT组基因型和等位基因的频率分布及比较[例(%)]Table 2 Comparison of rs4953388 genotype distributions,allele frequencies in CMS-s,CMS-r and HLT groups
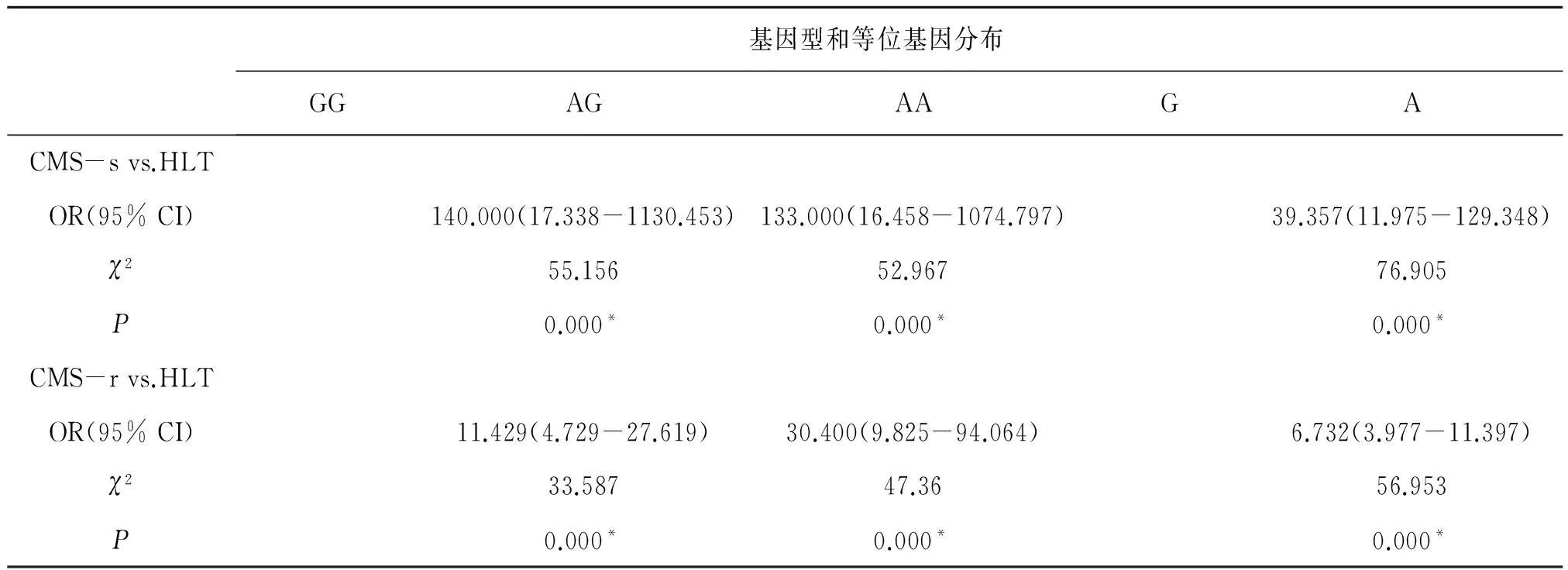
续表:
*:P<0.05.
ANGPTL4基因的SNP位点rs2278236的基因型CC在CMS-s和 CMS-r之间有显著性差异,见表3。该基因型人群CMS发病的风险率高[OR(95%):7.897(0.963-64.744),P=0.027]。基因型CT在HLT组的频率显著高于CMS组,为7.762(1.011-59.585),P<0.022。
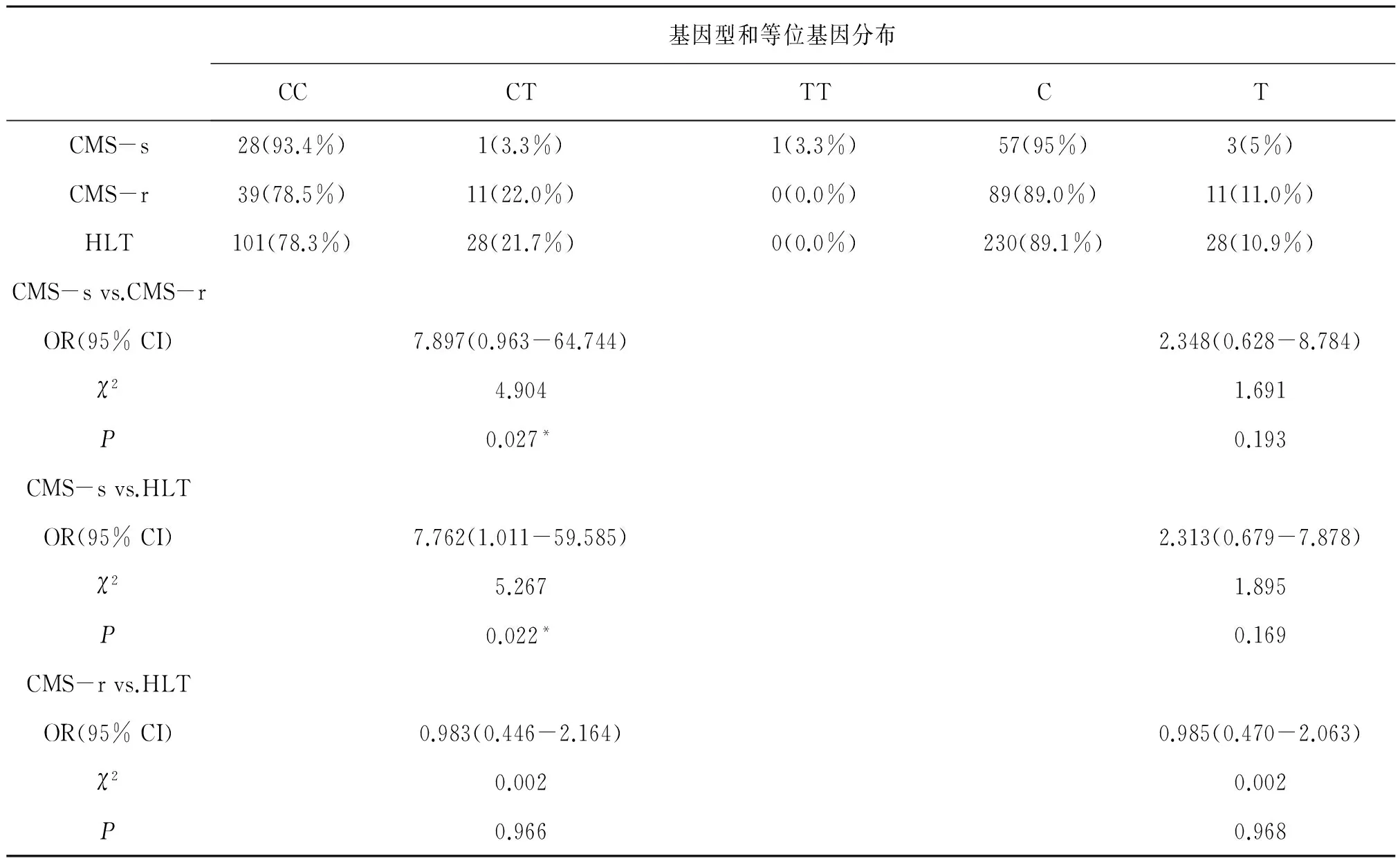
表3 rs2278236在CMS-s组、CMS-r组和HLT组基因型和等位基因的频率分布及比较[例(%)]Table 3 Comparison of rs2278236 genotype distributions,allele frequencies in CMS-s,CMS-r and HLT groups
*:P<0.05.
3 讨论
我们在青海玉树地区采集了明确临床诊断为CMS患者和同海拔汉族健康、藏族健康对照者的外周血白细胞DNA,检测了三组研究对象的DNA序列中EPAS1基因的SNP位点rs4953388和ANGPTL4基因的SNP位点rs2278236的多态性,通过统计学分析(比较基因型和等位基因分布的两组差异)发现,这两个SNP的分布频率在CMS患者组和对照组中存在显著差异。国内外报道认为,无论是移居青藏高原的汉族还是移居南美洲的西班牙人,CMS在这些人群中的发病率明显高于当地的世居者。相反,青藏高原的世居的藏族和夏尔巴人极少发生CMS,提示CMS发病具有明显的种族差异和个体易感倾向[4]。因此,本研究比较世居藏族和移居高原汉族CMS的遗传易感基因多态性正是从遗传学角度解释CMS发病率的差异。另外,诱发CMS形成的基因编码产物在CMS患者和高原健康人群之间的表达水平差异明显,造成这种差异的最根本原因可能在于这些基因CMS易感者体内存在特异的基因型[5]。与CMS发病相关的基因大多在呼吸和循环系统的氧感受作用中发挥重要功能,而这些基因也和藏族的高原适应性密切相关,其中就包括EPAS1基因和ANGPTL4基因。
人的EPAS1基因位于2p16-21,是重要的低氧相关基因。藏族包含EPAS1的基因组区域表现出明显的多态性[6],多篇报道证实了其多态性和藏族体内较低的血红蛋白浓度密切相关[7-9]。最近的研究显示,EPAS1基因与高原世居藏族人群高原适应性密切相关,与血红蛋白浓度高度关联的EPAS1基因单核苷酸多态位点在藏族和汉族人群中存在巨大差异[10]。我们的研究也证实了这一点:EPAS1基因的SNP位点rs4953388的基因型AA在健康藏族(HLT)组的频率显著高于CMS-s、CMS-r组,分别为[140.000(17.338-1130.453),P<0.0001]、[11.429(4.729-27.619),P<0.0001]。
同时,等位基因A在HLT组中的频率显著高于CMS-s组和CMS-r,分别为[39.357(11.975-129.348),P<0.0001]、[6.732(3.977-11.397),P<0.0001]。我们还发现了EPAS1基因的SNP位点rs4953388的基因型GG和等位基因G在CMS-s和CMS-r两组之间有明显差异,分别为[OR(95%):12.250(1.513-99.158),P=0.004]、[OR(95%):5.846(1.679-20.362),P=0.002]。说明EPAS1基因的单核苷酸多态性不仅在藏族健康和汉族健康人群中存在巨大差异,同时在CMS患者和同海拔汉族健康者之间也存在很大差异,这和Hanaoka等[11]的关于EPAS1基因的多态性与高原疾病、高原适应的关联性研究结果一致。CMS患者和健康藏族的EPAS1基因上有几个SNP位点的等位基因分布表现出明显的不同[12],其中rs12619696、rs13419896、rs4953354和rs1868092等SNP位点被多次报道[13,14]。EPAS1基因的启动子功能区域核苷酸序列特异性和藏族的高原适应性显著相关[15],说明EPAS1基因的多态性的确能够影响机体在高原低氧下的生理反应,CMS患者群体由于在EPAS1基因的某些SNP位点上存在和高原适应民族显著不同的基因型,使他们不能够适应长期低压低氧环境,从而出现血红蛋白浓度过高的现象。
人ANGPTL4基因位于19p13.3,参与机体血管生成、脂肪代谢等过程[16]。Buroker等[17]发现ANGPTL4基因的多个SNP位点和急性高原病密切相关,我们的研究证实该基因SNP位点rs2278236和CMS的易感性也是密切相关的:ANGPTL4基因的SNP位点rs2278236的CC基因型人群的CMS发病的风险率高:[OR(95%):7.897(0.963-64.744),P=0.027]。同时,基因型CT在HLT组的频率明显高于CMS-s组[7.762(1.011-59.585),P=0.022]。说明ANGPTL4基因遗传易感性既和CMS的易感性相关,又和藏、汉族对低氧环境的适应差异有关。
本研究采用的Sequenom基因分型技术是中等通量SNP分型的代表技术,其核心技术为基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)技术。检测原理为PCR扩增后的产物,加入SNP序列特异延伸引物,在需要检测的SNP位点上,延伸1个碱基,再用质谱仪检测其分子量。同一SNP位点不同等位基因的延伸产物至少具有16Da的分子量差异,因此可以检测到该位点的不同基因型。这种分型方法分析准确:可重复性高,直接检测待测物分子量,准确度超过99.7%。同时该法定制灵活,样本量的大小、SNP位点的位置和数量等都可以自由选择。
CMS是高原低氧的环境因素和许多微效致病基因共同作用的结果,其中诱导CMS形成的基因产物在CMS患者和高原习服人群之间的表达存在显著性差异[18]。本研究证实了EPAS1基因的SNP位点rs4953388及ANGPTL4基因的SNP位点rs2278236的多态性和CMS的易感性密切相关,为CMS的进一步预防和治疗提供了新的理论线索。这两个和CMS遗传易感性密切相关的基因,需要进一步在动物实验、细胞学实验等多层面深入研究,从而更深层次阐明其在CMS发生机制中发挥的作用。
[1]Windsor JS,Rodway GW.Heights and haematology:the story of haemoglobin at altitude[J].Postgrad Med J,2007,83:148-151.
[2]Murphy WG.The sex difference in haemoglobin levels in adults-mechanisms,causes,and consequences[J].Blood Rev,2014,28:41-47.
[3]Simonson TS,Yang Y,Huff CD,et al.Genetic evidence for high-altitude adaptation in Tibet[J].Science,2010,329:72-75.
[4]Bigham A,Bauchet M,Pinto D,et al.Identifying signatures of natural selection in Tibetan and Andean populations using dense genome scan data[J].PLoS Genet,2010,6(9):e1001116.
[5]Scheinfeldt LB,Soi S,Thompson S,et al.Genetic adaptation to high altitude in the Ethiopian highlands[J].Genome Biol,2012,13:R1.
[6]Huerta-Sanchez E,Jin X,Asan,et al.Altitude adaptation in Tibetans caused by introgression of Denisovan-like DNA[J].Nature,2014,512:194-197.
[7]Wang B,Zhang YB,Zhang F,et al.On the origin of Tibetans and their genetic basis in adapting high-altitude environments[J].PLoS One,2011,6:e17002.
[8]Xu S,Li S,Yang Y,et al.A genome-wide search for signals of high-altitude adaptation in Tibetans[J].Mol Biol Evol,2011,28:1003-1011.
[9]Yi X,Liang Y,Huerta-Sanchez E,et al.Sequencing of 50 human exomes reveals adaptation to high altitude[J].Science,2010,329:75-78.
[10]Peng Y,Yang Z,Zhang H,et al.Genetic variations in Tibetan populations and high-altitude adaptation at the Himalayas[J].Mol Biol Evol,2011,28:1075-1081.
[11]Hanaoka M,Droma Y,Basnyat B,et al.Genetic variants inEPAS1 contribute to adaptation to high-altitude hypoxia in Sherpas[J].PLoS One,2012,7:e50566.
[12]Buroker NE,Ning XH,Zhou ZN,et al.EPAS1 and EGLN1 associations with high altitude sickness in Han and Tibetan Chinese at the Qinghai-Tibetan Plateau[J].Blood Cells Mol Dis,2012,49:67-73.
[13]Xu J,Yang YZ,Tang F,et al.EPAS1 Gene Polymorphisms Are Associated With High Altitude Polycythemia in Tibetans at the Qinghai-Tibetan Plateau[J].Wilderness Environ Med,2015,26,288-294.
[14]Chen Y,Jiang C,Luo Y,et al.AnEPAS1 haplotype is associated with high altitude polycythemia in male Han Chinese at the Qinghai-Tibetan plateau[J].Wilderness Environ Med,2014,25:392-400.
[15]Xu XH,Huang XW,Qun L,et al.Two functional loci in the promoter ofEPAS1 gene involved in high-altitude adaptation of Tibetans[J].Sci Rep,2014,4:7465.
[16]Catoire M,Alex S,Paraskevopulos N,et al.Fatty acid-inducibleANGPTL4 governs lipid metabolic response to exercise[J].Proc Natl Acad Sci U S A,2014,111:E1043-1052.
[17]Buroker NE,Ning XH,Zhou ZN,et al.AKT3,ANGPTL4,eNOS3,and VEGFA associations with high altitude sickness in Han and Tibetan Chinese at the Qinghai-Tibetan Plateau[J].Int J Hematol,2012,96:200-213.
[18]王亚平,格日力.高原衰退症的研究进展[J].中华医学杂志,2012,92:2298-2300.
Association ofEPAS1 andANGPTL4 gene polymorphisms with susceptibility of CMS
XU Jin1,WANG Zhan2,HU Lei3,ZHANG wan4,YANG Ying-zhong△5
(1.Department of Basic Medical Science,Qinghai University School of Medicine; 2.Department of Hepatic-biliary-pancreatic Surgery,Qinghai university affiliated hospital; 3.Sichuan University Huaxi clinical medical college nursing department,Grade 2014; 4.Qinghai University School of Medicine,traditional Chinese medicine department,Grade 2013; 5.Research Center for High Altitude Medical Sciences,Qinghai University School of Medicine)
Objective To test whether the polymorphisms inEPAS1 gene andANGPTL4 gene are associated with susceptibility to CMS(Chronic mountain sickness,CMS).Methods We enrolled 30 Han CMS patients(CMS-s),51 and 131 healthy,age-and gender-matched control Hans(CMS-r)and Tibetans(HLT).All subjects are from the Yushu area of Qinghai where the altitude is over 3 500 meters,rs4953388 ofEPAS1 gene and rs2278236 ofANGPTL4 gene were genotyped by the Sequenom Mass ARRAY SNP assays.Results We discovered GG genotype of rs4953388 inEPAS1 gene were significantly different between CMS-s group and CMS-r group[28(93.4%)vs 32(62.7%),P=0.004].AA genotype of rs4953388 in HLT group had higher prevalence than that in CMS-s group and CMS-r group[57(44.2% vs 1(3.3%),P<0.0001;57(44.2%)vs 5(9.8%),P<0.0001 ].Additionally,CC genotype of rs2278236 inANGPTL4 gene were significantly different between CMS-s group and CMS-r group[28(93.4%)vs 39(78.5%),P=0.027].CT genotype of rs2278236 in HLT group had higher prevalence than that in CMS-s group[28(21.7%)vs 1(3.3%),P=0. 022].Conclusions Genetic variations inEPAS1、ANGPTL4 gene are not only associated with susceptibility to CMS but also nay have adaptive benefits for high altitude environment in Tibetans.
PolymorphismEPAS1ANGPTL4 CMS susceptibility
※:国家自然科学基金项目(81641078),青海省科技厅自然科学青年基金项目(2016-ZJ-924Q); 青海大学医学院中青年基金项目(2013-KY-1).Δ:通信作者,教授,硕士生导师,E-mail:81420209@qq.com 胥瑾(1987~),女,土族,青海籍,博士
R363.1
A
10.13452/j.cnki.jqmc.2017.01.004
2015-12-13

